YBX1依赖性m5C修饰上调RNF115可促进肝细胞癌的进展
5-甲基胞嘧啶(m5C) RNA修饰在转录后调控和癌症进展中起关键作用。然而,m5C阅读蛋白YBX1的下游效应物及其对肝细胞癌(HCC)的机制贡献在很大程度上仍未明确。在本研究中,我们进行了全转录组m5C谱分析,发现HCC中m5C修饰模式存在显著异质性。我们发现YBX1在HCC中显著上调,并与患者预后不良显著相关。在功能上,YBX1促进肿瘤细胞在体内和体外的增殖、迁移和侵袭。通过整合m5C MeRIP-seq和YBX1 RIP-seq数据,我们确定RNF115是一个直接的YBX1靶标,以m5C依赖的方式调节。机制实验表明,YBX1与RNF115 mRNA 3 ’ UTR内m5c修饰的基序结合,从而增强其稳定性和翻译性,导致RNF115蛋白表达升高。临床队列分析显示,RNF115过表达与HCC患者肿瘤分期晚期、复发转移增加、预后不良相关。体外和体内功能实验证实,RNF115对HCC恶性表型是必需的,并且RNF115过表达解除了YBX1敲低的抑制作用。进一步的机制研究表明,YBX1/ m5C-RNF115轴主要通过激活PI3K/AKT信号通路促进HCC进展。总之,我们的研究结果揭示了一种新的表转录组学机制,YBX1通过m5C依赖的RNF115稳定驱动HCC恶性肿瘤,突出了YBX1/m5C-RNF115轴作为HCC有前途的诊断生物标志物和治疗靶点。本文于2025年11月发表于npj Precision Oncology(IF=8)上。
技术路线:

结果:
1)YBX1在肝癌中的表达及临床价值
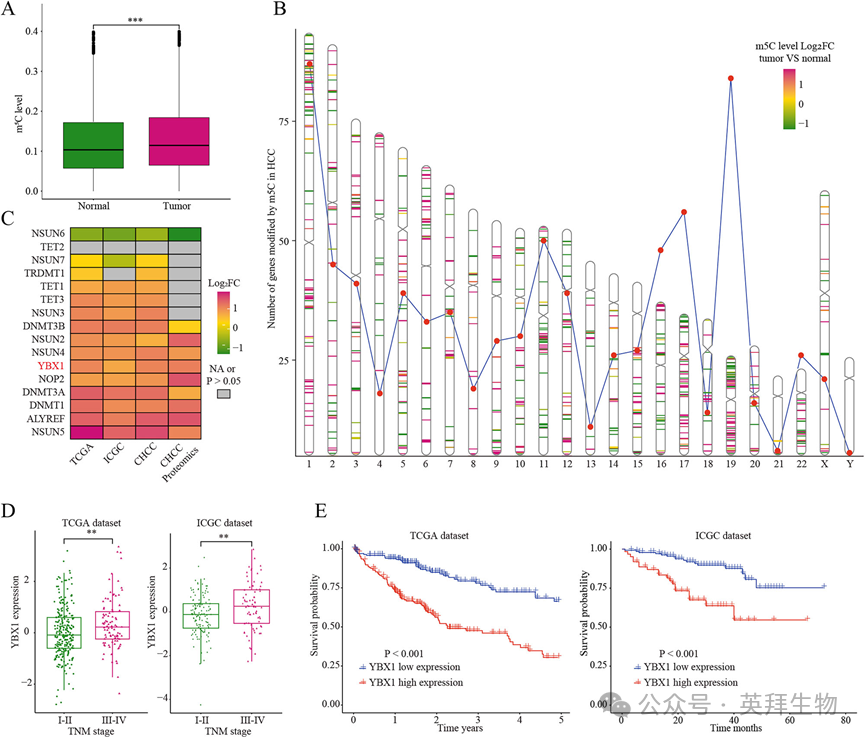
为了探讨m5C修饰在HCC中的特点,我们基于RNA-BisSeq数据,系统分析了肝癌mRNA中m5C修饰在肿瘤和癌旁组织中的差异。我们的分析揭示了HCC和邻近正常组织之间m5C修饰谱的显著异质性(图1A)。染色体图谱显示,除Y染色体外,表现出差异修饰的基因广泛分布在所有染色体上,其中染色体1和19含有最多的差异修饰基因(图1B)。m5c相关调节因子分析显示,HCC组织中DNMT3B、NSUN2、NSUN4、YBX1、NOP2、DNMT3A、DNMT1、ALYREF、NSUN5 mRNA和蛋白水平均显著上调,而NSUN6表达水平显著降低(图1C)。此外,YBX1在晚期肿瘤中表达升高,其高表达预示TCGA和ICGC队列中较差的总生存期(图1D和E)。总的来说,这些发现表明m5C修饰改变在HCC基因
组中普遍存在。
2)YBX1在体外促进肝癌细胞的增殖、迁移和侵袭
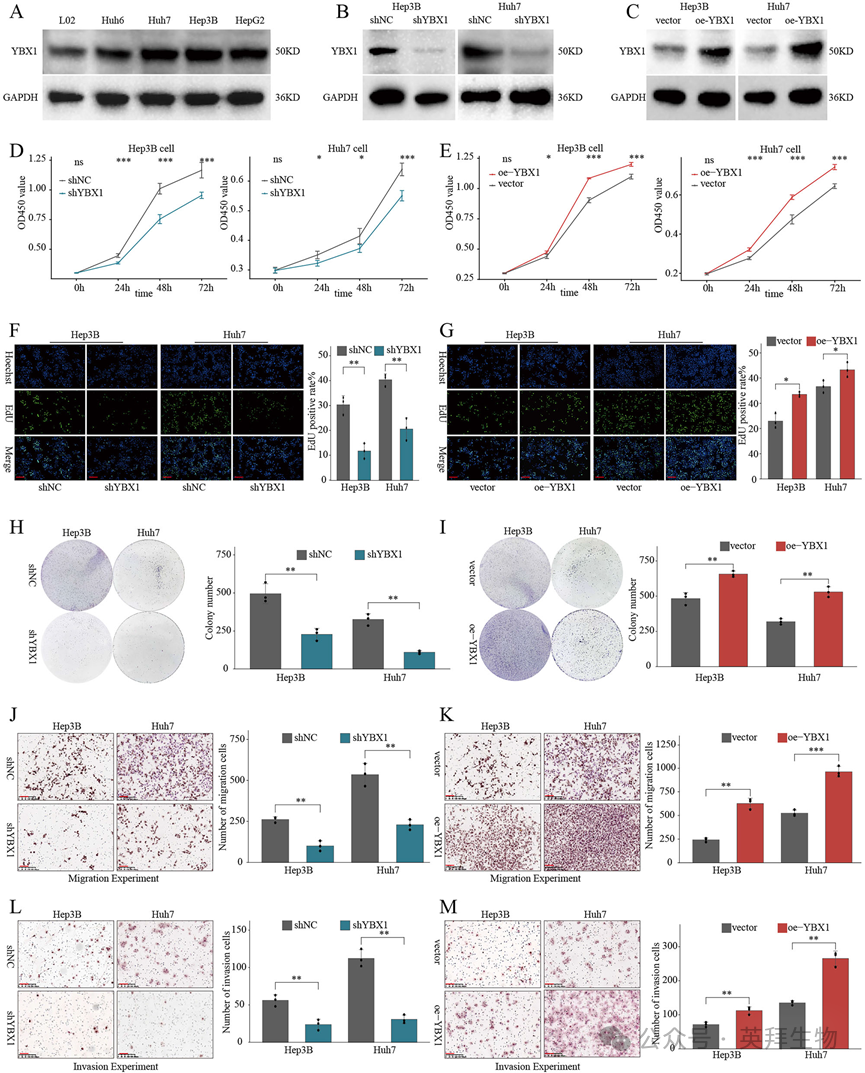
为了阐明YBX1的致癌功能,我们使用YBX1特异性shRNA进行敲除,使用过表达YBX1的慢病毒进行过表达(图2A-C),进行了丧失和获得功能的实验。上调YBX1显著促进HCC细胞增殖、DNA合成和集落形成,而沉默YBX1则起到相反的作用(图2D-I)。迁移和侵袭实验进一步表明,沉默YBX1显著损害HCC细胞的迁移和侵袭能力,而异位表达增强(图2J-M)。这些结果共同表明,YBX1增强了HCC细胞的恶性表型。
3)YBX1通过m5C修饰增强RNF115 mRNA的稳定性和翻译效率
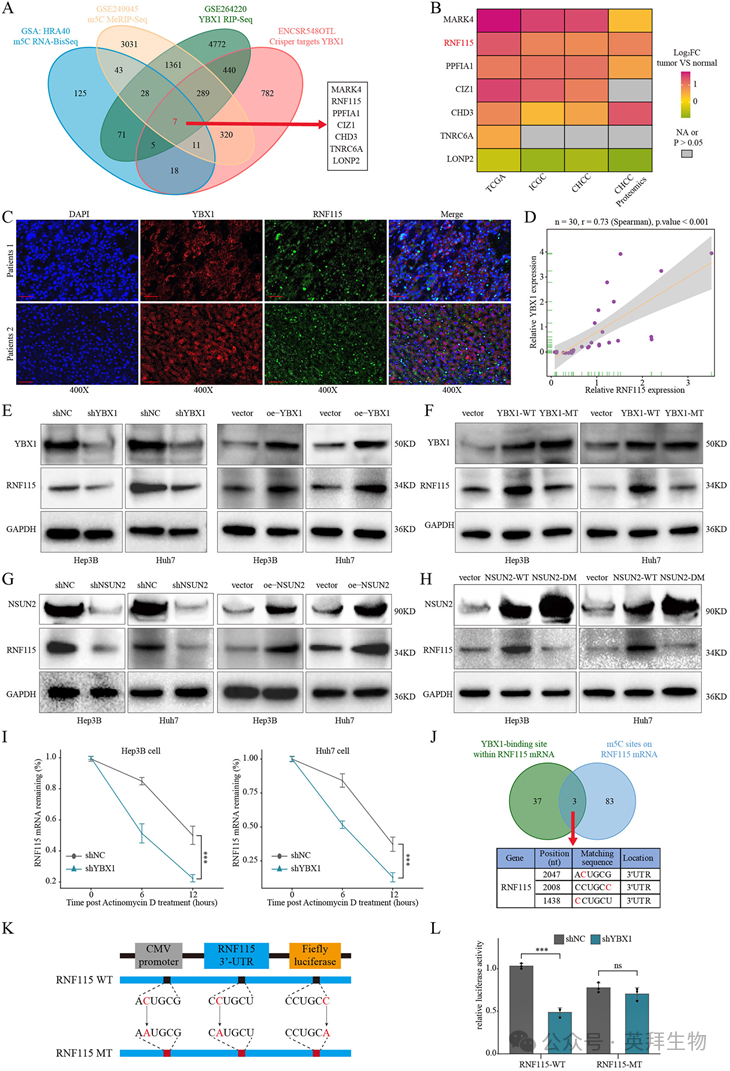
为了鉴定通过m5C调控的YBX1下游靶点,我们采用了多组学策略,结合m5C MeRIP-seq、m5C RNA-BisSeq、YBX1 RIP-seq和CRISPR介导的YBX1敲除数据集(图3A)。交叉分析得到7个候选基因,其中RNF115在HCC的mRNA和蛋白水平上均显著过表达(图3B)。HCC组织芯片的荧光免疫染色证实了YBX1与RNF115蛋白表达之间的强正相关(图3C和D)。此外,我们观察到YBX1或NSUN2的沉默导致RNF115的表达大幅下降。相反,正如western blot分析所证明的那样,YBX1或NSUN2的异位表达导致RNF115水平显著升高(图3E和G)。在HCC细胞中,YBX1-MT和NSUN2-MT突变体增加了RNF115的表达水平,而YBX1-WT和NSUN2-DM没有增加RNF115的表达水平(图3F和H)。鉴于YBX1在mRNA稳定中的已知作用,我们评估了其对RNF115 mRNA稳定性的影响。正如预期的那样,Actinomycin D处理显示,RNF115转录本在YBX1敲低细胞中的半衰期较短,而YBX1过表达延长了转录本的稳定性(图3I)。我们进一步利用m5C Finder和RBPDB数据库确定了RNF115 mRNA上可能与YBX1结合的m5C甲基化位点。结果显示,在RNF115转录物的3'UTR中有三个潜在的YBX1结合m5C位点(图3J)。我们构建了荧光素酶报告质粒,包含野生型RNF115序列(RNF115- WT)、m5C位点突变版本(RNF115-MT)和几个单点突变的RNF115变体(图3K)。YBX1基因敲低显著降低了RNF115-WT和单点突变组的荧光素酶活性,但对三点突变的RNF115-mt组没有影响(图3L)。综上所述,这些发现表明YBX1通过m5C依赖机制调节HCC中RNF115的表达。
4)RNF115在HCC中的过表达及其与不良预后的关系
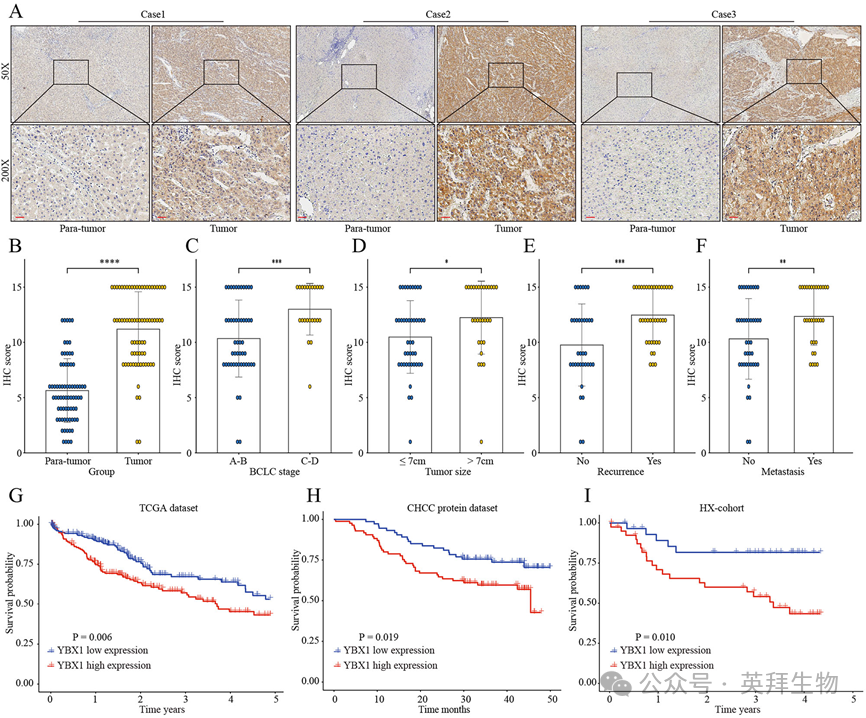
为了探讨RNF115在HCC中的临床意义,我们使用免疫组化方法分析了RNF115在HX队列中的表达。研究结果表明,相对于邻近的非肿瘤组织,RNF115在HCC组织中显著过表达。(图4A和B)。此外,RNF115的高表达与HCC的临床恶性进展密切相关,包括晚期BCLC(图4C和D)、较大的肿瘤大小(≥7 cm)、升高的PIVKA-II水平、复发和转移(图4C-F)。Kaplan-Meier分析进一步显示,HCC患者的高RNF115水平与较低的总生存率相关(图4G-I)。综上所述,这些发现表明RNF115在HCC的临床进展和预后中起关键作用。
5)敲低RNF115可抑制HCC细胞的增殖、迁移和侵袭
为了研究RNF115的功能,我们设计并构建了三个靶向RNF115的shRNA,分别转染到Hep3B和Huh7细胞中。Western blot分析显示,shRNF115-2显著抑制RNF115蛋白在HCC细胞中的表达,从而选择其进行进一步的功能分析(图5A和B)。CCK-8、EdU染色和集落形成实验显示,与NC对照转染的细胞相比,RNF115敲低显著抑制HCC细胞增殖、DNA合成和集落形成(图5C-E)。此外,沉默RNF115降低了HCC细胞的迁移和侵袭能力(图5F和G)。RNF115下调后,与上皮-间质转化(EMT)相关的间充质标志物,包括N-cadherin、Vimentin和MMP2的表达水平显著降低,而上皮标志物E-cadherin的表达水平上调(图5H)。为了评估RNF115在体内的致癌作用,我们通过皮下注射shRNF115或shNC感染的HCC细胞建立了异种移植物小鼠模型。与体外实验结果一致,RNF115敲低组的肿瘤生长速度和平均肿瘤重量明显低于shNC组(图5I)。此外,免疫组化分析表明,与shNC组相比,RNF115敲低组的肿瘤显示出较弱的Ki-67染色(图5J)。这些结果提示RNF115可能增强HCC的恶性表型。
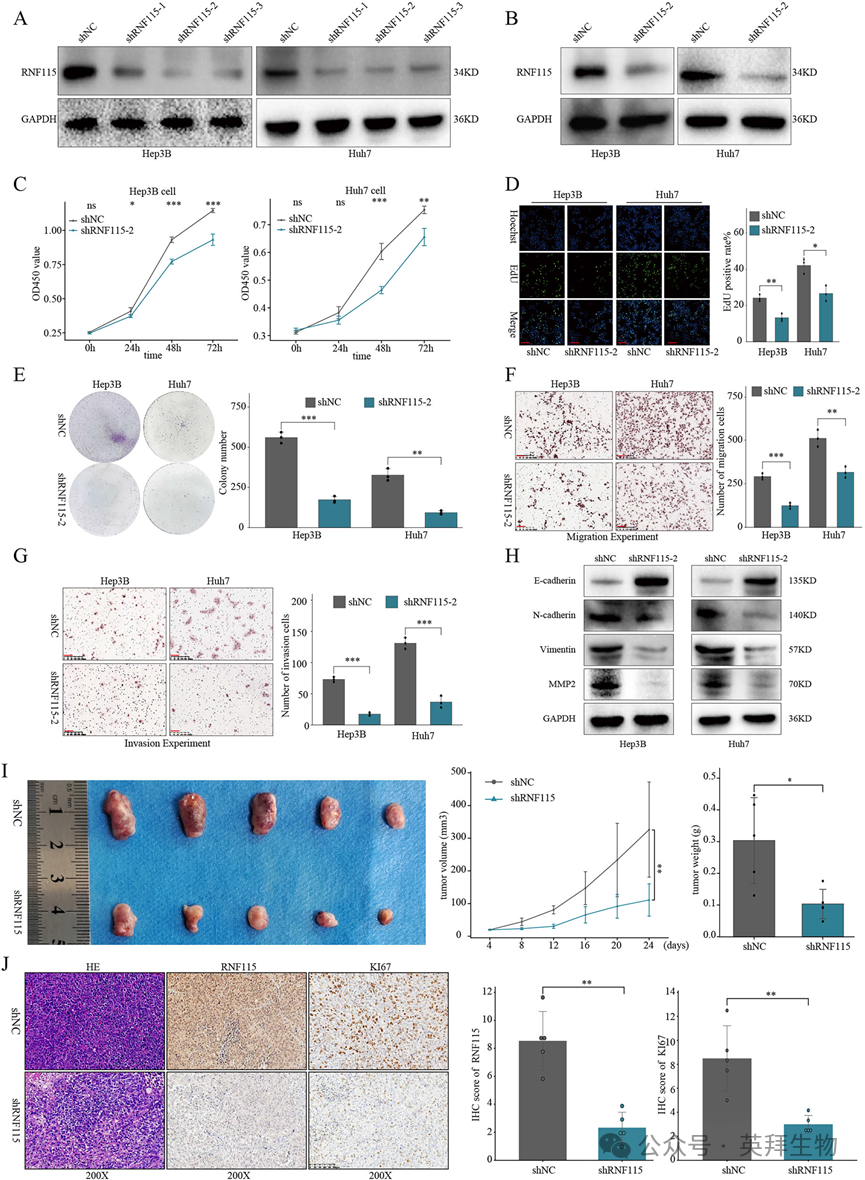
6)YBX1通过RNF115促进HCC细胞增殖、迁移和侵袭
基于我们的研究结果,YBX1以m5C依赖的方式促进RNF115 mRNA的稳定,我们提出YBX1/ RNF115途径与HCC的进展有关。为了验证这一假设,我们进行了修复实验,发现重新引入RNF115部分恢复了YBX1缺陷HCC细胞的增殖、DNA合成、集落形成、迁移和侵袭能力(图6A-F)。
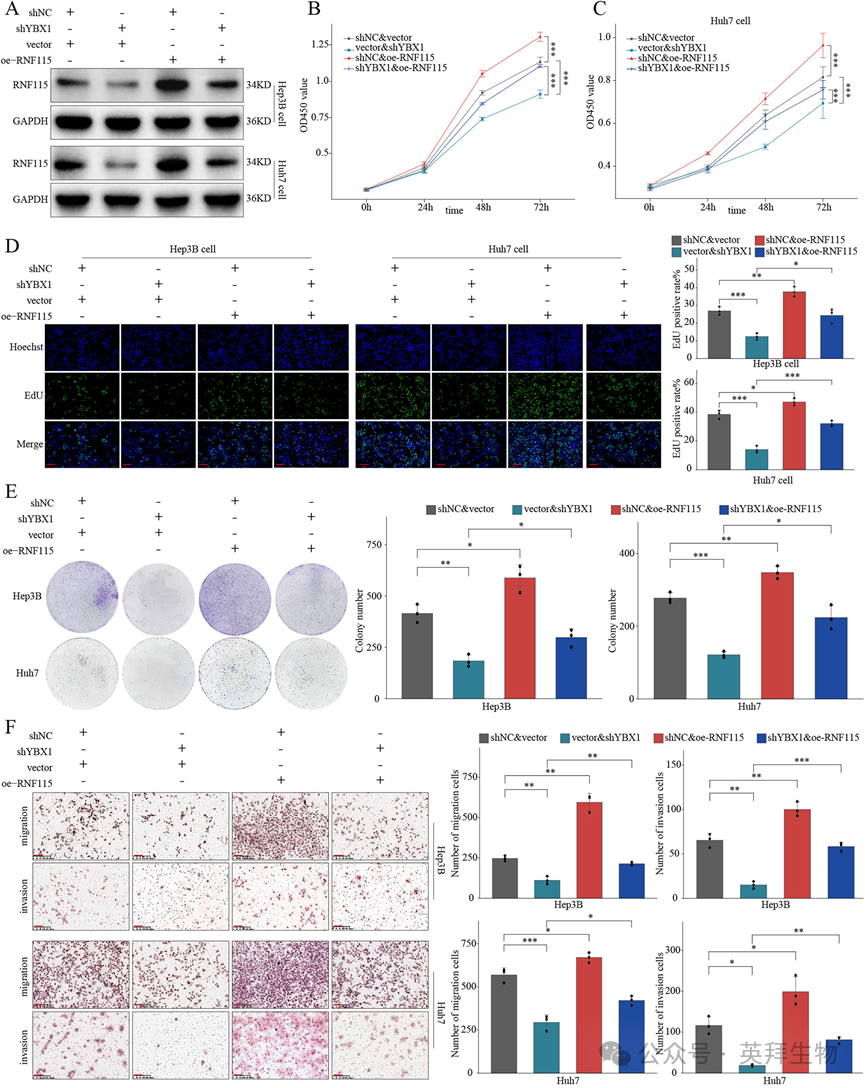
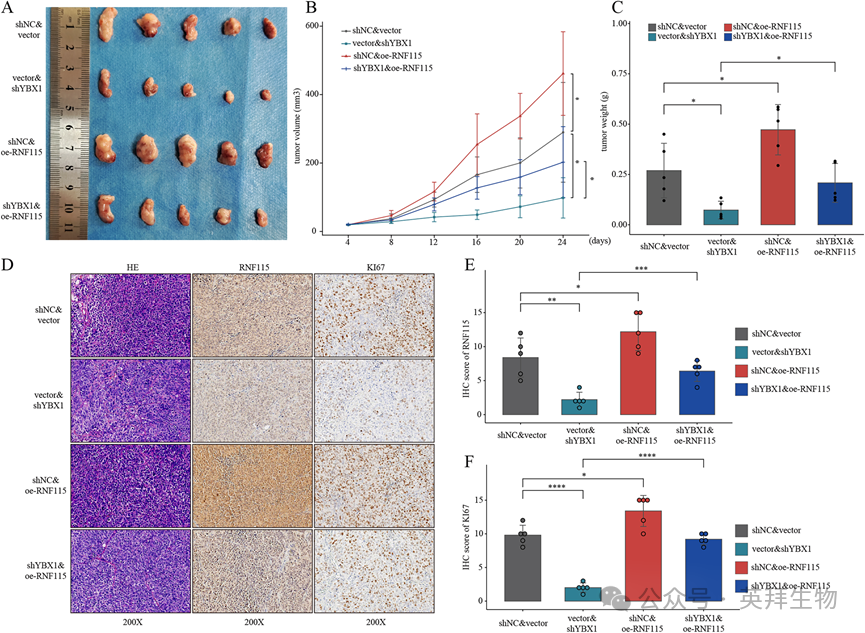
7)YBX1通过上调RNF115在体内促进HCC细胞增殖
进一步的体内皮下异种移植实验表明,过表达RNF115可以部分恢复YBX1缺陷HCC细胞的增殖能力(图7A-C)。免疫组化分析证实,在YBX1敲低组中Ki-67的表达减少,也通过RNF115过表达部分恢复(图7D-F)。总之,这些结果支持YBX1至少部分通过促进RNF115表达促进HCC进展的结论。
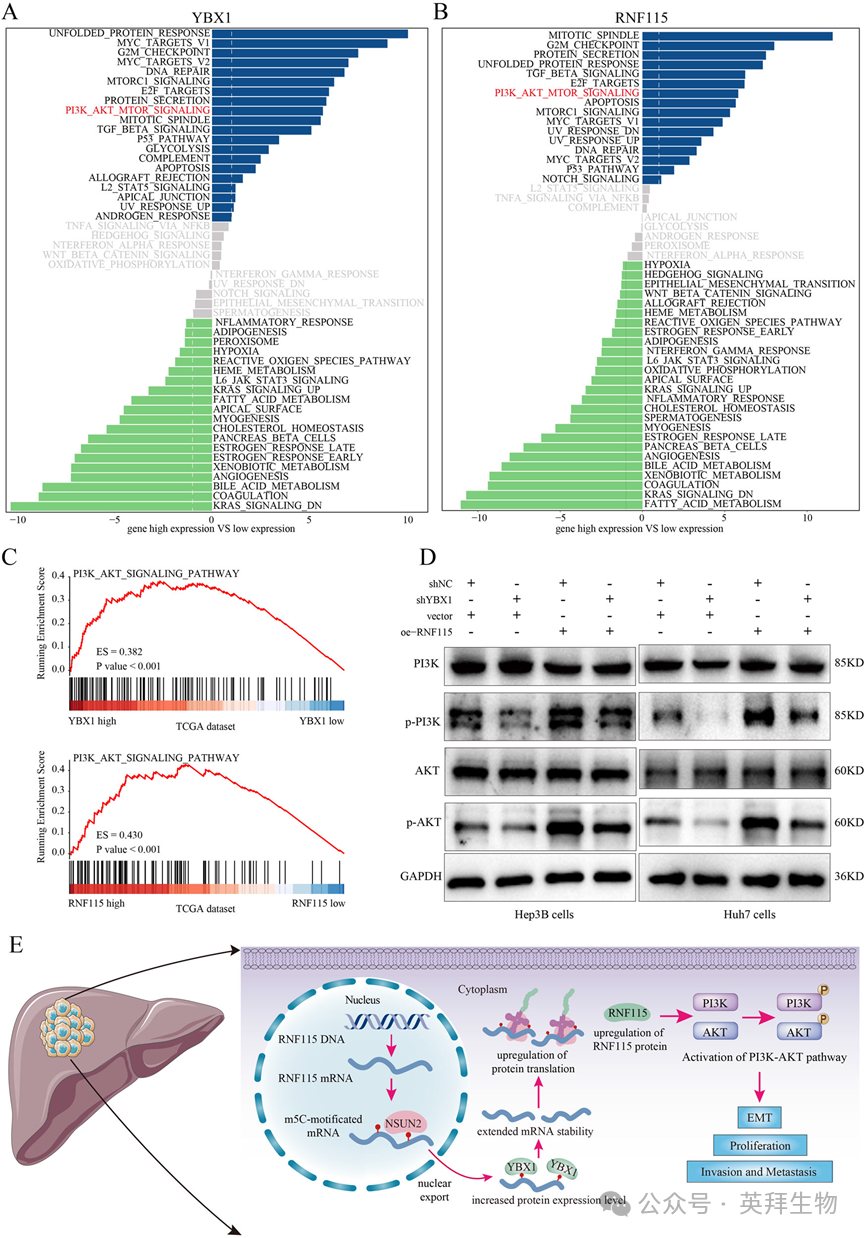
8)YBX1/m5C-RNF115轴通过激活PI3K/AKT信号通路促进HCC进展
为了研究YBX1/m5C-RNF115轴在HCC中促肿瘤作用的分子机制,我们进行了一系列探索性分析。GSVA显示,YBX1和RNF115的高表达与多种致癌途径的激活有关,包括未折叠蛋白应答、G2/M检查点、MYC靶基因激活、DNA修复和PI3K/AKT信号传导。其中,PI3K/AKT信号通路因其在HCC进展和治疗潜力中的作用而受到特别关注(图8A和B)。因此,我们选择了这一途径进行进一步的研究。GSEA表明,PI3K/AKT信号通路在YBX1和RNF115高表达的HCC组织中显著富集(图8C)。进一步验证表明,YBX1敲低导致p-AKT和p-PI3K的表达水平降低。此外,通过重组RNF115逆转了对p-AKT和p-PI3K的抑制作用(图8D)。这些发现表明YBX1/m5C-RNF115轴主要通过PI3K/AKT信号激活促进HCC进展。
结论:
我们的研究表明,YBX1/m5C-RNF115轴通过激活PI3K/AKT信号通路是HCC进展的关键驱动因素。我们的发现强调了这一调控轴在HCC发病机制中的核心作用,并强调了其作为治疗靶点的前景。靶向YBX1/m5C-RNF115轴为开发更有效的HCC治疗方法提供了令人信服的策略。
参考文献:
Li J, Chen H, Bai L, Tang H. RNF115 upregulation by YBX1-dependent m5C modification promotes hepatocellular carcinoma progression. NPJ Precis Oncol. 2025 Nov 21;9(1):375. doi: 10.1038/s41698-025-01160-9.






