m6A RNA甲基化测序
m6A RNA甲基化测序
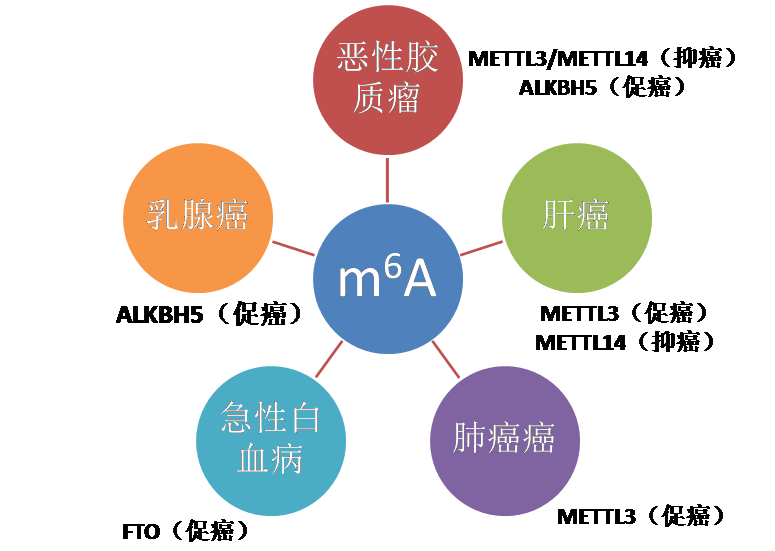
RNA甲基化修饰约占所有RNA修饰的60%以上,而N6-甲基腺嘌呤(N6-methyladenosine, m6A)是高等生物mRNA和lncRNAs上最为普遍的修饰。目前发现microRNA,circRNA, lncRNA, rRNA, tRNA和snoRNA上都有发生m6A修饰。 m6A修饰主要发生在RRACH序列中的腺嘌呤上,其功能由“编码器(Writer)”、“消码器(Eraser)”和“读码器(Reader)”决定。“编码器(Writer)”即甲基转移酶,目前已知这个复合物的成分有METTL3,METTL14, WTAP和KIAA1429;而ALKBH5和FTO作为去甲基酶(消码器)可逆转甲基化;m6A由m6A结合蛋白识别,目前发现m6A结合蛋白(读码器)有YTH结构域蛋白(包括YTHDF1, YTHDF2,YTHDF3, YTHDC1和YTHDC2)和核不均一蛋白HNRNP家族(HNRNPA2B1和 HNRNPC)。在基因表达、蛋白翻译和RNA剪切等正常生物过程中具有重要作用。近来有研究显示m6A RNA甲基化在乳腺癌、恶性血液病、胶质母细胞瘤、宫颈癌等多种癌症的发生发展中具有重要作用。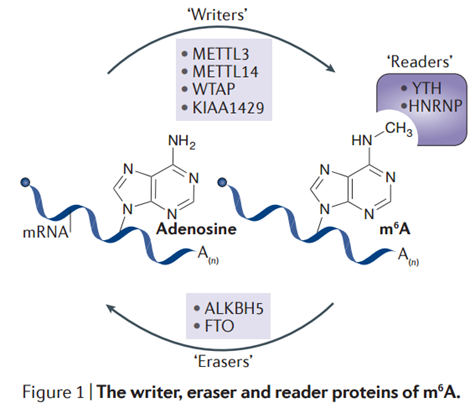
图 1 m6A修饰的酶系统 图 2 m6A生物学功能
一、MeRIP-seq实验流程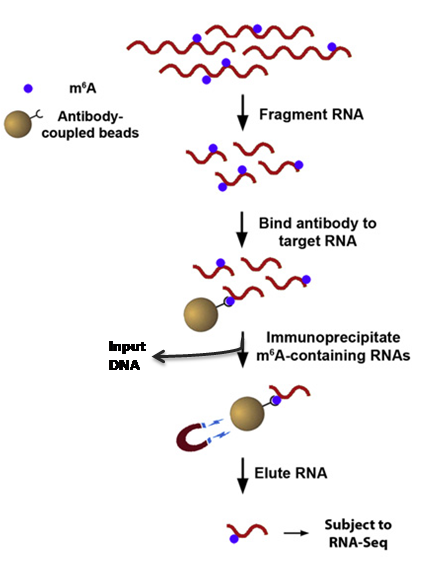
图3 英拜 m6A RNA甲基化测序实验流程
二、m6A甲基化测序分析内容
u 测序数据质量评估及QC
u 测序序列与参考基因组比对
u RNA甲基化peak calling
u peak在基因组中的分布及注释
u Peak在基因组中富集程度统计
u 差异RNA甲基化区域分析
u 差异RNA甲基化区域GO与KEGG富集分析
三、研究案例
1、m6A Demethylase ALKBH5 Maintains Tumorigenicity of Glioblastoma Stem-like Cells by Sustaining FOXM1 Expression and Cell Proliferation Program. Cancer Cell 2017.(IF=27.4)
DNA甲基化异常是胶质瘤的表观遗传调控因子,但RNA甲基化在肿瘤包括恶性胶质瘤(GBM)中的调控还尚未清楚。为研究m6A调节可能导致GBM患者临床疗效不佳,作者通过TCGA数据库,发现ALKBH5在恶性胶质瘤样干细胞(GSCs)中高表达且与GBM 病人不良预后相关,干扰ALKBH5 降低GSCs细胞的自我更新能力且抑制GSCs增殖,进一步体内验证敲除ALKBH5可抑制肿瘤生长。
为研究ALKBH5的m6A作用机制,作者利用芯片和m6A-seq筛选到胶质瘤增殖相关的FOXM1,最后通过qPCR、WB、免疫荧光、核质分离WB/qPCR、RIP和MeRIP等实验证明ALKBH5通过去甲基化调节FOXM1在GSCs中的表达。
为研究ALKBH5对FOXM1的作用是否受其他因子的调节,作者研究了FOXM1的邻近基因,发现lncRNA FOXM1-AS与FOXM1序列互补,且共表达、共定位,进一步通过RIP, RNA pull down等实验证明lncRNA FOXM1-AS促进ALKBH5 和FOXM1初级转录本的相互作用。最后通过细胞实验进一步验证ALKBH5在lncRNA FOXM1-AS的作用下维持FOXM1的表达和细胞增殖,从而维持GSCs的干性。
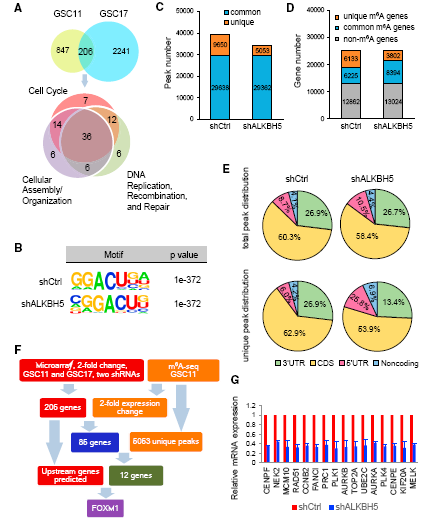 |
图4 ALKBH5敲除细胞中m6A修饰的特征和基因表达的变化
2、RNA N6-methyladenosine methyltransferase METTL3 promotes liver cancer progressionthrough YTHDF2 dependent post-transcriptional silencing of SOCS2. Hepatology,2017.(IF=13.2)
表观遗传改变极大地促进了人类癌症的发生。传统的表观遗传研究主要集中在DNA甲基化,组蛋白修饰和染色质重构。最近,RNA各种可逆的化学修饰被认为是一种新的表观遗传调控方式。m6A是真核生物mRNA最常见的化学修饰,在调控mRNA稳定性,剪切和翻译方面具有重要的作用。
作者使用转录组测序发现了METTL3(甲基转移酶3),一种主要的RNA N6-腺苷-甲基转移酶,在人肝细胞癌(HCC)和多种实体肿瘤中显著高表达。在临床上,METTL3的过度表达与肝细胞癌患者不良预后有关。体外实验证明敲除METTL3会显著抑制HCC细胞增殖,迁移及克隆形成。体内实验证明敲除METTL3会明显抑制HCC体内成瘤和肺转移。另外,使用CRISPR/dCas9-VP 64激活系统,内源性高表达METTL3会显著促进HCC细胞在体外和体内生长。通过转录组测序、m6A-Seq、MeRIP-PCR,作者确定了SOCS2(细胞因子信号2的抑制因子)作为METTL3介导的m6A修饰的下游靶基因。 敲除METTL3表达会消除SOCS2 mRNA m6A修饰并增强SOCS2 mRNA表达。m6A介导的SOCS2 mRNA降解是依赖于m6A“读取器”蛋白YTHDF2。总之,METTL3在HCC大部分高表达中,并通过m6A-YTHDF2依赖机制抑制SOCS2表达从而促进HCC进展。因此,作者发现了在肝肿瘤发生过程中表观遗传改变的一种新机制。
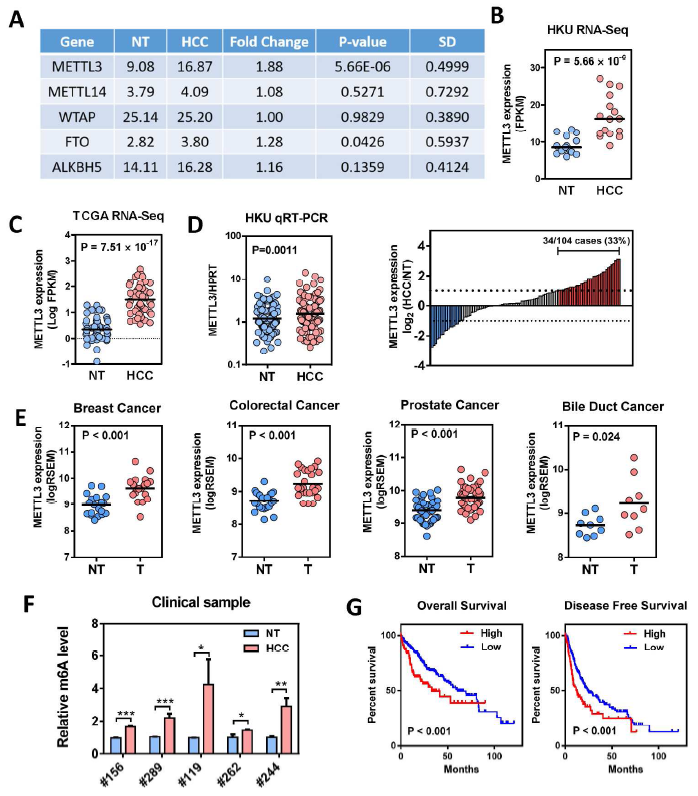
图5 RNA甲基化转移酶METLLT3在肝癌组织中高表达
(转录组测序结果及TCGA数据库分析)
3、N6-adenosine methylation in MiRNAs. PLoS One 2015,
在许多不同种类的RNA中,都已观察到N6 -腺苷(m6A)的甲基化,但其在microRNAs中还没有被研究。研究者在FTO1C1, FTO2D4 和 FTO3C3细胞系中,通过敲除m6A甲基转移酶FTO筛选到表达差异的microRNA,说明miRNA受m6A甲基化的调控。进一步通过MeRIP-Seq发现相当一部分的microRNA具有m6A修饰。通过motif分析,他们发现了区分甲基化和非甲基化microRNA的一致序列。该文章所述的表观遗传修饰在基因表达的转录后调控的复杂性上增加了一个新的层次。

图7 FTO敲除对甲基化的miRNAs的稳定状态的影响。
四、送样要求
A样品要求:
样品类型:细胞、新鲜组织或RNA样品。
样品量:细胞样品请提供至少5×107~108个细胞,组织样品请提供至少5g的组织块,RNA样品请提供500μg以上的总RNA。
样品质量:RNA无明显降解,提取的总RNA OD260/280值在1.8~2.2之间,浓度 ≥ 500ng/μl,28S:18S ≥ 1.5,RIN ≥7。
样品保存:细胞样品或新鲜组织块(切成~50mg的小块)可用TRIZOL或RNA保护剂处理或液氮冻存后,-80℃保存。RNA样品可溶于乙醇或RNA-free的超纯水中,-80℃保存。样品保存期间避免反复冻融。
样品运输:样品置于1.5 ml管中,封口膜封好,干冰运输。