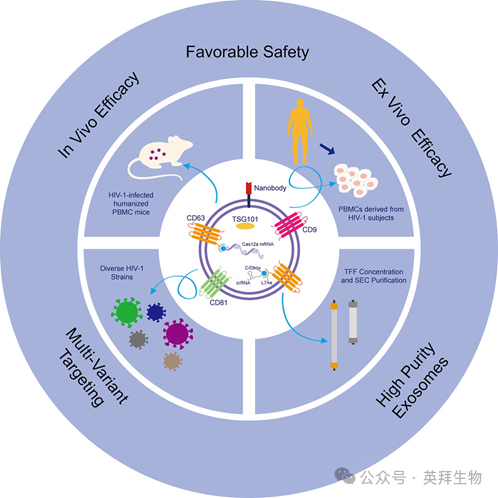
HIV治愈新曙光:外泌体介导的基因编辑疗法展现HIV治愈潜力
目前治疗HIV感染的策略,包括传统的联合抗逆转录病毒疗法(cART)和免疫疗法,虽能有效抑制病毒复制,但无法清除潜伏的病毒储存库,尤其是在循环免疫细胞中。尽管CRISPR-Cas基因组编辑为治愈HIV-1带来了希望,但体内的基因递送效率仍是待克服的障碍。在此,我们开发了一种外泌体介导的靶向CRISPR-Cas12a递送系统(EMT-Cas12a),这是一种工程化的外泌体系统,能够将Cas12a mRNA和crRNAs靶向递送至CD4+ T细胞。该EMT-Cas12a系统独特地优化了细胞特异性靶向、CRISPR-Cas12a表达、crRNAs成熟、核进入效率、以主要发生缺失/插入的方式进行精确切割,并在细胞模型和人源化小鼠模型中实现了显著的HIV抑制。与单一crRNA方法相比,多重crRNA阵列策略在HIV感染的小鼠模型、来自HIV阳性受试者的离体扩增的PBMCs,尤其是在未检测到HIV DNA的体外细胞系中,均显示出增强的抗病毒效果。至关重要的是,该系统未检测到脱靶效应,并在体内和离体PBMCs中恢复了CD4+ T细胞计数,表明其在病毒清除和免疫重建方面具有双重治疗潜力。总之,通过EMT-Cas12a递送,可在体外和体内实现HIV-1前病毒DNA的切除,这将推动该技术向人体临床试验迈进。本文于2025年11月发表于《Molecular Therapy》,IF 12.0。
图形摘要:
主要实验结果:
1.抗HIV crRNAs的设计与可视化筛选
为了能更好地应对HIV毒株的多样性和高度变异性,设计靶向HIV基因组高度保守区域的crRNAs至关重要。通过对来自中国地区的HIV-1毒株进行多序列比对,确定了DNA序列中的保守区域,包括39条CRF07_BC序列、36条CRF08_BC序列、59条B亚型'序列以及经典参考株NL4-3。此前,我们使用Benchling和CRISPOR CRISPR向导设计软件,针对这些保守区域设计了多个crRNA分子,遵循以下标准:特异性评分 >90(特异性);效率评分 >65(活性);以及在Genome Reference Consortium Human Build 38(GRCh38)基因组中预测的脱靶位点的切割频率决定(CFD)评分 <0.2。随后,通过基于荧光的体外筛选(图1E),鉴定出了七个有效的多毒株靶向crRNAs,表明Cas12a可以被激活并切割靶DNA探针。它们的靶向区域在图1A中示意性展示,而相应的基因组位点、crRNA序列、特异性评分和效率评分在图1B中详细列表呈现。
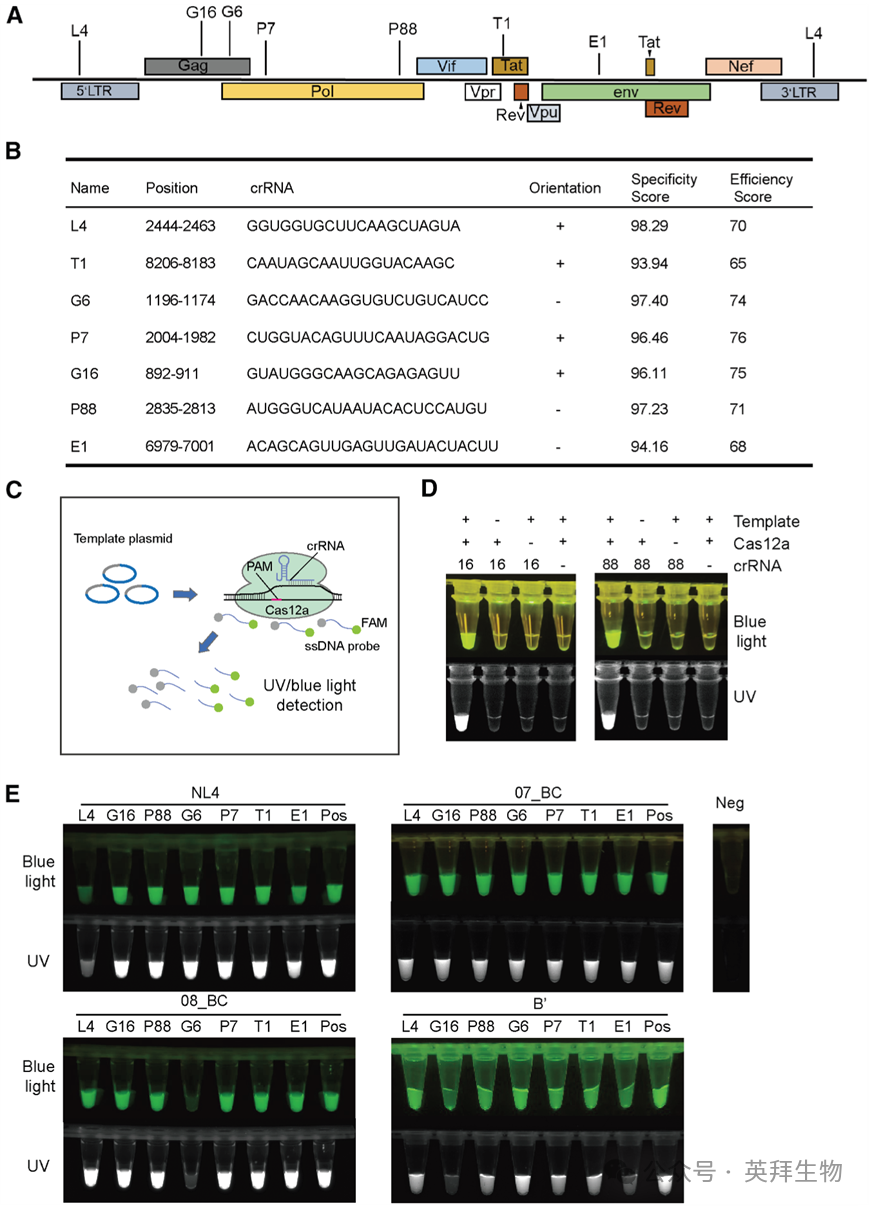
图1. Cas12a攻击HIV DNA基因组的crRNA靶点
2. EMT-Cas12a的制备与表征
接下来,我们着手开发一种活性包装装置——EMT-Cas12a,旨在实现抗HIV Cas12a系统对CD4+细胞的特异性递送。该装置通过将含有RNA包装装置(CD63-L7Ae)、靶向模块(靶向CD4的Nb1-Lamp2b)以及mRNA和crRNAs(Cas12a-crRNA-C/Dbox)的质粒共转染HEK293F细胞来制备。工程化的外泌体被CD4+ T细胞选择性摄取,而Cas12a mRNA和crRNAs则被递送至细胞质中。最终,Cas12a在靶细胞中表达,并在crRNAs的引导下切割HIV感染的CD4+ T细胞中的前病毒基因组。此外,我们构建了七个不同的PEC12cr质粒,每个质粒编码一种独特的抗HIV crRNA。这些质粒分别与pECD63L和pENb1质粒共转染HEK293F细胞,以包装加载了单一crRNA的EMT-Cas12a颗粒(质粒构建详见材料与方法部分)。空白外泌体(Blank EXO)从未转染的HEK293F细胞条件培养基中分离获得。纯化后的EMT-Cas12a样本在电子显微镜下拍摄,视野清晰,形态完整。透射电子显微镜(TEM)图像显示了其杯状形态,这是外泌体的典型特征(图2C)。纳米颗粒追踪分析也显示,大多数EMT-Cas12a直径约为150 nm,差异很小,这进一步证实了TEM图像数据(图2D)。此外,我们通过蛋白质印迹法,以Blank EXO为对照,分析了EMT-Cas12a中外泌体标志物CD63、TSG101和CD81的表达情况(图2E)。值得注意的是,EMT-Cas12a的外泌体蛋白独特地显示出一个额外的约65 kDa的CD63条带,对应于CD63 L7Ae融合蛋白。通过磁珠捕获流式细胞术,在EMT-Cas12a上检测到了强烈的CD63、CD9和CD81信号,而同型对照显示的结合可忽略不计(图2F)。这些结果证实了EMT-Cas12a已被成功分离和纯化。我们通过纳米流式细胞术和蛋白质印迹法测试了多步纯化方法分离的外泌体的纯度。超过96%的颗粒膜染料呈阳性,证实了囊泡富集。蛋白质印迹显示外泌体标志物(CD9、TSG101)信号强烈,而高尔基体标志物(GM130)几乎检测不到,这表明了高纯度且细胞残留物极少。
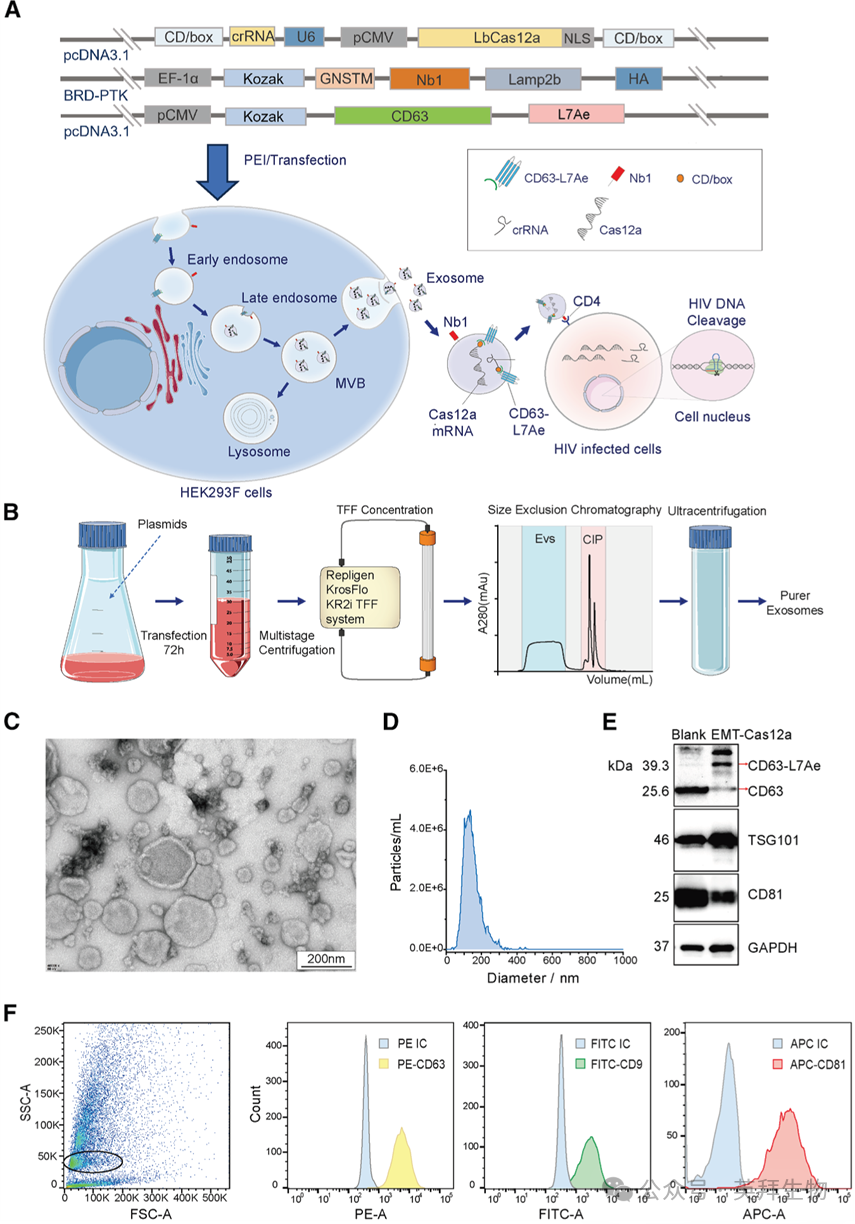
图2. EMT-Cas12a的合成与表征
3. EMT-Cas12a中工程化元件的功能验证
鉴于EMT-Cas12a旨在实现将Cas12a mRNA和crRNAs靶向递送至CD4+ T细胞,我们试图验证外泌体内每个工程化元件的表达和功能。为了解析工程化外泌体与天然外泌体之间的功能差异,我们利用纳米流式细胞术定量分析了EMT-Cas12a和空白外泌体(Blank EXO)中的外泌体标志物水平、表面纳米抗体密度以及核酸货物(图3A)。对EMT-Cas12a和Blank EXO之间CD63阳性率的分析显示存在显著差异;转染CD63-L7Ae质粒后,EMT-Cas12a的CD63阳性率为82.4%,而Blank EXO颗粒中仅有16.83%呈CD63阳性。然而,它们的CD9和CD81表达水平未显示出显著差异。抗VHH抗体的免疫标记证实了EMT-Cas12a颗粒上存在纳米抗体Nb1,其阳性率为15.3%,而Blank EXO的结合可忽略不计(<1%)。纳米流式细胞术结果还显示,与Blank EXO相比,EMT-Cas12a内的总核酸信号增加了26.4%。RT-qPCR和蛋白质印迹分析均显示,EMT-Cas12a外泌体中的Cas12a mRNA和蛋白质水平均显著高于缺乏L7Ae(L7Ae- EXO)或CD/box基序(CD/box- EXO)的对照外泌体(图3B和3F)。这些数据表明,CD63-L7Ae和CD/box RNA基序协同增强了所需RNA在外泌体内的包装效率。为了探究此方法是否能增强外泌体递送效率,我们从与不同工程化外泌体共孵育48小时的Jurkat细胞中提取蛋白质,并进行蛋白质印迹分析。值得注意的是,与缺乏L7Ae的外泌体对照组相比,与EMT-Cas12a外泌体共孵育的细胞其Cas12a蛋白表达量增加了10倍以上(图3C)。共聚焦显微镜观察显示,PBMCs与zsGreen标记的Nb1和非靶向工程化外泌体共孵育后,存在外泌体内化现象。正如预期,与未修饰的靶向外泌体相比,CD4靶向外泌体在PBMCs中诱导了更高的荧光强度,表明外泌体在细胞内的积累更高。流式细胞术结果(图3C)也表明,与非靶向的zsGreen标记外泌体相比,Nb1修饰的外泌体在PBMCs的CD4+细胞群中实现了约28倍的zsGreen信号富集增强(图3D),这与共聚焦显微镜结果一致。综上所述,这些发现证明Nb1赋予了EMT-Cas12a系统对CD4+细胞的靶向特异性,从而提高了其细胞类型特异性的递送效率。总体而言,我们的多模式实验证据验证了EMT-Cas12a系统代表了一种靶向CD4且高效的CRISPR-Cas12a递送策略。
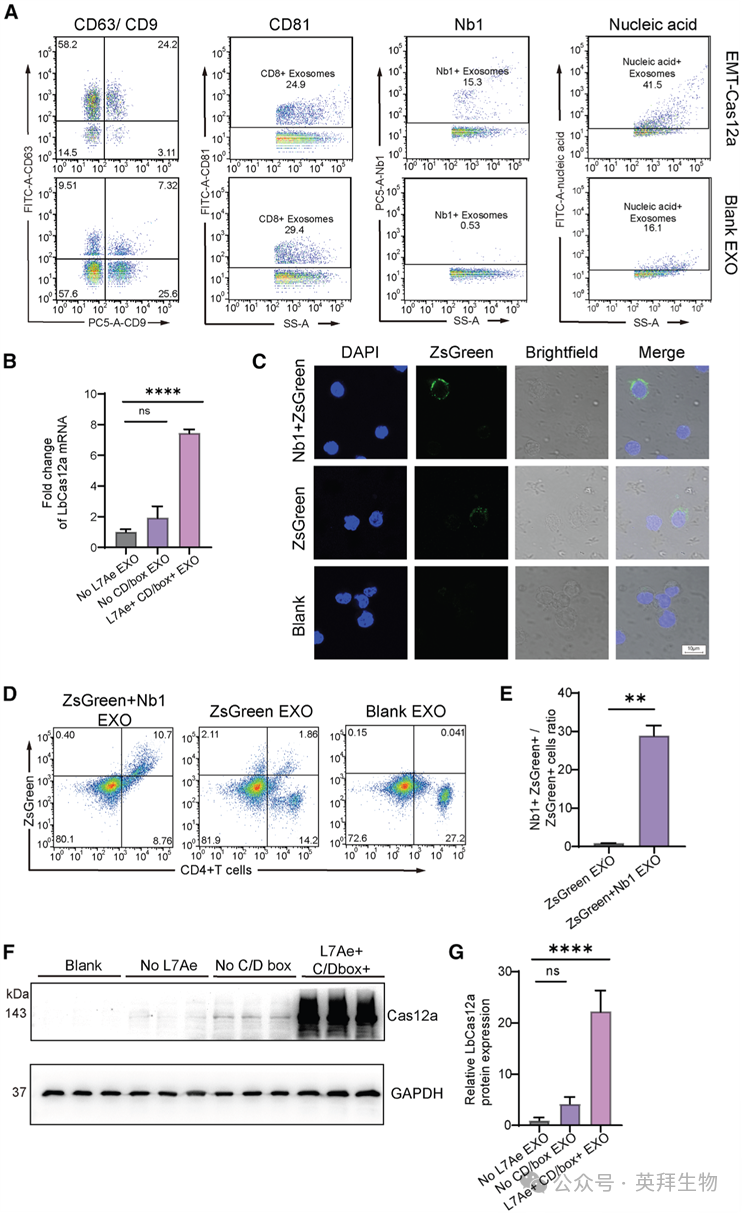
图3. EMT-Cas12a实现CRISPR-Cas12a机制的特异性高效递送
通过免疫荧光染色确认了Cas12a的亚细胞定位。对与EMT-Cas12a外泌体孵育的Jurkat细胞进行共聚焦显微镜分析,揭示了Cas12a蛋白的成功递送和强健表达。如图S11所示,Cas12a信号(绿色)显示出清晰的核定位模式,与DAPI染色的细胞核(蓝色)高度重叠。这证实了CRISPR效应因子存在于细胞核中,这是其能够接触并切割宿主基因组内整合的HIV-1前病毒DNA的先决条件。
4. EMT-Cas12a系统在细胞系中抗病毒活性的验证
接下来,我们评估了含有不同crRNA变体的EMT-Cas12a在感染NL4-nanoluc的Jurkat细胞中的抗病毒活性。为了标准化命名,工程化外泌体被分类为:(1) 单一crRNA型(Sicr-EMT-Cas12a,例如T1-EMT-Cas12a)和 (2) 多重crRNA阵列型(Arcr-EMT-Cas12a,例如Array1-EMT-Cas12a),字母数字后缀指定靶向坐标。详细的实验方案可参见材料与方法中“EMT-Cas12a体外抗病毒活性评估”部分,示意图见图4A。通过定量细胞内的NanoLuc荧光素酶来测量病毒产量(图4B)。设置两个对照:(1) 无crRNA对照(不含crRNA的EMT-Cas12a)和 (2) 阳性对照(模拟处理的细胞)。无crRNA对照和阳性对照观察到较高的NanoLuc水平,而Sicr-EMT-Cas12a构建体则显著降低了该水平。HIV的高突变率使得单一crRNA策略容易因基因组进化而导致病毒逃逸。然而,靶向保守病毒DNA位点的多重crRNA可通过施加更高的遗传抗性屏障,协同抑制病毒复制。如前所述,Cas12a具有RNase活性,使其能够通过识别crRNA靶向序列上游(5')的DR发夹结构,从前体转录本(前体crRNA阵列)中提取成熟的crRNA。我们设计了整合了4到5个crRNA单元、两侧为DR序列的CRISPR阵列,并通过体外基于荧光的切割实验验证了它们的功能。本研究中设计的crRNA阵列结构组织如图4E所示。如图4E所示,crRNA阵列(前体crRNA)可在体外被Cas12a加工成成熟crRNA,随后引导Cas12a识别靶DNA序列。这会激活Cas12a的DNA酶活性,导致靶DNA和探针被切割(图4C)。为了确认所有EMT-Cas12a制剂均介导了有效的Cas12a细胞递送,从与不同工程化外泌体共孵育48小时的Jurkat细胞中提取蛋白质裂解液,并进行蛋白质印迹分析(图4D)。与我们的预期一致,与单一crRNA(T1)相比,组合crRNA方法确实显著提高了HIV抑制水平。值得注意的是,到288小时终点时,所有五种crRNA阵列变体均使NanoLuc信号降至基线水平(图4F)。处理288小时后,将细胞在不含外泌体的培养基中继续培养72小时,通过定量PCR(qPCR)检测细胞内HIV RNA和DNA水平,并与阳性对照进行比较。值得注意的是,阵列1、阵列4和阵列5组中的HIV gag DNA均降至检测阈值以下(图4G和4H)。这些结果明确证实了EMT-Cas12a的体外抗病毒活性以及组合治疗方法的优越性。
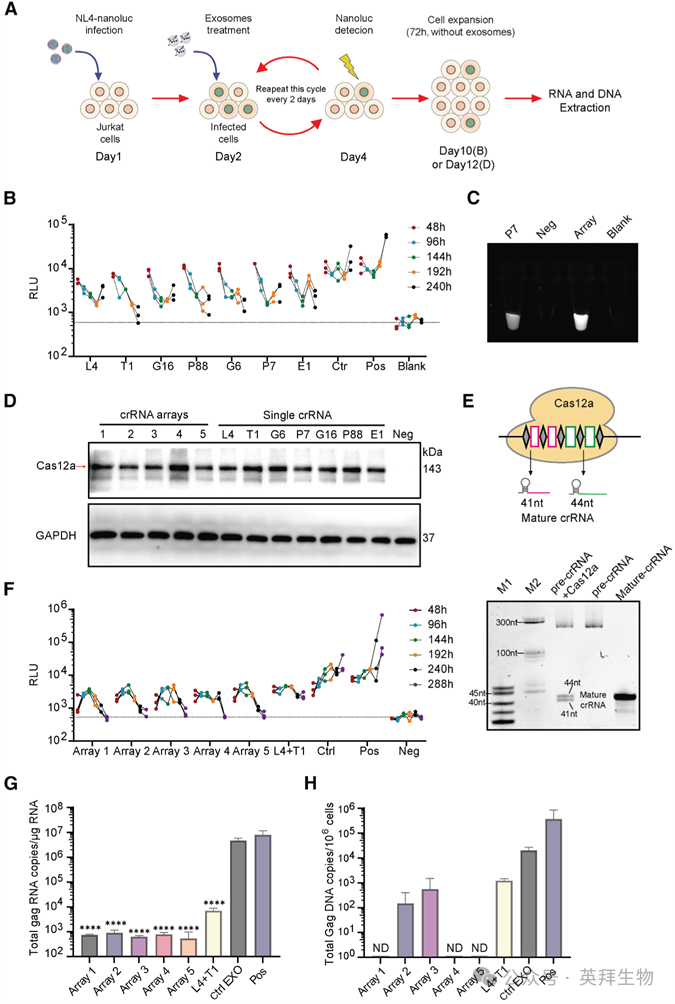
图4. 单一或串联crRNA在Jurkat细胞中测试的抗病毒活性及Cas12a递送能力
5. EMT-Cas12a处理培养物的表型与基因型分析
我们对细胞样本进行了HIV基因型测试,以定位HIV基因组中的编辑位点。对于下一代测序(NGS),感染了HIV-1 NL4-3的Jurkat细胞先用阵列3-EMT-Cas12a和阵列5-EMT-Cas12a(剂量为每细胞10^6个颗粒)预处理一次,随后培养5天。我们提取细胞DNA,PCR扩增靶向的HIV基因组区域,然后进行测序。图5A和S2显示了通过PCR产物的NGS获得的、NL4-3感染的Jurkat细胞中L4、G6、G16、P7、P88、T1、E1靶区域的序列。EMT-Cas12a处理的培养物在crRNA靶点的Cas12a切割位点处或跨越该位点显示出典型的缺失/插入突变。作为对照,细胞分别用装载了G16 crRNA的EMT-Cas12a处理。对G16处理组的NGS分析显示,仅在G16靶位点存在插入缺失突变,而在非靶向位点(如P7和T1)未观察到显著的序列变异。
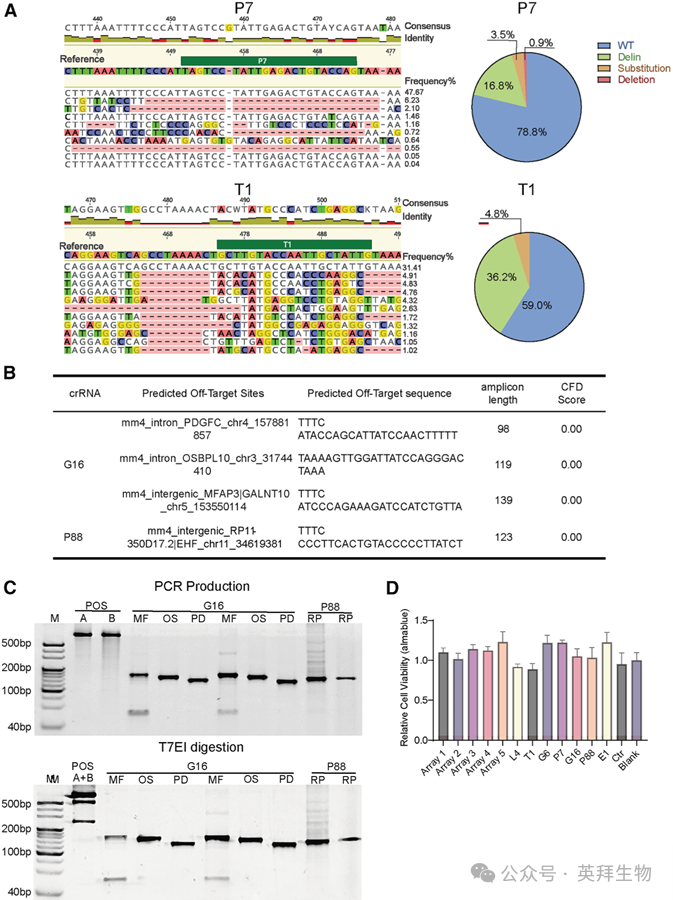
图5. EMT-Cas12a 的靶向活性和非靶向活性以及细胞毒性评估
6. EMT-Cas12a脱靶效应与药物毒性检测
我们接下来评估了被编辑细胞中潜在的脱靶效应,并根据人类参考基因组序列(GRCh38)预测了crRNA可能的脱靶位点。在所分析的七种crRNA中,只有G16和P88通过计算预测出存在脱靶位点,并设计了相应的扩增引物。根据CRISPOR生成的列表,所有预测的脱靶位点显示的CFD分数均为0.0,表明脱靶风险可忽略不计。从经G16或P88加载的EMT-Cas12a处理的Jurkat细胞中分离基因组DNA,PCR扩增包含crRNA靶位点侧翼序列的产物,并进行T7核酸内切酶I检测以探查插入缺失突变。凝胶分析表明,在所有预测的脱靶位点,与未处理的对照相比,均未出现额外的切割条带(图5C),从实验上验证了crRNA的特异性。为进一步提高脱靶检测的灵敏度,对G16和P88相同的预测脱靶位点进行了NGS测序。与T7EI结果一致,NGS分析证实这些位点不存在显著的诱变,观察到的突变频率低于检测阈值,从而为EMT-Cas12a的靶向特异性提供了高分辨率的验证。
为了评估EMT-Cas12a在长期暴露条件下对Jurkat细胞和原代人PBMCs的细胞毒性效应(细胞系基础研究及PBMC分离培养方法详见材料与方法部分),我们在这些细胞与EMT-Cas12a孵育后进行了Alamar Blue细胞活力测定。分析结果显示,Jurkat细胞和PBMCs的细胞形态和代谢活性未受影响,EMT-Cas12a处理后未观察到显著的细胞毒性(图5D)。此外,通过对用抗CD4-APC、抗CD8-BV421和7-AAD染色的PBMCs进行流式细胞术分析,我们进一步证明了EMT-Cas12a的低细胞毒性及其对T细胞亚群分类的微小影响。
7. DiR标记的EMT-Cas12a外泌体的系统分布与器官蓄积
在72小时内监测了静脉注射DiR标记的EMT-Cas12a外泌体的体内动力学和生物分布。全身成像显示了一种时间依赖性的分布模式:初始全身信号强烈,随后逐渐减弱,并伴随在腹部区域的明显蓄积。在各个时间点对获取的器官进行离体成像证实了这些观察结果,并得以进行详细的定量分析。在所有时间点,肝脏和肺始终显示出最高的荧光强度,尽管在外泌体注射48小时后信号出现明显降低。值得注意的是,肝脏和肺的荧光强度在48小时时间点均有所下降。与此同时,脾脏在所有时间点都显示出大量且相对稳定的信号。
8. EMT-Cas12a在HIV感染小鼠模型中的体内研究
我们进一步研究了EMT-Cas12a对HIV-1感染的PBMC人源化小鼠的抗HIV效果。通过静脉尾静脉注射将Ctrl EXO(不含crRNA的EMT-Cas12a)和不同的EMT-Cas12a制剂给予小鼠,并通过活体动物荧光成像系统追踪其抑制病毒复制的抗病毒功效。基于细胞实验结果,我们选择了Sicr-EMT-Cas12a(T1和L4)以及三种联合疗法(阵列1、阵列4和阵列5)进行体内实验。结果表明,在小鼠模型中,每种EMT-Cas12a制剂均能显著抑制病毒复制(图6B和6C)并降低死亡率(图6D),突显了其相对于Ctrl EXO的治疗优越性(图6B)。阳性对照组的所有小鼠在感染后第28天前死亡,而T1-EMT-Cas12a处理组的小鼠仅在36天时发生一例死亡。值得注意的是,阵列4亚组中的两只小鼠(编号A101和A129)和阵列1亚组中的一只小鼠(编号A126)显示出荧光信号降至背景水平(信号 < 10^6)。
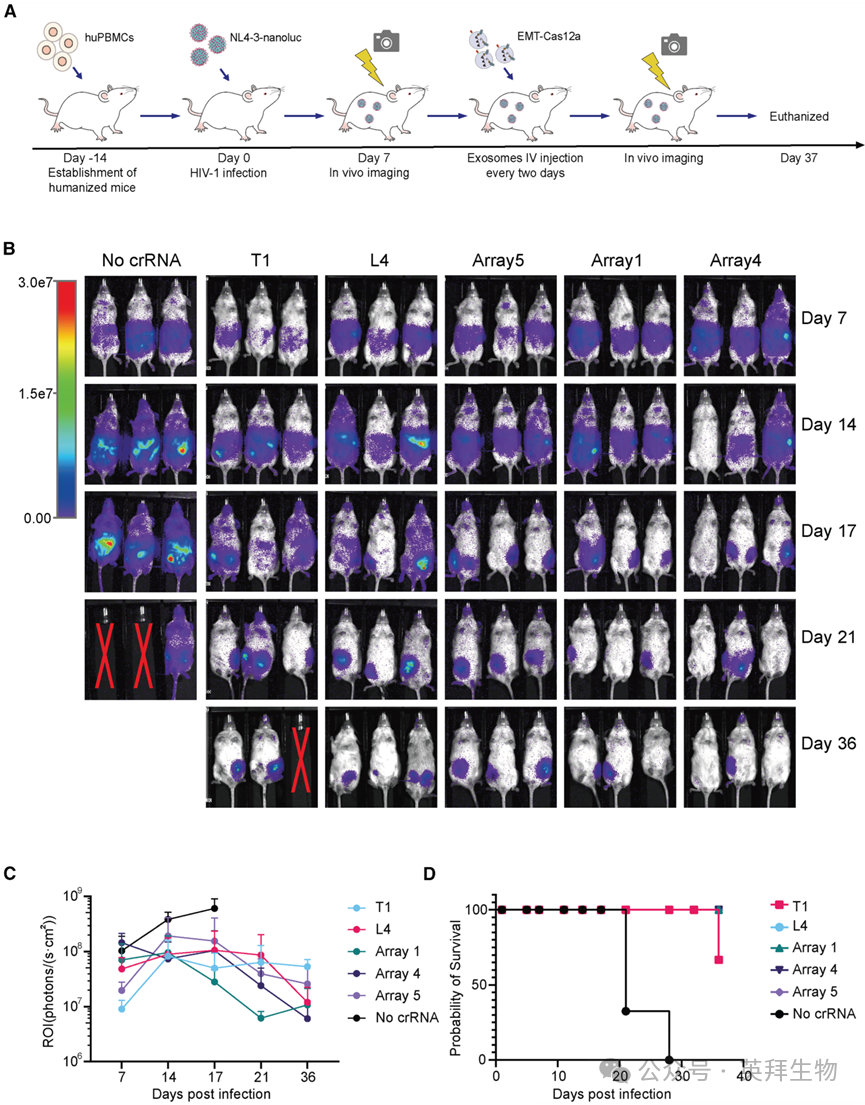
图6. EMT-Cas12a介导的HIV抑制提高了PBMC人源化小鼠的存活率
在实验终点,对小鼠实施人道Euthanasia,收集其器官和血液用于后续分析。尽管CD4+ T细胞耗竭是HIV感染的标志性特征之一,但近年来,CD4/CD8比值被认为是比单纯CD4计数更准确的临床进展标志物。因此,我们进行流式细胞术分析以评估小鼠脾脏中人源化T细胞的CD4/CD8比值(图7A和7B)。结果显示,所有EMT-Cas12a处理组都部分保留了CD4+细胞群,其中阵列4亚组的效果最为显著,其次是阵列1亚组,这与阳性对照组(CD4+ T细胞几乎完全耗竭,CD4/CD8比值 <0.002)形成鲜明对比。在阵列4亚组中,两只显示基线水平荧光信号的小鼠其CD4/CD8比值分别为1.56和0.115,而阵列1亚组中的那只小鼠比值为0.238。
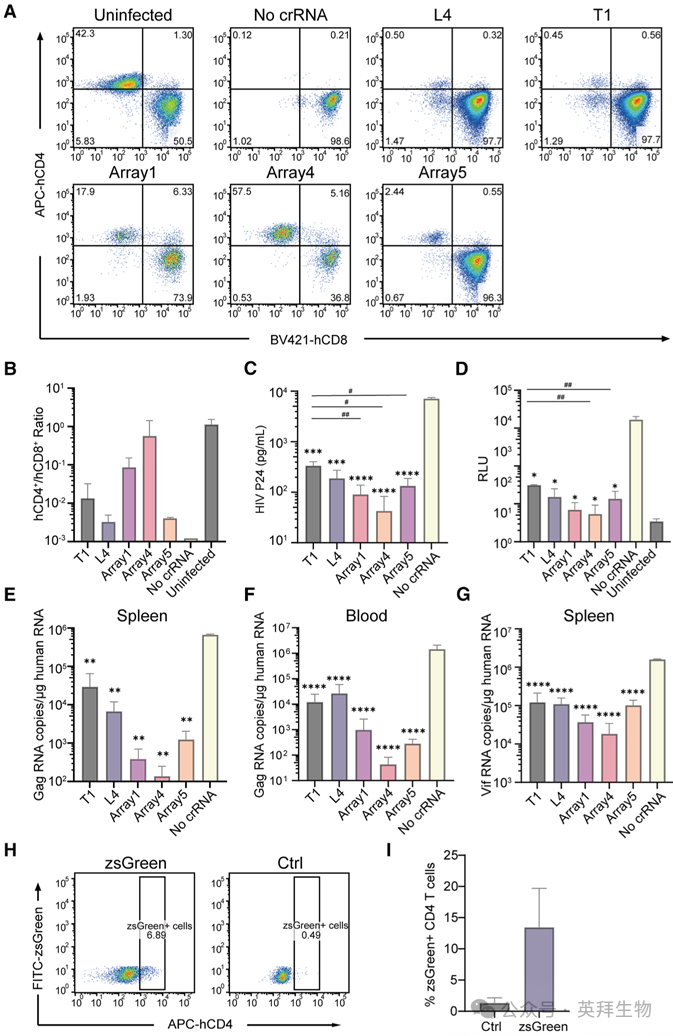
图7. EMT-Cas12a的体内多层面抗病毒分析:免疫评估、分子病毒学验证和体内摄取分析
随后,通过测量小鼠血浆中的病毒衣壳蛋白p24水平,确认了产毒性感染(图7C)。与阳性对照组相比,所有加载了crRNA的EMT-Cas12a组均显示出血浆p24水平的显著降低。此外,与单一crRNA T1组相比,阵列1、阵列4和阵列5组表现出显著更强的p24降低效果。
为分析小鼠血浆中的活性复制病毒库,用小鼠血浆(每10^4个细胞10 μL)感染C8166细胞并培养72小时以扩增感染性病毒。与无crRNA对照组相比,来自EMT-Cas12a处理小鼠的血浆再感染培养物显示出NanoLuc信号水平的显著降低,这反映了小鼠血浆内感染性病毒水平的明显下降(图7D)。阵列1和阵列4组的血浆感染性显著低于单一crRNA T1组。在加载了crRNA的EMT-Cas12a处理的小鼠中,HIV-1 Gag和Vif转录本水平有显著降低的趋势(图7E-7G)。特别是在阵列4亚组中编号为A101的小鼠体内,病毒RNA水平降至检测限以下。这些结果证明了EMT-Cas12a的体内抗病毒能力,并且与单一crRNA系统相比,Arcr-EMT-Cas12a在体内表现出更高的抗病毒效率。
接下来,为了验证移植的人CD4+ T细胞对EMT-Cas12a的摄取,向PBMC人源化小鼠通过尾静脉注射zsGreen标记或未标记的EMT-Cas12a。 注射12小时后分离PBMCs,进行流式细胞术分析以量化zsGreen+ CD4+ T细胞,这表明了向CD4+细胞的高效靶向递送(图7H和7I)。
为实现对病毒核酸更灵敏的定量,我们对一只经阵列4处理、先前qPCR检测HIV-1 RNA和DNA呈阴性小鼠的脾脏样本进行了微滴数字PCR(ddPCR)。 这些ddPCR结果证实了无可检测的病毒核酸,从而为正交验证qPCR结果提供了支持,并表明该动物体内的病毒水平低于检测限。
我们对小鼠组织进行了HIV基因型测试,以定位HIV基因组中的编辑位点。 对于NGS,我们从阵列1、4和5组的小鼠中提取脾脏DNA,并PCR扩增靶向的HIV基因组区域。仅有阵列4组中一只小鼠的T1切割位点,以及阵列5组中两只小鼠的G6、P7和T1切割位点能够被PCR扩增并随后进行测序。所有样本在crRNA靶点的Cas12a切割位点处或跨越该位点均显示出典型的缺失/插入突变(部分数据未显示)。图S6展示了通过PCR产物的NGS获得的、阵列5组中一只小鼠脾脏组织中G6、P7和T1靶区域的序列。
为了在组织水平上直观地确认HIV-1对人CD4+ T细胞的特定趋向性以及我们系统随后的抗病毒效应,我们对人源化小鼠模型的脾脏切片进行了免疫荧光分析。 未感染小鼠的脾脏显示存在预期的人CD4+ T细胞(红色),但完全无HIV-1 p24衣壳蛋白信号。与此形成鲜明对比的是,HIV-1 NL4-3感染且未经处理的对照小鼠的脾脏切片显示出丰富的p24蛋白(绿色),其与人CD4+细胞广泛共定位(在合并图像中呈黄色),证实了淋巴组织靶细胞群内存在强健且特异性的病毒复制。这一关键发现验证了我们后续体内成像中观察到的强生物发光信号确实归因于人移植物内的特异性病毒复制,非特异性背景可忽略不计。
9. EMT-Cas12a在HIV阳性受试者PBMCs离体培养物中抗病毒功效的验证
为了评估我们的细胞系和小鼠实验结果是否能在HIV阳性供体的PBMCs中重现,我们使用了四名HIV阳性受试者的PBMCs,通过CD3/CD28偶联磁珠刺激进行离体扩增细胞,用不同的EMT-Cas12a(无crRNA、T1、阵列1、阵列4和阵列5)处理细胞,并进行了流式细胞术、qPCR和具有复制能力的病毒库分析。健康供体的PBMCs用作阴性对照。
在携带CRF07_BC亚型的受试者1的PBMCs中,与阳性对照相比,EMT-Cas12a处理组的CD4+ T细胞水平显著升高。 此处,图8A-8F展示了受试者1的离体分析结果。与阳性对照组(CD4/CD8比值<0.04)相比,Arcr-EMT-Cas12a处理组的CD4+ T细胞比例和CD4/CD8比值显著增加,而T1亚组显示出减弱的治疗效果(p < 0.05)(图8A和8B)。分别通过qPCR检测了病毒RNA和整合HIV DNA的表达(图8C和8D),结果显示,与阳性对照相比,阵列4和阵列5 EMT-Cas12a显著降低了病毒RNA转录本,而所有治疗组的总细胞DNA拷贝数均表现出反常的升高。有趣的是,所有治疗组的病毒RNA/整合DNA比值均显示出显著降低,这表明EMT-Cas12a介导了前病毒转录的抑制并减轻了感染细胞的死亡(图8E)。
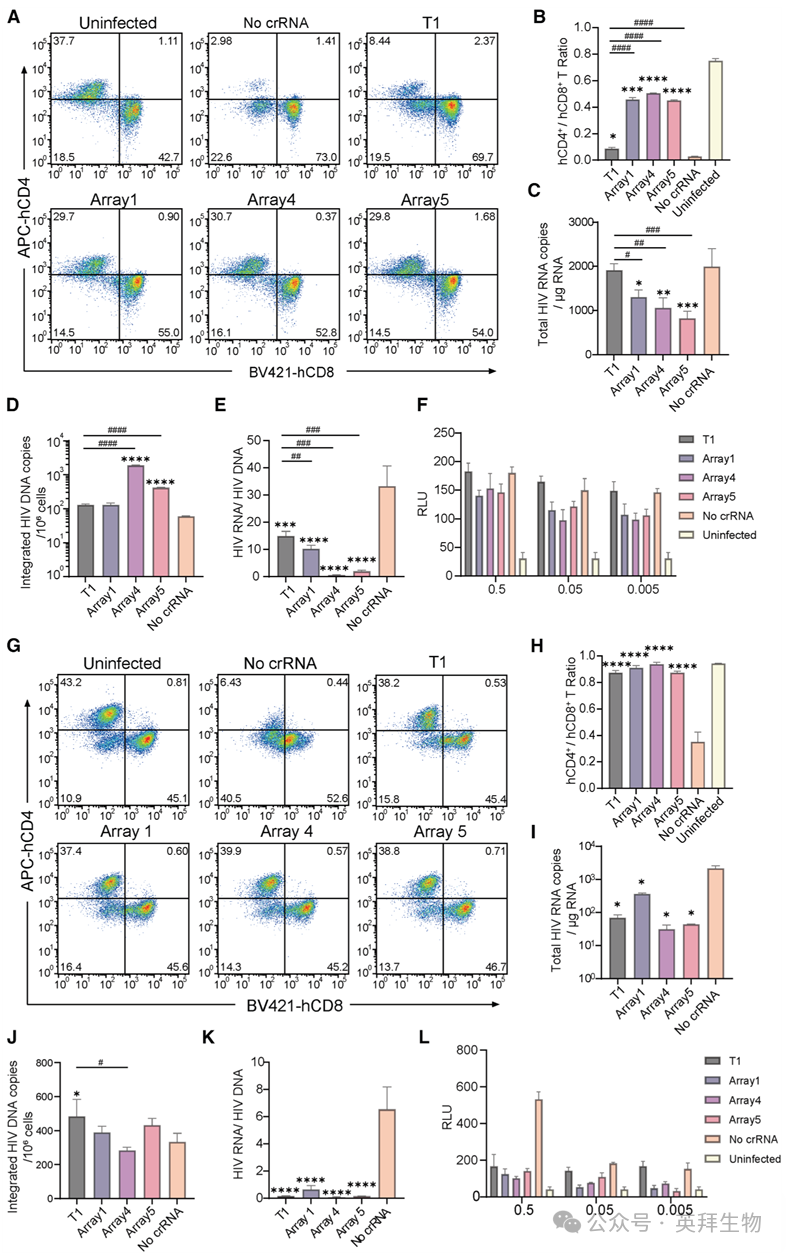
图8. EMT-Cas12a在HIV阳性受试者离体培养PBMCs中抗病毒活性的验证
通过将PBMC培养物上清液按0.5、0.05和0.005的稀释比例各取100 μL,转至提前一天接种于白色96孔板中的TZM-bl细胞中,对感染性病毒的产生进行了定量(图8F)。 数据显示,三种多重crRNA阵列型EMT-Cas12a均能有效抑制感染性子代病毒的产生。值得注意的是,T1组与阳性对照相比表现出升高的荧光素酶活性,这可能归因于:(1) 对照组中CD4+ T细胞逐渐耗竭(CD4+ T细胞比例<3%)影响了病毒产出,以及 (2) T1亚组中存在免疫逃逸特征。
对受试者2的流式细胞术分析显示,在所有治疗组中,其CD4+ T细胞比例和CD4/CD8比值的变化趋势与受试者1一致(图8G和8H)。 与受试者1相比,受试者2的CD4+ T细胞基线比例和绝对计数更高(数据未显示)。qPCR检测结果显示,与阳性对照相比,所有EMT-Cas12a治疗组的HIV RNA水平均显著下调(图8I)。值得注意的是,除T1单一crRNA治疗组外,在受试者2的其他治疗组中,与阳性对照相比,未观察到整合的HIV-1 DNA水平有统计学上的显著变化(图8J)。与阳性对照相比,经多重crRNA阵列型EMT-Cas12a处理的细胞显示出病毒RNA的明显下降,同时所有治疗组的病毒RNA/整合前病毒DNA比值均显著降低(图8K)。为验证我们的假设,我们进一步分析了培养上清液中的感染性病毒颗粒。这些结果表明,所有EMT-Cas12a处理均抑制了感染性病毒的产生,其中加载了crRNA阵列的EMT-Cas12a表现出更优的抑制功效(图8L)。
为进一步确认,我们对另外两名HIV阳性受试者的PBMCs进行了离体实验,与T1-EMT-Cas12a和Ctrl EXO相比,三种多重crRNA阵列型EMT-Cas12a治疗组在免疫细胞保护和前病毒沉默能力方面均表现出更优的效力。
通过对离体PBMC培养物进行基因型分析,我们表征了HIV基因组中的编辑位点。从受试者1经阵列5-EMT-Cas12a处理后的PBMCs中提取基因组DNA,随后通过NGS进行分析。仅G6、P7和T1切割位点通过PCR成功扩增。所有样本均在crRNA靶区域的Cas12a切割位点处或跨越该位点显示出特征性的缺失/插入突变。图S8展示了通过NGS获得的G6、P7和T1靶区域的序列。
结论:
本研究开发的抗HIV EMT-Cas12a系统,通过进一步的临床前研究,有望与联合抗逆转录病毒疗法(cART)联合应用于HIV阳性患者的临床试验,从而可能加速对HIV-1前病毒基因组的破坏并缩小潜伏病毒库的规模。此外,本文展示的结果也证明了外泌体作为HIV-1基因疗法递送载体的潜力,并预示了一个未来:将EMT-Cas12a与其他HIV治疗方法或策略相结合,或许能实现HIV的功能性治愈。
参考文献:
Ma Y, Wei W, Yang Z, Zhou Y, Dong T, Wang T, Xia X, Ma Y, Zhou M, Gao Y, Yu B, Wang C, Ruan L, Hong K, Gu C. Exosomes as nonviral carrier for targeted delivery of CRISPR-Cas12a for therapeutic HIV-1 proviral DNA editing. Mol Ther. 2025 Nov 11:S1525-0016(25)00949-9. doi: 10.1016/j.ymthe.2025.11.012. Epub ahead of print. PMID: 41229123.






