小胶质细胞TBK1信号传导促进乳腺癌脑转移
乳腺癌脑转移瘤(Breast cancer brain metastasis,BCBM)是脑肿瘤最常见和最致命的形式,其特征是肿瘤相关小胶质细胞(tumor-associated microglia, TAM)大量浸润。TAMG可以促进转移性乳腺癌细胞的播种和生长,因此需要阐明其功能的分子机制,以便开发有效的策略来靶向TAMG在BCBM中的作用。在这项研究中,作者使用BCBM患者的肿瘤样本和小鼠模型,以及体外小胶质细胞培养系统,作者证明了tank结合激酶1(TBK1)信号在TAMG中富集和激活。TBK1在TAMG中的抑制作用减少了乳腺癌细胞的上皮-间质转化、迁移、侵袭和增殖。通过对转录组谱、患者生存数据和分泌组数据的综合分析,以及随后的实验验证,GM-CSF被确定为介导TBK1调控的乳腺癌细胞转移行为的关键分泌蛋白。BCBM小鼠模型中TBK1的药理抑制可减少BCBM并延长生存期。总之,这些数据表明TAMG中的TBK1信号有助于BCBM,并且与其下游效应物GM-CSF一起,代表了这种致命疾病的有希望的治疗靶点。该文章于2025年9月发表在《Cancer Research》,IF:16.6。
技术路线:
主要研究结果:
1. TBK1信号在BCBM肿瘤的TAMG中表达并激活
为明确TBK1信号在BCBM肿瘤中的表达模式,作者分析了肿瘤免疫微环境(TIME)数据集的RNA-Seq数据。与肿瘤细胞、中性粒细胞和T细胞相比,TBK1特征在小胶质细胞和巨噬细胞中富集。为验证该结果,作者在4T1 BCBM肿瘤中进行流式细胞术分析,发现P-TBK1在CD45lowCD11b+细胞(如小胶质细胞)和CD45highCD11b+细胞(如巨噬细胞和中性粒细胞)中高表达,而在CD45-癌细胞和CD45+CD11b-淋巴细胞中几乎不表达(图1A)。既往研究强调CNS驻留髓系细胞在BCBM中的作用,促使作者聚焦TAMG中的TBK1。免疫荧光染色显示,在MDA-MB-231-Br和4T1模型(图1B)及患者(图1C)的BCBM肿瘤中,P-TBK1与小胶质细胞标志物TMEM119高度共定位。为确认TBK1能否在TAMG中被激活,作者用原发乳腺癌细胞及其配对BCBM细胞的条件培养基(CM)处理小胶质细胞。蛋白印迹显示,MDA-MB-231和BT-474细胞的CM可提高HMC3小胶质细胞中P-TBK1的表达,而MDA-MB-231-Br和BT-474-Br细胞的CM进一步放大该效应(图1D、E)。同样,4T1细胞的CM也增强了SIM-A9小胶质细胞中的P-TBK1(图1F)。综上,TBK1信号在BCBM肿瘤的TAMG中富集并被激活。
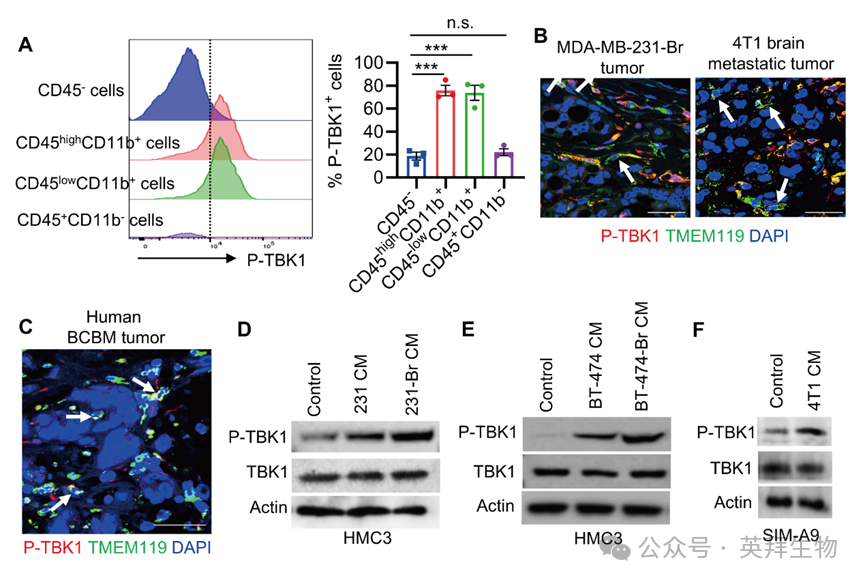
图1 TBK1信号在BCBM的TAMG中被富集和激活
2. 抑制TAMG中的TBK1可削弱乳腺癌细胞的EMT
为探究TBK1在BCBM中的作用,作者在有无TBK1抑制剂的情况下,让乳腺癌细胞与TAMG“对话”,并检测对转移至关重要的EMT过程(图2A)。模拟TME时,先用癌细胞CM“教育”小胶质细胞,再用这些肿瘤教育后的小胶质细胞上清(T-CM)处理乳腺癌细胞,以评估TAMG对癌细胞EMT、迁移和侵袭的调控(图2A)。RT-qPCR显示,HMC3和SIM-A9的T-CM可上调间质基因VIM(图2B、C)、SNAI1和ZEB1的表达;若提前用TBK1抑制剂BX795或Amlexanox(Amlex)处理小胶质细胞,这一诱导效应即被抵消。尽管T-CM本身对MDA-MB-231-Br和4T1的上皮基因CDH1表达无显著影响,但加入BX795或Amlex后,CDH1水平显著回升(图2D、E)。蛋白层面,微胶质T-CM升高了癌细胞中间质标志物vimentin和N-cadherin的蛋白量,而BX795或CMPD-1可逆转这一变化;同时,经TBK1抑制剂处理的微胶质细胞所分泌的T-CM,还能上调MDA-MB-231-Br和4T1细胞中上皮标志物E-cadherin的蛋白水平(图2F、G)。综上,TBK1信号对TAMG诱导的乳腺癌细胞EMT不可或缺。
3. TBK1在TAMG中的抑制作用会损害乳腺癌细胞的迁移、侵袭和增殖
为确认TBK1调控的TAMG在BCBM中的功能,本研究采用Transwell体系开展体外实验。结果显示,原代人小胶质细胞及HMC3小胶质细胞来源的T-CM显著增强MDA-MB-231-Br与BT-474-Br细胞的横向迁移能力;在小胶质细胞阶段予以TBK1抑制剂BX795或CMPD-1干预后,该促迁移效应被完全阻断(图2H、2I)。同样,BX795与CMPD-1可消除原代小鼠小胶质细胞及SIM-A9小胶质细胞T-CM诱导的4T1细胞迁移增强(图2J)。侵袭实验进一步表明,上述人源及HMC3小胶质细胞T-CM可显著提升MDA-MB-231-Br与BT-474-Br细胞的跨基质侵袭能力;于小胶质细胞水平实施TBK1药理抑制后,该增强作用被完全拮抗(图2K、2L)。4T1细胞在接受原代小鼠小胶质细胞及SIM-A9小胶质细胞T-CM处理时亦呈现一致结果,TBK1抑制剂的存在使其侵袭能力恢复至基线水平(图2M)。综上,TAMG内TBK1信号活性是乳腺癌细胞迁移、侵袭及增殖能力获得的关键调控节点。
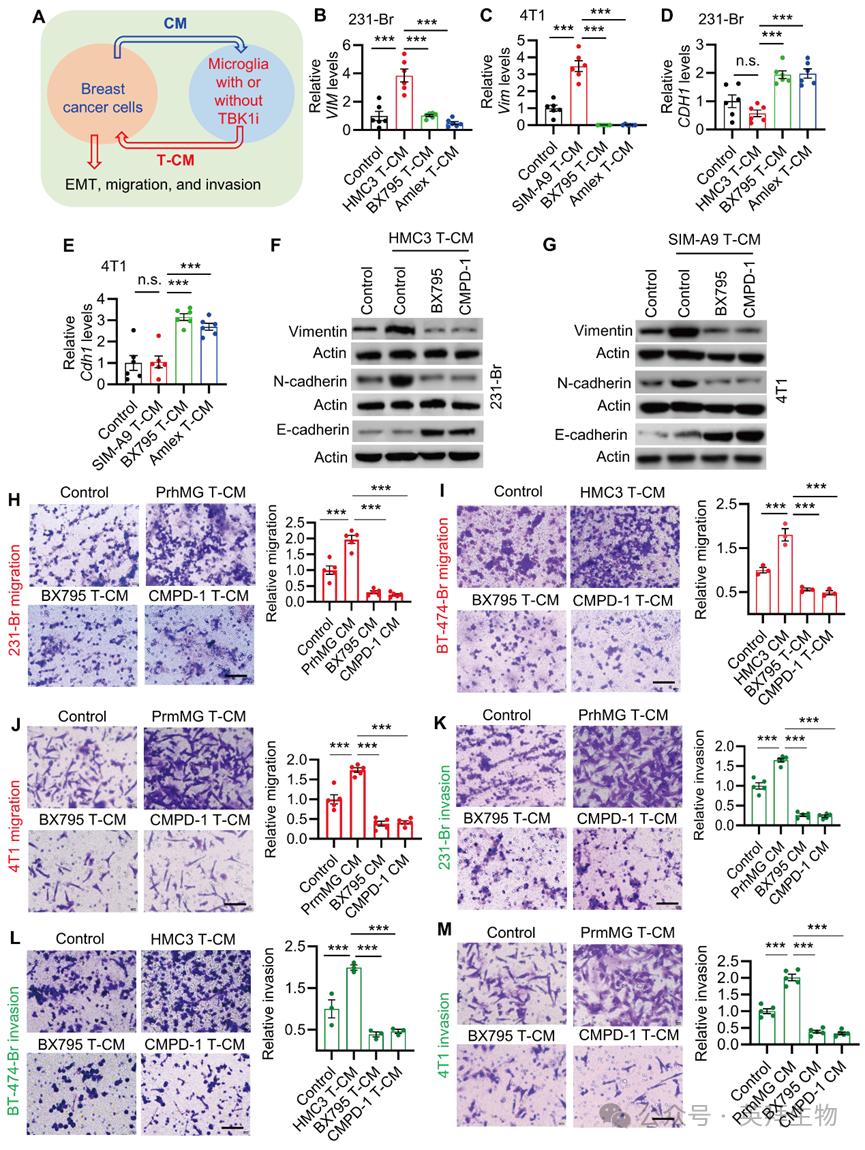
图2 TBK1介导的TAMG促进乳腺癌细胞EMT、迁移和侵袭
为明确TAMG内TBK1信号对乳腺癌细胞增殖及存活的影响,作者采用CFSE增殖实验与Annexin V/PI凋亡检测。结果显示,HMC3与SIM-A9小胶质细胞来源的T-CM可显著促进MDA-MB-231-Br、BT-474-Br及4T1细胞的增殖;而在小胶质细胞层面以BX795或CMPD-1抑制TBK1后,上述促增殖效应被完全抵消。值得注意的是,TBK1抑制并未诱导MDA-MB-231-Br、BT-474-Br或4T1细胞发生明显凋亡。为进一步验证TAMG-TBK1对转移的特异性调控作用,作者在癌细胞内分别实施TBK1基因敲低及药理学抑制。结果表明,4T1与MDA-MB-231-Br细胞自身TBK1活性的丧失并未改变其增殖、凋亡及EMT表型。综上,TBK1信号在TAMG而非癌细胞自主层面,对乳腺癌细胞的迁移、侵袭及增殖具有决定性调控作用。
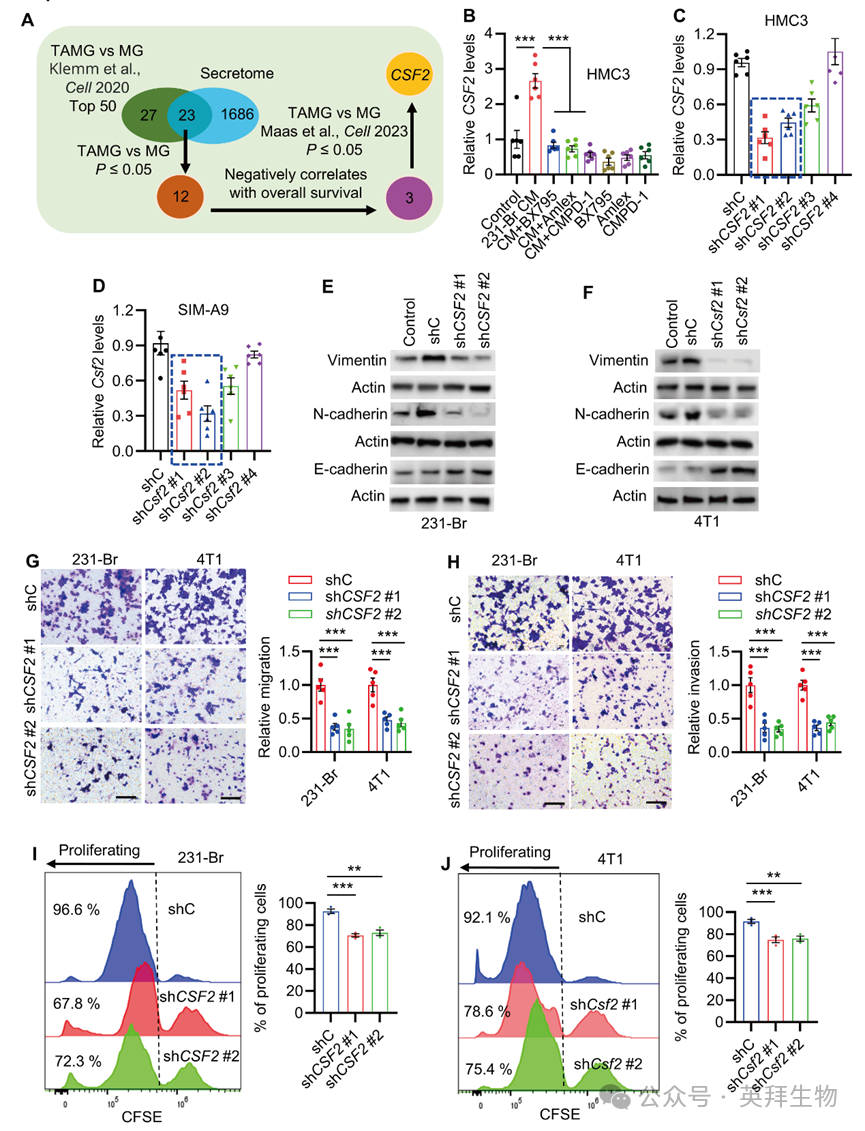
图3 TBK1调控的GM-CSF在TAMG中促进乳腺癌细胞的EMT、迁移和侵袭
4. 小胶质细胞TBK1信号通过分泌GM-CSF促进乳腺癌细胞EMT、迁移、侵袭及增殖
为阐明TBK1调控的TAMG在BCBM中的功能机制,本研究采用以下无偏策略:①利用TIME数据集筛选TAMG相较正常小胶质细胞显著上调的前50个基因(P≤0.05);②结合人分泌蛋白组数据库锁定编码分泌蛋白的基因;③保留与BCBM患者总生存期呈负相关的基因;④在独立TIME数据集中验证上述基因在TAMG中的富集。综合筛选后,CSF2(编码GM-CSF)被确定为关键候选因子(图3A)。
为验证TBK1对CSF2的调控作用,以MDA-MB-231-Br细胞条件培养基(CM)刺激HMC3小胶质细胞,并施加TBK1抑制剂BX795、CMPD-1或Amlex。RT-qPCR结果显示,MDA-MB-231-Br CM诱导的CSF2表达上调可被TBK1抑制剂完全阻断(图3B)。进而,利用shRNA在HMC3及SIM-A9小胶质细胞中敲低CSF2(图3C、3D),发现肿瘤教育后的小胶质细胞CSF2缺失可下调MDA-MB-231-Br及4T1细胞中vimentin、N-cadherin表达,并上调E-cadherin(图3E、3F)。对应地,接受CSF2敲低小胶质细胞T-CM处理的MDA-MB-231-Br及4T1细胞,其迁移(图3G)、侵袭(图3H)及增殖能力(图3I、3J)均显著降低。
最后,于4T1细胞中敲低CSF2受体CSF2RA,以验证GM-CSF是否通过该受体发挥功能。结果表明,CSF2RA缺失可完全阻断GM-CSF诱导的EMT、迁移、侵袭及增殖。综上所述,TBK1调控的GM-CSF是TAMG诱导乳腺癌细胞EMT、迁移、侵袭及增殖的关键介导因子。
5. TBK1抑制减轻BCBM并延长生存期。
为在体验证TBK1信号在BCBM中的功能,本研究经颈内动脉注射将MDA-MB-231-Br细胞接种至裸鼠,构建脑转移模型,随后给予具有中枢穿透性的TBK1抑制剂BX795或Amlex。结果显示,TBK1抑制显著降低脑转移负荷(图4A)并延长总生存期(图4B)。进一步探究TBK1对已定植BCBM的作用时,采用颅内直接注射MDA-MB-231-Br细胞的方式模拟肿瘤已驻留脑实质的状态。BX795或Amlex治疗仍可抑制脑内肿瘤继续扩增(图4C)。组织学层面,免疫荧光检测显示,经BX795或Amlex处理后,BCBM组织中EMT相关间充质标志物N-cadherin、vimentin及增殖标志物Ki67表达下调(图4D-4F),而上皮标志物E-cadherin表达上调(图4G)。综上,TBK1在BCBM进展中具有关键调控作用,并支持其作为BCBM患者潜在治疗靶点。
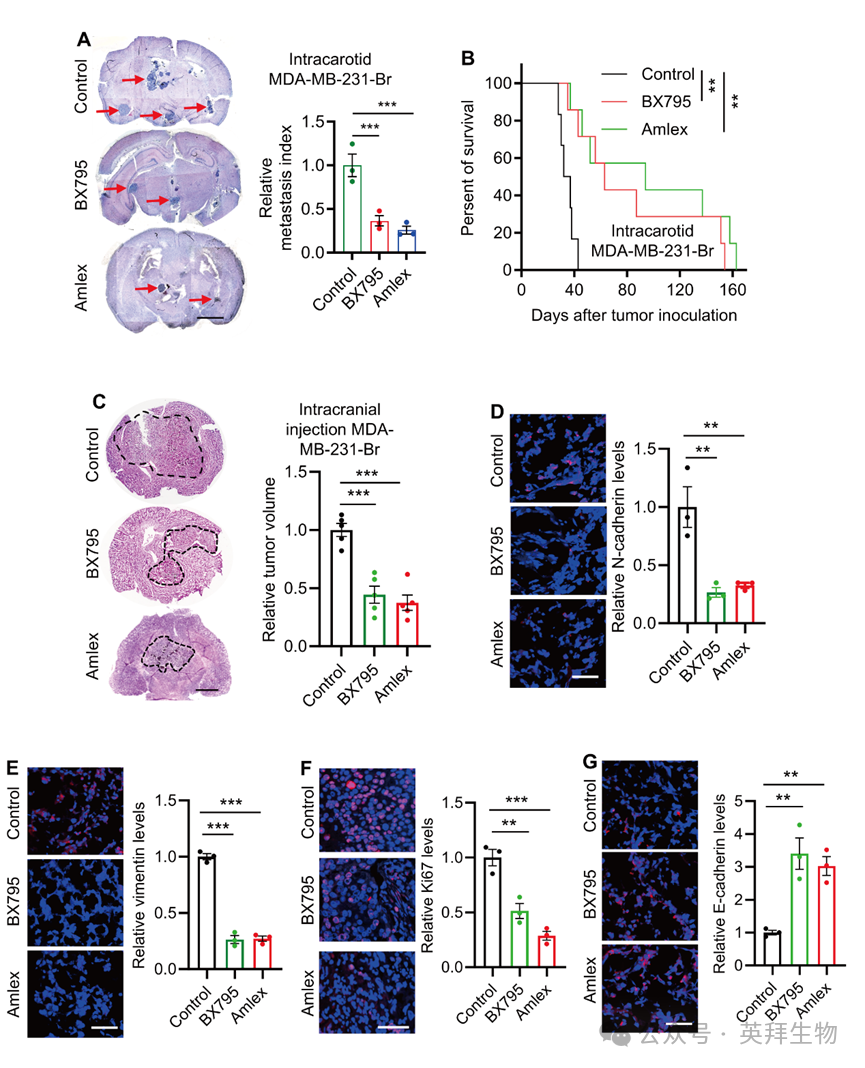
图4 抑制TBK1可减少BCBM和EMT,延长生存期
结论:
本研究证实,TBK1在乳腺癌脑转移(BCBM)肿瘤相关小胶质细胞(TAMG)中呈显著富集且活性增强,其信号通过诱导乳腺癌细胞发生上皮-间充质转化(EMT)、迁移及侵袭,从而加速脑转移进程。在BCBM小鼠模型中,给予具有中枢穿透性的TBK1抑制剂可显著降低脑转移负荷、抑制已定植肿瘤的颅内生长,并延长总体生存期。上述发现不仅阐明了TAMG促进BCBM的分子机制,亦提示TBK1具备可转化的治疗靶点价值。
参考文献:
Fatima Khan, Edgar Petrosyan, Yang Liu, Atousa Bahrami, Erfan Taefi, Changiz Geula, Maciej S. Lesniak, Peiwen Chen; Microglial TBK1 Signaling Promotes Breast Cancer Brain Metastasis. Cancer Res 2025






