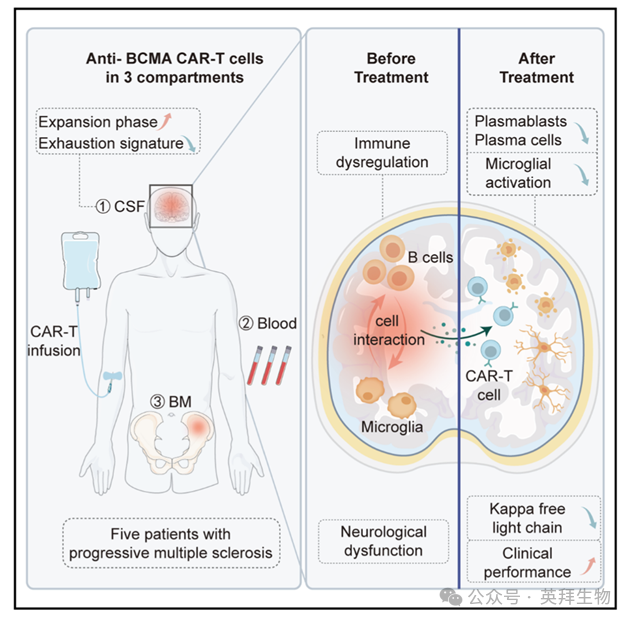
抗BCMA CAR-T疗法治疗进行性多发性硬化症患者
进行性多发性硬化症(PMS)以疾病持续进展为特征,目前缺乏有效治疗手段。尽管近期研究强调B细胞在驱动PMS发病机制中中枢神经系统(CNS)局部炎症反应的关键作用,但现有B细胞清除疗法(如CD20单克隆抗体)仍面临难以靶向CNS内浆细胞的挑战。本研究在一项正在进行的I期临床试验(ClinicalTrials.gov注册号:NCT04561557)中,采用抗B细胞成熟抗原(BCMA)嵌合抗原受体T细胞(CAR-T)疗法治疗了5例PMS患者(1例原发进展型与4例继发进展型)。治疗过程中仅观察到1级细胞因子释放综合征,所有≥3级的血细胞减少均发生在输注后40天内。同时,我们检测到CNS腔室中浆细胞被清除、脑脊液中CAR-T细胞持续扩增且耗竭状态缓解,以及小胶质细胞活化减弱。这些发现为抗BCMA CAR-T疗法推进PMS临床管理提供了新思路。该研究于2025年10月发表在《Cell》,IF 42.5分。
技术路线:
主要研究结果:
1、临床评估与PMS患者体内CAR-T细胞动力学
5例PMS患者(1例PPMS,4例SPMS,图1A)于2024年6月3日至11月8日入组,男女比例为4:1。基线特征见表S1。起病平均年龄37.0±7.6岁(30–50岁),入组时平均年龄47.0±7.7岁(36–55岁),基线EDSS 6.2±0.4分(6–7分)。入组前用药:糖皮质激素(5/5)、S1P调节剂(4/5)、DHODH抑制剂及抗CD20单抗(3/5)。所有MS药物于淋巴细胞清除前1天停用。按1.0×10⁶ cells/kg体重输注抗BCMA CAR-T细胞;预处理方案为氟达拉滨+环磷酰胺(-4、-3、-2天)。淋巴细胞清除显著减少T、B、NK亚群,而IgG、IgA、IgM水平无显著变化。CAR-T细胞约第10天达血峰,随后3个月内可在血液、脑脊液(CSF)及骨髓中持续检出(图1B、1C)。5例中4例(80%)出现1级细胞因子释放综合征(CRS),无≥2级CRS;CRS中位发生时间7.5天(6–9天),中位持续8.5天(4–12天)。5例循环细胞因子2周内达峰后下降。所有≥3级血细胞减少均发生在输注后40天内,无≥3级贫血或血小板减少。成像流式显示CAR-T与CD138⁺浆细胞直接结合(图1D);流式证实淋巴细胞清除及CAR-T输注后B系细胞显著减少(图1E)。5例EDSS评分改善,9孔插棒试验与25英尺步行时间显著缩短,4例CSF神经丝轻链(NfL)下降(图1A、1F、1G)。MRI未见新发活动:无新T1增强病灶,无新/扩大T2病灶;2例T2病灶体积缩小。
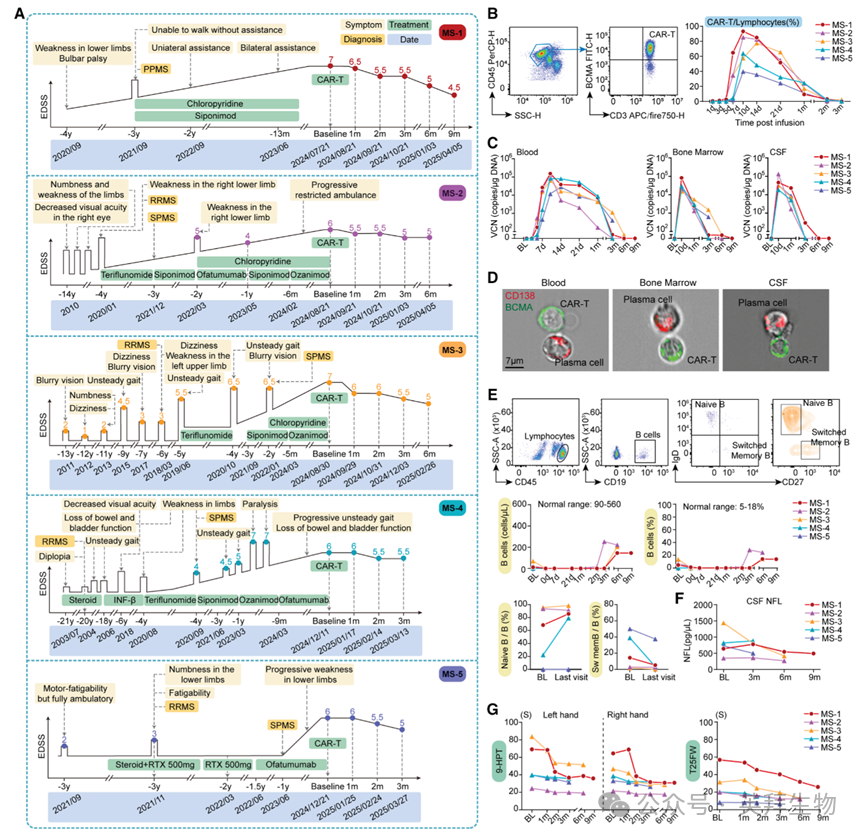
图1:CAR-T细胞治疗后的临床评价和CAR-T细胞动力学
2、CAR-T细胞在PMS治疗中的动态
为解析抗BCMA CAR-T细胞动力学,对5例患者在基线、治疗后多个时间点及回输产物进行单细胞多组学分析(scRNA-seq、scTCR/BCR-seq、CITE-seq、scATAC-seq;图2A)。质控后获498 114个高质量细胞,依经典标志分为17亚群(图2B)。重聚类217 820个T细胞得17亚群,其中199 712个(91.7%)带可检测TCR(图2C)。依CAR基因与蛋白表达在各腔室鉴定CAR-T细胞(图2C)。TCR克隆分析显示,PPMS与SPMS患者外周血及骨髓CAR-T细胞约第10天显著扩增,多个克隆≥10条相同TCR序列(图2D);相反,CSF中CAR-T细胞10天时克隆扩增有限、多样性高,1个月时扩增更明显,S/G2/M期克隆及≥10相同TCR序列比例增高(图2D、2E)。克隆相似性分析提示扩增期(*标)各腔室CAR-T细胞及1个月CSF CAR-T细胞显著重叠(图2F),提示最大扩增期跨腔室迁移增强。
克隆追踪显示,扩增期PPMS与SPMS患者三腔室CD8⁺效应T/CD8⁺效应记忆T(CD8T_GZMB/CD8T_GZMK)增幅最大,可能源自回输产物中周期细胞并持续至后续时点(图2G),保障靶细胞杀伤。消退期纵向分析显示,当CAR-T细胞即将消失时,CSF优先保留CD4⁺Tem(CD4T_GZMK)群体,可能来自CD4_GZMK驻留或CD4_GZMK_IL-7R分化(图2H)。基因模块评分提示,与其他两腔室相比,CSF中CAR-T细胞毒性相当但耗竭表型更低,可能因氧化应激及线粒体功能障碍减弱(图2I)。骨髓CAR-T细胞氧化应激显著,scATAC-seq显示氧化应激及T细胞耗竭相关转录因子(SMAD4、ID3等)表达升高(图2J),可能缩短其持续存在时间。
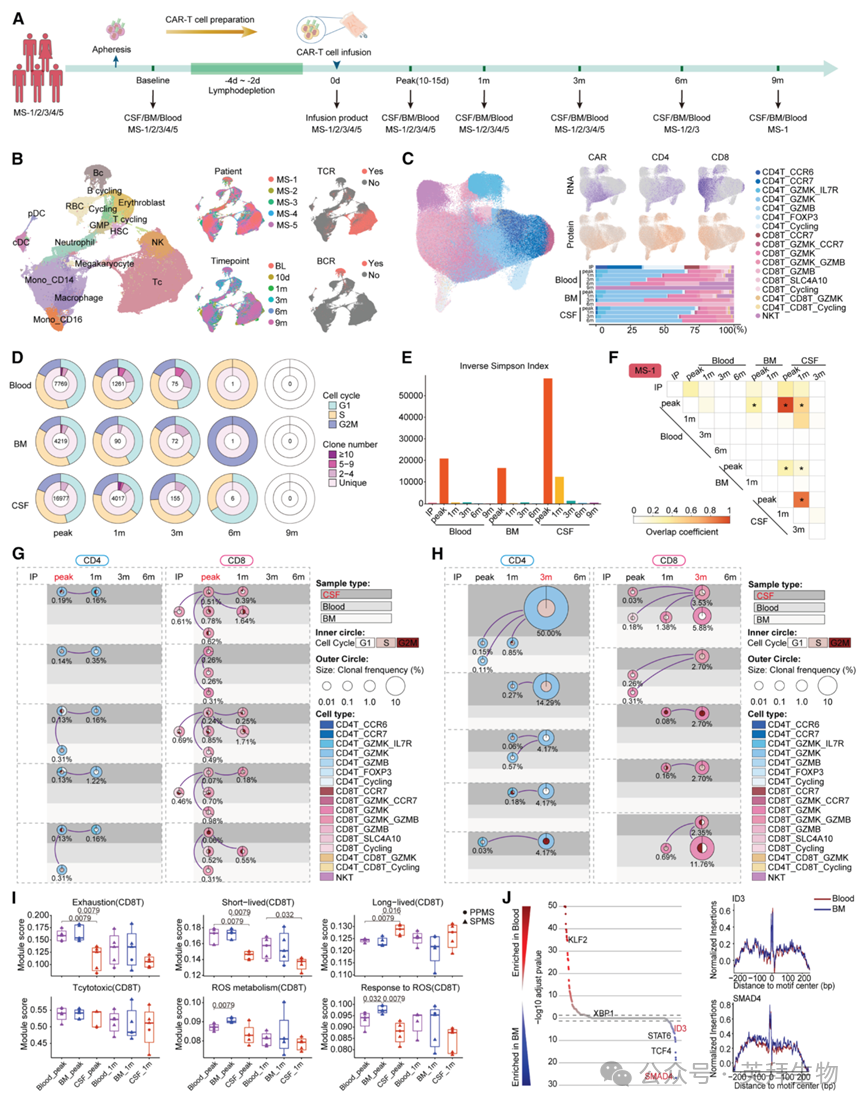
图2:抗BCMA CAR-T细胞动力学治疗经前综合征
3、CAR-T治疗后B细胞谱系的变化
鉴于B细胞系是CAR-T的靶点,我们对13 537个B细胞重新聚类并注释为5大亚群:CLP/proB、preB/ImmatureB、NaiveB、MemoryB及PB/PC,其中11 530个(85.1%)可检出BCR(图3A)。BCR分析显示,三腔室IGHV基因分布相似,IGHV1、IGHV3、IGHV4占比更高。与既往报道一致,13 IgG与IgA突变频率/数目显著高于IgM,且PB/PC高于其他B细胞;各腔室间突变频率/数目无显著差异。值得注意的是,CSF中PB/PC的CDR3区R/S比值(>1.5)明显高于健康对照(~1)9,14(图3B),PPMS患者尤为突出,提示CSF PB/PC受更强抗原选择压力,可能在PMS病理中起重要作用。尽管MS-4与MS-5两名患者在CAR-T治疗前接受过CD20单抗,B细胞极少(图1E),三腔室仍残存一定数量的PB/PC推动疾病进展(图3C、3D)。抗BCMA CAR-T输注后,光谱流式与scRNA-seq均证实三腔室PB/PC在3个月内显著清除,随后PPMS与SPMS患者PB/PC恢复至正常范围且突变频率/数目及R/S比值降低(图3C–3F),提示B细胞谱系趋于正常。血清游离轻链持续下降、OCB部分消失及CSF免疫球蛋白水平降低,进一步验证抗BCMA CAR-T的卓越疗效(图3G)。
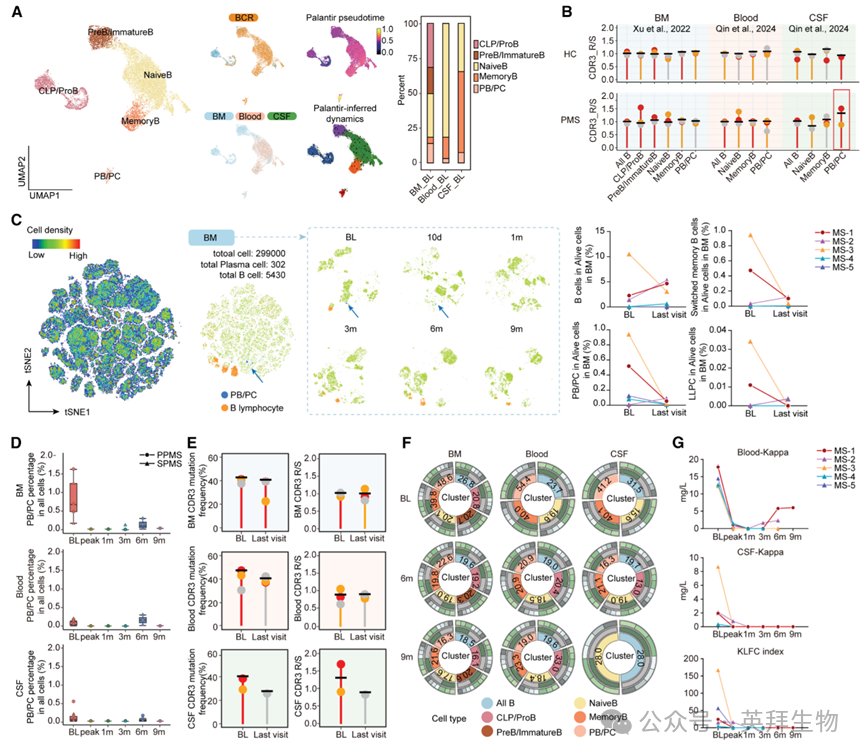
图3:CAR-T细胞治疗后B细胞谱系的改变
4、CAR-T细胞逆转PMS患者CSF免疫失调
随后,我们评估CAR-T对5例PMS患者CNS免疫微环境的免疫调节作用。基线CSF各类免疫细胞炎症通路分析显示,髓系细胞是介导神经炎症的主要集群(图4A),与既往报道一致9,15。进一步重聚类全部髓系细胞得11亚群(图4B),其中CSF特异的巨噬细胞/小胶质细胞亚群依经典标志再分为巨噬样细胞与小胶质样细胞(图4B)。细胞互作分析表明,B细胞与小胶质样细胞交互最强,输入与输出强度均显著升高,可在PPMS与SPMS患者中主要介导神经炎症反应(图4C–4E),提示B细胞激活的小胶质样细胞可能是驱动PMS神经炎症的关键亚群。抗BCMA CAR-T输注并有效清除B细胞后,小胶质样细胞炎症相关通路显著下调(图4F),CSF各免疫细胞间交互强度明显降低,尤以髓系细胞为著(图4G),Luminex检测亦显示促炎细胞因子水平下降(图4H)。此外,采用第二代TSPO示踪剂[11C]PBR28的MR-PET显像显示,3例患者病灶相关小胶质细胞活化显著减轻(图4I),另2例治疗前后未见明显摄取。综上,靶向PC的BCMA-CAR-T治疗可逆转这5例PMS患者的CSF免疫失调。
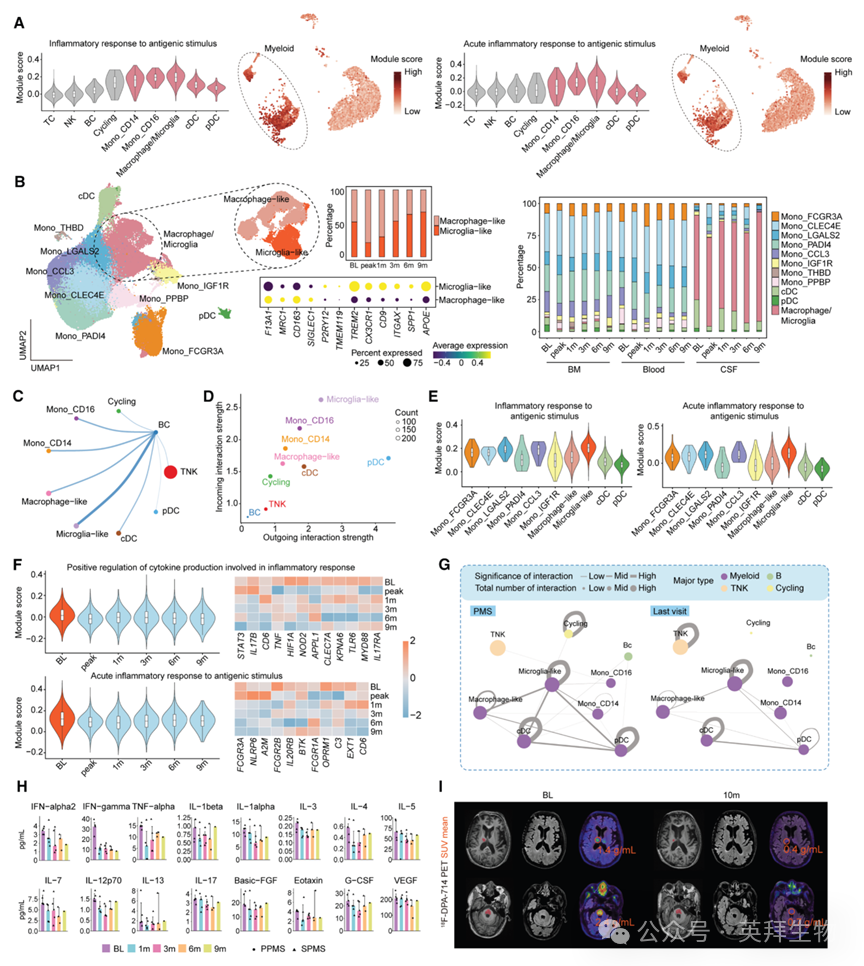
图4:CAR-T细胞逆转经前期综合征患者脑脊液免疫失调
结论:
综上所述,作者首次将抗BCMA CAR-T细胞疗法用于进展型多发性硬化症,证实其安全穿透中枢神经并持续清除致病浆细胞。治疗同时重塑中枢免疫微环境,缓解小胶质细胞炎症并带来临床功能改善。该研究为迄今缺乏有效疗法的进展型MS提供了可扩展的细胞免疫干预新策略。
参考文献:
Qin C, Dong MH, Zhou LQ, Chu YH, Pang XW, He JY, Shang K, Xiao J, Zhu L, Ye H, Cai SB, Wang D, Bu BT, Meyer Zu Hörste G, Li CR, Tian DS, Wang W. Anti-BCMA CAR-T therapy in patients with progressive multiple sclerosis. Cell. 2025 Oct 15:S0092-8674(25)01088-8. doi: 10.1016/j.cell.2025.09.020. Epub ahead of print. PMID: 41101309.






