富马酸二甲酯通过激活mDNA-cGAS-STING 通路重编程宫颈癌细胞,增强抗肿瘤免疫效应
宫颈癌(CC)仍是全球女性重大健康威胁,晚期及复发转移病例治疗手段有限,现有 PD-1/PD-L1 抑制剂、过继性 T 细胞治疗等免疫疗法应答率与持久性均偏低。富马酸二甲酯(DMF)作为 FDA 批准的自身免疫病治疗药物,已在多种癌症中显直接抗肿瘤活性,但对 CC 抗肿瘤免疫的作用及机制不明。以 CC 细胞系(TC-1、SiHa)、小鼠移植瘤及 PDX 模型为对象,结合 RNA-seq、qPCR、免疫印迹、流式细胞术等技术,探究 DMF 疗效与机制,并测试其与抗 PD-1/TIL 的联合效果。该文结果表明DMF诱导体外CC细胞线粒体功能障碍,促使mtDNA释放至细胞质,激活cGAS-STING-TBK1通路及I型干扰素应答,促进CCL5/CXCL10分泌,最终增强CD8⁺T细胞浸润;小鼠模型中DMF与抗PD-1联合显协同效应,PDX模型中DMF提升过继转移T细胞疗效。该研究明确DMF通过mtDNA-cGAS-STING通路重编程CC细胞,为其作为免疫佐剂联合现有疗法、改善CC临床结局提供新依据。这篇文章于2025年10月发表于《Journal of Biomedical Science》期刊上,IF:12.1。
研究技术路线:
主要实验结果:
1、富马酸二甲酯(DMF)通过CD8⁺T细胞介导的机制增强抗宫颈癌免疫效应
既往研究表明,富马酸二甲酯(DMF)处理可在多种癌症中实现肿瘤消退和/或减少转移。为在宫颈癌(CC)中验证上述结果并探索潜在机制,作者首先在经TC-1细胞系接种构建的免疫缺陷(裸鼠)移植瘤模型中,检测了DMF的治疗效果(图1A)。值得注意的是,本研究中DMF的给药剂量为临床等效剂量(即30mg/kg体重),该剂量已在多种自身免疫病小鼠模型中应用。结果显示,免疫缺陷小鼠经DMF处理后,肿瘤生长未出现显著变化(图1B、C),尽管体外实验中DMF对宫颈癌细胞表现出一定的杀伤作用。有趣的是,当将相同实验体系应用于免疫功能正常小鼠时(图1D),DMF处理可显著抑制肿瘤生长(图1E、F)。上述结果提示,尽管DMF具有抗宫颈癌潜力,但其效应的发挥依赖于功能完整的免疫系统。
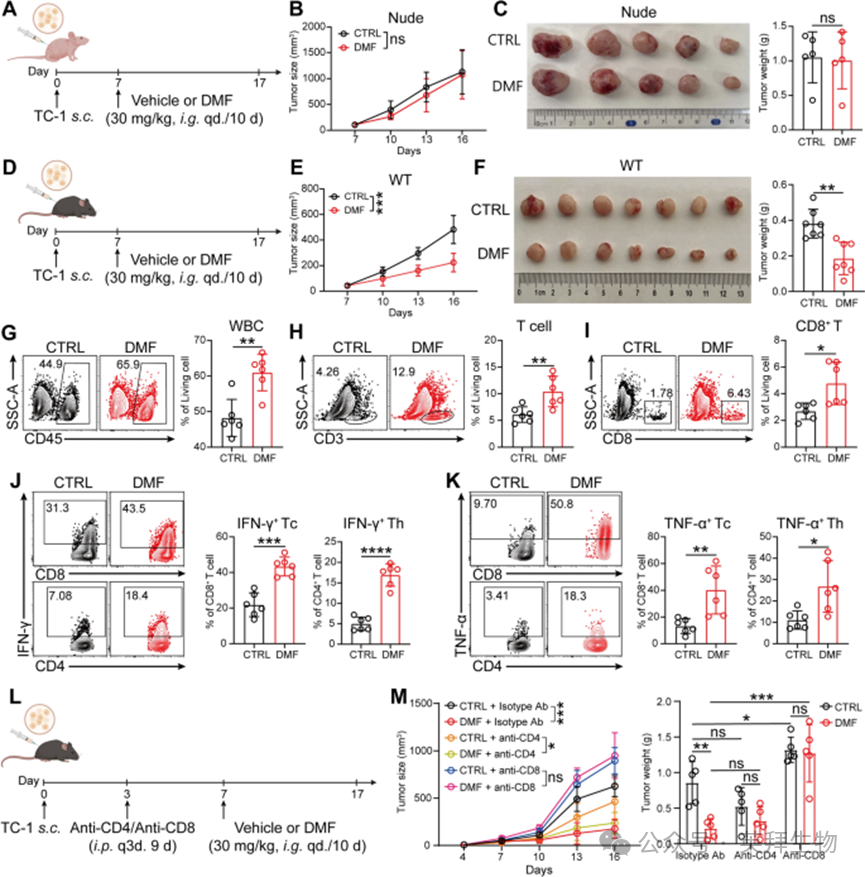
图1 富马酸二甲酯(DMF)通过 CD8⁺T 细胞介导的机制增强抗宫颈癌(CC)免疫效应
作者通过流式细胞术对免疫功能正常小鼠的肿瘤组织进行免疫表型分析。与对照组相比,DMF处理显著增加了肿瘤组织中浸润白细胞的数量(图1G),其中T细胞浸润的增加尤为显著(图1H)。进一步的亚群分析显示,DMF处理可显著增强CD8⁺T细胞在肿瘤组织中的浸润(图1I),而CD4⁺T细胞的总体比例基本无变化。值得注意的是,DMF处理可显著扩增多种效应T细胞亚群,包括IFN-γ⁺CD8⁺T细胞、IFN-γ⁺CD4⁺T细胞(图1J)、TNF-α⁺CD8⁺T细胞、TNF-α⁺CD4⁺T细胞(图1K)以及IL-17A⁺CD4⁺(Th17)细胞。这些结果提示,DMF可能通过招募和激活炎性CD8⁺T细胞与CD4⁺T细胞,增强免疫介导的抗宫颈癌应答。
对于其他浸润免疫细胞,DMF处理对自然杀伤(NK)细胞、树突状细胞(DC)或常规DC亚群(包括cDC1、cDC2和双阳性DC)的比例无显著影响,也不影响巨噬细胞数量或CD206⁺巨噬细胞的极化。在免疫抑制细胞群体中,DMF显著增加了单核细胞样髓系抑制细胞(M-MDSCs)的比例,但对粒细胞样髓系抑制细胞(G-MDSCs)、调节性T细胞(Tregs)以及CD8⁺T细胞上衰竭标志物PD-1和TIM-3的表达均无影响。
为进一步明确T细胞亚群在DMF介导的抗肿瘤效应中的作用,作者在DMF治疗小鼠模型中选择性清除CD8⁺T细胞和CD4⁺T细胞(图1L)。结果显示,清除CD8⁺T细胞(图1M)而非CD4⁺T细胞,可显著逆转DMF的抗宫颈癌效应,这进一步证实了CD8⁺T细胞在介导DMF诱导的抗宫颈癌免疫应答中的关键作用。
2、富马酸二甲酯通过增强肿瘤细胞的免疫原性,促进CD8⁺T细胞介导的抗宫颈癌免疫效应
鉴于CD8⁺T细胞在DMF介导的抗宫颈癌免疫应答中起关键作用,作者推测DMF是否通过直接作用于CD8⁺T细胞发挥效应。为此,作者纯化了初始CD8⁺T细胞,并在T细胞刺激条件下用DMF/富马酸单甲酯(MMF)或培养基处理。结果显示,DMF/MMF处理显著抑制CD8⁺T细胞的增殖。此外,尽管DMF/MMF处理后CD8⁺T细胞中细胞毒性亚群的比例升高,但其总数量显著减少,导致细胞毒性T细胞的绝对数量下降。因此,DMF处理引起的CD8⁺T细胞浸润增加和抗肿瘤功能增强,可能源于间接机制。
接下来,作者探究DMF是否通过不依赖肿瘤细胞的方式在体内调节包括CD8⁺T细胞在内的免疫细胞。为此,作者给无肿瘤的免疫功能正常小鼠口服与肿瘤模型中相同剂量的DMF。对小鼠外周血的流式细胞术分析显示,T细胞的总体比例及各T细胞亚群的比例均无显著变化。这些结果表明,DMF不会直接或广泛改变外周免疫细胞组成,因此其观察到的免疫刺激效应可能通过作用于肿瘤细胞实现。
这一推测与既往研究结论一致——肿瘤细胞免疫原性的改变可影响肿瘤微环境中免疫细胞的功能。为验证这一假设,作者在体外先用DMF或MMF处理TC-1细胞,再将其接种到免疫缺陷或免疫功能正常小鼠体内(图2A、D)。与体内治疗模型类似,在免疫缺陷小鼠中,经DMF/MMF处理与未处理的TC-1细胞的生长无显著差异(图2B、C);而在免疫功能正常小鼠中,肿瘤生长受到显著抑制,且DMF预处理组中有部分小鼠未形成肿瘤(图2E、F)。此外,肿瘤生长受显著抑制的小鼠,其肿瘤组织中CD8⁺T细胞的浸润增加,且效应功能增强(图2G-L)。这些结果表明,DMF通过作用于肿瘤细胞,间接促进CD8⁺T细胞介导的抗肿瘤免疫。
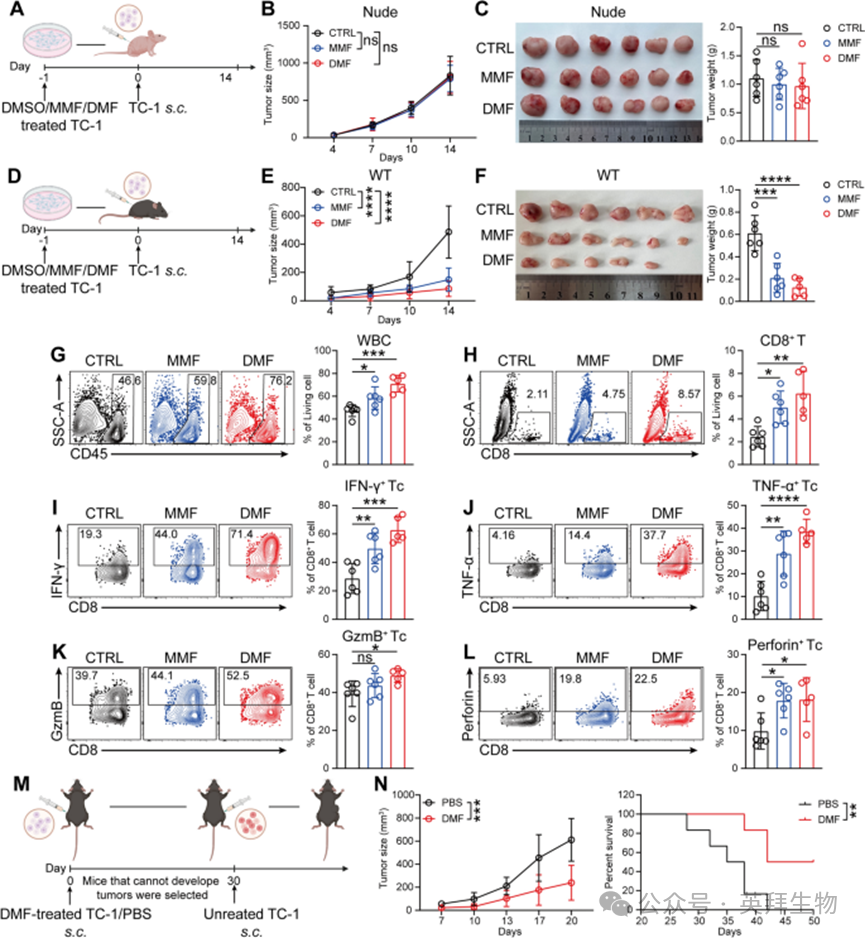
图2 DMF通过提高肿瘤细胞免疫原性,增强 CD8⁺T 细胞介导的CC免疫效应
在证实DMF通过作用于肿瘤细胞增强CD8⁺T细胞介导的抗肿瘤免疫后,作者进一步探究该效应是否伴随免疫记忆的诱导。为此,作者首先检测了DMF预处理TC-1肿瘤模型中,肿瘤引流淋巴结内T细胞记忆亚群的分布。结果显示,CD4⁺T细胞内记忆亚群的分布无变化;相反,DMF处理显著增加了CD8⁺T细胞中中枢记忆T细胞(TCM)的比例,提示DMF可促进抗原特异性CD8⁺T细胞向中枢记忆表型分化,这可能有助于实现持久的抗肿瘤免疫。
为验证DMF诱导的免疫记忆,作者采用肿瘤再接种小鼠模型。将DMF预处理组中未形成肿瘤的小鼠,在初次接种30天后于对侧胁腹再次接种肿瘤细胞(图2M)。结果显示,与左侧注射PBS的对照组相比,左侧接种DMF预处理TC-1细胞且未形成肿瘤的小鼠,其右侧肿瘤生长显著减慢,且存活率显著提高(图2N)。综上,这些结果表明,肿瘤细胞经DMF预处理后,可通过增强自身免疫原性,诱导强效且持久的抗肿瘤免疫应答。
3、富马酸二甲酯通过诱导肿瘤细胞分泌CCL5和CXCL10,增强CD8⁺T细胞浸润
为探究DMF增强肿瘤细胞免疫原性的机制,作者对DMF处理后的TC-1细胞进行RNA测序(RNA-seq)分析,并开展定制化基因集富集分析(GSEA)。作者首先关注MHC I类抗原呈递通路,该通路包含抗原加工、转运及表面呈递相关基因,已知其对CD8⁺T细胞的激活至关重要。结果显示,该通路的富集分数(P=0.76)未达到统计学显著性。一致地,DMF处理既未改变体内肿瘤细胞表面MHC I的表达,也未改变RNA-seq数据集中MHC I呈递相关基因的表达。这些结果表明,肿瘤细胞上MHC I介导的抗原呈递,不太可能是DMF诱导宫颈癌抗肿瘤免疫的主要机制。
随后,作者比较了DMF处理组与未处理组TC-1细胞的基因表达谱。差异表达基因(DEGs)火山图显示,与I型干扰素通路相关的Cxcl10、Ifit3、Ifit1和Ccl5基因在DMF处理的肿瘤细胞中显著上调(图3A)。一致地,GSEA分析也显示I型干扰素通路显著上调(图3B、C)。此外,对DMF处理组与未处理组DEGs的比较分析显示,DMF处理后多个I型干扰素应答基因显著上调,这一结果通过实时定量聚合酶链反应(qRT-PCR)进一步验证(图3D)。此外,在DMF处理的TC-1细胞上清中检测到更高水平的CCL5和CXCL10,进一步支持上述发现(图3E)。另外,作者选用人宫颈癌细胞系SiHa验证该结果,发现DMF/MMF处理同样可上调CCL5和CXCL10基因的表达(图3F)。重要的是,从DMF处理小鼠体内提取的肿瘤细胞,其Ccl5和Cxcl10的表达水平显著高于未处理组小鼠的肿瘤细胞(图3G)。对肿瘤间质液中CCL5和CXCL10水平的检测显示,DMF处理组中两种趋化因子的浓度均显著升高(图3H)。因此,作者的体外和体内研究结果共同表明,I型干扰素应答的增强(尤其是肿瘤细胞释放CCL5和CXCL10的增加),可能是DMF处理诱导CD8⁺T细胞浸润的原因。
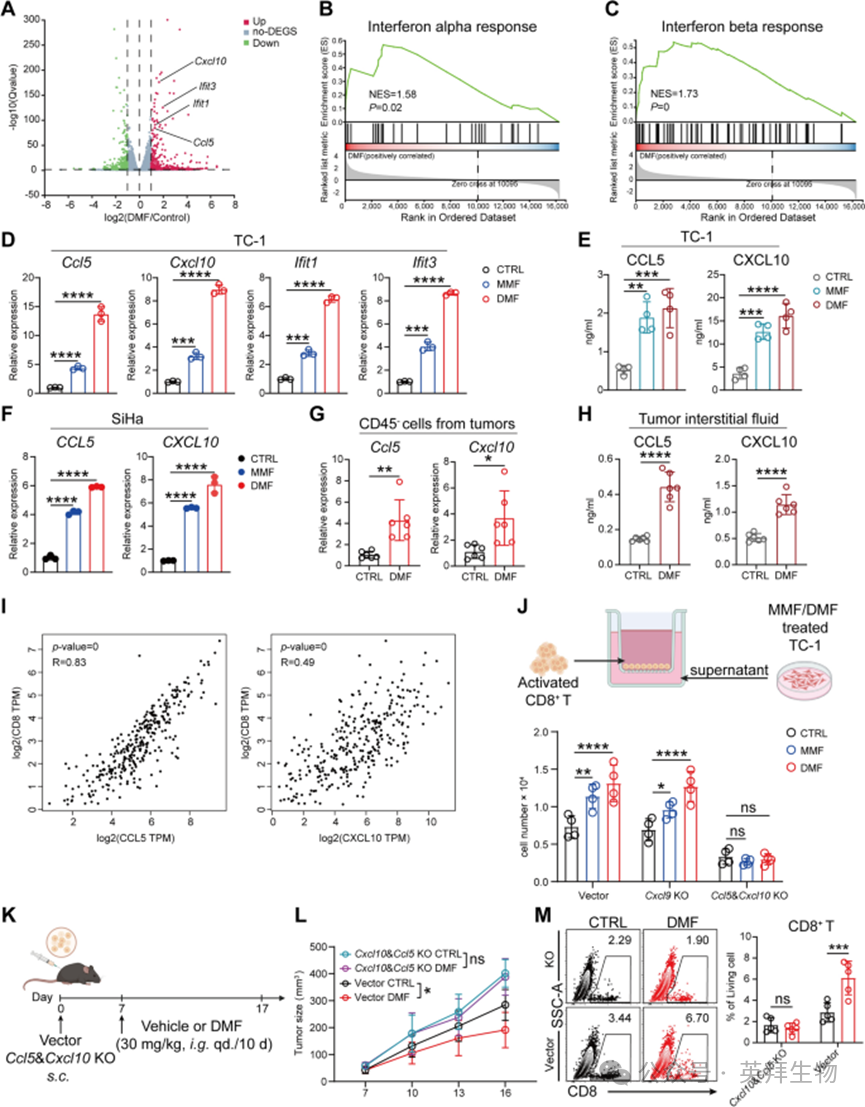
图3 DMF通过诱导肿瘤细胞分泌 CCL5 和 CXCL10,增强 CD8⁺T 细胞浸润
已知CCL5和CXCL10可招募CD8⁺T细胞进入包括肿瘤在内的组织。事实上,CCL5和CXCL10是DMF处理后肿瘤细胞中表达升高最显著的两种趋化因子。对宫颈癌患者公开基因表达数据集的回顾性分析显示,CCL5和CXCL10的表达与CD8⁺T细胞浸润呈正相关(图3I),且CCL5的表达还与预后改善相关。基于这些观察,作者推测CCL5和CXCL10介导了DMF诱导的CD8⁺T细胞浸润。值得注意的是,尽管CXCL9等其他趋化因子也可招募CD8⁺T细胞,但作者的数据显示,MMF/DMF处理后CXCL9的表达无显著变化,因此在后续实验中被用作阴性对照。
为验证CCL5、CXCL10和CXCL9在DMF诱导CD8⁺T细胞浸润中的作用,作者构建了两种TC-1敲除(KO)细胞系:一种是Ccl5和Cxcl10同时缺失(Ccl5&Cxcl10 KO),另一种是Cxcl9缺失(Cxcl9 KO)。通过检测细胞上清或细胞裂解液,证实了相应趋化因子的完全缺失。Transwell迁移实验显示,经DMF/MMF处理的对照载体细胞和Cxcl9 KO细胞的上清液,可显著促进CD8⁺T细胞迁移;而Ccl5&Cxcl10 KO细胞的上清液则完全丧失了这一能力(图3J)。这表明在体外实验中,CCL5和CXCL10(而非CXCL9)是DMF/MMF诱导CD8⁺T细胞招募所必需的。
作者进一步在体内验证其作用:将Ccl5&Cxcl10 KO或对照载体TC-1细胞植入小鼠体内,随后进行DMF处理(图3K)。结果显示,在对照肿瘤中,DMF显著降低肿瘤体积和重量,并增加CD8⁺T细胞浸润;而当CCL5和CXCL10缺失时,这些效应均消失(图3L、M)。综上,这些结果证实,在宫颈癌中,CCL5和CXCL10是DMF诱导CD8⁺T细胞招募和抗肿瘤活性的关键介导因子。
4、cGAS-STING-TBK1通路介导富马酸二甲酯诱导的抗肿瘤免疫应答
已知cGAS-STING-TBK1通路在对抗病原体和肿瘤的I型干扰素应答诱导中起关键作用。因此,作者接下来探究DMF/MMF诱导的抗宫颈癌免疫应答是否受该通路调控。结果显示,TC-1细胞经DMF/MMF处理后,p-TBK1和p-IRF3的表达显著增加(图4A),细胞内cGAMP水平也显著升高(图4B)。随后,作者在人源SiHa宫颈癌细胞系中重复该实验,得到了类似结果(图4C、D),这表明DMF/MMF激活I型干扰素应答的能力在不同物种来源的宫颈癌细胞中具有保守性。
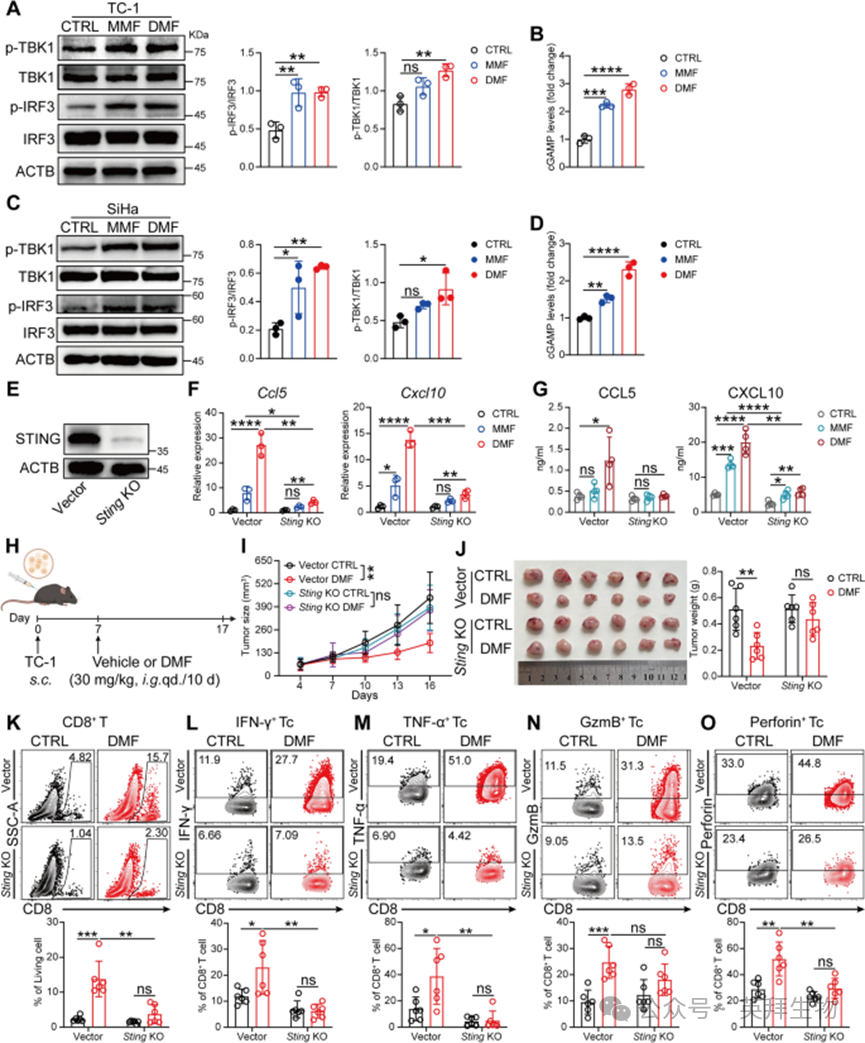
图4 cGAS-STING-TBK1 通路介导DMF诱导的抗肿瘤免疫应答
由于I型干扰素应答可通过不依赖STING的通路(如TLR通路)诱导,作者通过构建STING敲除(Sting KO)TC-1细胞系(图4E),验证STING是否为DMF/MMF激活I型干扰素应答所必需。结果显示,在STING缺陷的TC-1细胞中,DMF/MMF处理后I型干扰素相关基因的上调程度较对照载体细胞显著降低(图4F);同时,细胞上清中CCL5和CXCL10的水平也降低(图4G)。随后,作者将Sting KO TC-1细胞植入小鼠体内,并对荷瘤小鼠进行DMF处理(图4H)。与野生型(WT)组不同,在Sting KO组中,DMF处理对肿瘤大小无显著影响(图4I、J);此外,肿瘤组织中浸润CD8⁺T细胞的比例和功能也无变化(图4K-O)。综上,这些结果表明,cGAS-STING-TBK1通路在DMF诱导的抗肿瘤免疫应答中起关键作用。
5、富马酸二甲酯/富马酸单甲酯处理诱导肿瘤细胞向细胞质释放线粒体DNA(mtDNA)
作者进一步探究DMF/MMF处理后肿瘤细胞中cGAS-STING通路上调的潜在机制。GSEA分析显示,与对照组相比,DMF处理的TC-1细胞中,氧化应激应答相关基因显著富集(图5A)。进一步实验表明,DMF/MMF处理显著增加细胞内活性氧(ROS)水平和线粒体ROS水平(图5B、C),同时降低线粒体膜电位(图5D),提示线粒体可能存在损伤。电子显微镜分析进一步证实,DMF/MMF处理后肿瘤细胞的线粒体嵴结构紊乱(图5E)。
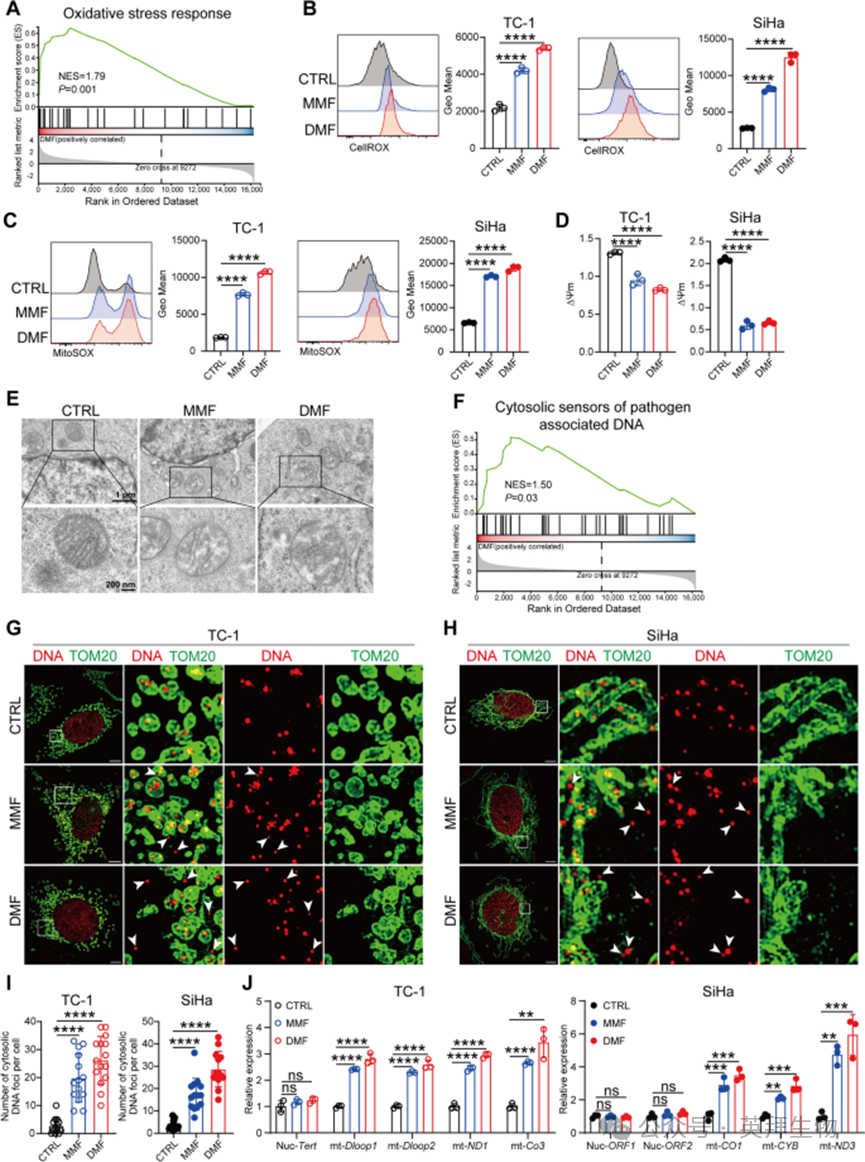
图5 DM)/ MMF处理诱导肿瘤细胞向细胞质释mtDNA
此外,基因本体(GO)富集分析显示,DMF处理组中“细胞对DNA损伤刺激的应答”通路显著增强,且“细胞质病原体相关DNA传感器”通路也显著富集(图5F)。基于这些观察,作者推测DMF/MMF处理可能通过增加细胞质DNA含量激活cGAS-STING通路。与该假设一致,免疫荧光染色结果显示,TC-1和SiHa细胞系经DMF/MMF处理后,细胞质DNA含量显著升高(图5G-I)。为进一步验证DMF/MMF处理后细胞质DNA的来源(即核DNA或线粒体DNA),作者去除线粒体后提取细胞质DNA进行qPCR分析。结果显示,在DMF/MMF处理的TC-1和SiHa细胞中,细胞质DNA主要是线粒体DNA(mtDNA),而非核DNA(nucDNA)(图5J)。综上,这些结果表明,DMF/MMF处理可诱导线粒体损伤,导致细胞质mtDNA含量增加。
DMF处理可增加ROS水平、降低线粒体膜电位(MMP)并激活DNA损伤应答通路,这提示线粒体ROS的产生可能驱动mtDNA释放。事实上,用N-乙酰半胱氨酸(NAC)抑制ROS生成后,DMF/MMF诱导的ROS升高被完全阻断,且mtDNA向胞外的释放也受到抑制。为明确这一过程是否与氧化性DNA损伤相关,作者通过流式细胞术检测8-羟基脱氧鸟苷(8-OHdG)水平,发现MMF/DMF处理后8-OHdG水平显著升高。此外,免疫荧光结果显示,氧化性DNA损伤主要发生在细胞质而非细胞核,这表明DMF处理主要诱导mtDNA的氧化性损伤。
6、细胞质线粒体DNA是富马酸二甲酯/富马酸单甲酯诱导cGAS-STING通路激活和抗肿瘤应答所必需的
作者通过已建立的线粒体DNA耗竭方案,探究线粒体DNA向细胞质的释放是否参与DMF/MMF处理细胞中cGAS-STING通路的激活及后续I型干扰素应答。通过在含有低浓度溴化乙锭(EthBr)或2',3'-双脱氧胞苷(DDC)的培养基中培养细胞,可实现mtDNA的耗竭,获得ρ⁰细胞(即缺乏线粒体基因组但保留核DNA的细胞衍生物)(。正如预期,mtDNA耗竭显著降低了DMF/MMF处理诱导的I型干扰素应答相关基因的上调(图6A),并减少了CCL5和CXCL10的分泌水平(图6B)。此外,TC-1和SiHa细胞中的mtDNA耗竭,均抑制了DMF/MMF诱导的cGAS/STING通路激活(图6C-F)。重要的是,当将mtDNA耗竭的TC-1细胞(TC-1ρ⁰)皮下植入小鼠体内时(图6G),在TC-1组中观察到的DMF预处理对肿瘤生长的抑制效应,在TC-1ρ⁰组中不再出现(图6H、I)。这些结果表明,线粒体DNA向细胞质的释放,是DMF诱导cGAS-STING通路激活及后续抗宫颈癌免疫应答所必需的。
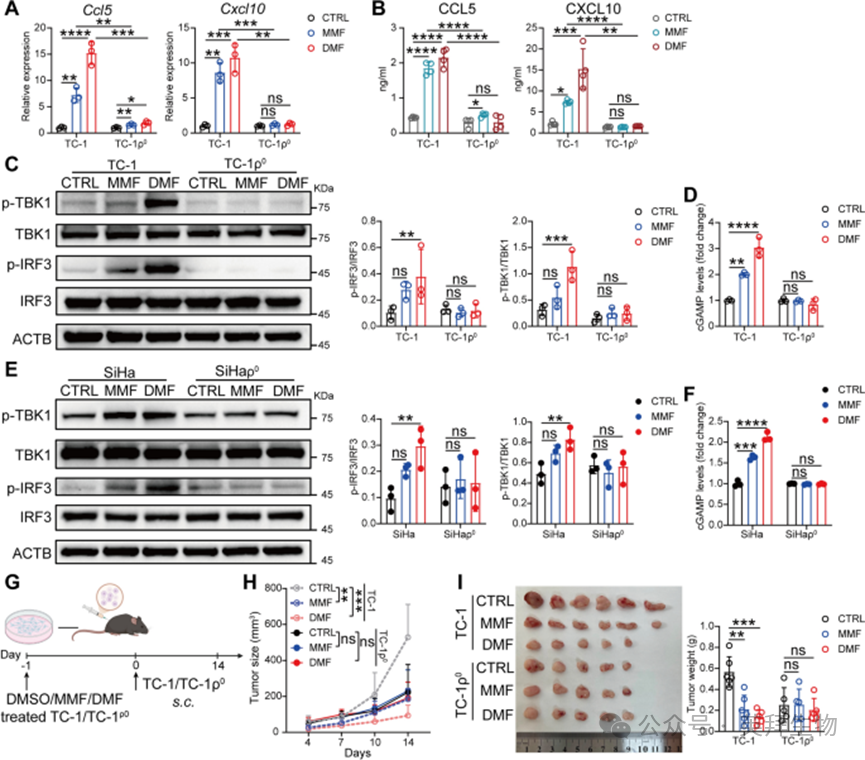
图6 mtDNA是DMF/ MMF诱导 cGAS-STING 通路激活及抗肿瘤应答所必需的
7、富马酸二甲酯可提高PD-1抑制剂和肿瘤浸润淋巴细胞(TIL)免疫治疗的疗效
尽管免疫检查点抑制剂(ICB)疗法已获批用于宫颈癌治疗,但其患者应答率仍较低,部分原因是经ICB重新激活的CD8⁺T细胞浸润不足。鉴于DMF处理具有增强CD8⁺T细胞浸润的能力,作者推测DMF可能通过促进免疫浸润,提高PD-1抑制剂的疗效。事实上,在TC-1移植瘤模型中,抗PD-1抗体单药治疗未显示出显著疗效,而DMF单药治疗已能显著延长小鼠存活时间;重要的是,DMF与抗PD-1抗体的联合治疗效果优于两种单药治疗(图7A、B),表明这两种治疗方案具有协同效应。
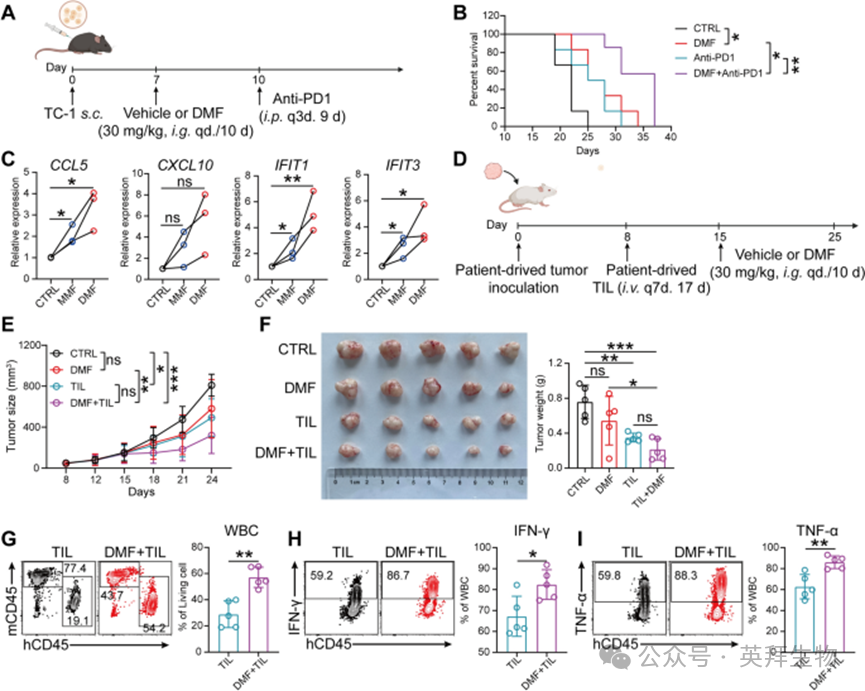
图7 DMF可提高 PD-1 抑制剂和肿瘤浸润淋巴细胞(TIL)免疫治疗的疗效.
接下来,作者探究激活cGAS-STING通路是否为治疗人宫颈癌的可行策略。为此,作者首先对宫颈癌患者的公共基因数据库进行关联分析,发现STING的高表达与宫颈癌患者的预后呈正相关,这提示激活cGAS-STING通路可能是治疗人宫颈癌的潜在有效策略。为验证这一假设,作者从3例宫颈癌患者中建立了患者来源异种移植(PDX)肿瘤模型,并生成了相应的类器官样本(PDXO),随后检测DMF对这些人源肿瘤的治疗效果。与在小鼠TC-1细胞中观察到的结果一致(图3D),PDXO经DMF/MMF处理后,CCL5、CXCL10、IFIT1和IFIT3的表达显著升高(图7C)。
随后,作者在PDX小鼠模型中,体内评估DMF/MMF诱导抗人宫颈癌免疫应答及肿瘤消退的能力。正如预期,由于NCG小鼠存在免疫缺陷,在NCG小鼠皮下植入PDX肿瘤后,从第15天开始每日单独使用DMF处理,无法抑制PDX肿瘤生长。因此,作者制备了与PDX来源相同患者的肿瘤浸润淋巴细胞(TIL),并在肿瘤接种后的第8、15和22天,将其输注到接受或未接受DMF处理的小鼠体内(图7D)。结果显示,DMF与TIL的联合治疗可有效抑制肿瘤生长,且治疗效果优于TIL单药治疗(图7E、F)。对肿瘤组织的流式细胞术分析显示,DMF可增强TIL的浸润和细胞毒性功能。综上,这些结果表明,DMF与PD-1抑制剂或TIL疗法联合使用,可能通过增强CD8⁺T细胞的浸润和功能,为人类宫颈癌治疗提供更有效的策略,从而改善临床结局。
结论
肿瘤免疫细胞趋化性失调仍然是有效癌症免疫治疗的核心问题。作者的研究发现,DMF 能够通过激活 mtDNA-cGAS-STING 通路,重新编程 CC 细胞以促进 CD8+ T 细胞依赖性抗肿瘤免疫。DMF 治疗诱导 CC 细胞线粒体功能障碍,导致mtDNA 释放到细胞质中,从而激活 cGAS-STING 通路和 I 型干扰素反应,进而诱导 CCL5 和 CXCL10 的分泌,从而促进 CD8+ T 细胞募集和细胞毒性分化。重要的是,在同种异体小鼠模型中,DMF 与 PD-1 阻断剂显示出协同活性,而在 PDX 模型中,它显著增强了 TIL 功能。这些发现为提高当前免疫治疗的疗效提供了可行的策略。
参考文献
Jiang H, Liu L, He S, Qu S, Yang Y, Kang G, Wu M, Liu H, Zhang Y, Wang Z, Tian W, Chen Y, Wang L, Wang Q, Ye T, Han J, Wang H, Huang Y. Dimethyl fumarate reprograms cervical cancer cells to enhance antitumor immunity by activating mtDNA-cGAS-STING pathway. J Biomed Sci. 2025 Oct 20;32(1):92. doi: 10.1186/s12929-025-01187-x. PMID: 41116174; PMCID: PMC12538808.






