FGFR4在结肠癌中通过CXCL10-CXCR3轴促进CAF激活
癌症相关成纤维细胞(CAFs)通过与肿瘤微环境中的肿瘤和免疫细胞的串扰促进癌症的恶性表型。因此,需要深入研究CAF激活的机制,以制定针对CAF的癌症免疫治疗策略。在这项研究中,作者研究了FGFR4在结肠癌CAF调控中的作用。FGFR4过表达的癌细胞在体内促进了CAF的丰度和激活,同时也通过其分泌组诱导正常成纤维细胞向CAF分化。机制上,FGFR4通过上调toll样受体3-干扰素调节因子-干扰素β (IFNβ)信号传导和IFNβ的自分泌作用诱导CXC趋化因子配体(CXCL)10的产生。CXCL10增加了成纤维细胞中CAF标记物的表达,包括α-平滑肌肌动蛋白和波形蛋白。CXCL10还促进了CAF的迁移、侵袭和收缩,这反映了CAF的激活。相反,敲除CXCL10或中和抗体可消除成纤维细胞中CAF标记物的表达。CXCL10的同源受体CXCR-3的抑制也会损害CAF的功能。在人类结肠癌样本中,FGFR4和CXCL10的表达与CAF标志物的表达呈正相关。最后,FGFR4和CXCR3的双重抑制抑制了肿瘤生长,并伴有CAF的下调。作者的研究结果揭示了FGFR4通过CXCL10-CXCR3轴促进TME中CAF分化/激活的机制,突出了FGFR4和CXCR3共同靶向作为基质显性肿瘤患者治疗策略的潜力。该文章于2025年2月发表在《Cell Death Disease》,IF:9.6。
技术路线:
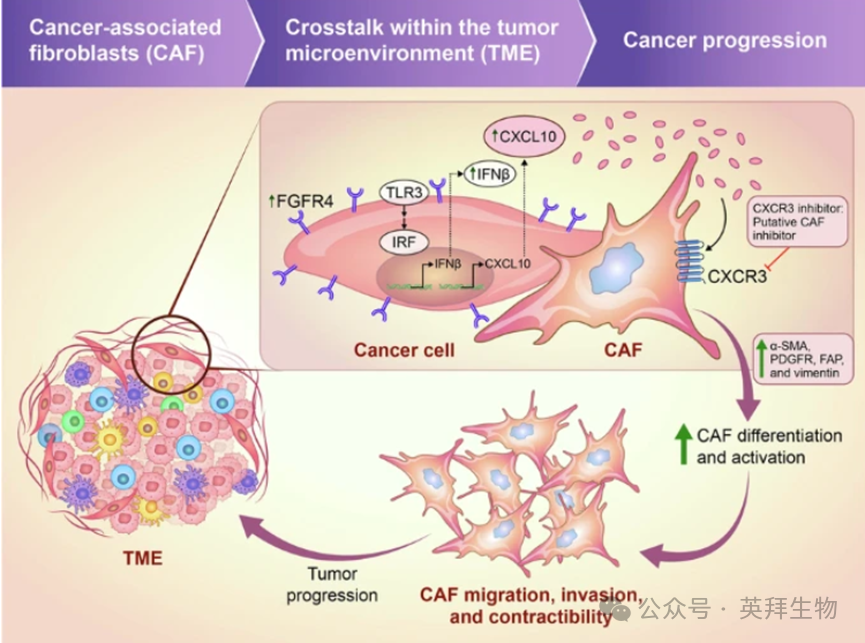
摘要图
主要研究结果:
1.FGFR4促进肿瘤生长及TME中CAF分化/激活
为探究FGFR4过表达对肿瘤生长与CAF激活的影响,作者利用小鼠结肠癌CT-26/EV或CT-26/FGFR4稳定表达细胞系建立皮下移植瘤模型。接种CT-26/FGFR4的异种移植小鼠肿瘤生长速度与重量显著增加。TME中α-SMA阳性细胞数量显著增多,提示癌细胞FGFR4过表达可提升TME内CAF丰度(图1A–C)。
作者进一步研究FGFR4在TME中对CAF激活的作用。分别来源于CT-26/EV或CT-26/FGFR4肿瘤的CAF中,评估CAF标志物及其激活状态。与CT-26/EV组相比,CT-26/FGFR4肿瘤来源的CAF在mRNA与蛋白水平均呈现更高的CAF标志物表达,包括α-SMA、成纤维细胞激活蛋白(FAP)、PDGF受体(PDGFR)及波形蛋白(图1D)。免疫荧光实验证实,CT-26/FGFR4来源的CAF α-SMA表达升高,且呈现明显的细长梭形形态(图1E)。通过侵袭实验及胶原凝胶收缩实验验证其激活状态,结果显示侵袭能力与收缩力均增强(图1F、G)。上述结果表明,FGFR4在TME中促进肿瘤进展,并伴随CAF激活。
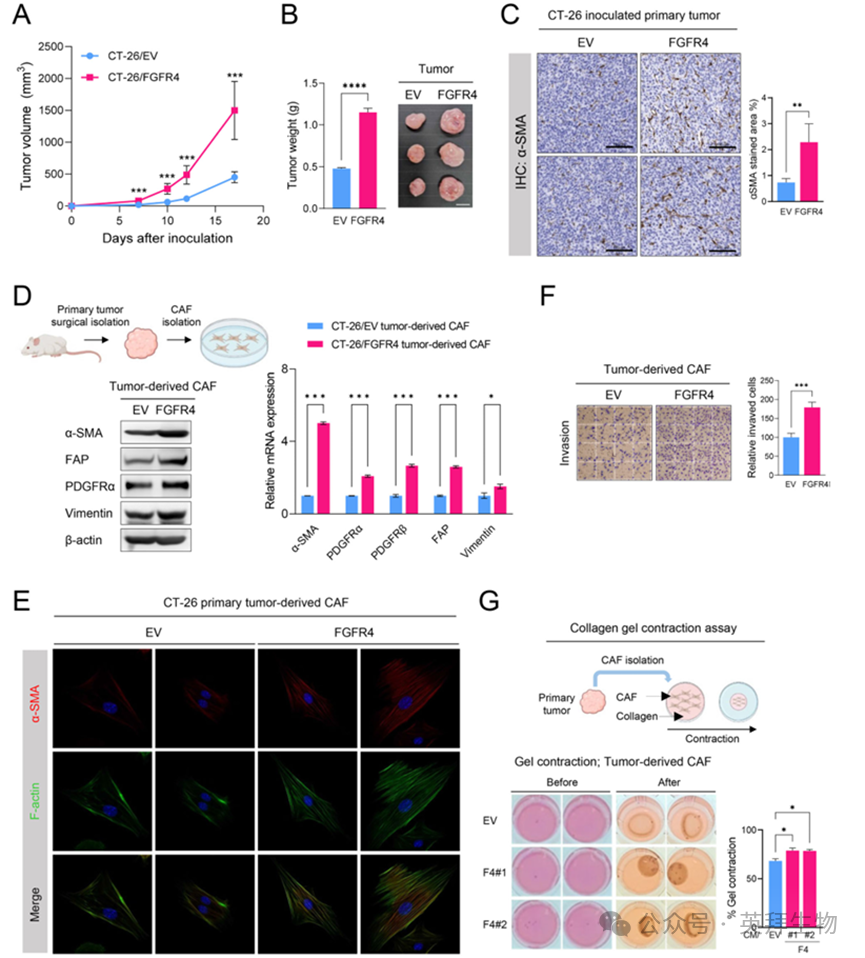
图1 FGFR4在体内促进肿瘤生长和CAF激活
2.FGFR4通过分泌组诱导CAF分化与激活
为探究肿瘤分泌组对正常成纤维细胞向CAF分化的影响,作者将NIH/3T3成纤维细胞与稳定癌细胞或其条件培养基(CM)共培养,并通过Western blot检测CAF标志物表达以评估分化程度。与体内结果一致,在共培养及CM处理体系中,Fgfr4高表达癌细胞通过分泌组显著诱导NIH/3T3细胞表达α-SMA、波形蛋白等CAF标志物,提示Fgfr4高表达肿瘤来源分泌组参与CAF分化(图2A)。此外,与CT-26/EV来源CM相比,CT-26/FGFR4来源CM显著增强NIH/3T3细胞的增殖、迁移、侵袭及收缩能力,表明静息成纤维细胞的CAF分化得以促进(图2B、C)。为进一步验证肿瘤分泌组对CAF激活的作用,作者从CT-26接种瘤中分离CAF,用CT-26稳定癌细胞CM培养并评估CAF活性。与CT-26/EV来源CM相比,CT-26/FGFR4来源CM显著增强CAF激活。上述结果证实,FGFR4通过其分泌组促进CAF分化与激活。
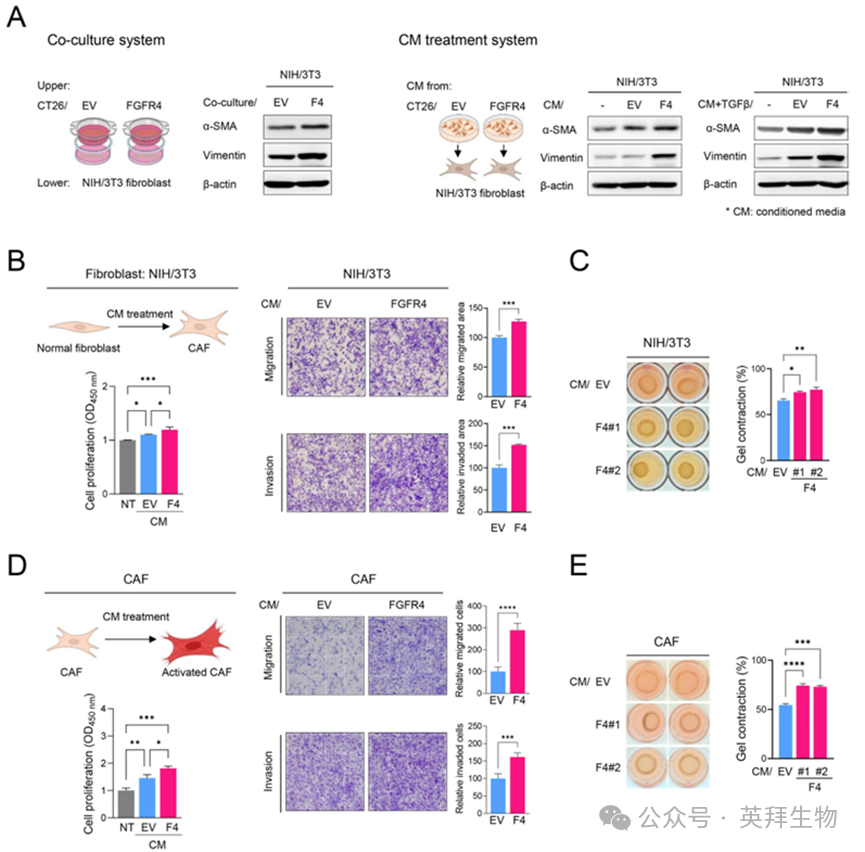
图2 FGFR4通过其分泌组诱导CAF分化和激活
3.FGFR4过表达结肠癌细胞的转录组分析
RNA-seq数据的主成分分析(PCA)图显示,CT-26/FGFR4与CT-26/EV对照细胞明显分离,表明FGFR4过表达导致基因表达谱显著不同(图3A)。对CT-26/EV与CT-26/FGFR4细胞进行RNA-seq分析,发现与EV对照相比,Fgfr4过表达细胞中有96个基因上调、44个基因下调(fold-change > 2,P < 0.001)(图3B)。Reactome通路分析显示,上调基因与干扰素(IFN)信号、涉及IFN刺激基因的抗病毒机制、免疫系统及细胞因子信号相关(图3C)。基因集富集分析(GSEA)亦显示,干扰素α应答、干扰素γ应答及细胞因子信号等免疫相关通路富集,提示FGFR4过表达强烈激活免疫与干扰素信号通路(图3D)。值得注意的是,Ifnβ1及其下游靶基因——IFN诱导蛋白10(IP-10/Cxcl10)被FGFR4过表达特异性上调(图3E、F)。Ifnβ与Cxcl10编码的分泌分子与TLR3-TBK-IRF及IFN-信号转导与转录激活因子(STAT)-CXCL10信号通路相关,这些通路与Reactome和GSEA分析中上调的通路重叠。ELISA验证显示,FGFR4过表达显著增加IFN-β与CXCL10的产生(图3G)。
4.FGFR4通过激活TLR3-IRF-IFNβ轴诱导结肠癌中CXCL10表达
Western blot分析证实,FGFR4过表达的结直肠癌细胞中,IFN-β与CXCL10表达升高,TBK1、IRFs及STAT1的磷酸化水平亦增加(图4A),提示TLR3-TBK-IRF与IFNβ-STAT-CXCL10信号通路被FGFR4过表达激活。反之,使用siRNA敲低FGFR4或给予FGFR4抑制剂BLU9931处理后,TBK1、IRF及STAT1的磷酸化水平下降,IFN-β与CXCL10表达减少(图4B)。此外,RT-qPCR显示,敲低或抑制FGFR4显著降低IFN-β与CXCL10的mRNA水平(图4C、D)。ELISA进一步验证,FGFR4敲低导致CXCL10分泌减少。综上,FGFR4通过激活TLR3-TBK-IRF信号及IFNβ自分泌作用,调控结肠癌细胞中CXCL10的表达与产生。
5.CXCL10诱导成纤维细胞向CAF分化
FGFR4过表达癌细胞可诱导CAF分化/激活,其CXCL10浓度亦高于对照细胞(图2、图3G)。为明确FGFR4介导的CXCL10分泌是否以旁分泌方式调控TME内CAF分化/激活,作者检测CXCL10是否直接调控成纤维细胞向CAF分化/激活。重组CXCL10处理可提高NIH/3T3成纤维细胞的收缩力、迁移、侵袭能力及CAF标志物表达,表明CXCL10可直接诱导成纤维细胞向CAF分化(图5A–C)。由此提示,FGFR4过表达细胞分泌的CXCL10可能在调控CAF分化/激活中起关键作用。
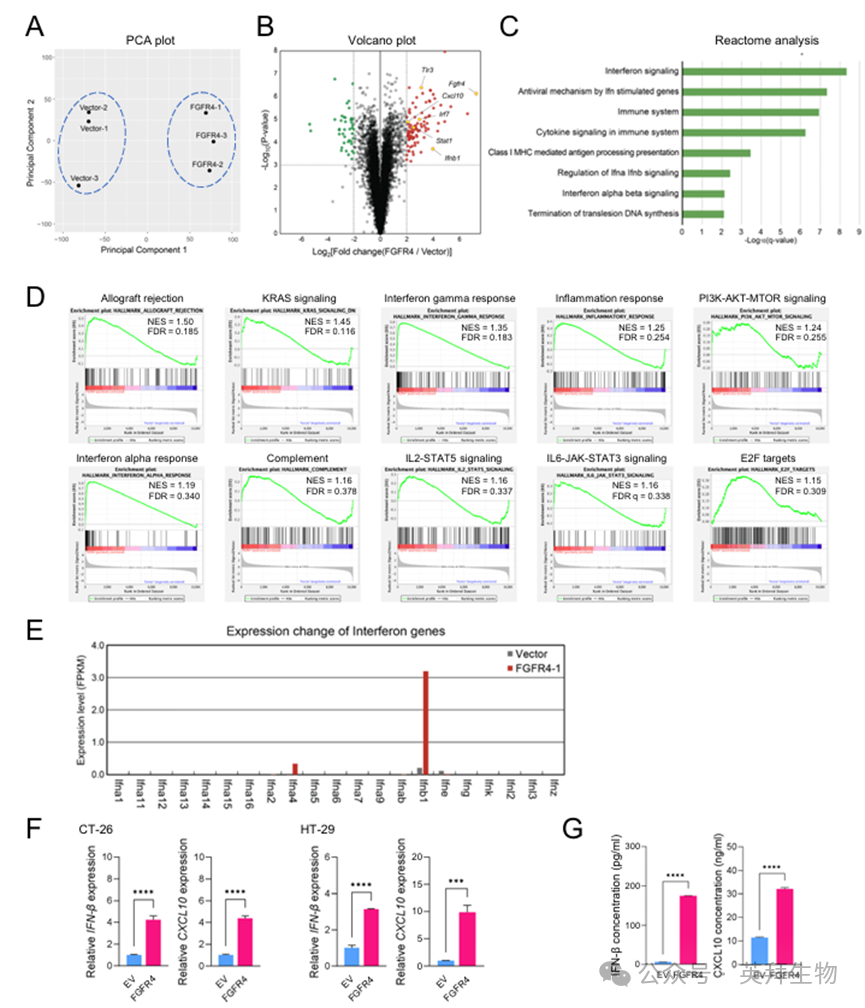
图3 过表达FGFR4的结肠癌细胞的转录组分析
6.FGFR4通过CXCL10-CXCR3轴诱导CAF分化与激活
作者进一步评估CXCL10在分泌组介导的CAF分化中的关键性。与si-阴性对照(NC)组相比,si-CXCL10处理的CT-26/FGFR4细胞的CM可降低α-SMA与波形蛋白表达(图5D)。为阻断分泌型CXCL10,作者亦检测CXCL10中和抗体对CM介导CAF分化的影响。CXCL10中和抗体处理可降低CT-26/FGFR4-CM在NIH/3T3成纤维细胞中诱导的α-SMA与波形蛋白基因表达(图5E)。结果提示,FGFR4通过分泌CXCL10诱导CAF分化与激活。
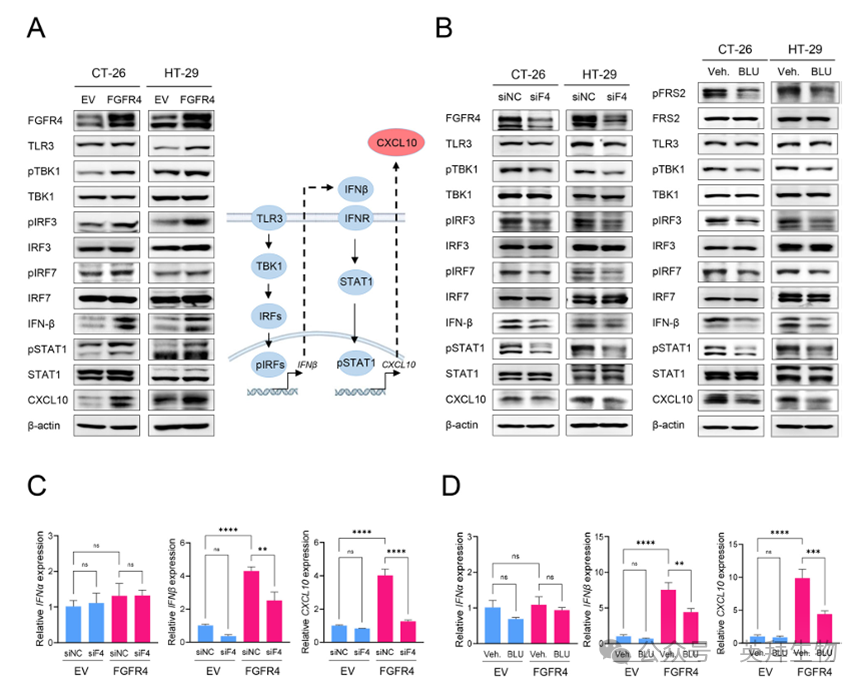
图4 FGFR4通过激活TLR3 - TKB - IRF轴和IFNΒ的自分泌作用诱导CXCL10分泌
作者检测CXCL10配体受体CXCR3是否参与CXCL10介导的CAF分化/激活。CXCR3拮抗剂AMG487处理可降低CM诱导的α-SMA与波形蛋白基因表达,表明CXCL10-CXCR3轴在CAF分化中起核心作用(图5F)。此外,AMG487及其他CXCR3抑制剂抑制CXCR3活性后,CT-26/FGFR4来源CAF的侵袭能力下降(图5G、H)。综上,FGFR4过表达通过CXCL10-CXCR3轴诱导CAF分化/激活。
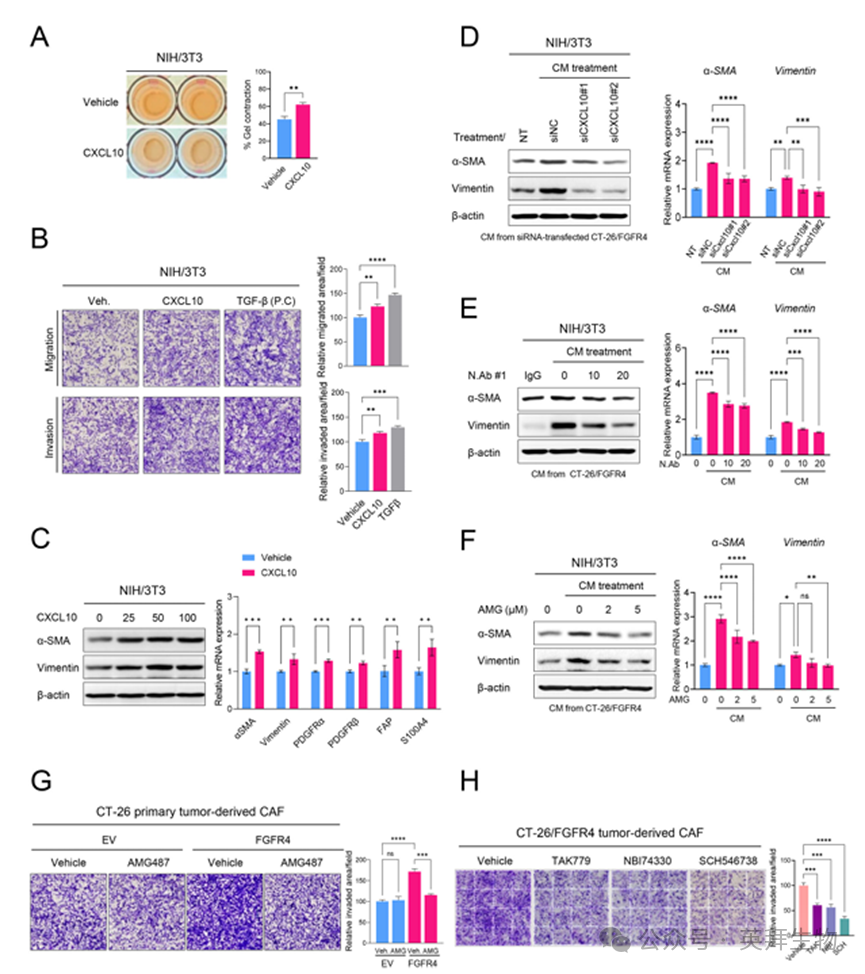
图5 FGFR4通过CXCL10-CXCR3轴诱导CAF分化和激活
7.FGFR4表达与CAF标志物在结肠癌中呈正相关
利用结肠癌患者临床样本评估FGFR4、CXCL10与CAF标志物表达的相关性。采用RT-qPCR分析137例Ⅱ–Ⅲ期结肠癌患者肿瘤及配对正常组织(各137例)的基因表达水平。与正常组织相比,肿瘤组织中FGFR4、CXCL10及CAF标志物表达显著上调(图6A)。在癌组织中,FGFR4表达与CXCL10(Pearson R = 0.32;P < 0.001)及CAF标志物α-SMA(Pearson R = 0.43;P < 0.0001)、PDGFR-β(Pearson R = 0.46;P < 0.0001)、FAP(Pearson R = 0.32;P < 0.001)均呈显著正相关(图6B)。CXCL10表达亦与α-SMA(Pearson R = 0.30;P < 0.001)、PDGFR-β(Pearson R = 0.32;P < 0.001)、FAP(Pearson R = 0.53;P < 0.0001)呈正相关(图6C)。上述结果强烈支持临床结肠癌样本中FGFR4、CXCL10与CAF标志物表达存在关联,并显示FGFR4参与结肠癌TME内CAF分化/激活,凸显所发现的FGFR4-CXCL10-CAF调控轴的临床相关性。
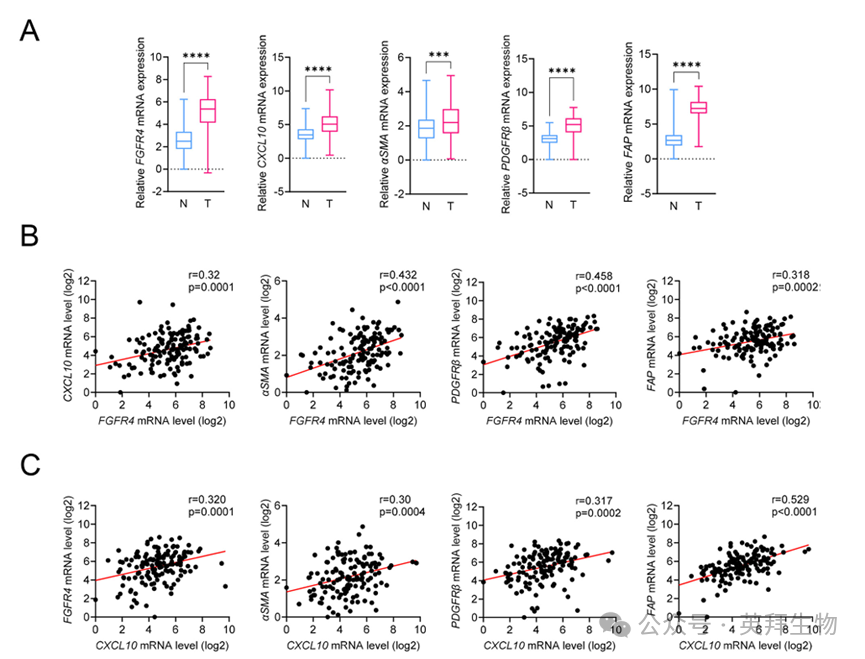
图6 结直肠癌患者组织样本中CAF标记物与FGFR4或CXCL10表达的相关性分析
8.FGFR4与CXCR3双重抑制通过抑制CAF阻断结肠癌生长
作者研究了FGFR4和CXCR3抑制剂能否抑制肿瘤生长及CAF分化。FGFR4抑制剂BLU9931单药即可减缓肿瘤进展,联合CXCR3抑制剂AMG487后抑制效应进一步增强,凸显两药协同(图7A)。通过监测体重及血生化评估毒性:各治疗组体重平稳,ALT、AST、BUN等指标正常,未见显著全身毒性(图7B)。
对肿瘤来源的预富集CAF(基质富集组分)行Western blot显示,BLU9931与AMG487联用后α-SMA表达下降,提示CAF受抑(图7C)。IHC证实,双重阻断减少TME内α-SMA与Ki-67阳性细胞,表明CAF分化减弱、肿瘤增殖受抑(图7D)。
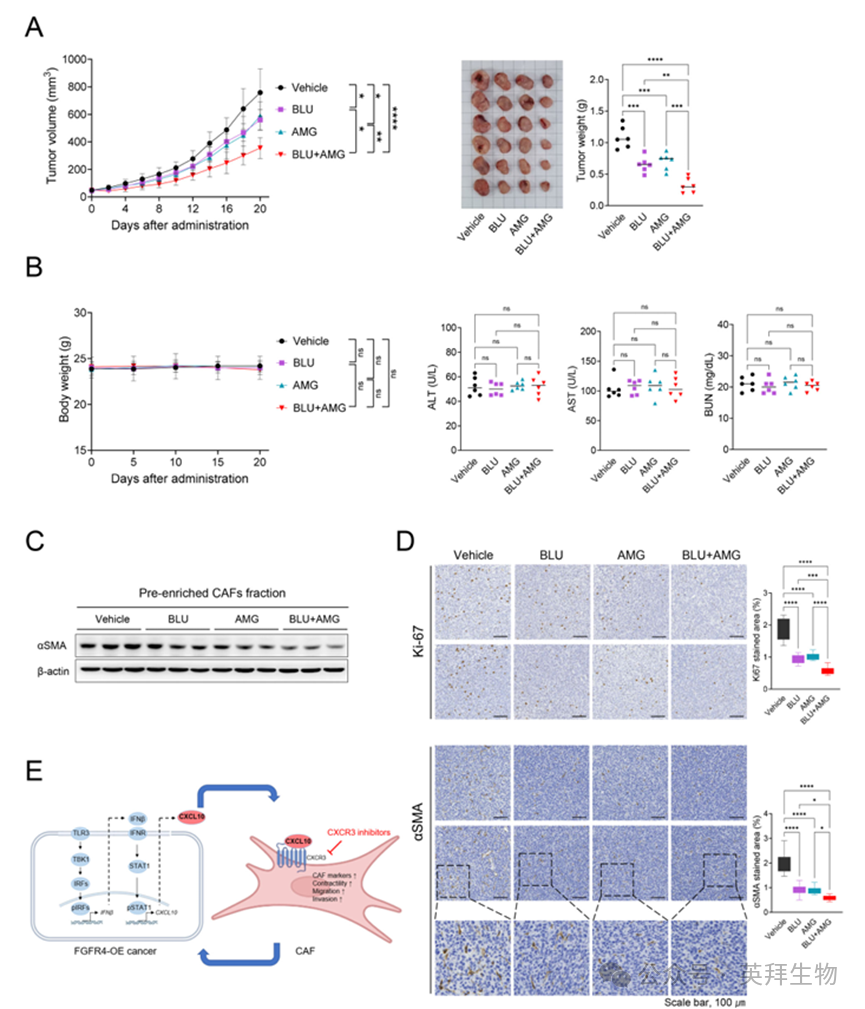
图7 体内抑制FGFR4和CXCR3的CAF失活和抗肿瘤效率
进一步通过CD8、CD86、CD206免疫组化评估免疫调节:联合治疗增加CD8⁺T细胞浸润,降低CD206⁺肿瘤相关巨噬细胞(TAM),并提升代表M1型的CD86⁺细胞,提示免疫微环境向抗肿瘤表型转化。综上,FGFR4与CXCR3双重抑制可在体内抑制肿瘤生长,其机制与阻断CAF分化并重塑免疫微环境相关。
结论:
总之,癌细胞中的FGFR4通过TLR3-IRF-IFN Β依赖的信号传导促进CXCL10的产生,随后诱导CAF分化和激活,最终导致结肠癌的进展。双重抑制FGFR4和CXCR3通过下调CAF抑制肿瘤生长。因此,通过抑制FGFR4/CXCR3抑制CAF具有克服治疗耐药性的潜力。
参考文献:
Sun, EG., Choi, JN., Park, MR. et al. FGFR4 promotes CAF activation through the CXCL10-CXCR3 axis in colon cancer. Cell Death Dis 16, 424 (2025). /10.1038/s41419-025-07588-y






