MP-10抑制磷酸二酯酶10A可挽救FOXP1综合征小鼠模型的行为缺陷并使小胶质细胞形态及突触修剪正常化
FOXP1单倍体不足引起的FOXP1综合征以智力障碍、言语语言功能受损、自闭症特征及焦虑多动等神经精神异常为主要临床表现。Foxp1±小鼠模型可重现患者的行为学表型。研究表明,Foxp1±小鼠纹状体中Foxp1蛋白表达降低会导致磷酸二酯酶10A(Pde10a)显著减少。Pde10a主要在中型多棘神经元中表达,对基底神经环路具有调控作用。此外,Foxp1±小鼠纹状体呈现小胶质细胞活化、突触修剪功能减弱及111个炎症相关基因表达紊乱等特征,其中稳态小胶质细胞标志物P2ry12和Fcrls表达下调,而反应性小胶质细胞标志物Cd74表达上调,表明神经炎症参与缺陷表型的形成。值得注意的是,新生Foxp1±小鼠经PDE10A拮抗剂MP-10(PF-2545920)干预后,不仅可纠正超声发声减少、多动和焦虑等行为异常,还能使小胶质细胞形态异常和突触修剪功能障碍恢复正常。神经炎症特异性基因组的转录组学分析显示,MP-10治疗能引起BDNF表达上调及神经营养因子信号通路富集等名义基因表达变化。鉴于FOXP1及其信号通路在物种间高度保守,MP-10或其他Pde10a拮抗剂或可改善FOXP1综合征患者的神经功能异常。该研究于2025年9月发表在《Advance Science》,IF:14.1。
技术路线:
主要研究结果:
1.Foxp1±小鼠纹状体呈现Pde10a mRNA及蛋白水平的显著降低
为验证Foxp1单倍体不足(Foxp1±)是否会导致纹状体组织中Pde10a表达降低——此前的Nestin-Cre(Foxp1-/-)小鼠模型全基因敲除数据已提示该可能性[7],我们检测了mRNA及蛋白表达水平。通过实时定量PCR和蛋白质印迹法分别测量了出生后1.5天(P1.5)、12.5天(P12.5)及成年Foxp1±小鼠的Pde10a表达。结果显示Foxp1±小鼠纹状体中mRNA和蛋白水平均显著下降:在P1和P12阶段,mRNA分别降低32%和40%,蛋白分别降低8%和32%;最强效应见于成年期,mRNA和蛋白水平分别下降53%和51%(图1A)。在皮层、海马和丘脑中检测到的Pde10a表达量极低(图1B),且成年Foxp1±小鼠这些脑区的Pde10a mRNA水平与野生型(WT)相比无显著差异(图1C),表明Pde10a下调具有纹状体特异性。
尽管Foxp1±小鼠纹状体中Pde10a表达显著降低,但对7月龄小鼠纹状体组织基础cAMP水平的定量分析显示,其与野生型小鼠相比无显著差异(图1D)。这表明尽管Pde10a介导的水解作用减弱,代偿机制仍能维持cAMP稳态水平。
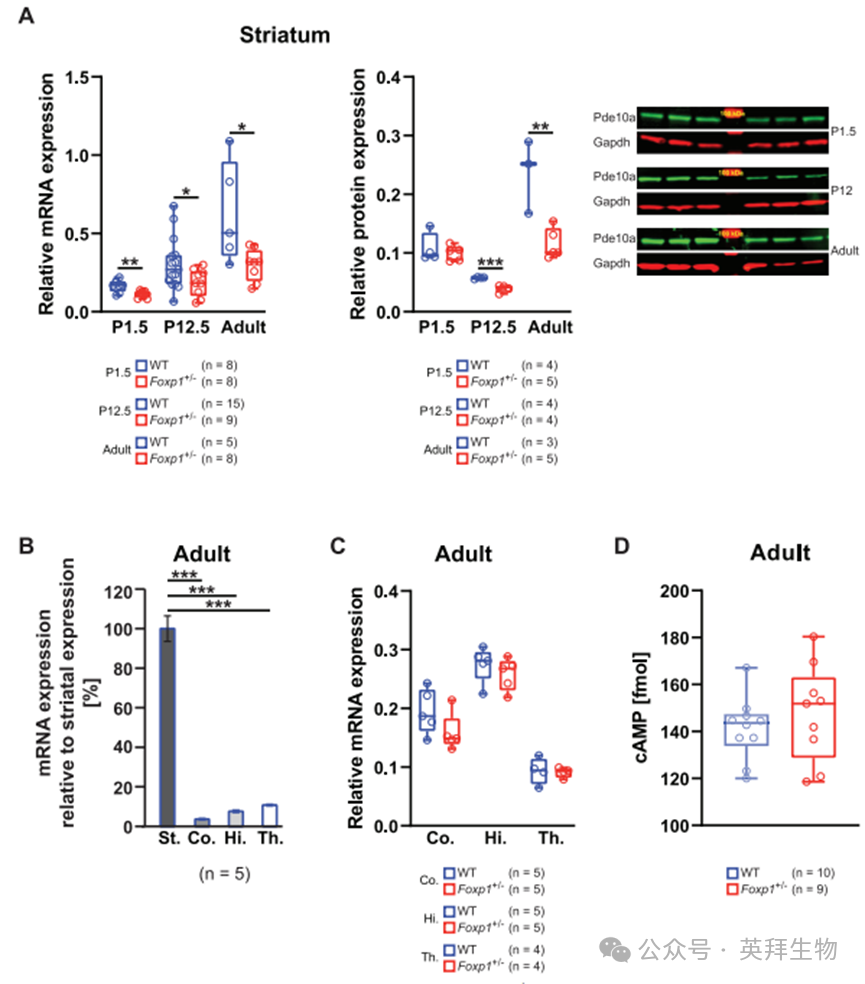
图1. Foxp1±小鼠纹状体呈现Pde10a mRNA及蛋白水平的显著降低
2.MP-10长期给药可逆转幼年Foxp1±小鼠的行为缺陷
我们进一步探究了抑制Foxp1±小鼠的Pde10a能否改善FOXP1单倍体不足相关的行为缺陷。实验采用PDE10A抑制剂——高选择性拮抗剂MP-10(PF-2545920,Mardepodect)。该药物IC50值为0.37 nM,对其他PDE家族成员的选择性超过1000倍,且在靶向疗效剂量范围内已证实具有良好安全性和耐受性[22,23]。鉴于Foxp1水平降低可能在出生后早期阶段即影响脑功能,我们在野生型和Foxp1±小鼠出生后立即(P0.5)开始给药,连续29天每日给予1.5 mg/kg MP-10或溶媒。MP-10给药剂量耐受良好,未出现明显副作用。治疗期间评估了新生鼠超声呼叫行为、焦虑水平和多动情况(图2A)。经处理的野生型小鼠与未处理野生型小鼠行为无差异,发育过程中也未观察到体重增长变化。除高架十字迷宫测试(图2C)和社会交互测试显示野生型与Foxp1±小鼠无差异外(参见支持信息图S1A-C),其他所有测试(新生鼠超声发声、旷场、洞板及明暗箱)均显示Foxp1±小鼠较野生型出现显著行为改变(图2B,D-F)。所有测试均表明未处理与MP-10处理的Foxp1±小鼠之间存在显著行为差异(图2B-F)。鉴于Nestin-Cre(Foxp1-/-)小鼠表现出严重增强的焦虑行为(支持信息图S2A-D),且焦虑障碍在FOXP1综合征患者中较为常见,我们通过多项测试对Foxp1±小鼠进行了深入研究。旷场实验显示:Foxp1±小鼠运动总距离较野生型同窝鼠增加117%,角落区域活动距离增加91%,证实了该模型存在既往文献报道的多动现象[15]。而经MP-10治疗的Foxp1±小鼠运动模式与野生型无差异(图2D)。在P7.5和P12.5时间点,溶媒处理的Foxp1±幼鼠超声呼叫次数显著减少约27%;但接受MP-10治疗的Foxp1±幼鼠呼叫次数与溶媒处理的野生型同窝鼠无统计学差异(图2B)。明暗箱实验中,Foxp1±小鼠进入明室次数及停留时间较野生对照组分别显著减少57%和73%;与之形成对比的是,MP-10治疗的Foxp1±小鼠未表现行为异常,其行为模式与野生型一致(图2E)。洞板实验同样显示Foxp1±小鼠存在行为异常,探头次数减少45%;而MP-10治疗组在该测试中与野生型无差异(图2F)。结论表明,MP-10治疗能显著缓解Foxp1±小鼠的所有行为异常,使其在各项测试中的表现与野生型动物无显著差异。
图2.MP-10长期给药可逆转幼年Foxp1±小鼠的行为缺陷
3.P8阶段Foxp1±小鼠呈现神经炎症征象但成年期无纹状体萎缩
近期研究提示活化胶质细胞参与ASD病理生理过程[24,25],由此引申出Foxp1±小鼠纹状体是否存在神经炎症的重要问题。为此,我们采用NanoString nCounter神经炎症检测板(含770个靶基因)对P8阶段野生型与Foxp1±小鼠纹状体组织进行批量表达分析。结果显示Foxp1±纹状体中共有111个基因表达发生显著改变,其中106个基因名义显著性改变,5个基因(Cd74、Fcgr2b、Ifi30、Fcrls和P2ry12)经多重检验校正后仍保持显著差异(参见图3A,B;支持信息表S1)。在Foxp1±纹状体中,Cd74、Fcgr2b和Ifi30分别上调约131%、52%和50%,而Fcrls和P2ry12分别下调约24%和35%(图3A,B)。名义显著性改变的基因包括上调的Cntnap2及其潜在靶标Pten、上调的Akt1、下调的Gpr34以及上调的Il10rb(参见支持信息图S3和表S1)。如讨论部分将详述,上述所有10个基因均与小胶质细胞活性改变相关。通过Metascape平台对失调基因进行基因本体论和通路分析[26],发现DNA损伤应答通路受影响最为显著(图3C;支持信息图S3B,C)。鉴于FOXP1综合征患者中偶有观察到轻度侧脑室扩大(称为代偿性脑积水)[27],这引发了一个重要问题:FOXP1单倍体不足引起的神经炎症是否会导致纹状体神经退行性变。侧脑室扩大可能源于心室发育缺陷、皮质厚度减小或纹状体萎缩。为此,我们通过MRI检测了成年野生型与Foxp1±小鼠的皮质厚度和侧脑室容积(支持信息图S4A-C)。研究结果显示,与野生型相比,Foxp1±小鼠既未出现皮质厚度改变(支持信息图S4B),也未发现侧脑室容积变化(支持信息图S4C),这一发现明确排除了纹状体萎缩的可能性。
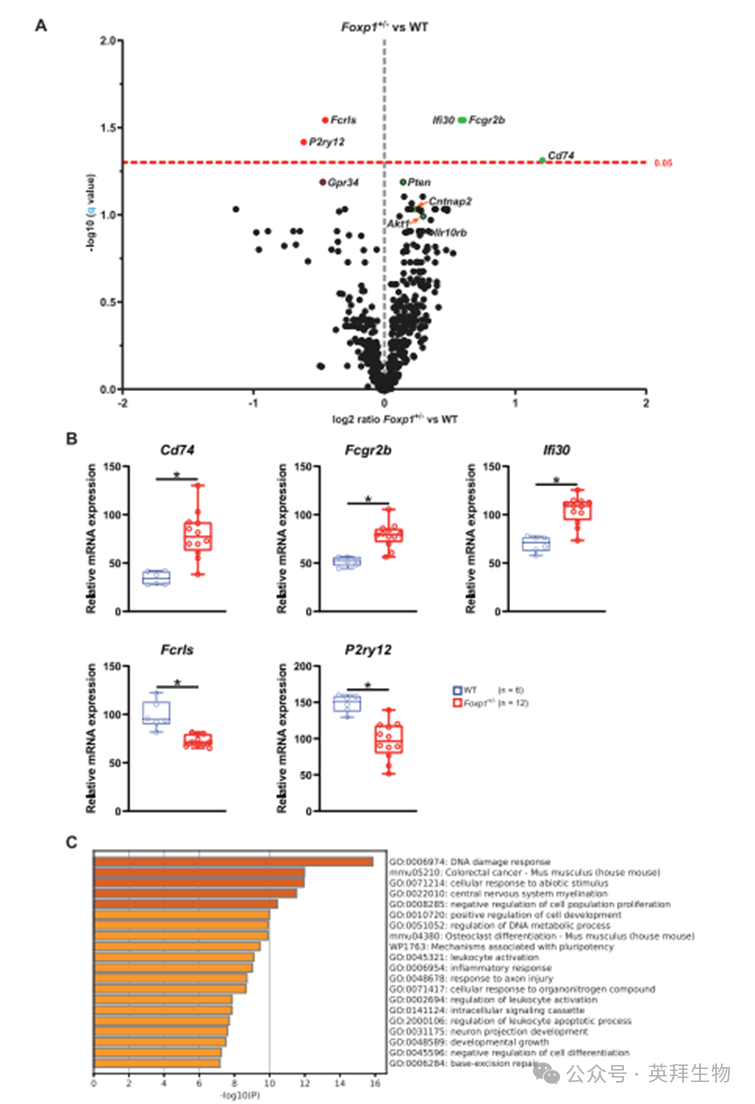
图3.P8阶段Foxp1±小鼠呈现神经炎症征象但成年期无纹状体萎缩
4.MP-10调控神经营养因子与免疫信号通路
为探究MP-10治疗对纹状体神经炎症标志物表达的影响,我们分析了P8阶段的Foxp1±幼鼠——这些个体在出生后立即开始接受每日连续给药(方案同前)。研究发现MP-10处理与未处理的Foxp1±小鼠间存在36个基因呈现名义显著性差异(P < 0.05)(图4A;支持信息表S1)。由于经多重检验校正后无基因保持显著,这些结果应视为探索性发现。值得关注的是,Bdnf及其调控基因Grin2a和Foxp3分别上调62%、22%和39%(图4B),这可能有助于解释观察到的小胶质细胞活化减弱现象。对名义调控基因的通路分析表明,MP-10给药影响了神经营养因子信号通路及免疫应答调节性细胞表面受体信号通路(图4C;支持信息图S5)。
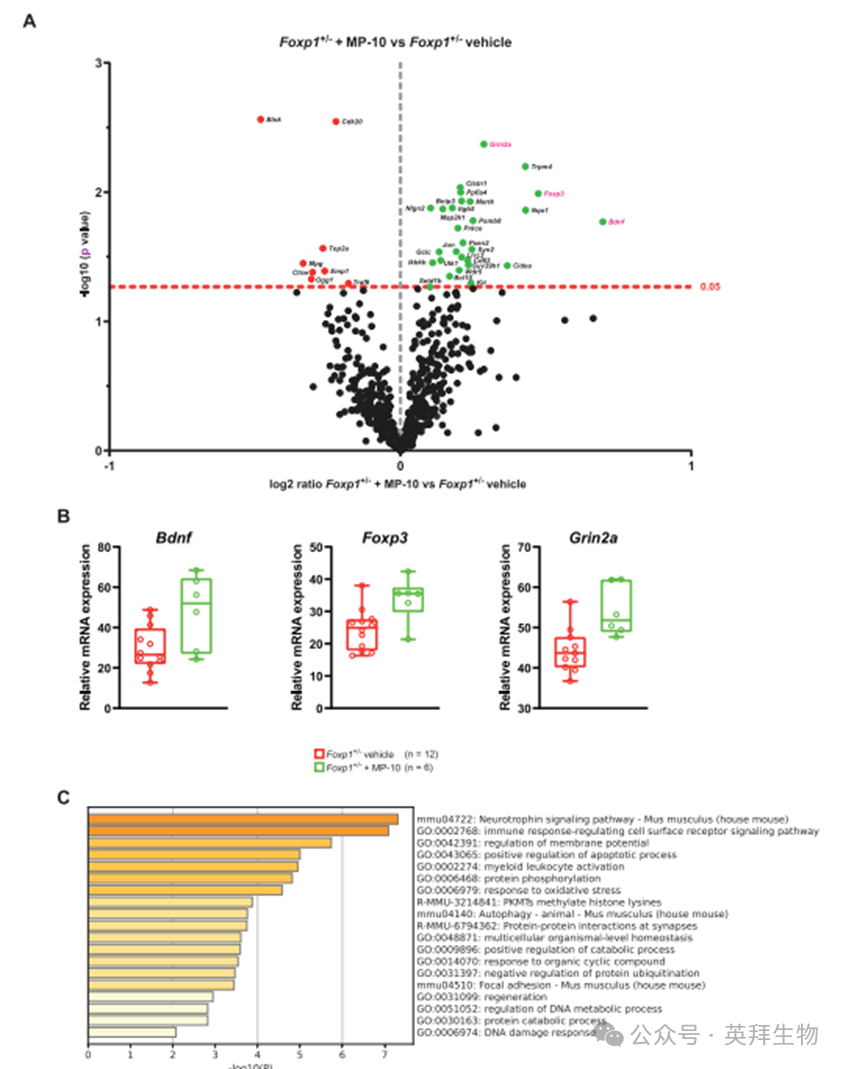
图4. Nira-SE调控靶基因RAD23A的表达机制研究
5.MP-10给药使Foxp1±大脑纹状体小胶质细胞活性正常化并减少其介导的突触清除
前文已证实MP-10给药可调控Foxp1±纹状体的神经炎症进程。随着越来越多证据表明胶质细胞改变参与智力障碍和自闭症等神经发育障碍[24,25,28],我们检测了野生型和Foxp1±小鼠的纹状体星形胶质细胞与小胶质细胞。通过三维重建技术比较了P8阶段溶媒处理与MP-10处理的野生型及Foxp1±幼鼠的小胶质细胞形态。我们采用离子钙结合衔接分子1(Iba1)免疫荧光抗体标记小胶质细胞,并运用Imaris软件分析其形态复杂度。共对42只动物进行分析(每组n=10-11),每只个体约重建1500个小胶质细胞。鉴于神经炎症进程以小胶质细胞-星形胶质细胞复杂相互作用为特征,我们同时通过胶质纤维酸性蛋白(GFAP)免疫荧光染色标记后者,以GFAP强度作为Foxp1±纹状体胶质增生/星形胶质细胞肥大的潜在指标。野生型与Foxp1±星形胶质细胞未发现差异(支持信息图S6A),不同基因型间小胶质细胞数量也无变化(支持信息图S6B)。与星形胶质细胞相反,Foxp1±小胶质细胞体积增加17%,表面积扩大10%(图5A,B);其丝状体长度和分支数量分别减少19%和25%(图5C-E),这些均提示促炎性小胶质细胞表型[29]。而经MP-10处理的Foxp1±小鼠,在小胶质细胞体积、表面积、丝状体长度及分支方面与溶媒处理的野生型动物无差异(图5A-F)。
为探究该效应是否具有区域特异性,我们进一步检测了海马区小胶质细胞形态。与纹状体类似,Foxp1±小鼠海马区小胶质细胞胞体体积显著增加45%,丝状体长度减少32%,呈现反应性小胶质细胞表型。然而与纹状体形成鲜明对比的是,MP-10治疗未能使海马区小胶质细胞形态正常化,MP-10处理的Foxp1±小鼠仍持续存在胞体肿胀现象(参见支持信息图S7)。鉴于小胶质细胞介导的突触修剪在发育期和疾病状态下对神经环路的塑造至关重要,我们进一步研究了纹状体的突触清除情况。通过小胶质细胞与突触后标志物PSD-95共标记技术评估突触接触与吞噬情况。结果显示:与野生型相比,Foxp1±纹状体中小胶质细胞的突触接触减少59%,突触吞噬量降低59%(图6A-C)。值得注意的是,MP-10治疗使Foxp1±纹状体的突触接触数量和吞噬水平均恢复至与野生型组织相当的程度(图6A-C)。综上所述,Foxp1单倍体不足会导致小胶质细胞形态改变并削弱其介导的突触清除功能,这揭示了神经炎症在病理表型形成中的关键作用。值得注意的是,早期MP-10治疗能有效抑制纹状体区小胶质细胞活化并改善其突触修剪功能障碍,但对海马区未见类似疗效。
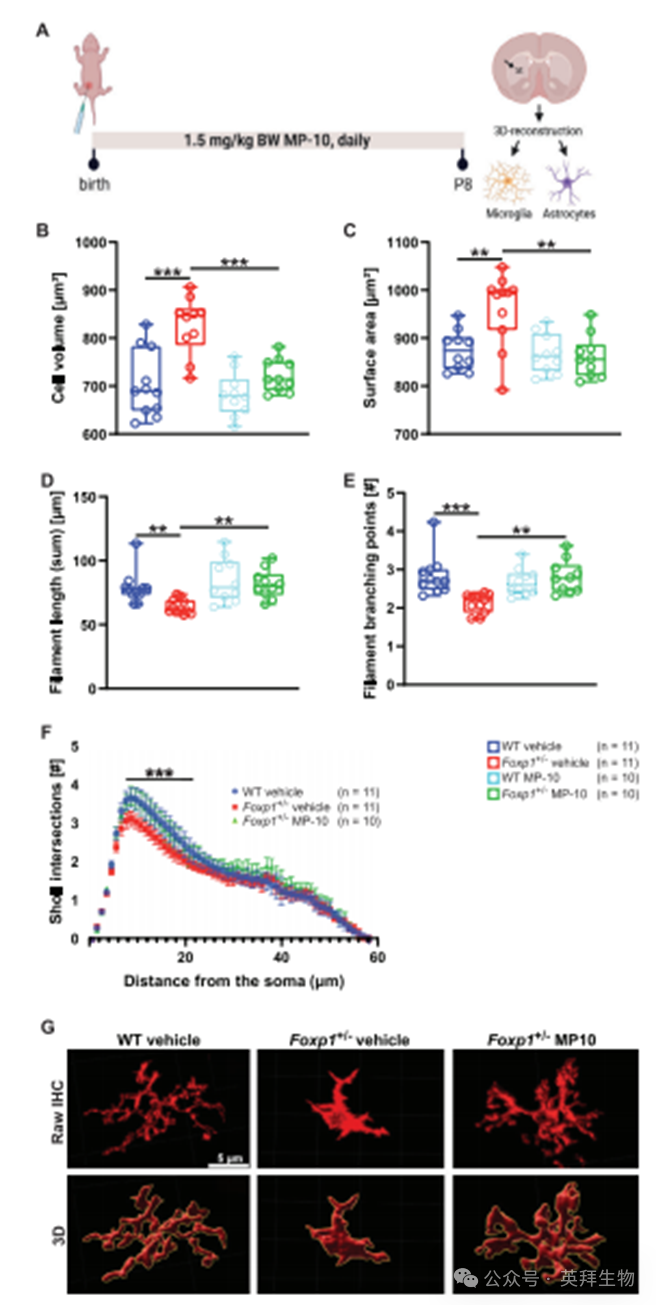
图5. MP-10给药使Foxp1±大脑纹状体小胶质细胞活性正常化并减少其介导的突触清除
结论:
本研究证实,在FOXP1综合征小鼠模型(Foxp1±)中,纹状体特异性Pde10a表达显著降低,并伴随小胶质细胞激活、突触修剪减少及神经炎症基因表达异常,从而导致自闭症样行为缺陷。出生后立即持续施用PDE10A拮抗剂MP-10,不仅能有效挽救小鼠的社交行为异常、多动和焦虑样行为,还能使纹状体中小胶质细胞的活化形态和突触修剪功能恢复正常,其作用机制可能与上调Bdnf表达、增强神经营养信号通路有关。这表明靶向PDE10A的早期干预可能是治疗FOXP1综合征的一种潜在策略。
参考文献:
Fröhlich H, Wang J, Althammer F, Schubert T, Kluck N, Grinevich V, Schmitteckert S, Schaaf CP, Rappold GA. Inhibition of Phosphodiesterase 10A by MP-10 Rescues Behavioral Deficits and Normalizes Microglial Morphology and Synaptic Pruning in A Mouse Model of FOXP1 Syndrome. Adv Sci (Weinh). 2025 Sep;12(36):e00623. doi: 10.1002/advs.202500623. Epub 2025 Jun 26.






