NLRP12通过降低TRIM25介导的HK2降解促进胃癌中糖酵解和H3K18la
胃癌是消化道最常见的原发性恶性肿瘤。近年来的研究表明,靶向肿瘤细胞代谢重编程是一种重要的癌症治疗策略。NLRP12与先天免疫、炎症和肿瘤发生有关,但其在胃癌进展中的作用尚不清楚。本研究发现NLRP12在胃癌组织和细胞中高表达,并与患者预后不良和生存呈正相关。NLRP12主要通过促进胃癌细胞的代谢重编程、H3K18la的表达和HK2的稳定来促进胃癌的进展。在本研究中,NLRP12与HK2竞争与TRIM25的结合,选择性地降低了HK2的k63连锁泛素化。此外,NLRP12在小鼠模型中也具有显著的促癌作用。综上所述,本研究表明NLRP12可以阻止TRIM25介导HK2的k63连锁泛素化,从而通过自噬体-溶酶体途径抑制HK2降解,从而提高其蛋白稳定性。这些变化增加乳酸生成并诱导H3K18la,从而增加Myc转录,从而促进胃癌进展。这些发现揭示了NLRP12的一种新的促癌机制,可能导致胃癌治疗的新靶点的确定。本文于2025年8月发表于Cell Death and Disease(IF=9.6)上。
技术路线:

结果:
1)NLRP12在胃癌中表达上调并与预后相关
为了研究NLRP12在胃癌进展中的作用,我们使用TCGA数据库和GSE134520数据集分析其在胃癌组织和邻近正常组织中的表达。根据TCGA数据分析,NLRP12在胃癌组织中显著过表达,且NLRP12高表达与较短的无病生存期相关(图1A,B)。GSE134520数据集涉及胃癌单细胞测序分析,分析该数据集发现NLRP12主要在胃癌恶性细胞中表达,在腺体粘膜、窝粘膜和血浆中也有部分表达(图1C)。免疫组化分析证实,与邻近正常组织相比,NLRP12在胃癌组织中特异性上调(图1D)。此外,通过对胃癌和癌旁组织中RNA和蛋白表达的分析,进一步发现NLRP12在胃癌中的表达高于癌旁组织(图1E,F)。为了进一步研究NLRP12在不同胃癌细胞系中的表达,我们从正常胃粘膜细胞(GES-1)和5种胃癌细胞系(SNU-216、AGS、HGC-27、Ncl-N87和MKN-45)中提取RNA和蛋白。NLRP12在SNU-216和AGS细胞中的表达水平显著高于GES-1细胞,而在其余3种胃癌细胞系(HGC-27、Ncl-N87和MKN- 45)中,NLRP12的表达水平与GES-1细胞无显著差异(图1G,H)。
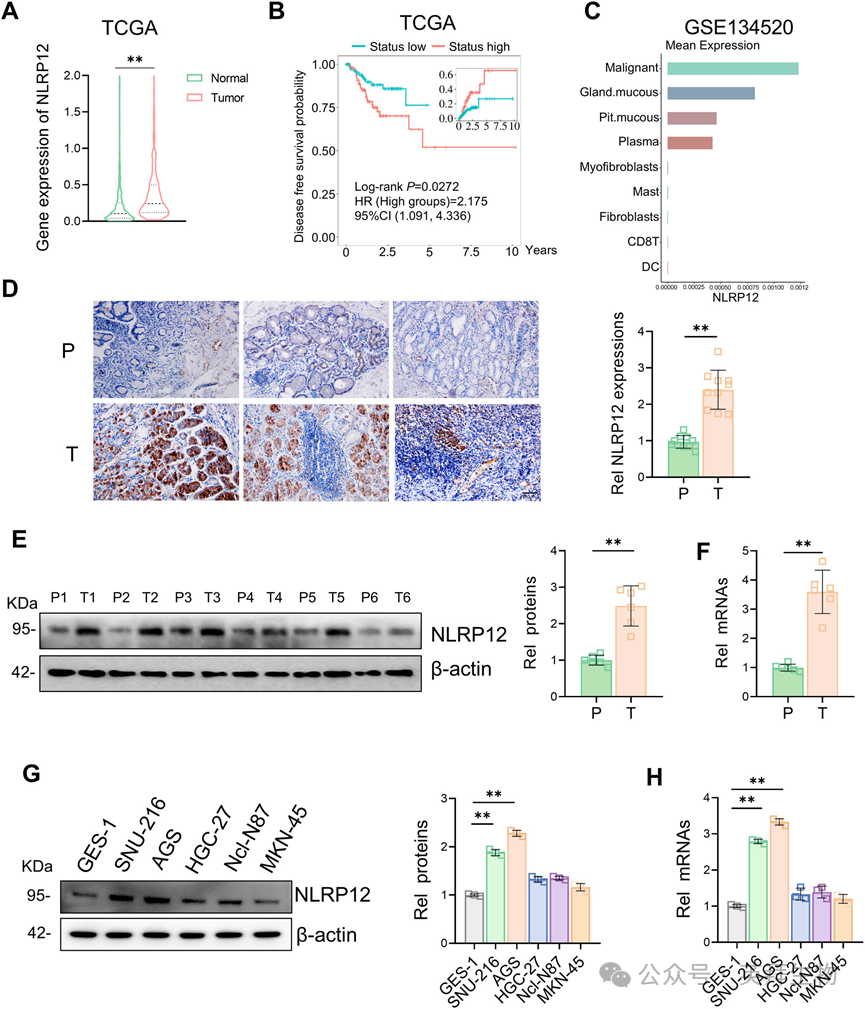
2)NLRP12在体内和体外均促进胃癌增殖
为了进一步探讨NLRP12在胃癌进展中的功能作用,我们在AGS细胞中敲低NLRP12,在MKN-45细胞中过表达NLRP12,并通过RT-qPCR和Western blot分析验证了敲低或过表达的效率(图2A-D)。为了验证NLRP12对胃癌细胞的作用,我们进行了CCK-8细胞活力实验、集落形成实验和EdU染色实验。NLRP12的下调显著降低了胃癌细胞的增殖能力,而NLRP12的过表达则显著增强了胃癌细胞的增殖能力(图2E-G)。为了进一步阐明NLRP12调控胃癌细胞增殖的能力,我们构建了裸鼠肿瘤异种移植模型。在体内,NLRP12的敲低显著抑制肿瘤的大小和体积,而NLRP12的过表达则增加肿瘤的大小和体积(图2H,I)。综上所述,NLRP12在体内和体外均能调控胃癌细胞的增殖。
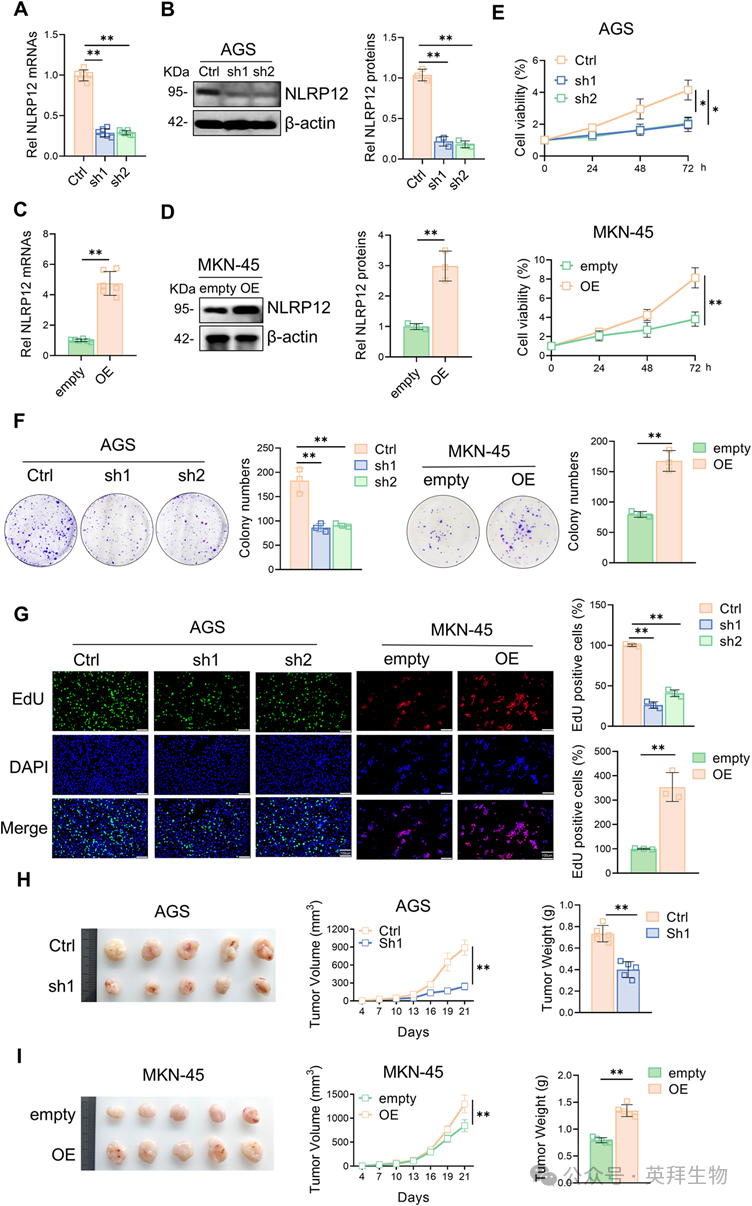
3)NLRP12通过糖代谢重编程促进H3K18la和胃癌进展
为了评估NLRP12是否通过糖酵解作用影响胃癌细胞增殖,我们进行了海马代谢通量分析。在胃癌细胞中,NLRP12敲低显著降低糖酵解水平和能力,而NLRP12过表达显著增加糖酵解水平和能力(图3A-C)。下调NLRP12后,胃癌细胞中乳酸总水平和组蛋白乳酸水平下降,而过表达NLRP12时则相反。通过泛乳酸化筛选和基于文献的优先级排序,我们确定H3K18是最受动态调节的乳酸化位点。引人注目的是,NLRP12敲低降低了H3K18的乳酸化水平,而NLRP12过表达则增强了这种修饰(图3D,E)。机制上,H3K18la已报道通过富集其基因组位点来激活Myc转录。ChIP和RT-qPCR实验一致显示,NLRP12被敲低后,H3K18la和Myc的转录水平下降,而NLRP12的过表达增加了H3K18la和Myc的转录水平(图3F,G)。总之,NLRP12通过糖代谢重编程驱动胃癌细胞增殖,并通过H3K18la与Myc转录激活机制相关。
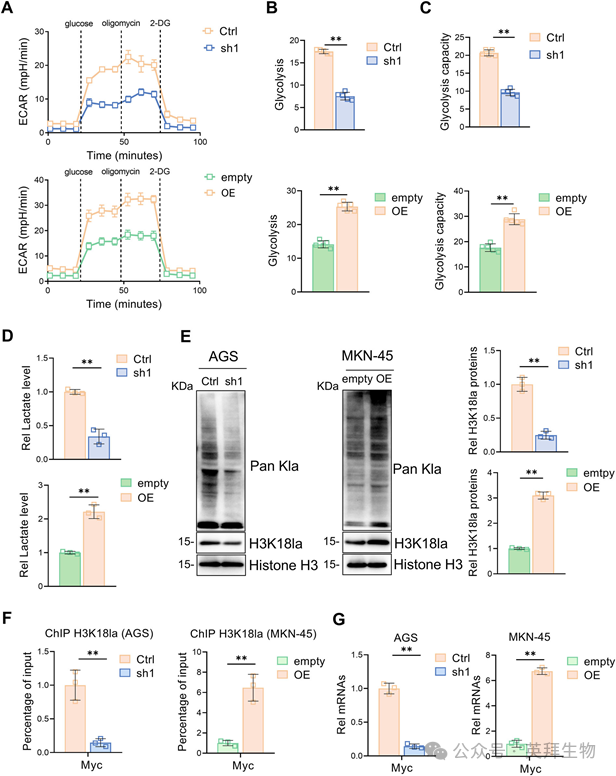
4)NLRP12促进HK2介导的胃癌H3K18la和增殖
为了评估NLRP12调控胃癌细胞糖酵解和乳酸生成的具体机制,我们研究了参与糖酵解的酶。当NLRP12被敲低时,HK2的表达显著下调,而PFKP的蛋白水平显著上调。相反,NLRP12过表达时,胃癌细胞中HK2蛋白水平显著升高,而其他糖酵解酶水平无显著变化。结合NLRP12敲低和过表达实验的结果,我们得出结论,NLRP12主要通过调节HK2的表达影响糖酵解的改变(图4A,B)。此外,为了建立因果关系,我们通过在NLRP12缺失的细胞中共表达HK2进行了拯救实验,从而恢复了乳酸生成、H3K18la、Myc转录和增殖能力(图4C-I)。
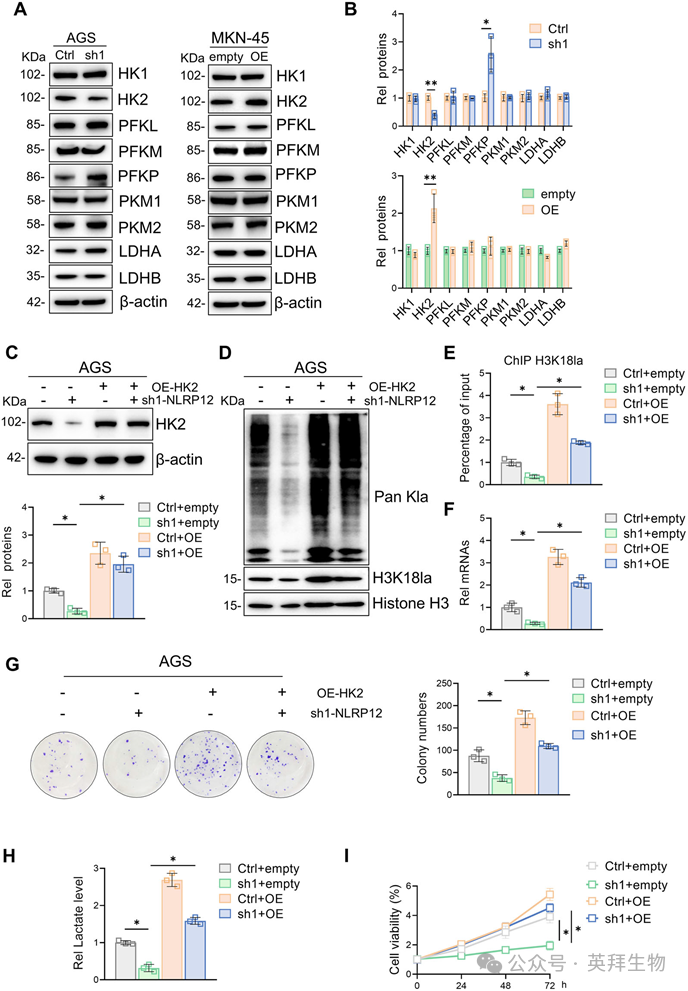
5)靶向HK2抑制NLRP12介导的胃癌增殖和进展
为了进一步阐明NLRP12通过HK2介导的糖酵解促进胃癌增殖,我们采用了药理学抑制(2-DG,一种竞争性HK2抑制剂)和基因沉默(shRNA介导的HK2敲低)。在NLRP12过表达的细胞中,2-DG处理显著降低了pan-Kla、H3K18la修饰、乳酸生成、Myc转录水平和增殖能力(图5A-F)。此外,在相同的细胞背景下,HK2缺失表型上显示了2-DG诱导的抑制(图5G-M)。总之,这些数据表明,靶向HK2可破坏NLRP12介导的代谢重编程和胃癌的恶性进展。
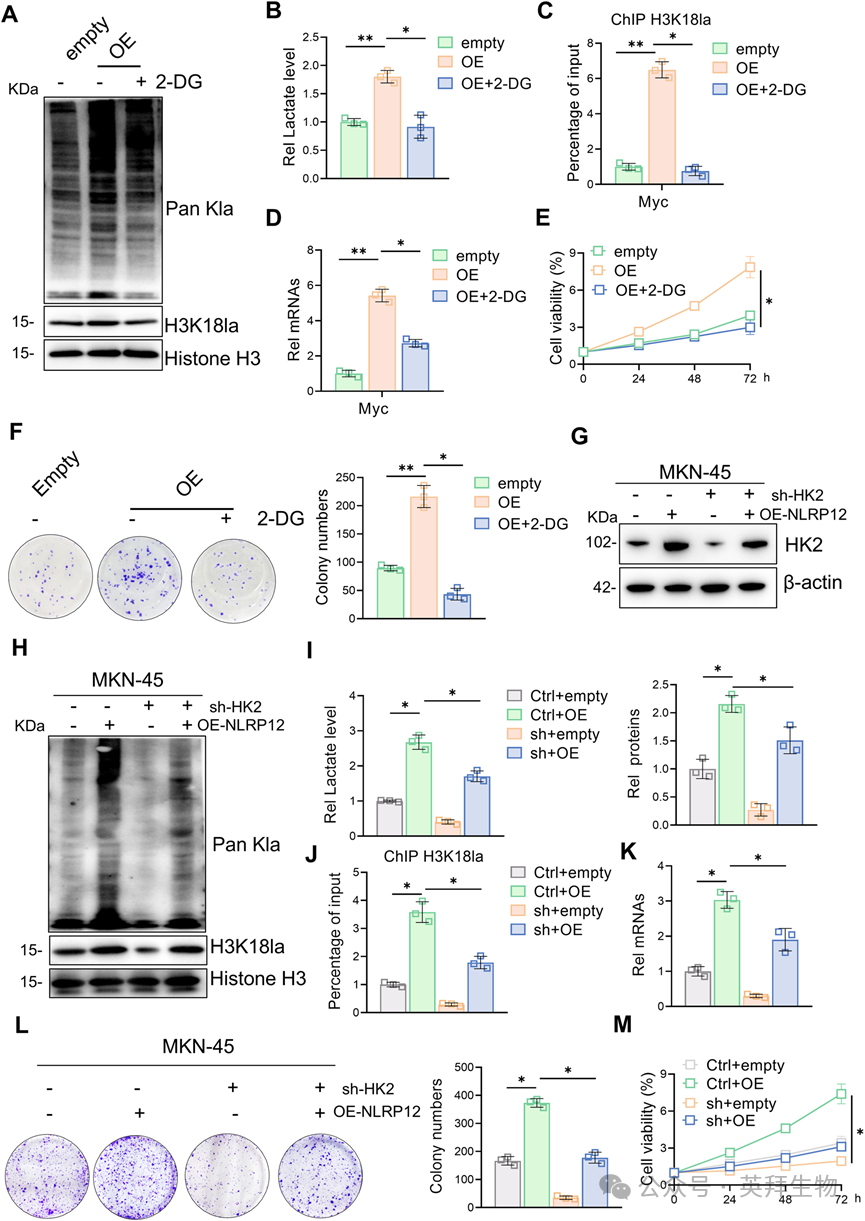
6)NLRP12通过阻断K63连接的泛素化和溶酶体靶向来稳定HK2
为了进一步探索NLRP12调控HK2的具体机制,我们检测了所有糖酵解酶的转录水平。NLRP12的敲除和过表达都没有显著改变HK2的转录水平。为了确定HK2的转录和蛋白质稳定性,我们用CHX或ActD处理胃癌细胞以阻断蛋白质或mRNA的合成,并在NLRP12缺失或NLRP12过表达的细胞中随时间(0,3,6和12 h)评估HK2的降解情况。NLRP12调节HK2蛋白的稳定性,但不影响HK2 mRNA的转录稳定性(图6A)。由于蛋白质的稳定性主要受泛素蛋白酶体系统和自噬系统的调节,我们使用经典的泛素化抑制剂MG132和自噬溶酶体途径抑制剂CQ处理NLRP12过表达的胃癌细胞。结果表明,NLRP12可能通过溶酶体降解途径影响HK2的蛋白降解(图6B)。NRLP12敲低或过表达后,HK2泛素化水平分别降低或升高(图6C)。先前的研究表明,自噬调节的泛素化介导的HK2降解可能主要依赖于k63连锁的泛素化;为了直接探究k63连锁泛素化的作用,我们用野生型泛素(Ub-K63)或K63R泛素突变体(Ub-K63R)转染293T细胞,以阻止k63特异性链的形成。NLRP12抑制k63连锁的HK2多泛素化,而Ub-K63R突变体的表达消除了这种调节作用,证实了NLRP12对k63连锁链的特异性(图6D,E)。为了进一步明确HK2蛋白在溶酶体中的水平,我们进行了溶酶体IP实验。实验结果表明,HK2可以进入溶酶体。EBSS治疗后,溶酶体中HK2蛋白水平显著升高,表明HK2可以通过溶酶体途径降解。NLRP12敲除后,溶酶体中HK2水平显著升高。同时,我们进行了IF染色并定量分析了HK2与溶酶体的共定位。值得注意的是,NLRP12敲低显著增强了HK2和溶酶体之间的共定位。这些发现表明NLRP12可能通过抑制其溶酶体靶向来抑制HK2蛋白的降解(图6F,G)。
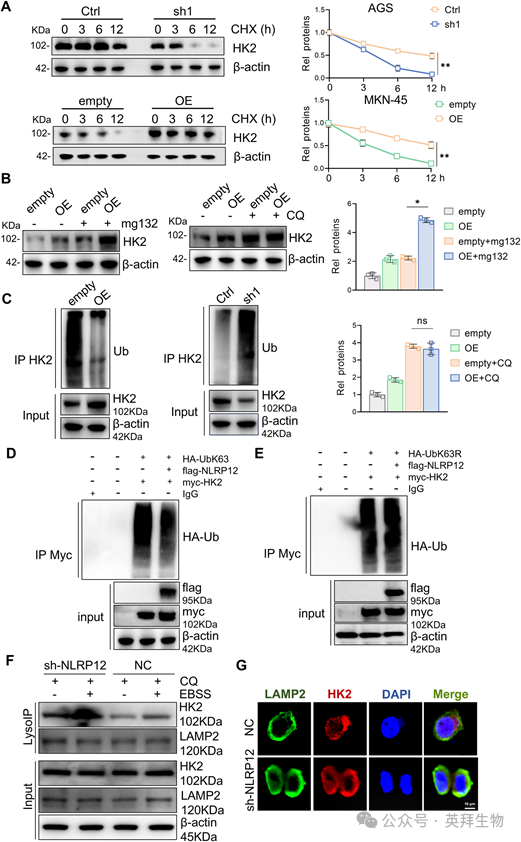
7)NLRP12通过竞争结合抑制TRIM25介导的K63连接的HK2泛素化
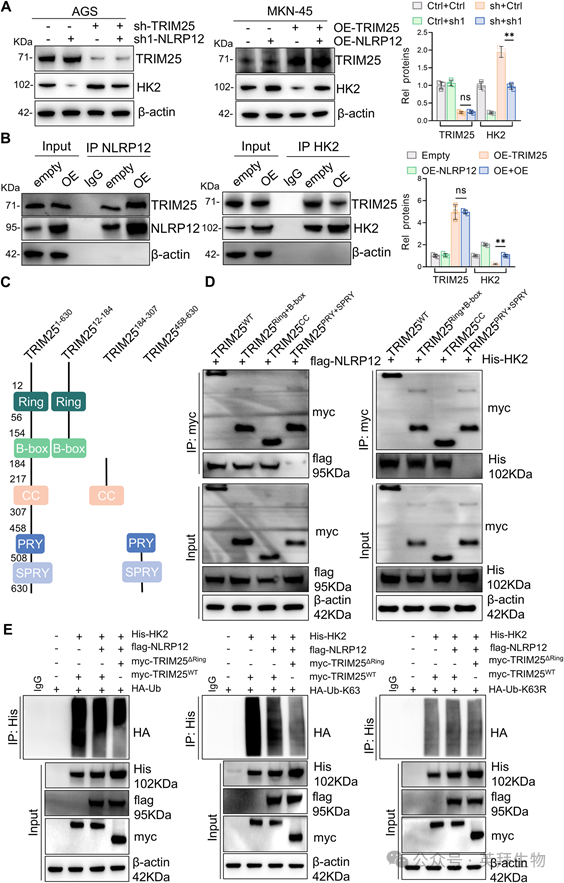
IP-MS筛选发现E3连接酶TRIM25与HK2相互作用。进一步研究发现,敲低TRIM25可显著逆转NLRP12敲低导致的HK2表达降低,过表达TRIM25可显著降低NLRP12过表达导致的HK2表达升高(图7A)。Co-IP证实了NLRP12-TRIM25的相互作用,NLRP12过表达时NLRP12-TRIM25结合增加,TRIM25过表达时TRIM25-HK2结合减少(图7B)。TRIM25的域特异性截断分析表明,NLRP12与HK2竞争结合其Ring/B-box/CC结构域,而不是PRY/SPRY结构域。NLRP12过表达显著降低了TRIM25和HK2之间的相互作用,从而损害了TRIM25依赖的k63连接的HK2泛素化及其溶酶体降解(图7C,D)。随后,我们生成结构域缺陷突变体(ΔRing)并进行泛素化分析。在TRIM25ΔRing-expressing细胞中,总泛素化和k63连接的HK2多泛素化均明显减少。引人注目的是,K63连锁缺陷泛素突变体(Ub-K63R)的表达在同等程度上消除了TRIM25WT或TRIM25ΔRing介导的HK2泛素化。这些数据表明,TRIM25通过其功能性环结构域选择性地驱动HK2的K63-linked多泛素化(图7E)。
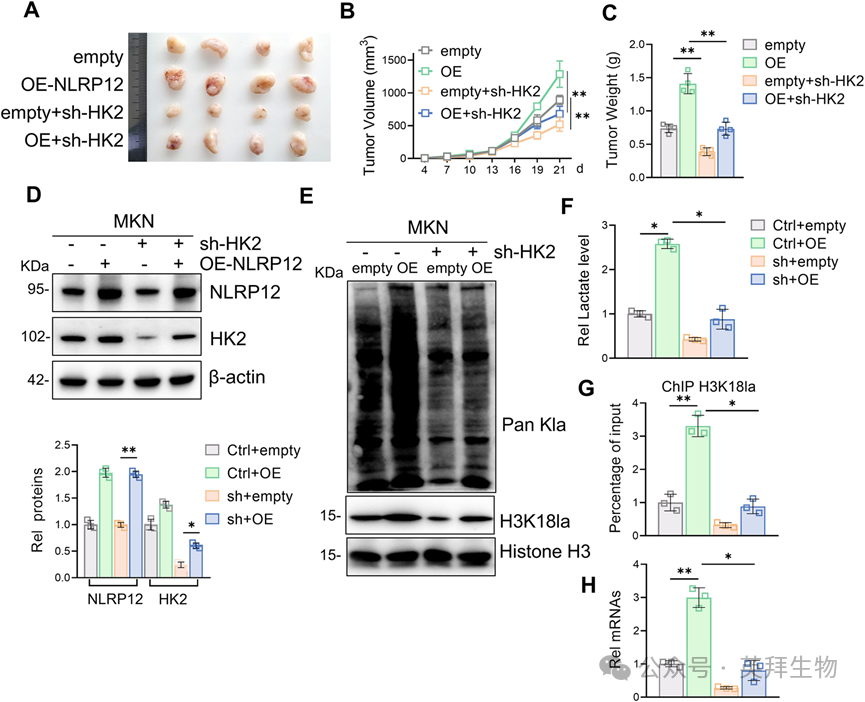
8)NLRP12在体内通过HK2促进胃癌进展
为了研究NLRP12在体内促进胃癌发生的具体机制,我们建立了异种移植胃癌模型。与对照组相比,NLRP12过表达显著增加了肿瘤负荷参数(大小/体积/重量),而HK2敲低显著降低了这些致瘤指标(图8A-C)。此外,对肿瘤组织的分析显示,NLRP12在体内促进HK2表达、组蛋白乳酸化、H3K18la、乳酸水平和Myc转录,这些都被sh-HK2干预逆转(图8D-H)。这些研究结果表明,NLRP12通过HK2依赖性调节H3K18la修饰和Myc信号驱动胃癌发生。
结论:
本研究揭示NLRP12介导的HK2泛素化是胃癌中调节糖酵解和组蛋白乳酸化的主要机制,对胃癌的进展具有重要意义。本研究结果为胃癌的临床治疗应用提供了强有力的证据。
参考文献:
Zhou L, Wang Z, Huang Y, Zhang X, Jiang H, Guo Z, Zhou G, Liu H. NLRP12 decreases TRIM25-mediated HK2 degradation to promote glycolysis and H3K18la in gastric cancer. Cell Death Dis. 2025 Aug 13;16(1):615. doi: 10.1038/s41419-025-07923-3.






