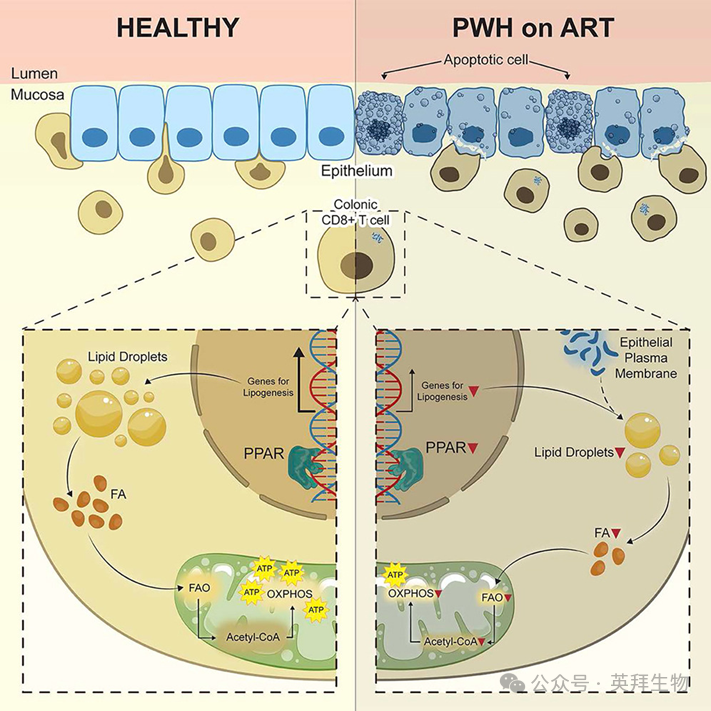
CD8+ T 细胞免疫代谢缺陷破坏HIV感染者的肠道屏障
HIV感染的一个标志性特征是肠道屏障完整性的破坏,这种破坏在HIV感染者(PWH)中即使接受抗逆转录病毒治疗(ART)后仍持续存在。该现象是HIV疾病进展的核心环节,但其成因尚未完全阐明。我们报道了一种机制:PWH患者结肠驻留CD8+ T细胞的免疫代谢缺陷会导致肠上皮细胞凋亡和肠道屏障完整性破坏。研究发现,PWH患者的这些细胞下调脂质感应器过氧化物酶体增殖物激活受体γ(PPARγ),导致细胞内脂滴减少、脂肪酸氧化受损,并促使CD8+ T细胞从肠上皮细胞获取脂质,进而引发上皮细胞死亡。我们的研究结果表明,HIV相关的结肠CD8+ T细胞免疫代谢失调会导致肠上皮稳态失衡。这些发现为减少PWH患者及其他肠道屏障完整性受损疾病的并发症提供了潜在策略。本文于2025年9月发表于《Cell》, IF 42.5。
图形摘要
主要实验结果
1. ART治疗者肠道屏障破坏由结肠驻留免疫细胞介导
通过检测血浆肠道脂肪酸结合蛋白(I-FABP,肠上皮损伤的生物标志物),我们发现无论是否接受ART治疗,PWH患者的水平均高于HIV未感染者(图1A)。对结肠组织活检标本进行凋亡标志物cleaved caspase 3(CC3)染色显示,与未感染HIV者相比,未治疗和ART治疗的PWH患者上皮细胞死亡均增加(图1B、1C)。尽管存在这些现象,HIV感染并未改变结肠隐窝中肠道干细胞和增殖细胞的频率。通过结肠上皮的电子断层扫描技术,我们未发现ART治疗的PWH患者存在紧密连接异常的证据。为深入探究PWH上皮细胞凋亡机制,我们利用内镜结肠组织活检建立了患者来源的结肠类器官(colonoid)模型(图1D)。直接从ART治疗的PWH患者体外培养的原代结肠类器官比HIV未感染者表现出更高的上皮细胞凋亡(图1E)。将这些类器官机械分离为单细胞后,ART治疗者原代结肠类器官中的上皮干细胞仍能再生形成新的次级结肠类器官(图1F)。这种肠道干细胞形成次级类器官的能力("克隆形成能力")在ART治疗者与HIV未感染者中无差异。值得注意的是,在源自ART治疗者的次级结肠类器官中,原代结肠类器官中观察到的上皮细胞凋亡增加现象消失(图1G、1H)。与此一致,衡量细胞损伤的乳酸脱氢酶(LDH)释放量在ART治疗者原代结肠类器官中高于HIV未感染者,但次级类器官中未见此现象。这些结果表明,体内观察到的肠上皮细胞凋亡在ART治疗者原代结肠类器官中得以重现,但在解离后种植形成的次级类器官中该细胞死亡现象消失。
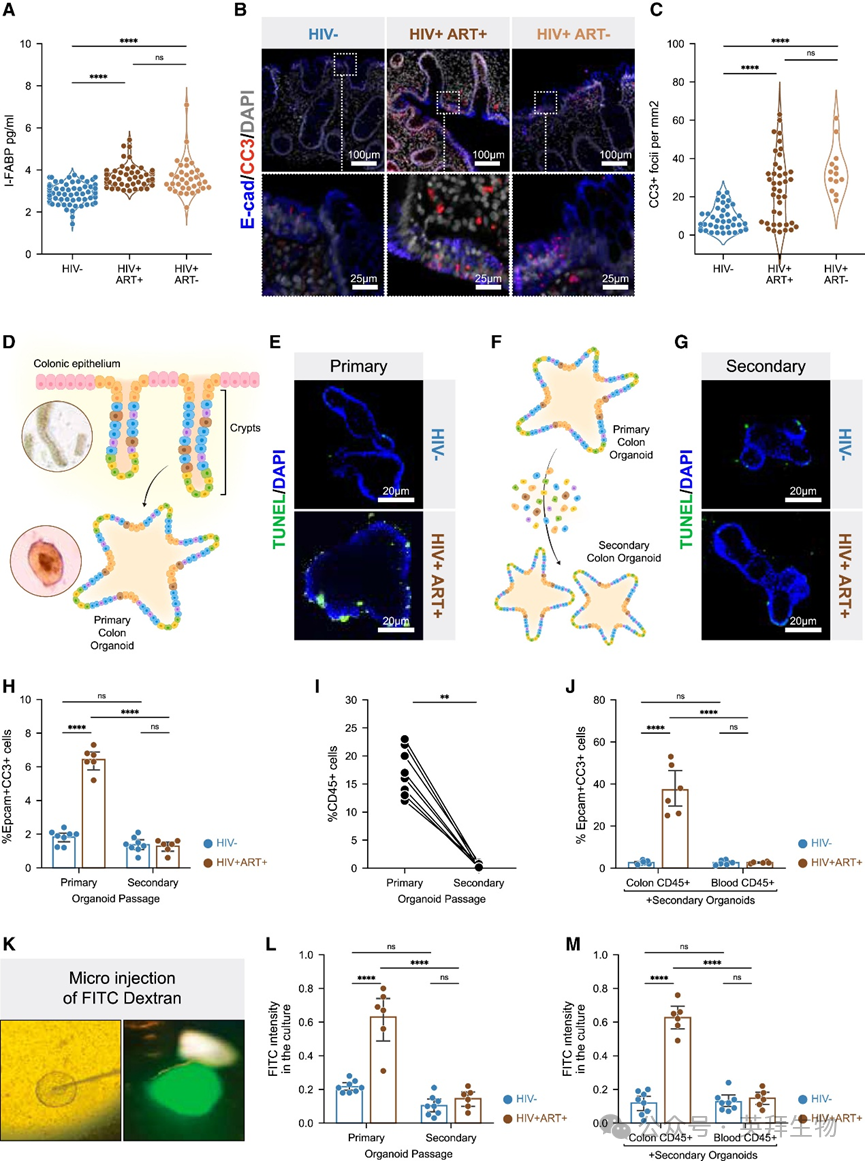
图1 ART治疗的HIV感染者肠道屏障破坏由结肠驻留免疫细胞介导
通过流式细胞术分析原代与次级类器官的细胞组成,我们发现次级类器官中CD45+免疫细胞缺失,且该现象与HIV感染状态无关(图1I)。当将自体结肠固有层(而非外周血)来源的CD45+免疫细胞与ART治疗者的次级结肠类器官共培养时,上皮细胞凋亡增加现象恢复(图1J)。而将自体结肠CD45+免疫细胞添加到HIV未感染者的次级类器官中则不会诱发上皮细胞凋亡(图1J)。LDH释放检测结果与此一致。这些发现表明结肠CD45+免疫细胞是诱导ART治疗者结肠类器官上皮细胞凋亡的必要且充分条件。
为验证ART治疗者结肠上皮细胞凋亡是否导致屏障完整性丧失,我们向原代结肠类器官腔内微量注射FITC-葡聚糖并通过检测上清液渗漏量进行评估(图1K)。结果显示ART治疗者原代结肠类器官的FITC渗漏量高于HIV未感染者(图1L)。次级类器官中FITC渗漏现象消失,但添加自体结肠驻留CD45+免疫细胞(而非血液来源CD45+细胞)后可重现该现象(图1M)。综上所述,这些结果表明ART治疗的PWH患者结肠驻留CD45+免疫细胞介导了上皮细胞凋亡和屏障完整性破坏。
2. ART治疗的PWH患者结肠CD8+ T细胞通过非经典功能诱导上皮细胞凋亡
为确定具体哪种CD45+免疫细胞亚群介导上皮细胞凋亡,我们将ART治疗者次级结肠类器官分别与自体结肠CD4+ T细胞、CD8+ T细胞及非T免疫细胞(CD45+ CD3−)共培养。仅CD8+ T细胞的加入能重现原代结肠类器官中观察到的上皮损伤(图2A)。通过共聚焦显微镜观察结肠组织样本中CD8+ T细胞相对于上皮层的定位,发现ART治疗者的结肠CD8+ T细胞比HIV未感染者更靠近或直接位于上皮层内(图2B、2C)。两组人群结肠中总CD8+ T细胞频率无显著差异。为探究CD8+ T细胞介导上皮凋亡的机制,我们采用Transwell分隔培养、直接共培养或添加T细胞上清液的方式培养类器官。结果表明上皮细胞凋亡主要依赖CD8+ T细胞与上皮细胞的直接接触,但可溶性因子也可能部分参与(图2D)。这些发现说明ART治疗者结肠CD8+ T细胞与上皮细胞的近距离接触是诱导上皮凋亡的必要条件。
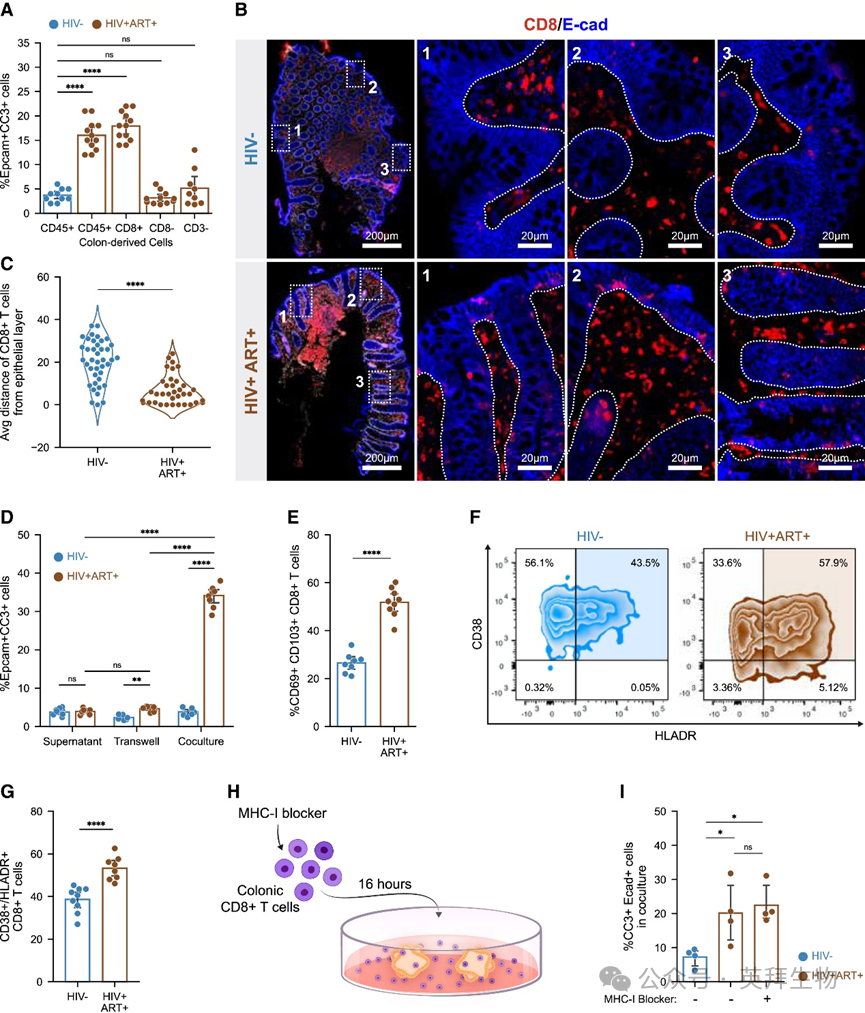
图2 ART治疗者结肠CD8+ T细胞通过接触依赖性非经典机制触发上皮细胞凋亡
鉴于结肠组织驻留记忆(TRM)CD8+ T细胞在抗感染和抗肿瘤中起关键作用,我们分析了记忆性(CD45RO+)和驻留性(CD69+ CD103+/−)亚群,发现ART治疗者中CD103+ TRM(CD45RO+ CD69+ CD103+;下称TRM CD8+ T细胞)频率高于HIV未感染者(图2E),但总记忆性CD8+ T细胞(CD45RO+CD8+)无差异。ART治疗者的TRM CD8+ T细胞活化程度(CD38+ HLA-DR+)也更高(图2F、2G)。值得注意的是,ART治疗者结肠来源免疫细胞的细胞内IL-15水平高于未感染者,提示T细胞可能通过IL-15促进自身活化。然而当用植物血凝素(PHA)、CD3/CD28抗体或IL-15激活HIV未感染者的TRM CD8+ T细胞并与次级结肠类器官共培养时,这些细胞未能诱导上皮细胞凋亡,表明T细胞活化不足以介导该效应。我们还发现PWH患者的TRM CD8+ T细胞效应细胞因子(IFNγ和TNFα)、穿孔素分泌减少,颗粒酶分泌无变化。阻断这些通路不能阻止CD8+T细胞介导的类器官上皮细胞凋亡,且该过程不依赖MHC-I(图2H、2I)。综上,ART治疗者的TRM CD8+ T细胞通过接触依赖性非经典机制介导上皮细胞凋亡。
3. ART治疗的PWH患者结肠CD8+ T细胞存在脂质代谢功能障碍
通过差异基因表达(DGE)分析发现,ART治疗者结肠TRM CD8+ T细胞中多个脂质代谢相关基因和通路表达下调(图3A、3B)。在南非独立队列的PWH患者中也观察到类似现象。两个数据集均显示ART治疗者过氧化物酶体增殖物激活受体γ(PPARγ)表达下调。PPARγ下游基因表达也显著降低,包括:编码长链脂肪酸摄取膜蛋白的CD36;甘油三酯合成关键酶二酰基甘油O-酰基转移酶2(Dgat2);调控细胞内脂滴(LD)的Patatin样磷脂酶域蛋白7(Pnpla7);以及通过调控二酰基甘油(DAG)在脂滴形成中起核心作用的二酰基甘油激酶α/γ(DGKa/DGKg)。既往研究证实这些基因启动子区存在PPAR反应元件(PPRE)。我们进一步证实ART治疗者结肠TRM CD8+ T细胞中PPARγ蛋白表达下调。由于PPAR是关键的脂肪酸感应器,这些基因及其他PPAR家族成员的表达减少凸显了ART治疗者脂质代谢通路的广泛紊乱。
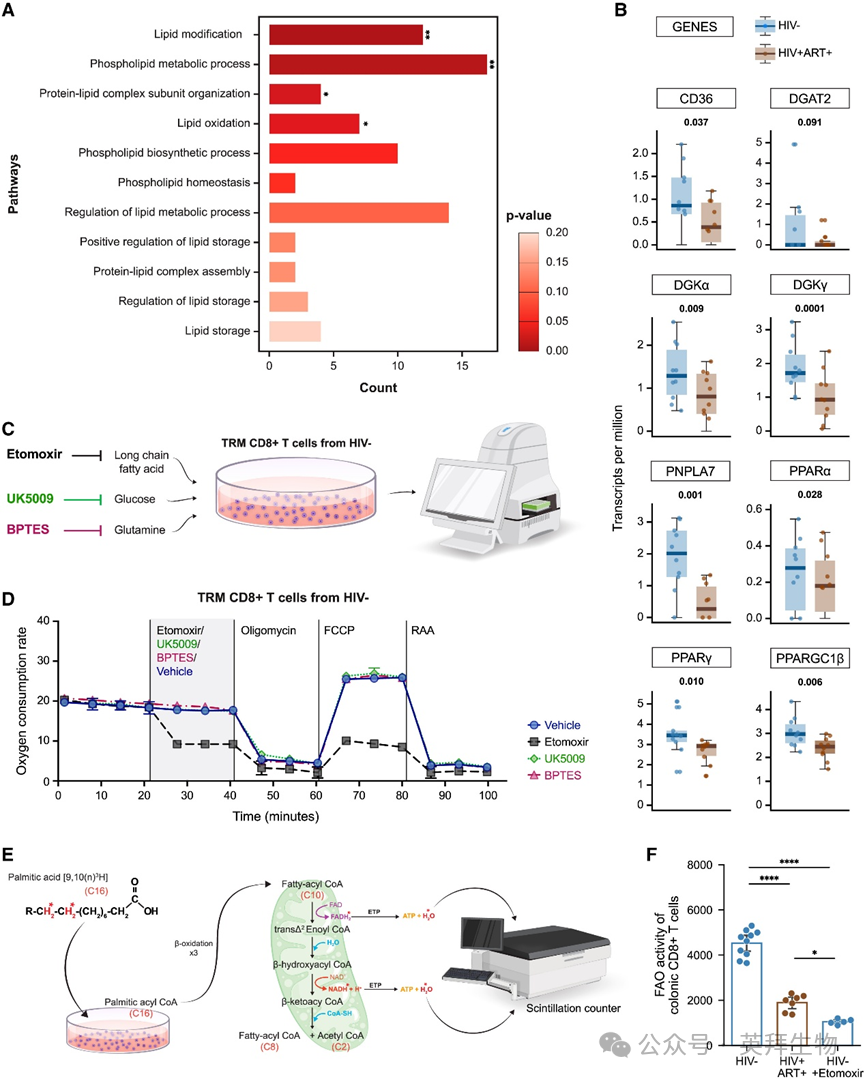
图3 ART治疗者结肠TRM CD8+ T细胞的脂质代谢受损
针对脂质代谢转录失调,我们检测了这些细胞的代谢需求。HIV未感染者结肠TRM CD8+ T细胞高度依赖脂肪酸利用——肉碱棕榈酰转移酶-1A(CPT1A)抑制剂乙莫克舍(etomoxir)处理会降低其线粒体氧化代谢(图3C、3D),该现象在外周血CD8+ T细胞中未出现。葡萄糖或谷氨酰胺的缺失不影响结肠TRM CD8+T细胞的线粒体氧化代谢(图3C、3D),表明其维持高度依赖脂肪酸氧化(FAO),与外周血CD8+ T细胞截然不同。
采用氚标记棕榈酸处理细胞并通过检测氚水释放量评估FAO活性(图3E),发现ART治疗者TRM CD8+ T细胞的FAO活性低于HIV未感染者(图3F)。乙莫克舍处理也可降低未感染者CD8+ T细胞的FAO活性(图3F)。通过测量基础呼吸和储备能力(满足细胞ATP需求的关键参数)发现,ART治疗者结肠TRM CD8+ T细胞线粒体氧化代谢受损,表现为基础呼吸和储备能力降低。外源性棕榈酸处理未能恢复其线粒体氧化代谢功能。但BODIPY C16标记实验显示,ART治疗者与未感染者的TRM CD8+ T细胞具有相似的脂肪酸摄取能力。这些数据表明,ART治疗者结肠TRM CD8+ T细胞高度依赖FAO且能从局部环境摄取脂肪酸,但无法有效利用外源性脂肪酸进行FAO。
4. PPARγ激动剂治疗恢复ART治疗者结肠CD8+ T细胞脂质稳态
细胞内脂滴(LDs)作为内部脂质储备,为细胞代谢提供脂肪酸。鉴于脂质感应器PPARγ及其下游靶标表达下调,我们探究了LDs是否为结肠TRM CD8+ T细胞FAO的脂肪酸来源。通过分别阻断LD生物合成和脂解关键酶DGAT与ATGL(图4A),发现HIV未感染者结肠TRM CD8+ T细胞的FAO活性降低(图4B),表明这些细胞从LDs动员脂肪酸进行FAO。使用DGAT或ATGL抑制剂(Atglistatin)耗尽LDs后,HIV未感染者的结肠TRM CD8+ T细胞也能诱导上皮细胞凋亡。这表明LD动员的脂肪酸对CD8+ T细胞内在FAO至关重要,破坏TRM CD8+ T细胞的LD代谢会导致上皮细胞凋亡。
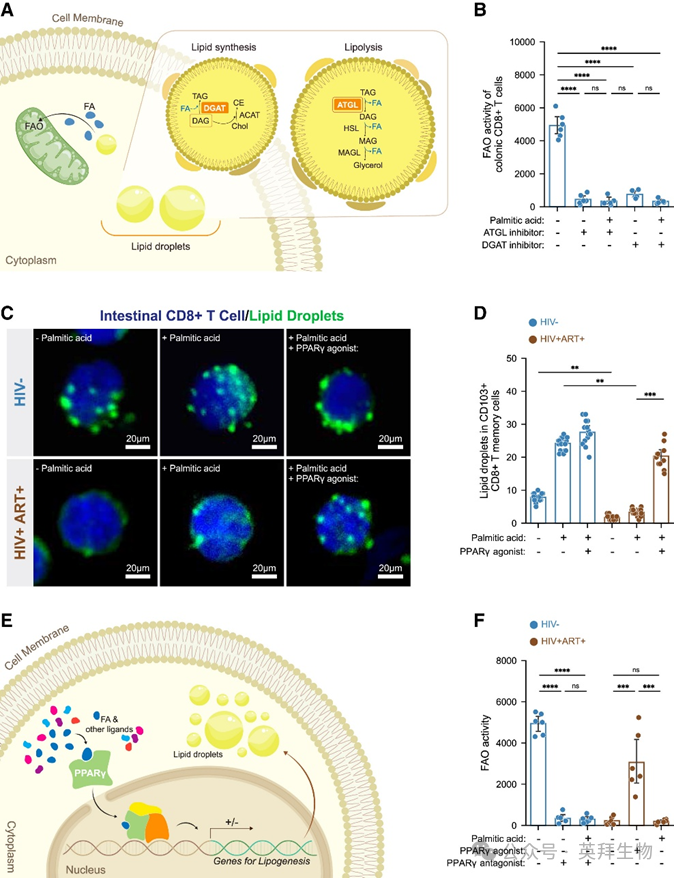
图4 PPARγ介导的脂滴补充恢复ART治疗者结肠CD8+ T细胞脂质稳态
通过LD染色发现,ART治疗者结肠TRM CD8+ T细胞的LDs少于HIV未感染者(图4C、4D)。外源性脂肪酸(棕榈酸)处理无法逆转这种耗竭(图4C、4D),与外源性脂肪酸不能增强线粒体代谢的观察一致。但PPARγ激动剂罗格列酮处理可补充LDs(图4C、4D),这与PPARγ调控LD生物合成的功能相符(图4E)。罗格列酮处理还提高了ART治疗者TRM CD8+ T细胞的FAO活性,而PPARγ拮抗剂GW9662显著降低未感染者细胞的FAO活性(图4F)。这些结果表明结肠TRM CD8+ T细胞依赖LDs维持代谢稳态,但HIV感染者的LDs耗竭且FAO受损。重要的是,PPARγ激动剂罗格列酮可逆转这种LD耗竭和FAO缺陷。
5. ART治疗者结肠TRM CD8+ T细胞通过PPARγ依赖性脂质摄取介导上皮细胞凋亡
为探究脂质代谢失调如何导致上皮细胞凋亡,我们对TRM CD8+ T细胞与结肠类器官进行实时成像以观察细胞间相互作用。用亲脂性染料DiI标记类器官上皮细胞脂质,两亲性染料CellMask标记质膜,并与CellTrace Violet标记的自体TRM CD8+ T细胞共培养。结果显示ART治疗者的TRM CD8+ T细胞与上皮细胞的接触频率显著高于未感染者(图5A、5B)。DiI标记的上皮细胞脂质向TRM CD8+ T细胞的转移水平在ART治疗者中也更高(图5C)。加入肌动蛋白聚合抑制剂latrunculin A或PI3激酶抑制剂渥曼青霉素可阻断这种脂质转移(图5C),这两种抑制剂此前被证实能抑制T细胞和癌细胞从靶细胞摄取质膜片段。latrunculin A或渥曼青霉素处理显著降低了ART治疗者样本的上皮细胞凋亡(图5D)。通过共培养Cy5-PE标记的模拟质膜的脂质体纳米颗粒(图5E),进一步证实TRM CD8+ T细胞的脂质摄取能力,Cy5-PE可快速转移至CD8+T细胞(图5F)。这些发现表明ART治疗者的结肠TRM CD8+ T细胞通过接触上皮细胞、从上皮细胞膜获取脂质,进而诱导其凋亡。
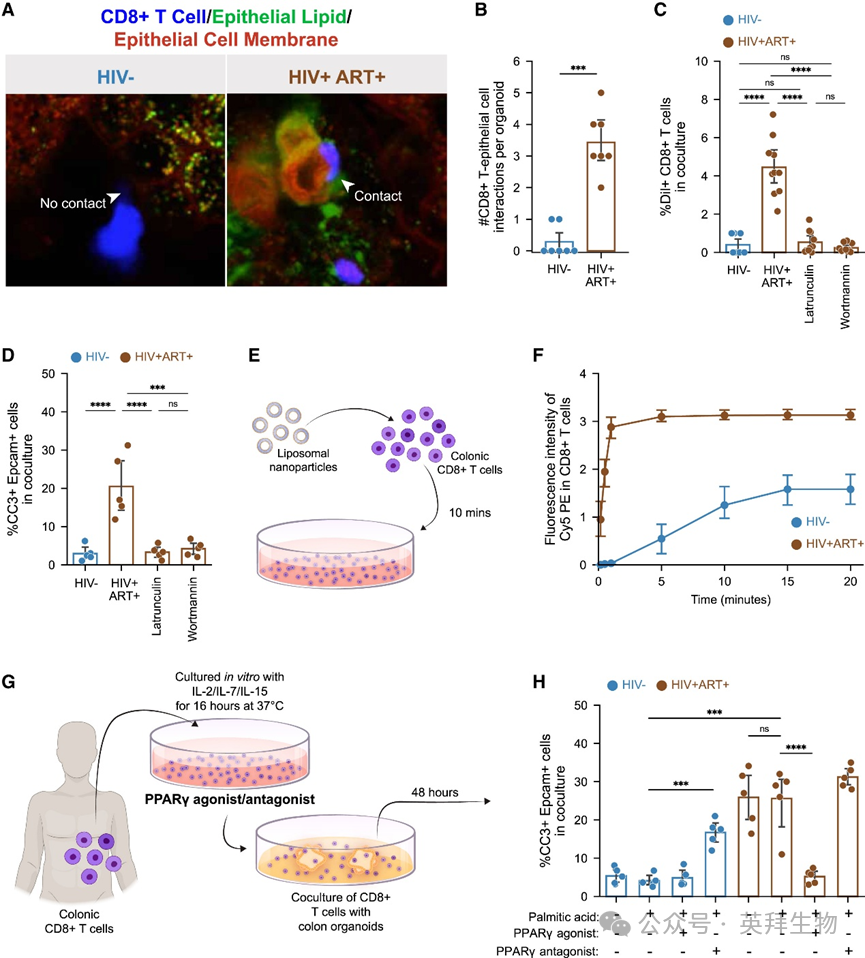
图5 PPARγ激动剂处理消除TRM CD8+ T细胞介导的上皮细胞凋亡
前述研究表明激活PPARγ可通过补充内在LDs增强FAO活性(图4F)。为验证PPARγ激动剂能否逆转PPARγ缺陷的TRM CD8+ T细胞所致上皮细胞凋亡,我们用罗格列酮处理ART治疗者的结肠CD8+ T细胞(图5G),发现其诱导的上皮细胞死亡减少(图5H),CD8+ T细胞-上皮细胞接触频率降低,DiI从上皮细胞的转移量减少。相反,用PPARγ拮抗剂GW9662处理HIV未感染者的TRM CD8+ T细胞后,其诱导上皮细胞凋亡(图5H),与上皮细胞接触增加,DiI从上皮细胞的转移量升高。这些结果表明结肠TRM CD8+ T细胞中PPARγ信号减弱导致其从上皮细胞 scavenge 脂质,进而诱导上皮细胞凋亡。重要的是,PPARγ激动剂罗格列酮可逆转该过程。
6.小鼠模型中结肠CD8+ T细胞PPAR信号是维持肠道屏障完整性的必要条件
为验证PPAR下调在结肠TRM CD8+ T细胞诱导上皮细胞凋亡中的关键作用,我们构建了CD8+T细胞特异性缺失PPARα/β/γ(小鼠中功能冗余的同工型)的小鼠模型(CD8-PPAR全身敲除[TKO])。CD8-PPAR TKO小鼠结肠CD8+ T细胞出现LD耗竭(图6A、6B),符合PPAR在LD生物合成中的关键作用。将肠系膜淋巴结分离的TKO CD8+T细胞过继转移至Rag2 KO小鼠后,其结肠上皮细胞凋亡显著多于野生型(WT)CD8+ T细胞转移组(图6C、6D、6E)。TKO小鼠结肠CD8+ T细胞与小鼠结肠类器官共培养时也诱导更高水平的上皮细胞凋亡。通过FITC-葡聚糖灌肠评估肠道屏障功能,发现接受TKO CD8+ T细胞的Rag2 KO小鼠屏障破坏程度显著高于WT组(图6F)。这些发现进一步支持以下模型:结肠TRM CD8+ T细胞中PPAR下调通过异型细胞相互作用导致肠上皮细胞凋亡和肠道屏障破坏。
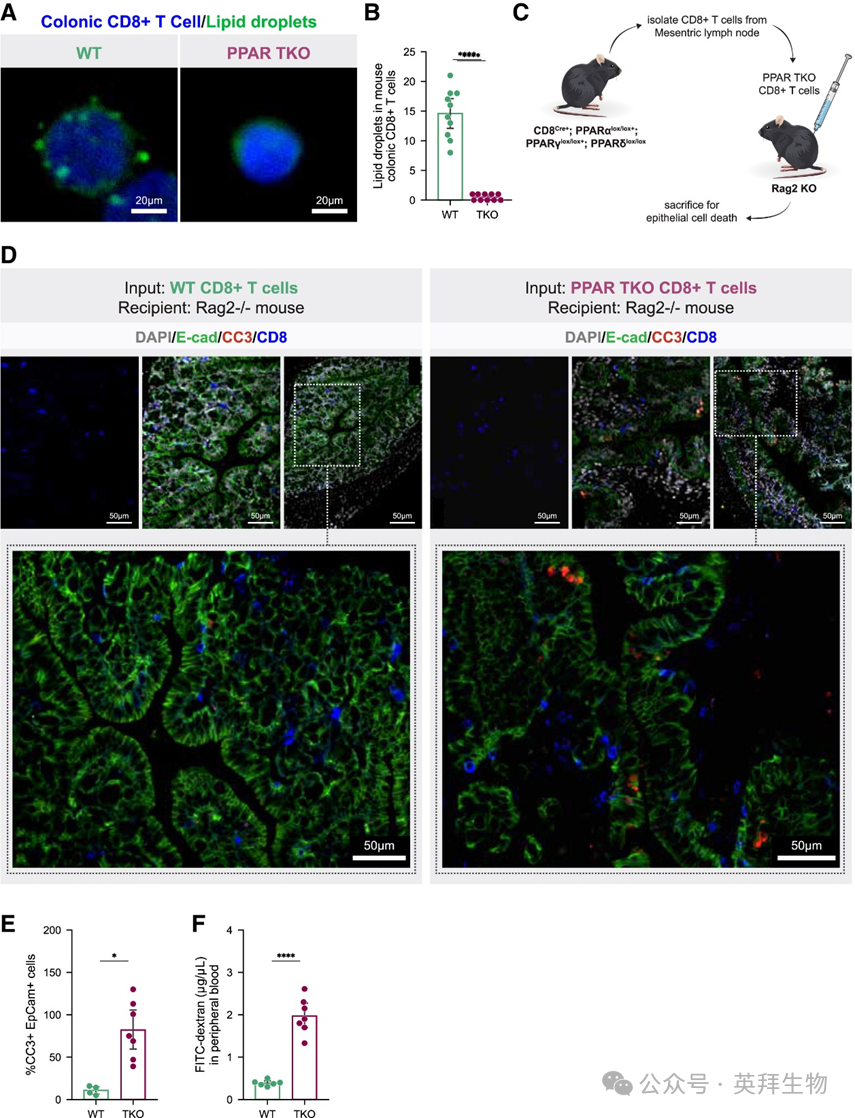
图 6 结肠CD8+ T 细胞中的 PPARγ信号传导对于维持肠道屏障完整性至关重要
结论
本研究发现HIV感染者存在持续性肠上皮损伤(ART未治疗者和治疗者血浆I-FABP水平均升高)。结肠活检显示上皮细胞凋亡增加,但肠道干细胞频率未改变。患者来源的结肠类器官模型重现了这种上皮细胞凋亡,且依赖于自体结肠TRM CD8+ T细胞共培养。这些细胞呈现PPAR及脂质代谢通路下调、FAO受损。小鼠模型中CD8+ T细胞PPAR的基因缺失进一步强调了这些脂质调控因子在维持上皮-免疫微环境及肠道屏障功能中的重要作用(不仅限于HIV感染背景)。重要的是,PPARγ激动剂罗格列酮处理可恢复HIV感染者TRM CD8+ T细胞的脂质稳态,并减轻CD8+ T细胞诱导的上皮细胞凋亡。这些发现可能推动新型疗法的开发,以改善HIV感染者及其他影响肠道稳态疾病的肠道屏障功能及相关并发症。
参考文献:
Das Adhikari U, Froehle LM, Pipkin AN, Baharlou H, Linder AH, Shah P, Hussey A, Zhang Q, Nyquist S, Khwaled S, Chi F, Goswami S, Sedhain S, Hussain S, Diefenbach TJ, Read BJ, Kim B, Irvine D, Asowata O, Ladinsky M, Bjorkman P, Madela F, Kader S, Shalek AK, Ghebremichael M, Kloverpris H, Ringel AE, Yilmaz ÖH, Kwon DS. Immunometabolic defects of CD8+ T cells disrupt gut barrier integrity in people with HIV. Cell. 2025 Sep 11:S0092-8674(25)00979-1. doi: 10.1016/j.cell.2025.08.024. Epub ahead of print. PMID: 40939591.






