m6A阅读器IGF2BP2稳定的lncRNA LHX1-DT抑制肾细胞癌细胞的增殖和侵袭
m6A已被确定为多种人类癌症的关键调节因子。然而,m6A修饰在肾癌(RCC)中的作用及其与长链非编码RNA LHX1-DT (LHX1-DT)的相互作用尚不清楚。通过微阵列分析鉴定差异表达的lncRNA和m6A水平。通过RNA免疫沉淀和荧光素酶报告基因检测IGF2BP2与LHX1-DT的相互作用。在RCC组织中发现LHX1-DT表达下调,并且LHX1-DT表达降低与RCC患者总生存率较差相关。功能实验表明,过表达LHX1- DT可显著抑制RCC细胞的增殖和侵袭。METTL14介导的m6A读取器蛋白IGF2BP2识别LHX1-DT上的m6A修饰位点,促进其稳定性。此外,LHX1-DT通过海绵化miR-590-5p作为竞争性内源性RNA (ceRNA),进而下调PDCD4,从而抑制RCC细胞的增殖和侵袭。LHX1-DT作为RCC的独立预后生物标志物,IGF2BP2/LHX1-DT/miR-590-5p/PDCD4轴代表了RCC进展的新治疗靶点。本文于2025年6月发表于npj precision oncology(IF=8.0)上。
技术路线:

结果:
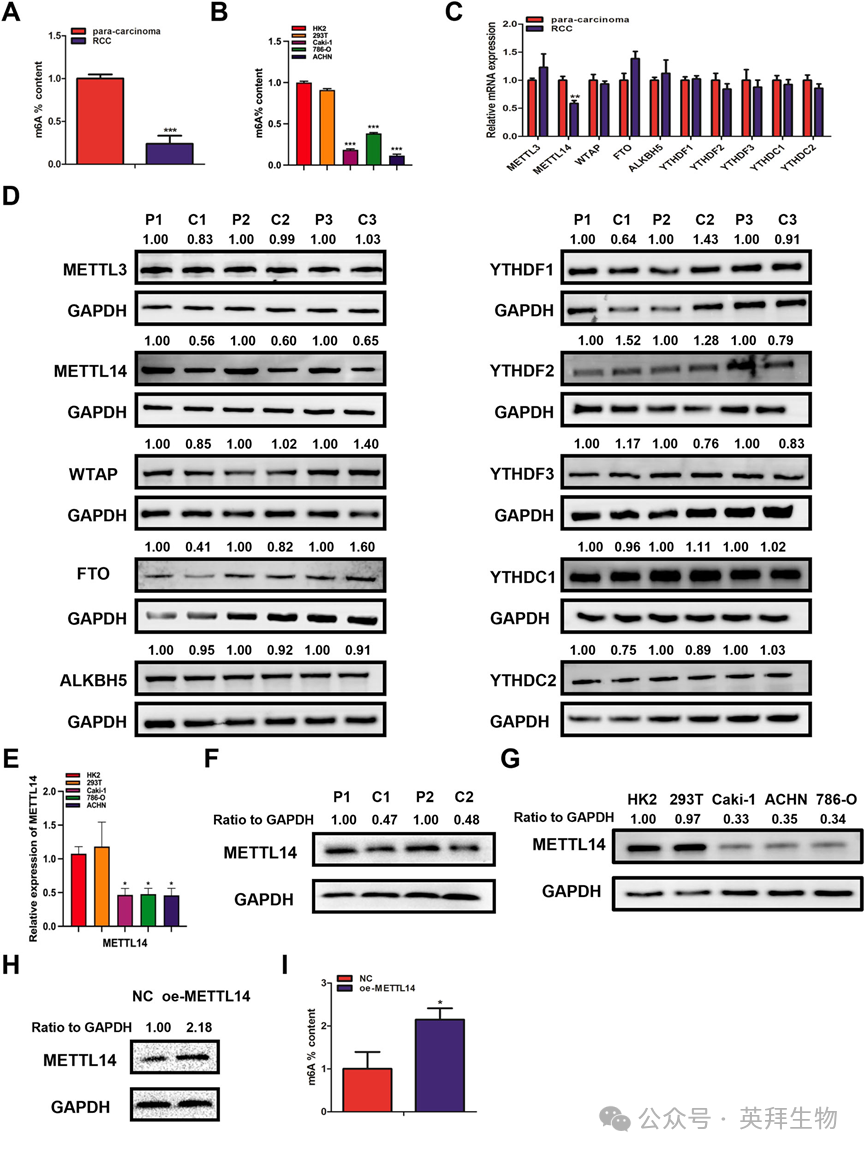
1)在RCC组织和细胞系中m6A水平下调
最近的进展表明,m6甲基化参与了各种人类癌症的发生和发展。为了进一步研究这一点,我们评估了RCC组织和细胞系中的m6A水平。采用比色法检测RCC组织、邻近正常肾组织、正常肾小管上皮细胞(HK-2)、293 T细胞和RCC细胞系(Caki-1、786-O和ACHN)中m6A的总体水平。结果显示,RCC组织和细胞系的总体m6A水平明显低于邻近正常肾组织、HK-2细胞和293 T细胞(图1A, B)。接下来,我们检测了RCC组织和邻近正常肾组织中METTL3、METTL14、WTAP、FTO、ALKBH5等关键m6A调节因子的mRNA和蛋白表达。结果显示,RCC组织中METTL14的mRNA和蛋白表达明显低于邻近正常肾组织(图1C, D)。随后,我们评估了mettl14在HK-2细胞、293 T细胞和RCC细胞系中的表达。结果表明,METTL14mRNA在RCC细胞系中的表达明显低于HK-2细胞和293 T细胞(图1E)。western blot在RCC组织和细胞系中也观察到类似的结果(图1F,G)。同时,将METTL14过表达质粒转染到Caki-1细胞中(图1H)。结果表明,在Caki-1细胞中,METTL14过表达后m6A水平显著升高(图1I)。这些发现表明,RCC组织和细胞系中m6A水平的下调可能在调节RCC的发生和进展中起着至关重要的作用。
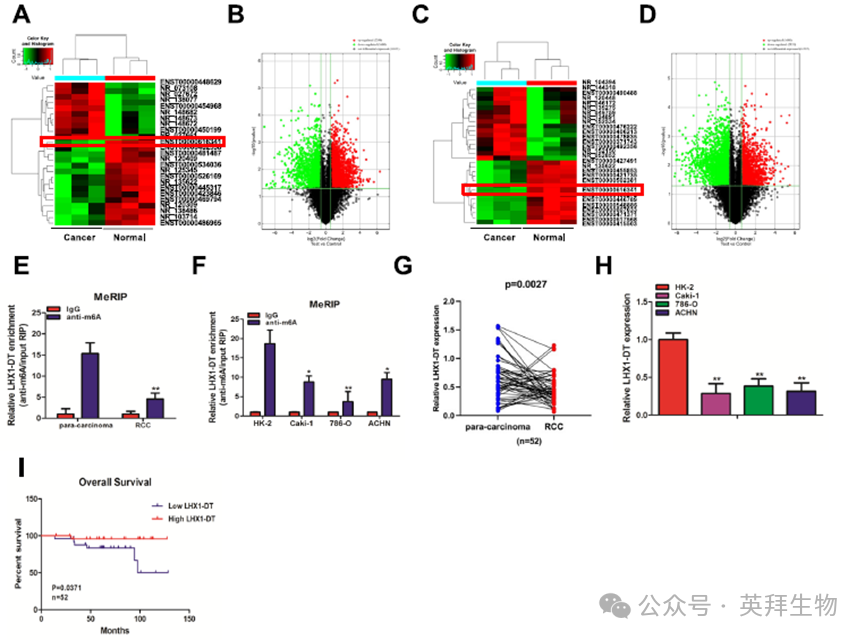
2)LHX1-DT是由m6A修饰调控的关键靶基因,与RCC患者预后不良有关
最近的研究表明m6A修饰与lncRNA表达密切相关。几个研究小组发现m6A修饰可以通过影响lncRNA的稳定性来调节其表达。鉴于此,我们对3对RCC组织和邻近正常肾组织进行了m6A-mRNA和lncRNA表转录组微阵列分析。结果显示,m6A水平在2290个lncRNA中上调,在1660个lncRNA中下调。图2A列出了m6A水平上调前10位和下调前15位的lncRNA,其中m6A水平下调最明显的是LHX1-DT。两组的差异表达基因(DEGs)显示在火山图中(图2B)。同时,进行另一项微阵列分析,比较上述3对样品之间的lncRNA表达谱。结果显示,两组分别有1688个lncRNA上调,2931个lncRNA下调。图2C列出了上调和下调最多的15个lncRNA。值得注意的是,LHX1-DT在RCC组织中的表达明显低于配对相邻正常肾组织。火山图显示了两组之间的DEG(图2D)。随后,我们评估了RCC组织和细胞系中LHX1-DT的m6A水平。使用m6A抗体从RCC组织、邻近正常肾组织、HK-2细胞和RCC细胞系(Caki-1、786-O和ACHN)中拉下m6A修饰RNA,meRIP检测LHX1-DT的水平。结果显示,RCC组织和细胞系中LHX1-DT的m6A水平明显低于配对相邻的正常肾组织和HK-2细胞(图2E,F)。正如预期的那样,LHX1-DT在RCC组织和细胞系中的表达明显低于配对相邻的正常肾组织和HK-2细胞(图2G,H)。Kaplan-Meier分析进一步显示,在RCC患者中,高LHX1-DT表达与更好的OS相关(图2I)。这些发现提示LHX1-DT是一种受m6A修饰调控的独立预后因子,其表达与RCC患者预后良好相关。
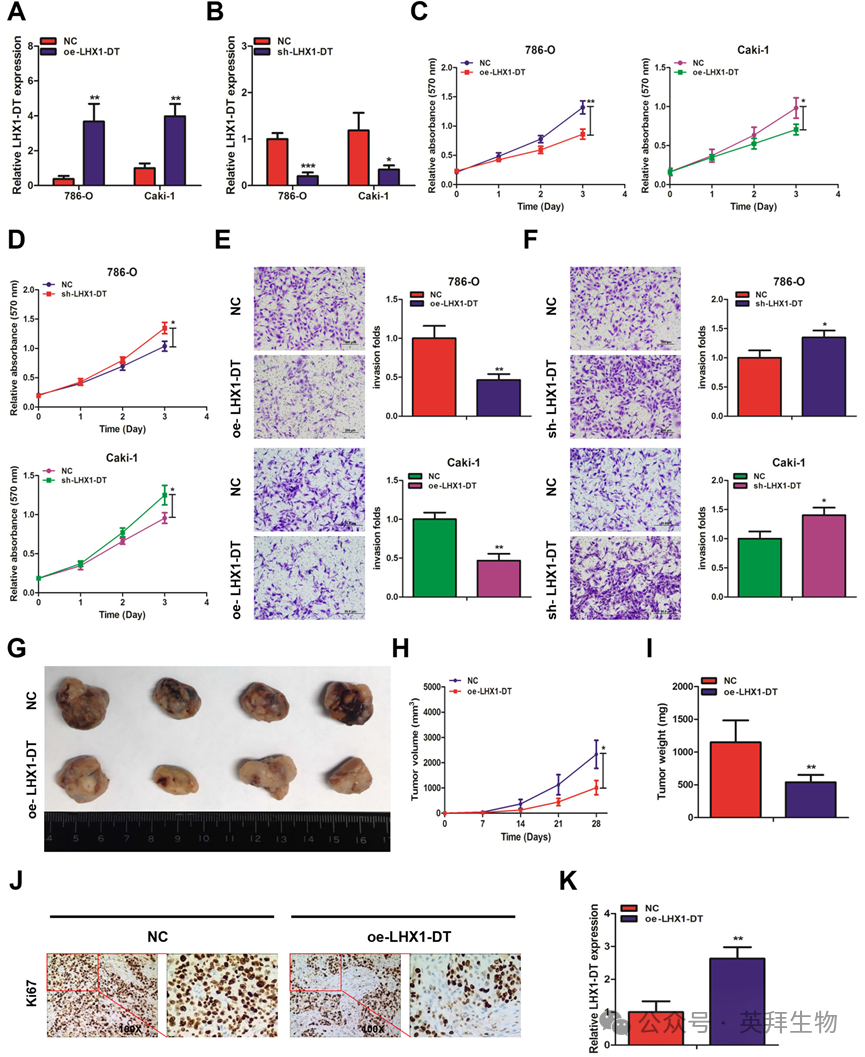
3)LHX1-DT在体外和体内均能抑制RCC细胞的增殖和侵袭
为了研究LHX1-DT在RCC中的生物学功能,我们进行了细胞增殖和侵袭实验。首先,用功能性LHX1-DT-cDNA和LHX1-DT-shRNA转染786-O和Caki-1细胞。qRT-PCR结果证实LHX1-DT表达得到有效调控(图3A,B)。细胞增殖实验结果显示,在786-O和Caki-1细胞中,过表达LHX1-DT可显著抑制细胞增殖,而敲低LHX1-DT可显著促进细胞增殖(图3C,D)。同样,在786-O和Caki-1细胞中进行的transwell侵袭试验也得到了类似的结果(图3E,F)。这些数据表明,LHX1-DT在体外抑制RCC细胞的增殖和侵袭。为了进一步探讨LHX1-DT在体内的作用,我们建立了原位异种移植小鼠模型来验证LHX1-DT的抗肿瘤作用。用荧光素酶标记Caki-1细胞并转染功能性LHX1-DT-cDNA。然后将这些细胞注射到裸鼠的肾包膜中。使用体内成像系统监测肿瘤大小。6周后,结果显示,与对照组相比,LHX1-DT过表达组的肿瘤生长、体积和重量均显著减少(图3G-I)。此外,与对照组相比,LHX1-DT过表达组Ki67染色降低(图3J)。qRT-PCR分析证实,过表达组LHX1-DT表达升高(图3K)。综上所述,上述数据表明LHX1-DT在体外和体内均能抑制RCC细胞的增殖和侵袭。
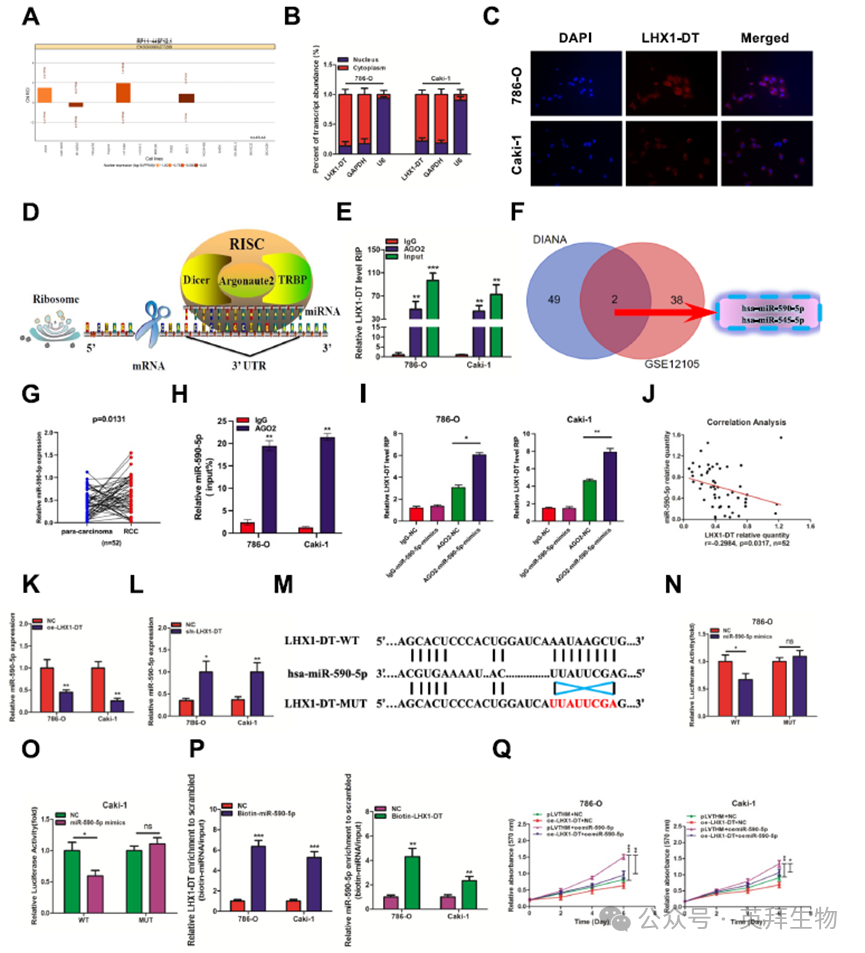
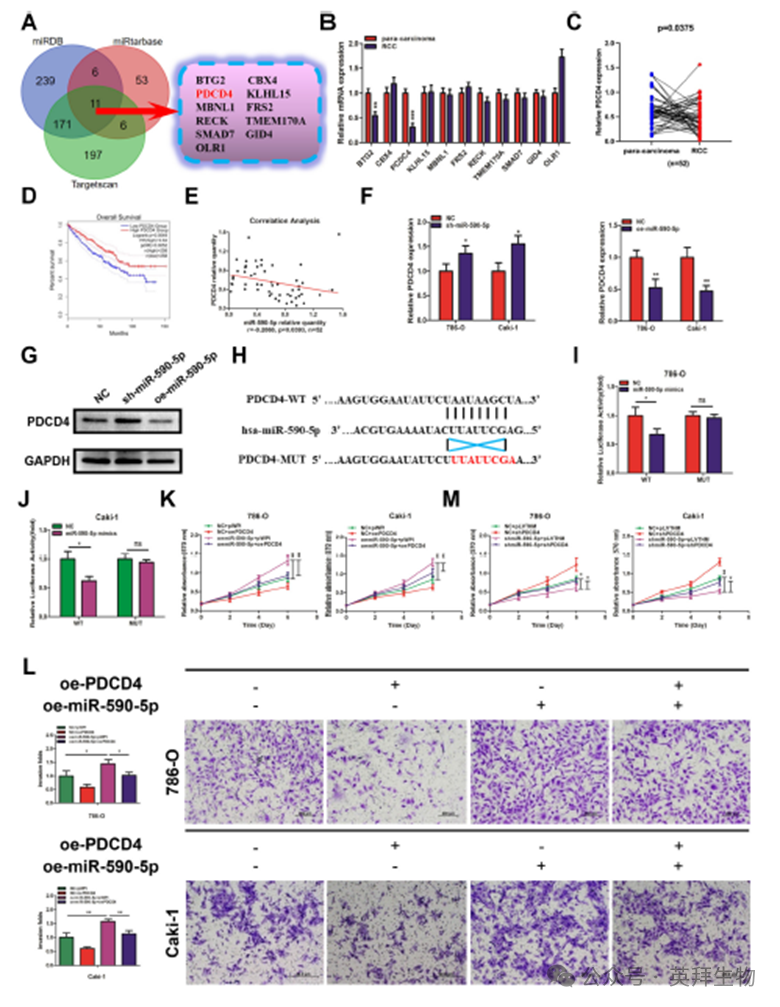
4)LHX1-DT作为ceRNA吸收miR-590-5p
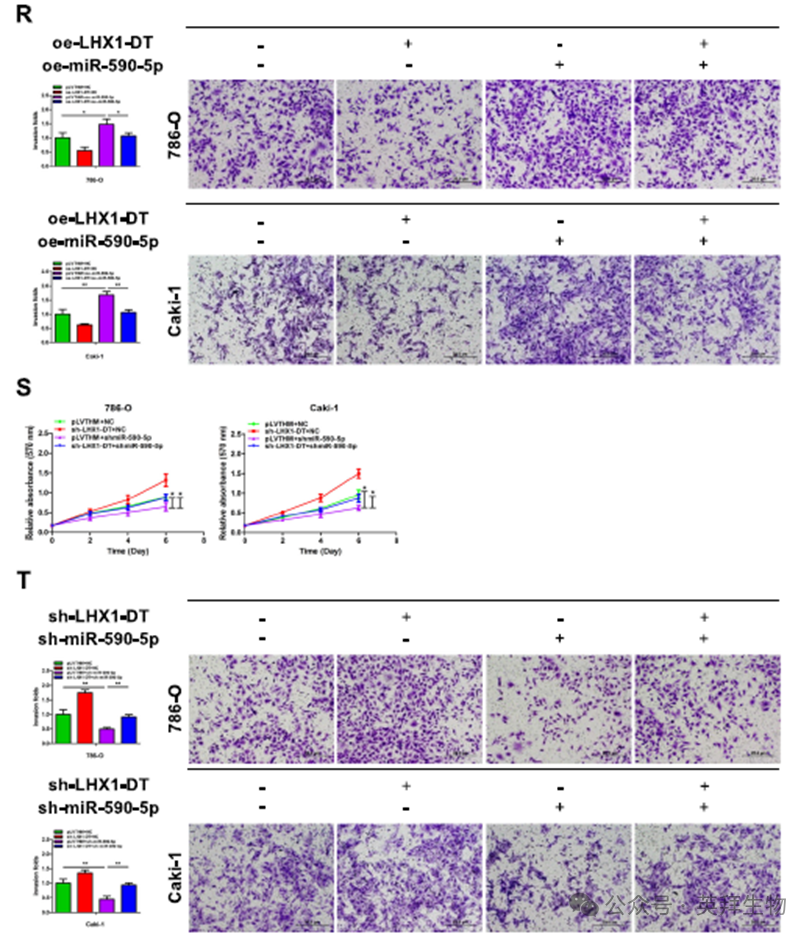
为了探索LHX1-DT如何发挥其功能,我们使用在线工具lncATLAS预测了其亚细胞定位。结果表明LHX1-DT主要定位于细胞质中(图4A)。核细胞质分离实验证实了这一点(图4B), FISH实验进一步验证了这一点(图4C)。最近的研究报道,细胞质lncRNA在人类癌症中既可以作为肿瘤抑制因子,也可以作为致癌基因,通常作为miRNA海绵发挥作用。因此,我们假设LHX1-DT可能通过海绵miRNA抑制RCC细胞的增殖和侵袭。为了验证这一点,我们使用特异性抗AGO2抗体进行了RIP实验,AGO2抗体是miRNA介导的mRNA翻译抑制和不稳定复合物的关键成分(图4D)。结果显示,与对照相比,内源性LHX1- DT AGO2的富集程度更高(图4E)。这些数据表明LHX1-DT可能作为ceRNA抑制RCC细胞的发育。然后,我们寻找可能与LHX1- DT结合的潜在miRNA。使用DIANA Tools,预测51个miRNA与LHX1-DT相互作用。通过GEO数据库(GSE12105)分析,其中40种miRNA在RCC组织中与邻近正常肾组织存在差异表达。在两个数据集中,miR-590-5p和miR-545-5p被鉴定为常见的miRNA(图4F)。qRT-PCR分析显示,与邻近正常肾组织相比,miR-590-5p在52对RCC组织中显著上调,而miR-545-5p无显著变化(图4G)。RIP实验证实AGO2可以与miR-590-5p相互作用(图4H)。因此,我们选择miR-590-5p进行进一步研究。为了探究LHX1-DT是否是ago2-miR-590-5p复合物的一部分,我们进行了AGO2实验。结果证实,LHX1-DT在miR-590-5p模拟物组中更富集(图4I)。接下来,我们发现在RCC组织和邻近正常肾组织中,miR-590-5p水平与LHX1-DT表达呈负相关(图4J)。LHX1-DT过表达导致miR-590-5p显著下调,而LHX1-DT沉默导致miR-590-5p上调(图4K,L)。采用野生型(LHX1-DT-WT)和突变型miR-590-5p结合位点(LHX1-DT-MUT)设计荧光素酶报告基因检测(图4M)。结果表明,野生型组的荧光素酶活性在miR-590-5p模拟物处理后显著降低,而突变组的荧光素酶活性保持不变,这表明LHX1-DT以序列特异性的方式靶向miR-590-5p(图4N,O)。此外,生物素偶联miR-590-5p成功拉下LHX1-DT的结合,而生物素偶联LHX1-DT在786-O和Caki-1细胞中成功拉下miR-590-5p(图4P)。随后,进行了一项拯救实验来研究miR-590-5p在RCC细胞增殖和侵袭中的作用。过表达miR-590-5p促进细胞增殖和侵袭,而上调LHX1-DT部分逆转了miR-590-5p对RCC细胞增殖和侵袭的促进作用(图4Q,R)。相反,沉默miR-590-5p抑制细胞增殖和侵袭,LHX1-DT沉默部分逆转了miR-590-5p对786-O和Caki-1细胞增殖和侵袭的抑制作用(图4S,T)。上述数据共同表明,LHX1-DT作为miR-590-5p的miRNA海绵,从而调节RCC的进展。
5)IGF2BP2结合LHX1-DT并以依赖m6A的方式调控其表达
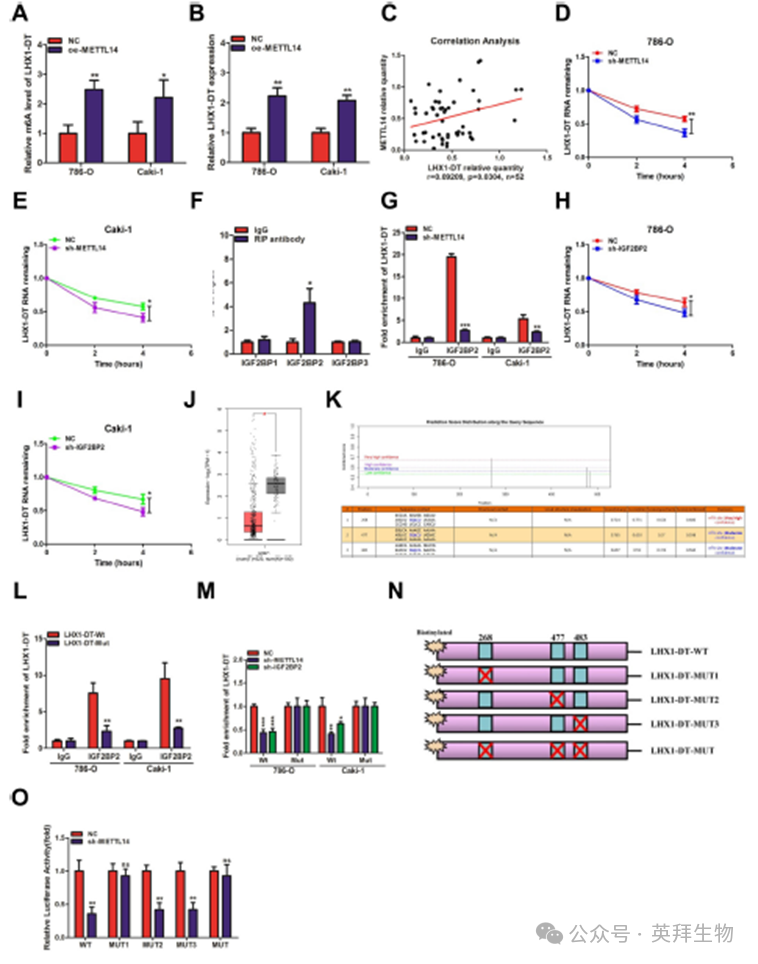
我们发现lncRNA可能是通过m6A修饰机制调控的靶标,尽管确切的潜在机制仍然很复杂。在此基础上,我们研究了LHX1-DT的m6A修饰。qRT-PCR结果显示,过表达METTL14显著增加了786-O和Caki-1细胞中m6A水平和LHX1-DT表达(图5A,B)。在RCC组织中也观察到METTL14和LHX1-DT水平呈正相关(图5C)。这些发现表明m6A修饰在LHX1-DT的下调中起作用。接下来,我们检测了METTL14操作后LHX1-DT的稳定性。结果显示,在actinomycin-D处理的786-O和Caki-1细胞中,METTL14的敲低显著降低了LHX1-DT的半衰期(图5D,E),表明METTL14通过调节LHX1-DT的稳定性来调节LHX1-DT的表达。因此,我们研究了能够识别甲基化LHX1-DT并调节其稳定性的潜在m6A读取器。最近的研究表明,IGF2BP家族可以识别m6A修饰并增加RNA稳定性。RIP实验显示LHX1-DT显著富集IGF2BP2,而不是IGF2BP1和IGF2BP3(图5F)。METTL14的缺失降低了IGF2BP2中LHX1-DT的富集(图5G),表明METTL14诱导的m6A修饰调节了IGF2BP2对甲基化LHX1-DT的识别。同时,抑制IGF2BP2降低了786- O和Caki-1细胞中LHX1-DT的半衰期(图5H,I),结果与METTL14敲除相似。这些数据表明IGF2BP2作为LHX1- DT的m6A读取器起作用。接下来,根据GEPIA2数据集,发现IGF2BP2表达在RCC中下调(图5J)。此外,为了研究SRAMP预测的潜在m6A修饰位点是否与LHX1-DT和IGF2BP2之间的相互作用有关,我们突变了所有预测的m6A修饰位点(图5K)。RIP实验结果表明,LHX1-DT与IGF2BP2之间的直接结合被它们的修饰位点突变所破坏(图5L)。m6A修饰位点突变后,METTL14或IGF2BP2介导的LHX1-DT调节功能受损(图5M)。为了确定哪个特定的m6A修饰位点负责稳定LHX1-DT,设计了三个LHX1-DT突变体(图5N)。荧光素酶报告基因分析显示,1号位点(UUGGACU)在调节LHX1-DT稳定性中起着关键作用(图5O)。综上所述,IGF2BP2以依赖m6A的方式结合LHX1-DT并增强其稳定性。
6)LHX1-DT通过靶向miR-590-5p/ PDCD4轴抑制RCC进展
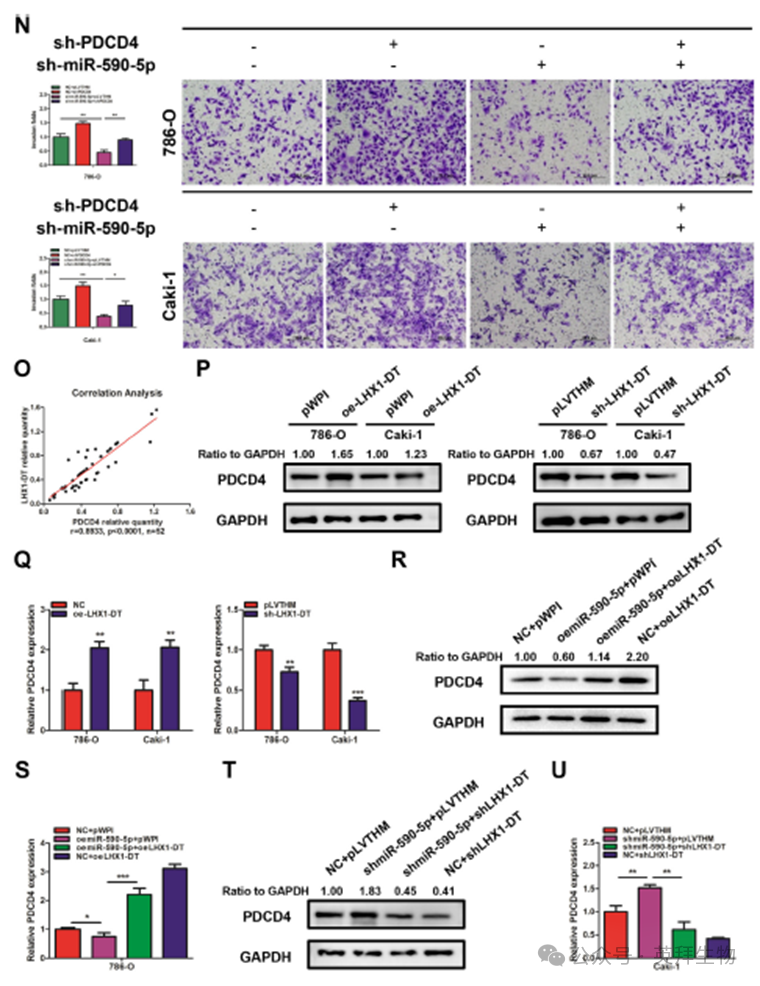
为了研究LHX1-DT/miR-590-5p轴在RCC进展中的机制,我们使用了三种在线分析工具并鉴定了11种可能成为miR-590-5p靶点的mRNA,包括PDCD4(图6A),一种已知的RCC中的肿瘤抑制因子。qRT-PCR结果显示,与邻近正常肾组织相比,RCC组织中PDCD4和BTG2的表达水平较低,其中PDCD4的表达下降更为明显(图6B)。使用52个配对的RCC样本,我们证实,与邻近的正常肾组织相比,RCC组织中的PDCD4表达显著降低(图6C)。KM分析结果显示,低PDCD4水平表明较差的OS(图6D)。此外,发现miR-590-5p水平与RCC组织中PDCD4表达呈负相关(图6E)。我们还观察到,在786-O和Caki-1细胞中,通过引入miR-590-5p模拟物或抑制剂,PDCD4的mRNA和蛋白水平分别下调或上调(图6F,G)。为了进一步验证miR-590-5p在PDCD4 3 '-UTR的预测结合位点,我们进行了荧光素酶报告基因实验(图6H)。结果显示,miR- 590-5模拟物处理后PDCD4-WT构建物的荧光素酶活性显著降低,而PDCD4-MUT构建物的活性保持不变(图6I,J)。在786-O和Caki-1细胞中,PDCD4过表达部分逆转了miR-590-5p模拟物对细胞增殖和侵袭的促进作用(图6K,L),而PDCD4敲低部分逆转了miR-590-5p抑制剂对细胞增殖和侵袭的抑制作用(图6M, N)。这些发现证实pdcd4是miR-590-5p的直接靶点。我们进一步发现RCC组织中PDCD4与LHX1- DT表达呈正相关(图6O)。结果表明,转染功能性LHX1-DT-cDNA或LHX1-DT-shRNA进入786-O和Caki-1细胞后,PDCD4蛋白和mRNA水平分别上调或下调(图6P,Q)。过表达LHX1-DT部分逆转了miR-590-5p模拟物对PDCD4表达的抑制作用(图6R,S),而敲低LHX1-DT部分逆转了miR-590-5p抑制剂在蛋白质和mRNA水平上对PDCD4表达的促进作用(图6T,U)。总之,这些数据表明LHX1-DT对RCC进展的抑制作用主要是通过miR-590-5p/PDCD4轴介导的。
7)PDCD4负责LHX1-DT介导的细胞增殖和侵袭抑制
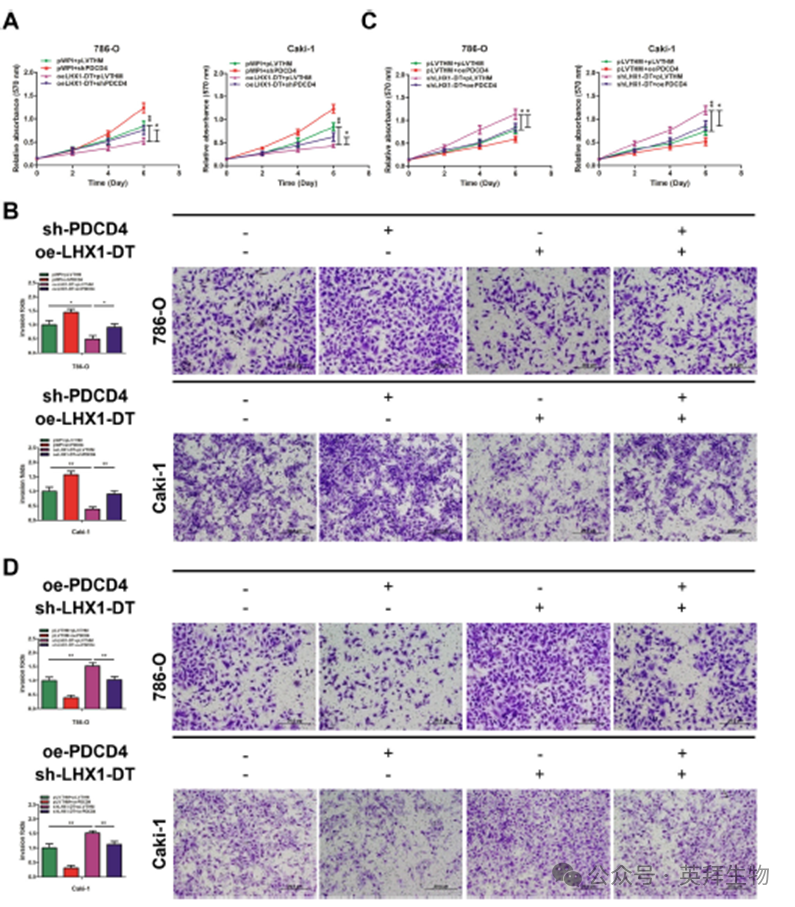
为了研究LHX1-DT是否以PDCD4依赖的方式抑制RCC进展,我们在786-O和Caki-1细胞中转染了功能性LHX1-DT-cDNA和PDCD4敲低载体。结果显示,PDCD4下调部分逆转了LHX1-DT过表达对RCC细胞增殖的抑制作用(图7A)。在786-O和Caki-1细胞中使用transwell侵袭实验获得了类似的结果(图7B)。相反,PDCD4的上调部分逆转了LHX1-DT敲低对RCC细胞增殖和侵袭的促进作用(图7C,D)。这些发现表明,LHX1-DT作为肿瘤抑制lncRNA,通过miR-590-5p/PDCD4信号通路抑制RCC细胞增殖和侵袭。
结论:
我们的研究阐明了m6A修饰和lncRNA在调控RCC增殖和侵袭中的关键作用。我们证明m6Areader IGF2BP2可以通过识别特定的m6A修饰位点来增加LHX1-DT的稳定性,从而通过miR-590-5p/PDCD4轴抑制RCC的进展。这些发现突出了m6A修饰的LHX1-DT的功能意义,并为m6A甲基化对RCC的表观遗传调控提供了新的见解。
参考文献:
Zhu C, Li R, You X, Xu J, Wang J, Dong D, Chen X, Wang K. m6A reader IGF2BP2-stabilized lncRNA LHX1-DT inhibits renal cell carcinoma (RCC) cell proliferation and invasion by sponging miR-590-5p. NPJ Precis Oncol. 2025 Jun 17;9(1):193. doi: 10.1038/s41698-025-00958-x.






