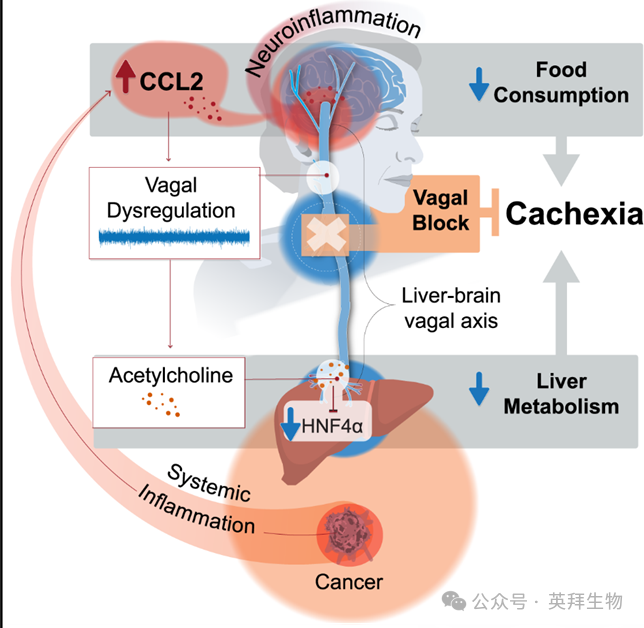
迷走神经对脑-肝轴的阻断可抑制癌症相关恶病质
癌症相关恶病质(CAC)是一种由多种因素引起的、目前无法治愈的综合征,造成了近三分之一的癌症相关死亡。它导致患者对治疗产生抵抗,并增加其死亡率。本研究显示,在CAC小鼠模型中,癌症诱导的全身性炎症改变了迷走神经张力。这种迷走神经失调破坏了脑-肝迷走神经轴,通过耗竭肝功能的关键转录调节因子HNF4α,导致肝脏蛋白质代谢的重编程。HNF4α的缺失扰乱了肝脏代谢,加剧了全身性炎症,最终导致恶病质表型的出现。通过手术、化学、电学或非侵入性经皮装置靶向干预右侧颈迷走神经,能够减弱CAC的进展、缓解其临床症状,并协同增强化疗效果,从而改善小鼠的整体健康状况和生存率。本文于2025年8月发表于《Cell》, IF 42.5。
图形摘要:
主要实验结果:
1.CAC动物模型中,迷走神经功能受趋化因子(CC基序)配体2(CCL2)的失调影响。
侧腹注射的Lewis肺癌(LLC)细胞和原位注射的胰腺癌Kras G12D, Trp53 R172H, Pdx-1-Cre(KPC)细胞是研究CAC的成熟模型。为了验证迷走神经参与癌症发生过程中CAC的假说,我们首先对荷瘤(LLC或KPC)与非荷瘤小鼠膈下迷走神经的肝总分支进行了电生理记录。在体重下降发生之前,与野生型(WT)小鼠的记录相比,两种癌症小鼠均表现出改变的迷走神经活动模式(图1A)。记录分析表明,通过均方根量化测量,癌症小鼠迷走神经信号的噪声显著增加,而通过峰峰值量化测量,单个信号的强度则减弱(图1B)。综合来看,这些测量结果表明迷走神经正在发送噪声信号,从而增加了其整体活动水平。

图1. 癌症诱导的神经炎症促进迷走神经功能亢进
迷走神经背运动核(VDMN)是迷走神经中大多数副交感神经突触前纤维的来源,负责响应传入感觉迷走神经信号而触发消化液分泌的反射回路。确实,VDMN中神经元激活标志物cFos的染色显示,LLC或KPC小鼠的VDMN活动增强,进一步支持了癌症促进迷走神经活动发生中枢性改变的观点(图1C)。
我们及其他人发现,趋化因子(CC基序)配体2(CCL2),也称为单核细胞趋化蛋白-1(MCP-1),是一种巨噬细胞相关的促炎细胞因子。在罹患肝脑以外部位癌症的小鼠中,CCL2能将先天性免疫细胞募集至肿瘤及肝脏、大脑等多种器官。我们发现,在LLC和KPC癌症小鼠的脑组织、脑脊液(CSF)和血清中,CCL2水平均升高,这支持了CCL2在癌症发生过程中的系统性作用(图1D)。先前研究已表明CCL2可使神经元敏化并增加其兴奋性。在表达Thy1-GCamp6的转基因小鼠分离培养的迷走神经初级神经元中加入CCL2,可增加神经元激活(图1E)。我们还在癌症诱导后的第3、7、14和21天测量了多个组织中CCL2以及迷走神经主要神经递质乙酰胆碱(ACh)的水平。我们发现,在迷走神经张力改变和ACh升高之前,血清、VDMN、CSF和肝脏中的CCL2水平就已升高。
我们近期在乳腺癌和胰腺癌小鼠模型中证实,肝脏中先天性免疫细胞浸润逐渐增加,从而驱动了癌症相关的代谢功能障碍。现在我们探究了癌症引起的系统性免疫反应是否同样延伸至迷走神经核团,以此作为迷走神经张力障碍的潜在解释。脑组织切片的组织学分析显示,癌症小鼠的VDMN中存在炎症性肉芽肿。使用离子钙结合衔接分子1(IBA1)染色,我们进一步证明LLC小鼠存在神经炎症(图1F)。利用CD45+细胞免疫荧光进行的补充研究观察到VDMN中存在显著的免疫细胞浸润(图1G)。为了鉴定特定的浸润免疫细胞亚型,我们进行了额外的染色和荧光辅助细胞分选(FACS)分析。我们发现脑浸润的免疫细胞主要为CD45+ CD11b+ F4/80+群体,符合巨噬细胞特征,包括CD86+和CD206+巨噬细胞,而其他髓系细胞和T细胞的存在则无显著差异(图1G)。
我们及其他人先前已证实,在患癌小鼠中敲除CCL2受体(CCR2)可限制CAC的发展。因此,我们首先确认了CCR2敲除(KO)动物VDMN中的CD45+细胞浸润和神经炎症均减少。接着,通过使用药物Bindarit阻断CCL2活性,我们发现VDMN中的免疫细胞浸润和神经炎症显著减少,尽管其减少程度不如CCR2 KO组明显。此外,与PBS处理的动物相比,Bindarit处理的动物血清中ACh水平更低,迷走神经张力的改变也更轻微。Bindarit处理的动物在恶病质特征方面有所改善,包括体重减轻、肌肉萎缩和厌食性进食行为,尽管它们在生存期方面的改善无统计学意义(图1H, 1I)。Bindarit能够减轻迷走神经过度激活并改善小鼠CAC症状的能力表明,CCL2可能在CAC相关的迷走神经失调中起重要作用,并且迷走神经活动增强促进了CAC的发生。
值得注意的是,我们观察到与非恶病质胰管腺癌(PDAC)患者相比,发生恶病质的PDAC患者的CCL2和ACh水平同样升高(图1J)。CCL2水平与患者体重减轻呈负相关,而ACh水平与患者从癌症诊断到恶病质诊断之间的时间间隔长度呈负相关(图1K)。此外,对伴或不伴CAC的PDAC患者进行无偏倚80因子人类炎症因子分析,鉴定出在CAC期间差异性升高的几种炎症因子,包括其他CCL信号蛋白CCL17、CCL24和CCL25,以及其他恶病质相关炎症因子如肿瘤坏死因子α(TNF-α)。
综上所述,这些数据突显了神经炎症串扰在荷瘤小鼠模型和患者CAC中的重要性,并表明癌症诱导的全身性炎症改变了迷走神经的激活状态,并很可能促进了CAC的发生发展。
2.迷走神经切断术可减轻小鼠CAC模型中的恶病质进展和表型
为直接评估在CAC中破坏迷走神经-肝脏轴的潜在益处,我们在KPC和LLC两种CAC小鼠模型以及WT(PBS注射)对照小鼠中实施了右侧颈部迷走神经切断术(vagotomy)。小鼠接受假手术(保留迷走神经完整,WT + sham vs. KPC + sham 或 LLC + sham)或迷走神经切断术(WT + vagotomy vs. KPC + vagotomy 或 LLC + vagotomy)(图2A)。我们发现,荷瘤小鼠接受迷走神经切断术后,其健康状态改变(包括弓背姿势和毛发蓬乱)得到改善(图2B, 2C)。接受PBS注射的小鼠在手术后体重达到峰值的时间略有延迟(2.5天),但接受迷走神经切断术的小鼠与接受假手术的小鼠相比,体重无显著差异(图2C)。此外,我们未检测到雌性和雄性荷瘤小鼠对迷走神经切断术的反应存在可测量的性别相关体重差异。值得注意的是,虽然接受迷走神经切断术的KPC和LLC小鼠形成的肿瘤肿块大小与假手术的KPC和LLC小鼠相似,但它们的体重减轻显著减少(图2C)。此外,KPC + vagotomy和LLC + vagotomy小鼠损失的瘦体组织和脂肪组织也少于其假手术组。
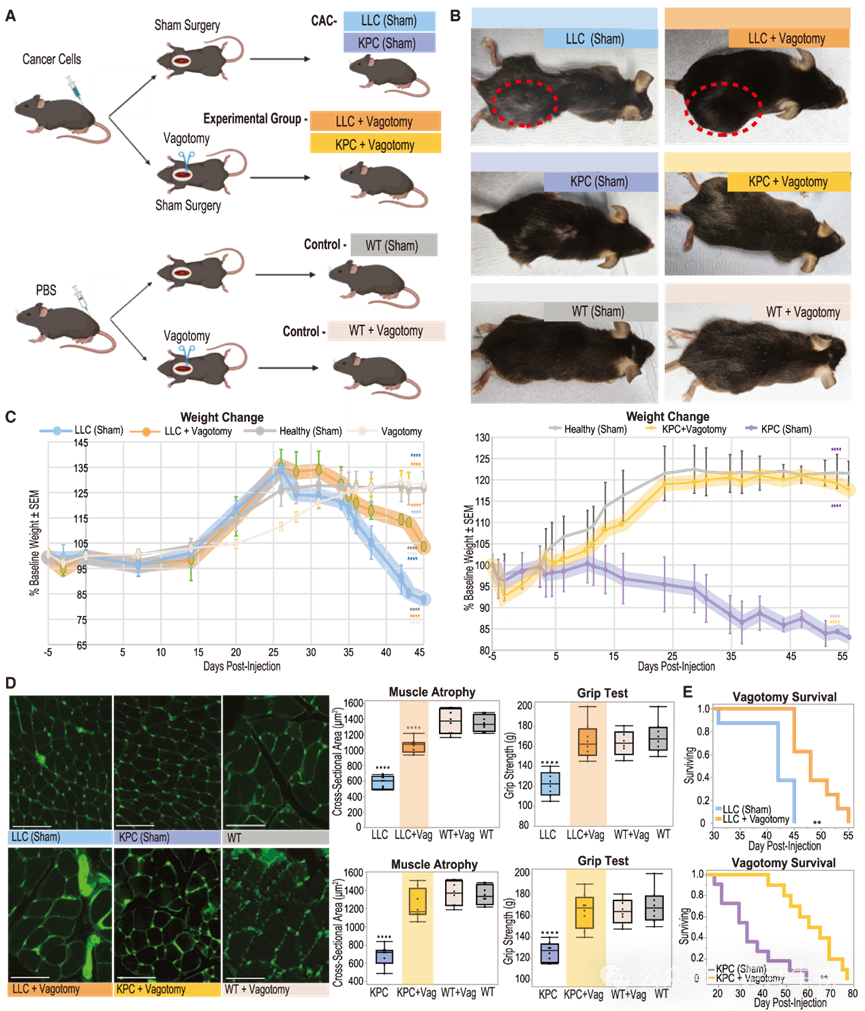
图2. 右侧颈迷走神经切断术可减轻肺癌或原位胰腺癌小鼠的CAC表现
由于肌肉萎缩是CAC的既定诊断标准,我们进一步检测了CAC小鼠右侧腓肠肌纤维的横截面积、右侧腓肠肌重量和握力。右侧迷走神经切断术后,我们发现KPC和LLC小鼠腓肠肌平均纤维面积的减少、腓肠肌质量的丧失以及握力的下降均得到显著缓解(图2D)。此外,我们在这些组织中观察到肌肉萎缩相关基因表达降低,进一步支持了迷走神经切断术恢复瘦体质量的一个主要贡献因素是减少肌肉损失。迷走神经切断术对CAC小鼠腓肠肌的功能益处也体现在诱发电肌电图(EMG)反应的减弱得到缓解以及悬丝测试表现的改善上(图2D)。值得注意的是,在所有接受迷走神经切断术的小鼠中,在肝脏撕裂模型中未发现心率或肝脏血流动力学发生统计学上的显著改变。
重要的是,接受右侧迷走神经切断术治疗的KPC和LLC小鼠,其寿命与假手术对照组相比显著延长(图2E)。虽然两种模型的荷瘤假手术小鼠绝大多数死于疾病本身,但接受迷走神经切断术的KPC和LLC小鼠主要因肿瘤负荷达到人道终点而被euthanasia。鉴于食欲减退、体重下降、瘦肌肉和脂肪组织丢失是CAC的临床定义特征,我们评估了这些变量的变化是否与生存期相关。我们发现,尽管每个特征的保留都与生存期延长相关,且无性别特异性差异,但肌肉质量的保留相关性最强。与假手术小鼠相比,在死亡或达到人道终点时,接受迷走神经切断术的KPC和LLC小鼠体内的CCL2、TNF-α、MIP2、白细胞介素(IL)-1β、IL-2和CXCL10水平降低,这与它们改善的CAC表现一致。
此外,KPC + sham和LLC + sham小鼠表现出行为异常,包括抑郁和厌食迹象(图3A, 3B)。与假手术动物相比,接受迷走神经切断术的动物更活跃且更具社交性(图3A)。LLC + sham和KPC + sham动物也比WT假手术组或接受迷走神经切断术的患癌小鼠消耗更少的食物,无论食物是从悬挂式给料器还是笼底食槽获取(图3B)。
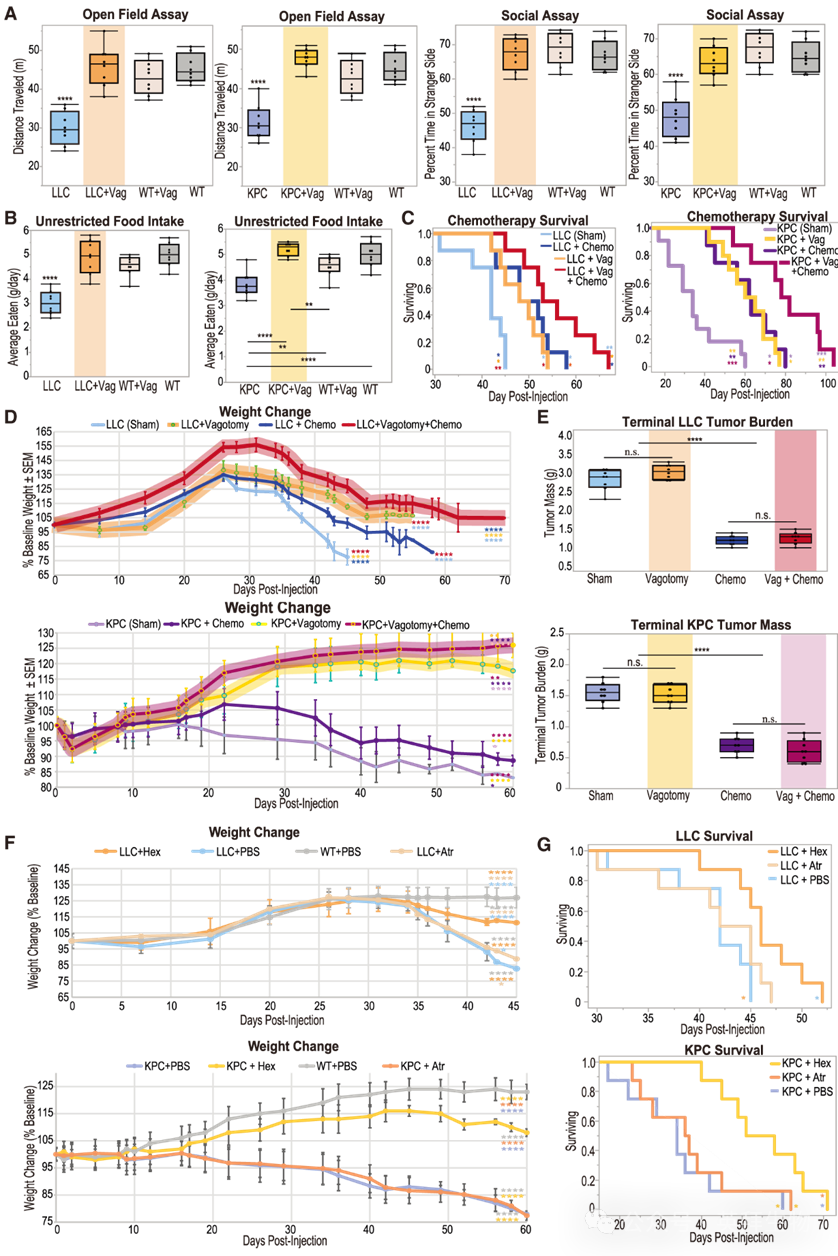
图3. 右侧颈迷走神经切断术可减轻肺癌或原位胰腺癌小鼠的行为异常并增强化疗反应
最后,尽管仍承受肿瘤负荷,但接受迷走神经切断术的KPC和LLC小鼠健康状况的显著改善促使我们评估右侧颈部迷走神经切断术是否能与顺铂化疗(一种B6小鼠耐受性良好的常用化疗药物)联用提供额外益处。令人鼓舞的是,尽管化疗本身可能导致体重减轻,但接受顺铂化疗的两个模型中的迷走神经切断术小鼠体重减轻较少,肿瘤体积减小,从而延长了生存期(图3C–3E)。
3.右侧颈部迷走神经切断术在缓解CAC方面效果最佳
为确认我们结果的特异性,我们使用多种对照进行了额外实验。首先,鉴于左右迷走神经不对称地支配参与重要肠-脑神经回路形成的器官,我们比较了接受左侧或右侧颈部迷走神经切断术30天后LLC小鼠的体重变化(假手术组每组n=16,迷走神经切断组每组n=8)。虽然左侧迷走神经切断术(LLC + LV)相对于WT对照组减轻了部分体重下降,但接受右侧迷走神经切断术(LLC + RV)的小鼠相对于WT对照组体重下降无统计学显著性。随后,我们采用右侧迷走神经后干膈下迷走神经切断术,以研究是否可通过靶向下游分支来减少全身效应。尽管膈下和颈部迷走神经切断术均能减轻体重下降,但接受膈下迷走神经切断术的小鼠维持体重的能力低于接受颈部迷走神经切断术的小鼠。这些结果表明,在CAC小鼠模型中,颈部迷走神经切断术更利于限制体重下降,因为没有单一的膈下分支能产生完全效果。
为进一步确认右侧迷走神经切断术效果的特异性,我们在右侧迷走神经显微注射了肉毒杆菌毒素A(Botulinum toxin A),这是一种通过化学方式阻断乙酰胆碱(ACh)释放的神经毒素。我们发现,注射肉毒杆菌毒素A的LLC小鼠实现了与迷走神经切断术相当的体重减轻限制和肌肉萎缩减少,且比假手术小鼠存活时间更长。值得注意的是,在LLC小鼠中,迷走神经切断术对减轻体重下降和保留肌肉的有益效果超过了使用anamorelin(一种生长激素促分泌素受体(GHSR)激动剂和恶病质实验疗法)观察到的效果。正如其他人先前报道的那样,anamorelin治疗的小鼠未见生存获益。
因此,我们得出结论:在侧腹肺癌和原位胰腺癌小鼠模型中,右侧颈部迷走神经切断术是限制CAC发展的最有效迷走神经干预措施,并在所有后续实验中继续采用此方法。
4.右侧颈部迷走神经切断术的益处主要由传出效应介导
为了更好地理解迷走神经切断术在CAC中产生益处的机制,我们分别干扰了主要与传入通路相关的毒蕈碱型乙酰胆碱(muscarinic ACh)信号和更多参与传出通路的nicotine型乙酰胆碱(nicotinic ACh)信号。atropine是一种毒蕈碱型ACh受体拮抗剂,而六甲铵(hexamethonium)是一种nicotine型ACh受体拮抗剂,因此,使用这些药物治疗可分别阻断传入和传出信号传导。我们发现,阻断毒蕈碱型或 nicotine型ACh信号传导均未能缓解上游的神经炎症或免疫细胞向迷走神经背运动核(VDMN)的浸润,但它们对全身性ACh和CCL2水平有影响,其中六甲铵产生的效应更为显著。六甲铵治疗显著改善了CAC的表现,包括体重维持、肌肉保留、握力、行为以及生存期,而atropine的效果则无统计学意义(图3F, 3G)。这些结果表明,尽管迷走神经信号的传入和传出成分可能都参与了CAC的发生,但传出成分主导了CAC的症状。
因此,我们通过测量LLC皮下肿瘤和KPC原位肿瘤中的肝脏神经支配和肿瘤神经支配,探究右侧迷走神经切断术的这些有益效果是否与对肿瘤或肝脏神经支配的次级影响有关。我们发现,在迷走神经切断术后,两种肿瘤类型的总神经支配、内在神经支配、自主内在神经元比例或肝脏神经支配方面均无显著变化。
值得注意的是,在LLC和KPC小鼠中,迷走神经切断术降低了血清和肝脏中的ACh水平,而CCL2在血清、大脑和脑脊液(CSF)中降低,但在肝脏中未见降低。在这些荷瘤小鼠中,终末期ACh水平在胃和胰腺中升高,但在结肠或肿瘤中未见升高。此外,死于疾病或在人道终点被euthanasia的小鼠的肝脏和血清ACh水平与生存期呈负相关。尽管在注射LLC细胞一周后,接受迷走神经切断术的LLC小鼠的巨噬细胞浸润水平与非切断术的LLC小鼠相似,但在2周时,其VDMN中的巨噬细胞浸润水平(特别是与肿瘤进展相关的CD206+巨噬细胞)与非切断术的LLC小鼠相比显著减少。
5.迷走神经切断术通过保护肝脏代谢缓解CAC表现
我们近期发现,在乳腺癌和KPC胰腺癌小鼠模型中,CAC相关的全身表现与肝脏代谢的主要调控因子HNF4α水平下降有关。结果导致肝脏代谢发生显著重编程,特别是在蛋白质代谢方面,这表现为HNF4α靶基因(如白蛋白)以及尿素循环酶(主要是鸟氨酸氨甲酰基转移酶,OTC)表达水平的降低,从而促进了CAC表现。因此,我们评估了LLC小鼠的肝脏中是否发生了类似的变化。在LLC小鼠中,我们发现与对照小鼠相比,肝脏HNF4α几乎完全消失,OTC蛋白水平显著降低(图4A)。对HNF4α的纵向评估发现,在癌症诱导后早至7天其即发生耗竭,值得注意的是,这与在肝脏中观察到ACh变化的时间点一致。由于HNF4α对控制肝脏代谢至关重要,其在肝脏中的表达在不同发育阶段和细胞状态下受到多层次的调控。为评估副交感神经系统是否也能调节LLC小鼠肝脏HNF4α表达的变化,我们在培养的人肝细胞中添加了ACh。我们观察到随后HNF4α的RNA和蛋白水平下降,这表明副交感神经系统至少可以部分地通过迷走神经释放的ACh来调节HNF4α的表达(图4B)。

图4. 右侧颈迷走神经切断术在癌症恶病质期间保护肝脏代谢
为确认HNF4α的下降直接导致恶病质表现(独立于肿瘤效应),我们给WT小鼠注射了腺相关病毒AAV8-shHNF4α或AAV8-shLUCIFERASE(对照)。我们通过在RNA和蛋白水平上证实其耗竭,确认了HNF4α的敲低(图4C)。此外,我们验证了在HNF4α耗竭后,其已知靶基因(OTC、白蛋白)以及参与脂肪酸β-氧化的基因的RNA表达也相应减少(图4C,右下)。在注射shHNF4α的小鼠肝脏中,未观察到大体肝脏组织学或脂肪变性的改变。值得注意的是,注射shHNF4α的WT小鼠出现了体重下降以及脂肪和瘦体组织减少(图4D)。在分子水平上,shHNF4α增加了肌肉萎缩相关基因的表达,这支持了HNF4α耗竭在独立于癌症的情况下促进恶病质表现的显著且直接的作用。
重要的是,我们在接受迷走神经切断术治疗的WT小鼠的血浆生化指标中未发现肝功能异常。迷走神经信号传导和HNF4α均已被证明可调节肝脏释放脂质运载蛋白2(LCN2),LCN2是一种恶病质驱动因子,它能增强全身炎症并穿过血脑屏障调节食物摄入。如图4A所示,右侧迷走神经切断术提高了HNF4α水平,预计会降低循环中的LCN2水平。确实,我们发现发生HNF4α耗竭的LLC小鼠肝脏中LCN2水平升高,这与注射shHNF4α的WT小鼠情况类似(图4E)。此外,LLC小鼠大脑中的LCN2也升高。
此外,我们发现迷走神经切断术增加了肝脏HNF4α和OTC的RNA及蛋白水平,并通过白蛋白蛋白水平的升高证明了肝功能的改善(图4F, 4G)。值得注意的是,迷走神经切断术保护了肝脏氨基酸代谢,这体现在LLC小鼠肝脏和血浆中尿素循环代谢物的水平与假手术的LLC小鼠相当(图4H)。另外,迷走神经切断术恢复了支链氨基酸(BCAAs)的水平(图4H),这些氨基酸已被证明与蛋白质分解代谢导致的肌肉损失相关,并导致生存期缩短。值得注意的是,HNF4α和血清白蛋白水平的升高与生存期呈正相关。因此,虽然通过耗竭HNF4α破坏肝脏代谢会促进恶病质表现,但迷走神经切断术维持了HNF4α调控的肝脏蛋白质代谢,限制了蛋白质分解,并改善了生存期。
6.间歇性迷走神经调控足以减轻CAC表型
尽管迷走神经切断术具有侵入性的特点,使其作为潜在的临床干预手段并非理想选择,但新型经皮神经调控技术对恶病质患者而言是一种极具吸引力的治疗方法。虽然迷走神经刺激先前已在肺癌患者中用于激活免疫系统进行评估,但未观察到生存获益,且尚未进行关于迷走神经阻断或迷走神经起搏的等效研究。为评估电迷走神经阻断对CAC的影响,我们在小鼠右侧颈迷走神经上植入微线钩电极,施加旨在诱发低频交变电流阻断(LFACb)的电刺激模式。
在近期使用LFACb缓解疼痛的临床试验中,91%的患者报告在停止LFACb治疗后其治疗效果持续超过24小时,这促使我们使用我们的波形探究单次LFACb剂量的作用持续时间。我们进行了一系列研究,对KPC或LLC小鼠施加单次30分钟的LFACb治疗。为重现人类CAC情景,我们在肿瘤生长一段时间未干预后测试了迷走神经干预的有效性。我们给小鼠注射KPC或LLC细胞,并将其分配至植入电极但不施加电流组(LLC + sham, KPC + sham)或植入电极并接受治疗性LFACb组(LLC + LFACb, KPC + LFACb)(图5A)。所有LLC小鼠在无干预情况下随访34天,所有KPC小鼠随访11天(此时它们表现出恶病质发作的定性指标,包括与WT对照组相比体重差异达5%)。随后,我们根据治疗前、治疗后即刻、治疗后12小时、24小时、36小时和48小时的测量结果,评估了单次迷走神经阻断剂量对迷走神经张力、肝脏ACh水平和HNF4α水平的影响(图5B)。我们发现迷走神经张力在治疗后即刻得到改善,并在2天内逐渐恢复到与假手术组相比无统计学显著改善的状态。然而,肝脏ACh水平以及由此产生的HNF4α水平直到治疗后12小时才受到显著影响,但在两种模型中分别至少在24小时和36小时内保持显著优于假手术组。因此,持续治疗对于维持肝脏代谢的益处是必要的。然而,这些结果表明,即使是短时的电迷走神经干预(无需进行不可逆的迷走神经切断术),也可能通过重置相关神经回路,提供类似的恶病质症状缓解效果。

图5. 每日30分钟的间歇性迷走神经阻断足以挽救CAC
为验证这一假说,我们重复了该实验:从第11天(KPC小鼠)和第34天(LLC小鼠)开始,小鼠在清醒周期开始时每天接受30分钟的治疗性LFACb。与假手术组小鼠相比,接受LFACb治疗的小鼠体重减轻显著减少,且身体状况显著改善(图5C和5D)。与假手术组小鼠相比,两种模型中接受LFACb治疗的小鼠肌肉萎缩也得到统计学显著的缓解,握力和前爪悬挂于金属丝上的能力等功能性指标也得到改善,且与WT对照组无统计学差异(图5E–5G)。重要的是,接受LFACb治疗的LLC和KPC小鼠生存期显示出统计学上的显著改善(图5H)。
接受LFACb治疗的小鼠在行为学方面也获得了与接受迷走神经切断术小鼠相似的益处。两种模型中接受LFACb治疗的小鼠都比假手术组小鼠更活跃、更具社交性且消耗更多食物,无论食物是来自悬挂式给料盒还是地面浅槽(图6A–6C)。与迷走神经切断术小鼠相似,体重、肌肉质量和脂肪质量的保留均与生存期延长相关,其中肌肉保留的相关性最强,而在生存获益或体重维持益处方面未观察到性别特异性差异。
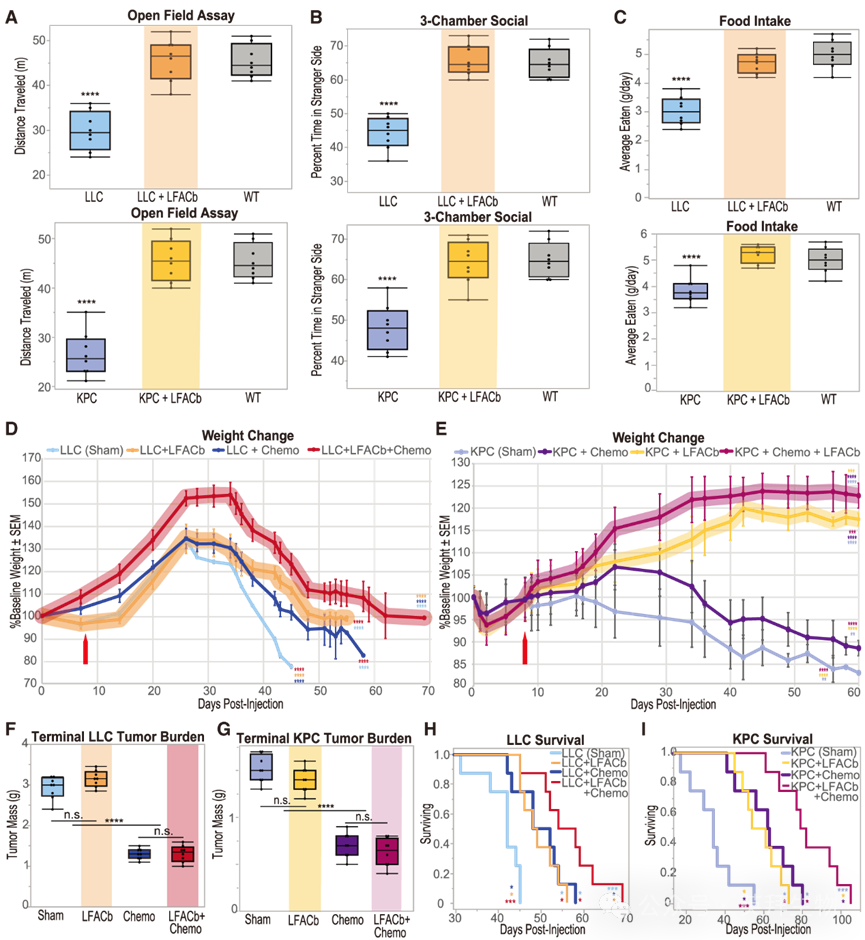
图6. LFACb(低频交变电流阻断)可改善行为并增强化疗反应
最后,为评估迷走神经阻断疗法是否能与化疗联用提供叠加益处,LLC和KPC小鼠被分为无治疗组、仅LFACb组、仅顺铂组或LFACb联合顺铂注射组。接受任何治疗的小鼠体重维持时间均长于未治疗组。值得注意的是,接受LFACb治疗的小鼠体重维持时间长于仅接受化疗的小鼠,而体重维持最佳的小鼠组始终是接受LFACb联合化疗的组(图6D和6E)。肿瘤负荷在接受或未接受化疗的小鼠之间存在差异,但在接受或未接受LFACb的小鼠之间无差异,这表明任何记录的益处纯粹源于恶病质症状的减轻而非肿瘤负荷的降低(图6F和6G)。与未治疗的LLC小鼠相比,仅LFACb治疗和仅化疗均提供了生存获益(图6H)。然而,联合治疗比任一单一疗法提供了显著的生存获益,其相对于未治疗LLC对照组的平均生存获益几乎是单一疗法的两倍。在荷KPC肿瘤的小鼠中,联合治疗的生存获益甚至更为显著(图6I)。
7.使用经皮迷走神经阻断的概念验证性转化治疗
为使LFACb成为一种临床可行的方法,非侵入性技术将是必要的,因为CAC患者可能过于虚弱而无法承受手术。为此,我们开发了一种柔性粘性电极贴片来输送经皮LFACb(tLFACb)。通过先前在植入动物中使用的头戴式装置输送相同的LFACb波形,其幅度通过下游迷走神经记录凭经验确定。贴片每天在颈部右侧靠近迷走神经走行路径的位置粘附30分钟(图7A)。输送tLFACb足以重现LFACb的益处,包括体重维持、活动水平改善、正常社交和食欲维持(图7B–7E)。腓肠肌纤维测量结果证实了肌肉保留,这得到了握力测试和悬丝测试表现改善的支持(图7F–7H)。治疗后12小时的迷走神经张力与植入装置达到的水平相当(图7I)。在tLFACb治疗后也观察到了相似的生存获益,包括与化疗联用时的生存获益(图7J)。
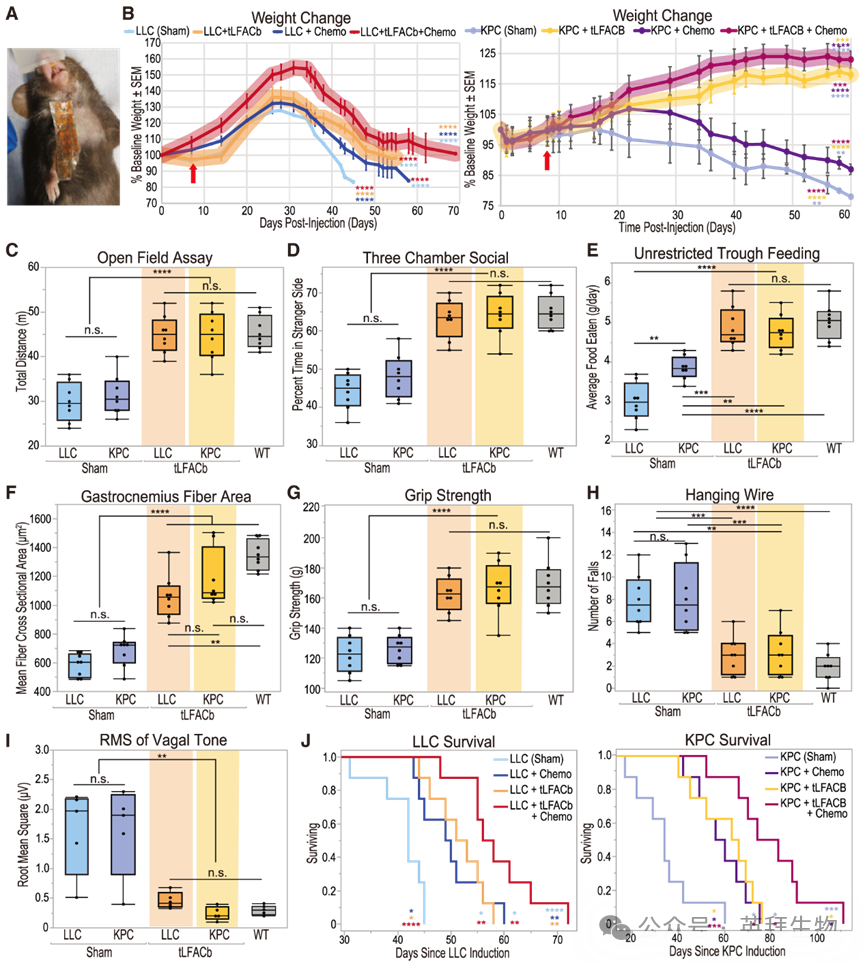
图7. 每日30分钟的经皮迷走神经阻断可挽救CAC
作为tLFACb能否在人体规模实现的初步概念验证测试,我们在猪身上进行了tLFACb。在30分钟的tLFACb后未观察到心率、呼吸和体温的变化,但在间隔1周进行的四次tLFACb治疗期间,三头猪的迷走神经信号传导显著降低。同步心电图(EKG)在tLFACb方案实施期间未显示异常。对tLFACb电极贴片下的皮肤和肌肉以及包括心脏、肺、肾脏和肝脏在内的主要器官进行的组织学检查未发现损伤或大体异常。
结论
本研究揭示癌症相关恶病质(CAC)的核心机制:肿瘤诱导的全身炎症(尤其CCL2升高)引发迷走神经过度激活,导致肝脏代谢主调控因子HNF4α下调,进而驱动蛋白质代谢紊乱和恶病质表型。通过右侧颈迷走神经干预(手术切断或经皮低频电流阻断),可有效维持HNF4α表达,改善摄食行为,缓解肌肉萎缩并延长生存期。非侵入性经皮迷走神经调控技术(tLFACb)每日30分钟即显效,与化疗协同增效,为临床转化提供新策略。总的来说,我们的研究为针对迷走神经-大脑-肝脏轴来造福患有 CAC 的患者提供了概念验证,为健康和疾病中的神经代谢调节这一新兴领域做出了贡献。
参考文献:
Garrett A, Darzi N, Deshmukh A, Rosenfeld N, Goldman O, Adler L, Bab-Dinitz E, Singer O, Hassani Najafabadi A, Wong CW, Bose S, Randon PM, Bustamante F, Larios R, Brandis A, Mehlman T, Smaglo B, Chang P, Oliva J, Haymaker C, Nagawekar L, Wu SR, Huang Y, Shen A, Vora A, Padilla JF, Pfeffer A, Sutherland G, Starr M, Zimmers T, Zhu Y, Morizio J, Erez A, Shen X. Vagal blockade of the brain-liver axis deters cancer-associated cachexia. Cell. 2025 Jul 29:S0092-8674(25)00805-0. doi: 10.1016/j.cell.2025.07.016. Epub ahead of print. PMID: 40780194.






