膀胱癌中巨噬细胞与癌细胞之间ERα依赖性crosstalk增强血管生成拟态和M2巨噬细胞极化
膀胱癌(BLCA)的发生和发展中存在与性别相关的差异,这受到性激素及其受体信号通路的影响。针对血管内皮生长因子的血管生成抑制剂在膀胱癌患者中并未显示出治疗效果。在本研究中,我们发现雌激素受体α(ERα)的表达与血管拟态(VM)的形成以及M2 型肿瘤相关巨噬细胞(TAM)的浸润呈正相关。然而,目前尚不清楚ERα 与巨噬细胞之间的这种联系如何影响 VM 及其详细机制。我们的体外研究结果表明,巨噬细胞诱导的ERα 表达上调通过转录上调 CDH5 促进BLCA 细胞的 VM。进一步的研究发现,BLCA细胞中上调的 ERα 通过肿瘤细胞衍生的外泌体激活PTEN/PI3K/pAKT 通路,诱导M2 巨噬细胞的极化。机制研究揭示,由 ERα 在BLCA 细胞中上调产生的外泌体 miR-642a-5p 通过直接靶向PTEN mRNA 的3'UTR 降低巨噬细胞中的 PTEN 表达。涉及体外BLCA 细胞系和体内小鼠异种移植模型的临床前实验证实了这一新发现的通路及其反馈回路,为BLCA 的创新治疗策略的开发提供了新的思路。。该研究于2025年7月发表在《Cell Communication and Signaling》,IF:8.9。
技术路线
1.在BLCA中,ERα的表达与TAMs的浸润呈正相关
巨噬细胞是多种实体肿瘤(包括 BLCA 在内)中常见的浸润性免疫细胞群体。为了探究巨噬细胞在肿瘤微环境中的作用及其对 BLCA 发展的影响,我们首先使用 TIMER2.0 数据集评估了巨噬细胞浸润的预后意义。我们的分析表明,巨噬细胞浸润水平较高的 BLCA 患者生存率低于浸润水平较低的患者(图 1A)。在评估 M2 型巨噬细胞浸润的预后价值时也观察到了类似的结果(图 1B)。鉴于 BLCA 的发病率和预后在男性和女性之间存在差异,我们进一步分别对男性和女性 BLCA 患者的 M2 型巨噬细胞浸润的预后相关性进行了详细研究。在女性患者中,M2 型巨噬细胞浸润水平较高的患者生存率低于水平较低的患者(图 1C),而在男性患者中,两组之间未观察到显著差异(图 1A)。此外,我们的分析表明,女性BLCA患者体内的 M2 型巨噬细胞浸润程度高于男性患者(图 1D)。我们接着利用 TIMER2.0 数据库研究了激素受体与巨噬细胞浸润之间的关系。我们的研究结果表明,ERα 的转录基因 ESR1 与巨噬细胞浸润以及 BLCA 中的 M2 型巨噬细胞浸润之间存在正相关关系(图 1E)。然而,M2 型巨噬细胞浸润与 ESR2 或 AR 的表达并无显著相关性(图 1B)。
通过使用在线工具 TRGAted,我们分析了 ERα 表达与 BLCA 患者生存率之间的关联。根据 TRGAted 分析结果,ERα 表达水平高的 BLCA 患者生存率更低(图 1F)。在 III 和 IV 期的晚期 BLCA 患者中,ERα 表达水平较高的患者生存率更差,尤其是女性患者(图 1G)。然而,在早期阶段(I 和 II 期)的 BLCA 患者中,ERα 的较高表达水平与更好的生存率相关(图 1C)。上述结果表明,ERα 在晚期 BLCA 中可能与早期 BLCA 中发挥的作用不同。
根据 TCGA 数据集的不同临床阶段,对 TAMs 标记物 CD68 和 CD163 的表达进行了分析。结果显示,与 II 期患者相比,III 和 IV 期患者的这两种标记物的表达显著增加(图 1H)。根据我们对 GSE13507 的分析结果,CD163 在原发性 BLCA 肿瘤和复发性肿瘤中的表达与 ESR1 的表达呈正相关,且具有统计学意义(图 1D)。为了阐明TAMs浸润与膀胱癌组织中ERα表达之间的关系,我们对 40 例膀胱癌(BLCA)患者样本(包括 24 例肌层浸润性膀胱癌(MIBC)样本和 16 例非肌层浸润性膀胱癌(NMIBC)样本)的 CD68/CD163 和 ERα 表达进行了检测,结果表明 ERα 的表达与 TAMs 浸润呈正相关(图 1I-J)。我们还发现,MIBC 样本中的 CD163 表达明显高于 NMIBC 样本(图 1K)。MIBC 样本中 ERα 阳性样本的比例显著高于 NMIBC 样本(图 1L)。
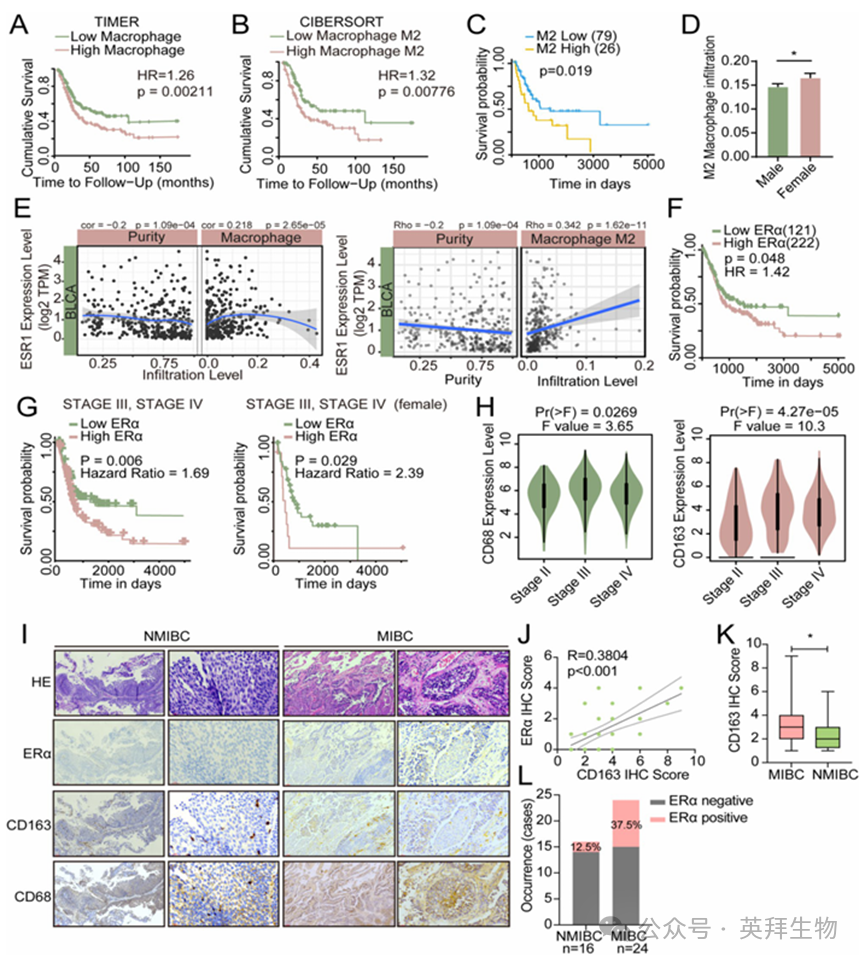
图1.在BLCA中,ERα的表达与TAMs的浸润呈正相关
2.TAMs增加ERα的表达并促进肿瘤细胞的血管生成拟态
我们之前的研究表明, TAMs会促进肾细胞癌中的VM形成。VM被认为与癌症的侵袭和转移以及对抗血管治疗的不敏感性或耐药性有关。为了探究BLCA中 TAMs 与VM之间的关系,我们根据我们发表的论文中的方法建立了体外共培养系统。首先,我们检测了四种不同膀胱癌细胞系(J82、TCC-SUP、T24 和 UMUC-3)中 ERα 的表达水平以及形成VM的能力。结果表明,TCC-SUP 细胞系的 ERα 表达水平和形成VM的能力最强,其次是 UMUC-3 细胞,然后是 T24 细胞。T24 细胞的 ERα 表达水平和形成VM的能力低于 UMUC-3 和 TCC-SUP 细胞,而 J82 细胞在体外实验中无法形成管状结构(图 2 A-B)。因此,我们选择了 TCC-SUP 细胞和 T24 细胞进行后续实验。
如图 2A 和 2B 所示,与巨噬细胞共培养显著增强了 T24 和 TCC-SUP 细胞形成二维和三维VM结构的能力。我们评估了与巨噬细胞共培养后 BLCA 细胞中 ERα 的表达情况,结果显示 ERα 的表达显著增加(图 2C)。为了验证 ERα 在巨噬细胞诱导的VM形成中的作用,我们进行了实验来评估二维和三维VM形成的能力。我们将用 ERα 敲低载体(ERα-KD)产生的慢病毒转染的 TCC-SUP 细胞与用正常对照载体(NC)产生的慢病毒转染的 TCC-SUP 细胞进行比较。将用 ERα cDNA 载体(ERα-OE)产生的慢病毒转染的 T24 细胞与用 pWPI cDNA 载体(NC)产生的慢病毒转染的 T24 细胞进行比较。结果表明,降低 ERα 的表达会阻碍二维和三维VM的形成,而提高其表达则会促进VM的形成(图 2D-F)。
为探究巨噬细胞是否通过上调 ERα 的表达来促进VM的形成,我们进行了拯救实验。我们将 ERα 缺失型慢病毒转染至 TCC-SUP 细胞中,然后将这些细胞与或不与巨噬细胞共培养。随后,收集肿瘤细胞进行 2D/3D VM形成实验。结果表明,敲低 ERα 可逆转与巨噬细胞共培养所诱导的VM形成增强现象(图 2G-H)。此外,我们使用雌激素受体抑制剂 ICI-182,780 进行了拯救实验。结果显示,通过 ICI-182,780 抑制 ERα 也能逆转与巨噬细胞共培养所诱导的VM形成增强现象(图 2C)。我们还进行了进一步实验,以检查 ERα 基因敲除(ERα-KO)和野生型(WT)小鼠的 BBN 诱导的 BLCA 肿瘤中巨噬细胞标志物 F4/80 和VM标志物 PAS+/CD31- 的存在情况(图 2I)。WT 样本中 MIBC 的比例显著高于 ERα-KO 组(图 2J)。我们的结果表明,与 WT 肿瘤相比,ERα-KO 肿瘤的VM形成显著减少(图 2K),并且VM形成与巨噬细胞浸润之间存在正相关关系(图 2L)。综合来看,图 2A-L 和图 S2A-C 的结果表明,ERα 起到了促甲状腺上皮瘤形成的作用,即它充当了TAM促进VM形成的媒介。
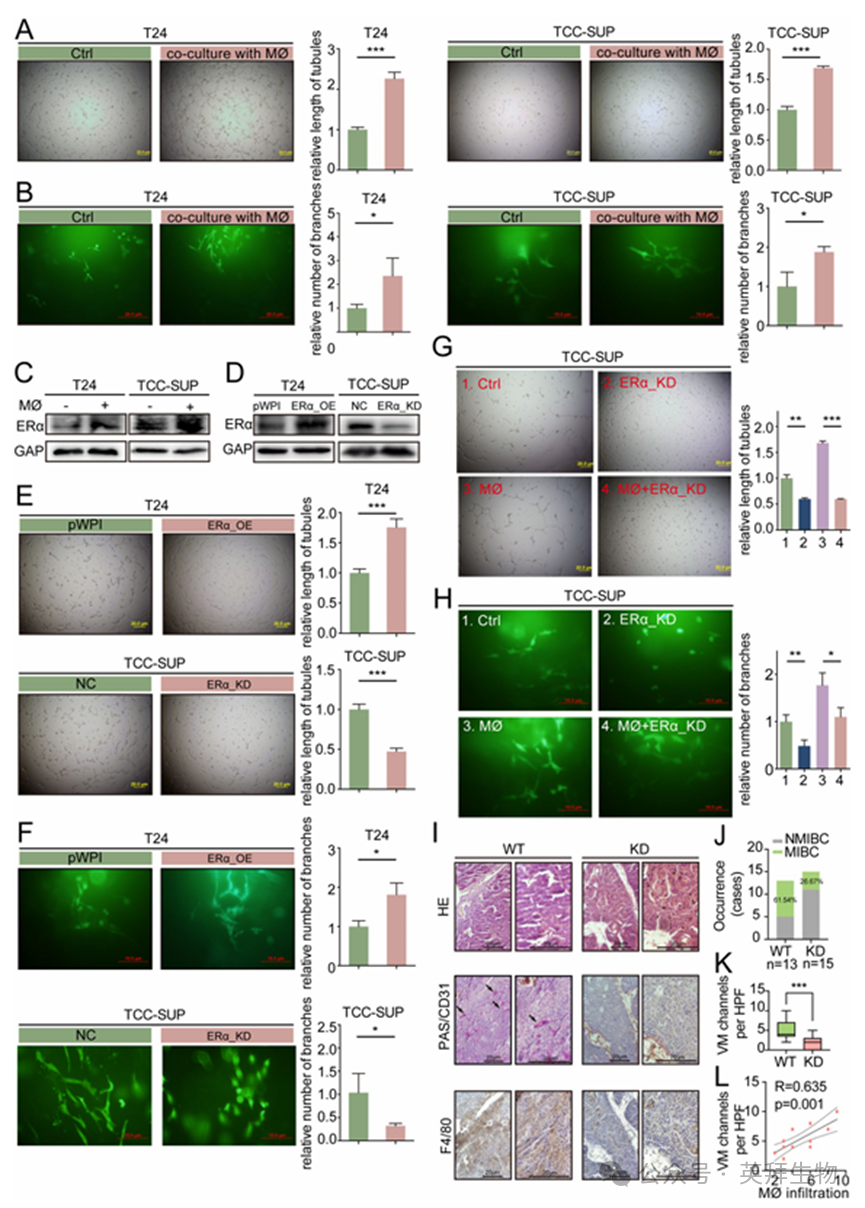
图2.巨噬细胞增加BLCA细胞ERα表达,促进VM形成
3.ERα通过上调CDH5促进VM形成
为阐明巨噬细胞诱导的 ERα 如何促进VM形成的具体机制,我们在 T24 和 TCC-SUP 细胞中(无论是否与巨噬细胞共培养)分别在 mRNA 和蛋白质水平上鉴定出了 12 种已知的与VM形成相关的分子(图 3A-B)。结果显示,共培养的 T24 和 TCC-SUP 细胞中 CDH5 的表达显著增加。为了进一步探究 ERα 是否能调节 CDH5,我们进行了更多的实验。这些实验表明,敲低 ERα 的表达会导致 CDH5 表达的降低,而 ERα 的过表达则会产生相反的效果(图 3C)。根据在线的 TCGA 数据库,我们分析了 ESR1 和 CDH5 在 BLCA 中的关联,发现这两个基因之间存在显著的正相关(图 3D)。此外,我们还研究了 ESR1 和 CDH5 在 34 种不同癌症类型中的关联,结果在大多数癌症类型中(包括 BLCA)都显示出显著的正相关(图 3E)。
为确认 ERα 是否通过调节 CDH5 来促进VM的形成,我们进行了拯救实验,实验结果表明,在 T24 细胞中敲低 CDH5 的表达会减少VM的形成,并且能够逆转由 ERα 过度表达所导致的VM形成(图 3F、G)。相反,在 TCC-SUP 细胞中过表达 CDH5 会增强VM的形成,并且能够逆转 ERα 抑制所导致的VM形成(图 3A-B)。接下来,我们使用在线工具 UALCAN 根据 TCGA 数据库分析了 BLCA 患者的生存情况,结果显示,CDH5 表达水平高的患者预后较差,尤其是女性患者(图 3C)。此外,晚期(III 和 IV 期)患者的肿瘤组织中 CDH5 的表达明显高于早期(II 期)患者(图 3D)。接下来,我们通过 IHC 检测了 BLCA 样本中的 ERα 表达,然后将患者分为 ERα 阳性组和 ERα 阴性组(图 3H)。如图 3I-J 所示,ERα 阳性肿瘤组织中 CDH5 的表达和VM的形成明显高于 ERα 阴性肿瘤组织。此外,ERα 的表达水平与 CDH5 的表达水平呈正相关(图 3K)。综合来看,图 3A-K 和图 S3A-D 中所呈现的结果表明,ERα 通过调节 CDH5 的表达来影响VM的形成。
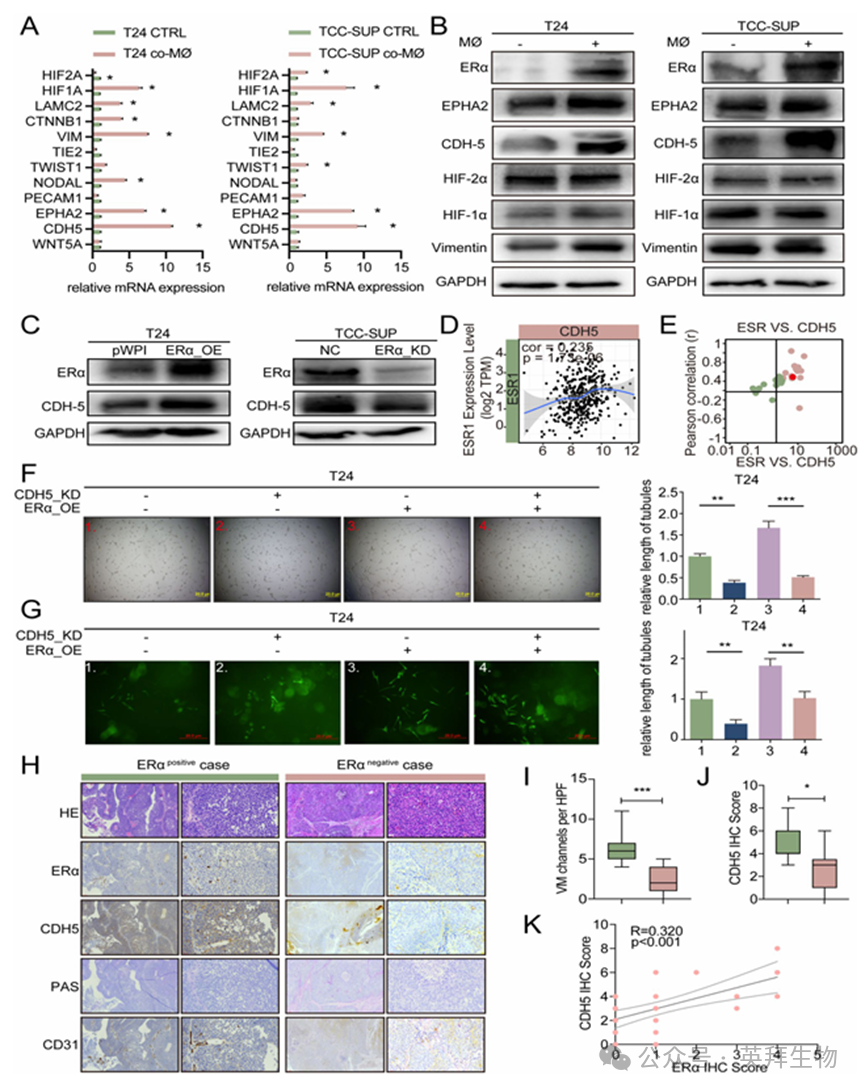
图3.ERα通过上调CDH5促进VM形成
4.ERα通过转录调控调控CDH5表达的机制剖析
为探究 ERα 如何调控 BLCA 细胞中的 CDH5,我们检测了 TCC-SUP-ERα-KD 细胞与 TCC-SUP-NC 细胞以及 T24-ERα-OE 细胞与 T24-NC 细胞中 CDH5 的 mRNA 水平。结果显示,CDH5 mRNA 水平的变化与其蛋白表达的变化一致(图 4A),这表明转录调控可能是主要机制。接下来,进行了 ChIP 实验以确定 ERα 是否能与 CDH5 启动子结合并调节其转录。在 CDH5 启动子的 3 千碱基区域内鉴定出了三个预测的 ESR1 反应元件(EREs),它们可能通过 ERα 结合发挥作用(图 4B、C)。ChIP 结果表明,ERα 在 CDH5 启动子区域与 ERE2 结合以启动基因转录(图 4D)。然后,我们使用含有野生型(WT)或突变型(Mut)ERE2 的 pGL3 报告质粒进行荧光素酶测定,以确认 ERE2 的功能。荧光素酶报告基因活性测定显示,ERα 表达的下调降低了野生型报告基因转染组的荧光素酶活性,而在突变组中没有显著变化。相反,ERα 的过表达仅在野生型报告基因转染组中显著提高了荧光素酶的活性(图 4E、F)。综上所述,图4A-F的结果表明,ERα可以转录调节BLCA细胞中CDH5的表达。
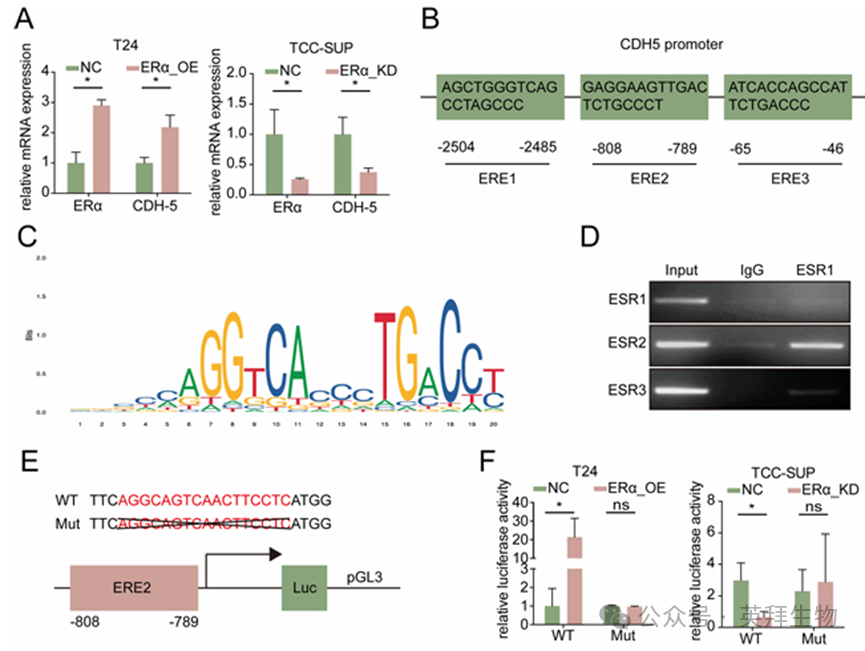
图4.ERα通过转录上调CDH5的表达
5.巨噬细胞浸润增加BLCA细胞ERα表达的机制剖析:通过IL-17 a介导的表观遗传机制
众多研究表明,巨噬细胞分泌的细胞因子能够影响肿瘤的生物学功能。我们的 qRT-PCR 分析显示,在与巨噬细胞共培养后,T24 和 TCC-SUP 细胞中的 ESR1 mRNA 表达显著增加,这表明 ERα 的上调可能是在转录水平上受到控制的(图 5A)。我们筛选了在与或不与 BLCA 细胞共培养的条件下由巨噬细胞产生的十种潜在细胞因子(图 5B)。随后,我们在 T24 和 TCC-SUP 细胞中检查了这五种升高的细胞因子,无论是否与巨噬细胞共培养,最终确定 IL-17 A 和 TGFβ 为有前景的候选物(图 5C)。值得注意的是,一项关于子宫内膜癌细胞中细胞因子对 ERα 表达调控的研究强调,IL-17 A 可通过刺激 ESR1 转录来增强 ERα 表达。该研究还提出,IL-17 A 诱导的 ERα 表达可能与 TET1 介导的 ESR1 基因启动子去甲基化有关。此外,我们使用 UALCAN分析了 ESR1 启动子的甲基化水平。(http://ualcan.path.uab.edu/)公布了一项重要发现,即在BLCA肿瘤中,ESR1启动子的甲基化水平显著降低(图4A)。此外,我们还对 TCGA 数据库中不同临床阶段的 ESR1 启动子甲基化水平进行了评估,结果显示,在晚期阶段(II、III 和 IV 期)的甲基化水平明显低于 I 期(图4B)。鉴于上述发现以及我们之前的成果,我们提出以下假设:巨噬细胞可能通过一种涉及 IL-17A 介导的 TET1 依赖性 ESR1 启动子去甲基化的表观遗传机制来提高 BLCA 细胞中的 ERα 表达。
基于上述假设,我们试图通过在共培养系统中引入 IL-17 A 受体抗体(IL17RA)来阻断 IL-17 A 的功能,以验证 IL-17 A 在 ERα 表达中的调节作用。结果表明,抑制 IL-17 A 的功能会减弱巨噬细胞介导的 T24 和 TCC-SUP 细胞中 ERα 表达的上调(图 5D)。随后,蛋白质印迹分析证实,添加外源性 IL-17 A 会导致 ERα 表达随时间呈剂量依赖性增加(图 5E,Sfig.4 C)。根据所提出的机制,IL-17 A 被认为通过 TET1 介导的 5-羟甲基化途径影响 ESR1 启动子的去甲基化,从而上调 ERα 表达。为了排除 IL-17 A 对 CDH5 的直接调节作用,并证明 IL-17 A 在 BLCA 中通过特异性上调 ERα 的表达来促进 CDH-5 依赖性 VM 形成,我们向 ERα 基因敲低细胞中添加外源性IL-17 A 并检测 CDH5 的表达。结果表明,敲低 ERα 表达会降低 CDH5 的表达,无论是否添加外源性 IL-17 A(Sfig. 4D)。为了进一步探究这一现象,我们检测了在敲低 TET1 表达后 BLCA 细胞中 ERα 的表达情况。值得注意的是,TET1 敲低显著抑制了 ERα 的表达,并阻碍了VM的形成(图 5F,S 图 4E)。此外,在 BLCA 细胞中敲低 TET1 逆转了巨噬细胞诱导的 ERα 表达上调和VM形成(图 5G-H)。我们使用 GEPIA 对 BLCA 中 TET1 的预后价值进行了评估,结果显示高 TET1 表达的患者生存率更低,从而为 TET1 在 BLCA 中的促肿瘤作用提供了更多证据(S 图 4F)。
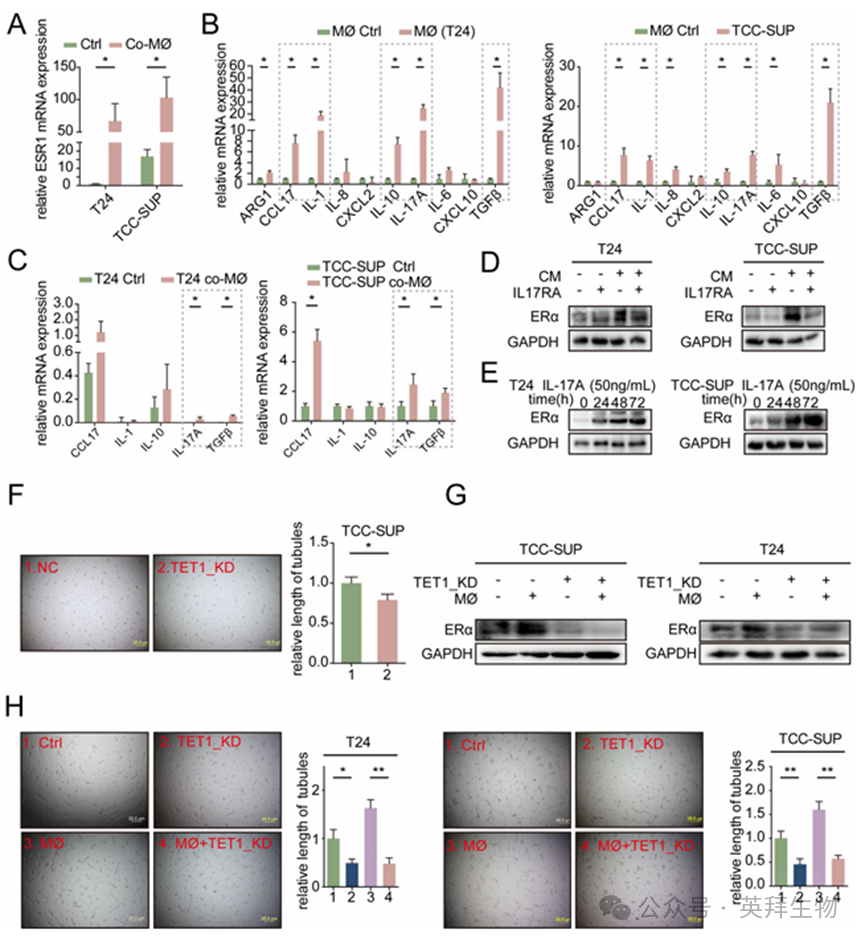
图5.巨噬细胞通过IL-17 a介导的表观遗传机制增加BLCA细胞中ERα的表达
6.来自BLCA细胞的ERα调节的肿瘤源性外泌体通过pten/pakt途径促进M2极化和IL-17 A的产生
TAMs在炎症反应和肿瘤微环境中起着关键作用。在膀胱癌(BLCA)中,TAMs 的双重作用取决于不同的极化状态,即 M1/M2 类型。巨噬细胞与肿瘤细胞之间的相互作用已被证实能够重塑肿瘤微环境并促进肿瘤进展。TAMs,尤其是 M2 型,被认为在这一微环境中发挥着促进肿瘤生长的作用。根据图 1 的结果,发现 ERα 的表达与 M2 型巨噬细胞的浸润程度呈正相关。因此,我们假设 ERα 是否参与调节巨噬细胞的 M2 极化过程。为了进一步验证这一假设,我们检查了在与或不与 BLCA 细胞共培养后巨噬细胞中 M1 和 M2 标志物的表达情况。结果表明,共培养后大多数 M2 标志物的表达显著增加,而 M1 标志物的水平则降低(图 6A)。随后,我们检测了在与转染了/未转染 ERα 过表达病毒的 T24 细胞或转染了/未转染 ERα 缺失病毒的 TCC-SUP 细胞共培养后巨噬细胞中 M2 标志物的表达情况。正如预期的那样,结果表明,在 T24 ERα-OE 共培养组中,M2 标志物显著增加,而在 TCC-SUP ERα-KD 共培养组中,M2 标志物显著减少,这表明在 BLCA 细胞中改变 ERα 的表达能够有效地影响 M2 巨噬细胞的极化(图 6B)。根据先前的研究,肿瘤来源的细胞外囊泡(EVs)包含诸如微小 RNA 等小分子,能够介导 M2 巨噬细胞的极化。为了确定肿瘤来源的外泌体在 M2 巨噬细胞极化中的作用,使用外泌体抑制剂 GW4869 来阻断共培养系统中的外泌体功能。通过蛋白质印迹法评估外泌体标志物 CD63 和 CD9 的蛋白水平,并通过电子显微镜检查肿瘤细胞来源的外泌体的形态,所有这些都证实了我们收集到的外泌体的存在(图 6C,Sfig.5 A)。结果表明,在共培养系统中添加 GW4869 能够显著阻断巨噬细胞的 M2 极化(图 6D),并且添加来自 T24 ERα-OE 细胞的外泌体能够显著诱导 M2 巨噬细胞极化(图 6E)。
鉴于在 BLCA 细胞中,M2 型巨噬细胞极化受到 ERα 表达的反馈调节,我们探究了其潜在的机制。多项研究表明,pAKT 介导的信号通路在 M2 极化调节中起着重要作用。有趣的是,PTEN/pAKT 轴也被报道能够调节巨噬细胞中的 IL17 表达。为验证 PTEN/pAKT 轴在促进 M2 巨噬细胞极化中的作用,我们检测了用 T24-CM 和 TCC-SUP-CM 处理的巨噬细胞中 PTEN 和 pAKT 的表达情况。结果显示,来自 T24 和 TCC-SUP 的细胞培养基的添加降低了巨噬细胞中 PTEN 的表达,并增加了 pAKT 的表达(图 5B)。此外,我们发现 T24 和 TCC-SUP 细胞衍生的外泌体能够影响巨噬细胞中的 PTEN/pAKT 通路(图 6F)。在共培养系统中添加 GW4869 使肿瘤细胞失去了调节巨噬细胞中 PTEN/pAKT 通路的能力,而提供外泌体则逆转了这种剥夺状态(图 6G)。此外,我们还检测了用来自 T24 ERα-OE 细胞和 TCC-SUP ERα-KD 细胞的外泌体处理的巨噬细胞中 PTEN 和 pAKT 的表达情况。结果表明,加入 T24 ERα-OE 细胞来源的外泌体后 PTEN 的表达增加,而加入 TCC-SUP ERα-KD 细胞的外泌体后其表达降低,同时 pAKT 的表达与 PTEN 的表达变化方向相反(图 6H)。巨噬细胞中 IL-17 A 的 mRNA 表达与 TCC-SUP 和 T24 细胞中 ERα 的表达变化一致,这与报道的 PTEN/pAKT 途径对 IL-17 A 的转录调控相符(图 6I)。此外,KEGG 通路分析显示,在 BLCA 细胞中,ERα 可通过外泌体调节巨噬细胞中的 PTEN/pAKT 通路来促进 M2 型极化和 IL-17 A 的产生(图 5C)。综上所述,图 6A-I 的结果表明,BLCA 细胞中的 ERα 可通过外泌体调节巨噬细胞中的 PTEN/pAKT 通路,从而调控巨噬细胞的 M2 极化和 IL-17 A 的产生。
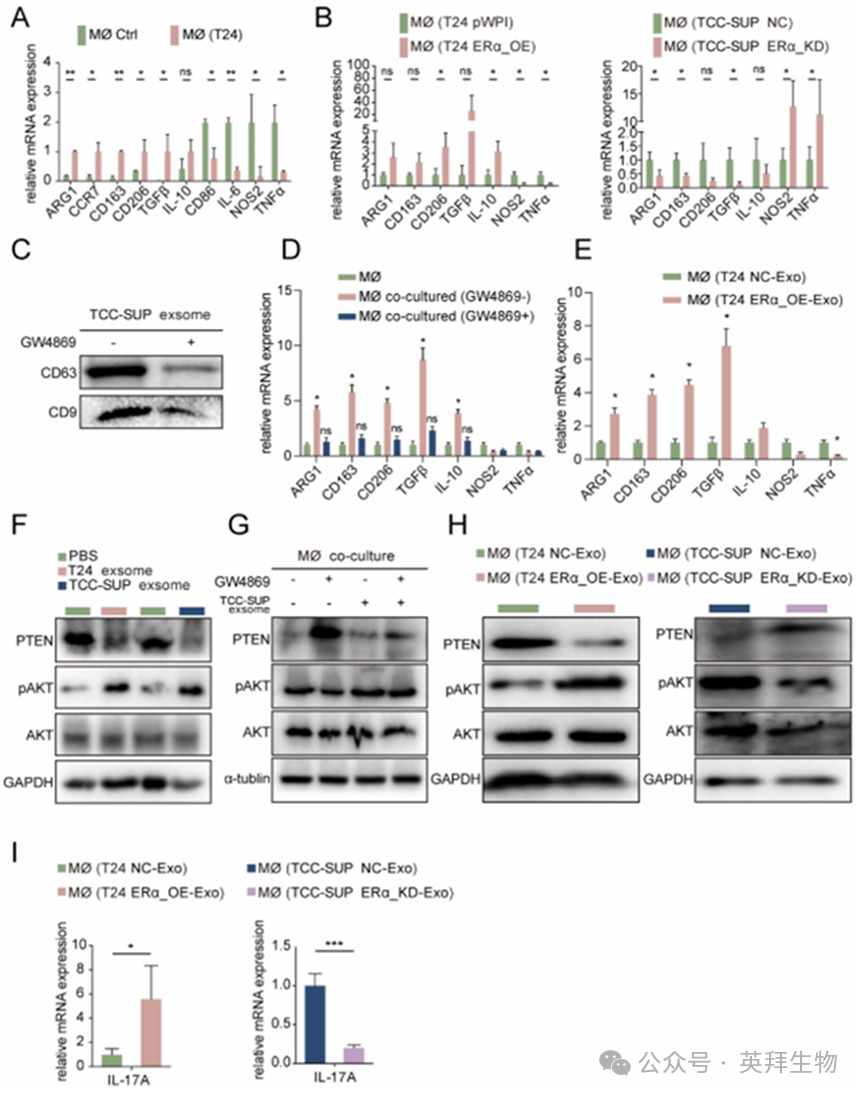
图6.由ERα调控的肿瘤源性外泌体可通过PTEN/pAKT途径促进M2极化和IL-17 A的产生
7.ERα对pten/pakt通路下调机制的剖析:miR-642a-5p直接靶向PTEN mRNA的3'UTR区段
我们观察到,源自 BLCA 细胞的外泌体能够通过调节 PTEN/pAKT 信号通路,促进巨噬细胞向 M2 型极化以及 IL-17A 的生成。我们还发现,改变 BLCA 细胞中的 ERα 表达并不会改变巨噬细胞中 PTEN 的 mRNA 表达水平(图 5D)。由于 PTEN 可能在转录后水平受到调控,我们重点关注了 miRNAs,因为它们通常存在于外泌体中,并在转录后调控中发挥着作用。通过生物信息学分析,我们筛选出了八种在 BLCA 中参与 PTEN 调控的候选 miRNAs(图 7A),并通过调节 BLCA 细胞中的 ERα 表达来评估它们的表达情况,随后我们确定了 miR-642a-5p 和 miR-5754-3p 为有潜力的候选分子(图 7B)。为了验证这些候选分子的功能,我们将 T24 细胞与巨噬细胞共培养,同时用针对 miR-642a-5p 和 miR-5754-3p 的基于载体的抑制剂进行转染。随后,我们评估了巨噬细胞中 PTEN/pAKT 的表达情况。有趣的是,与转染了 miR-642a-5p 抑制剂的 T24 细胞共培养的巨噬细胞,其 PTEN/pAKT 信号轴发生了显著变化,与与 T24-pLKO 细胞共培养的巨噬细胞相比(图 7C)。此外,在 BLCA 细胞中抑制 miR-642a-5p 能够有效逆转 ERα 对巨噬细胞中 PTEN/pAKT 的影响(图 7D)。
基于上述研究结果,我们进行了荧光素酶报告基因检测,以进一步证实 miR-642a-5p 在转录后阶段通过与 PTEN 的 3'UTR 结合而下调其表达。首先,我们使用 starBase v2.0在 PTEN 的 3'UTR 中确定了潜在的 miR-642a-5p 靶向位点。随后,我们利用 psiCHECK2 载体构建了野生型(WT)和突变型(Mut)的 3'UTR 版本,后者缺少 miR-642a-5p 的靶向位点(图 7E)。荧光素酶检测结果表明,转染了野生型 PTEN 3'UTR 的 THP-1 细胞在加入 miR-642-5p 抑制剂后荧光素酶活性显著增加,而在过表达 miR-642-5p 时则降低。相反,转染突变型 PTEN 3'UTR 的 THP-1 细胞中的荧光素酶活性基本保持不变(图 7F)。
鉴于 BLCA 细胞中 miR-642a-5p 的表达受 ERα 影响(图 7B),我们进行了 CHIP 检测,以探究 ERα 是否能通过与 miR-642a-5p 的启动子结合来转录调控其表达。我们还研究了位于 miR-642a-5p 启动子区域内的三个预测的雌激素反应元件(ERE),这些元件可能与 ERα 结合。结果表明,ERE1 可能是最有前景的候选者(图 6A-B)。随后,我们进行了荧光素酶报告基因检测,使用含有野生型(WT)或突变型(Mut)ERE1 的 pGL3 报告质粒来验证 ERE1 的功能(图 6C)。荧光素酶检测结果表明,在 ERα 过表达组中,野生型报告基因转染组的荧光素酶活性显著增加,而在 ERα 去除组中则急剧下降。相比之下,突变组未观察到变化(图 6D)。
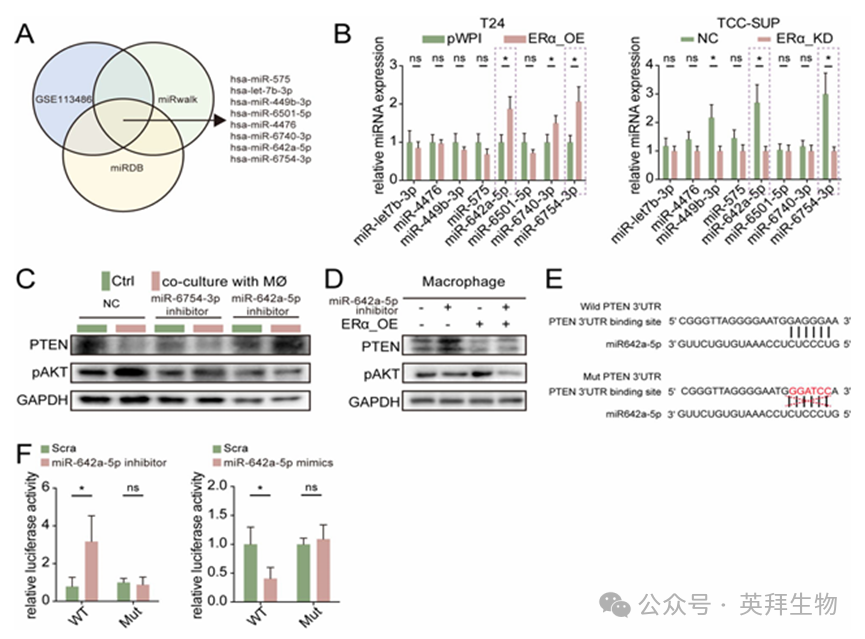
图7.ERα调节的 miR-642a-5p 通过靶向PTEN mRNA 的3'UTR 作用,下调了 PTEN/pAKT 通路
8.临床前小鼠模型研究证实,靶向ERα通过阻碍M2巨噬细胞极化和VM形成来抑制肿瘤进展
为验证上述发现,我们构建了一个体内异种移植小鼠模型。将TCC-SUP 细胞和 THP-1 细胞一起皮下注射到小鼠的两侧背部,并对肿瘤荷瘤小鼠每隔3 天通过尾静脉给予来自共同培养的 TCC-SUP 细胞的外泌体或PBS(作为对照)进行治疗,持续两周。为了针对上述小鼠模型中的ERα 进行靶向治疗,每隔一天通过腹腔注射其拮抗剂ICI-182,780 或DMSO,持续 4 周,直至小鼠达到治疗终点(图8A)。根据不同的治疗方式,将小鼠分为四组:PBS + DMSO 组、PBS + ICI-182,780组、外泌体 + DMSO 组和外泌体+ ICI-182,780组(每组 6 只)。各组的肿瘤生长率和肿瘤生长曲线显示,来自共同培养的BLCA 细胞的外泌体显著促进了肿瘤生长,而通过 ICI-182,780抑制 ERα 可以减少肿瘤生长(图8B、C)。免疫组化染色分析的结果证实,肿瘤细胞衍生的外泌体通过上调CDH-5 表达促进了 VM 的形成,并促进了TAMs 的 M2 型极化。此外,通过添加ICI-182,780 来抑制ERα,显著减少了由 BLCA 小鼠模型(使用TCC-SUP 和 THP-1 系统构建)中CDH5 控制的VM形成以及M2 型极化现象(图 8D、E)。
为进一步验证miR-642a-5p 在体内的作用是否与我们在体外的研究结果相符,我们进行了另一项异种移植动物实验。在该实验中,我们将三种不同的组合分别注射到小鼠的侧腹壁:单独的TCC-SUP 细胞、转染了 pLKO 载体的TCC-SUP 细胞与 THP-1 细胞的组合,以及转染了pLKO-miR-642a-5p 抑制剂的TCC-SUP 细胞与 THP-1 细胞的组合。六周后,我们观察到,与TCC-SUP 细胞或TCC-SUP-pLKO-miR-642a-5p 抑制剂+ THP-1 细胞所产生的肿瘤相比,TCC-SUP-pLKO + THP1 细胞的联合注射导致肿瘤明显更大。重要的是,与其他两组相比,TCC-SUP-pLKO-miR-642a-5p抑制剂 + THP-1 细胞的联合注射显著抑制了肿瘤生长(图8F)。此外,免疫组化染色显示,miR-642a-5p 的抑制减少了巨噬细胞诱导的IL-17A 表达和 M2 极化,从而减少了体内ERα 调控的VM的形成(图8G-H)。
综上所述,这些结果表明,巨噬细胞通过诱导BLCA 中 ERα 表达的上调来促进肿瘤生长和VM的形成。相反,ERα会促进巨噬细胞向 M2 型极化,并通过上调miR-642a-5p(该miRNA 由 BLCA 细胞的外泌体转运)来增加巨噬细胞中IL-17A 的表达。此外,本研究还表明,在 BLCA 微环境中,巨噬细胞与癌细胞之间存在一个由ERα 介导的反馈回路,这显著促进了 BLCA 的进展(图9)。
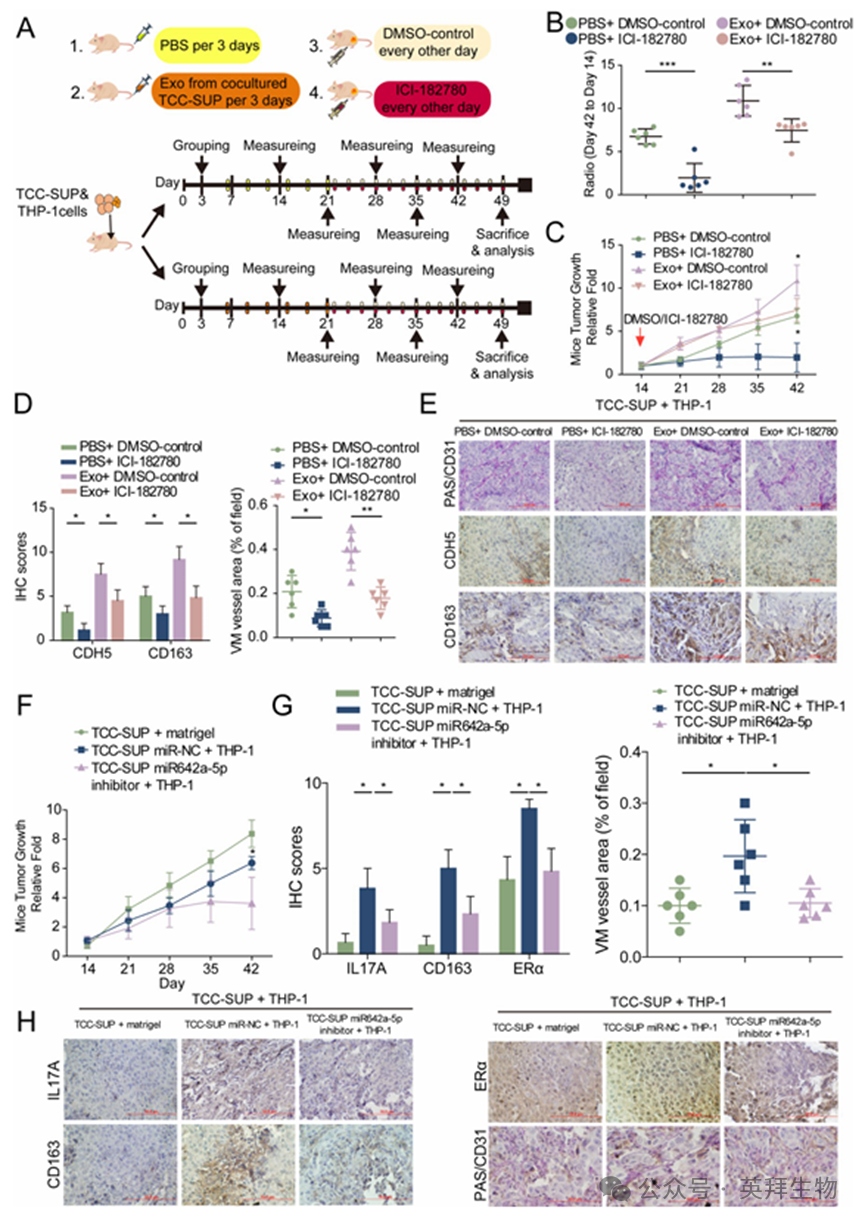
图8.在体内,靶向ERα通过抑制M2巨噬细胞极化和VM形成来抑制肿瘤进展
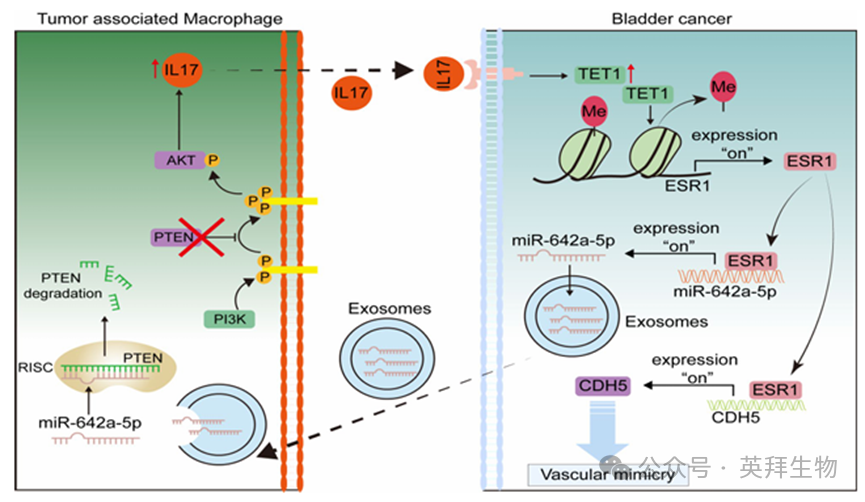
图9.BLCA微环境中巨噬细胞与癌细胞之间的反馈回路示意图
结论
总之,巨噬细胞诱导的 BLCA 中的 ERα 通过转录上调 CDH5 来促进血管生成瘤的形成。ERα 表达的增加随后通过肿瘤来源的外泌体所携带的 miR-642a-3p 促进 M2 型极化。因此,针对这一新发现的信号通路的治疗策略可能对 BLCA 患者的治疗具有重要意义。
参考文献
Liu Q, Wang J, Gao S, Li Z, Zhang W, Liu W, Liu B, Dong G, You B. ERα-dependent crosstalk between macrophages and cancer cells potentiates vasculogenic mimicry and M2 macrophage polarization in bladder cancer. Cell Commun Signal. 2025 Jul 15;23(1):339. doi: 10.1186/s12964-025-02297-7. PMID: 40665298; PMCID: PMC12261844.






