肥胖与减肥对癌症防治的影响:TREM2缺乏在瘦小鼠中独特地减弱乳腺癌生长并改变克隆T细胞群
肥胖是乳腺癌发展和预后不良的一个确定的危险因素。乳腺肿瘤周围的脂肪环境在肥胖中被炎症化,这与肿瘤的进展有关,而髓样细胞上表达的触发受体2 (TREM2)是脂肪组织和肿瘤中巨噬细胞上表达的跨膜受体,是一个新兴的癌症治疗靶点。为更好地了解肥胖与乳腺癌关联的机制以及减肥的潜在益处,作者利用瘦、肥胖和减肥小鼠模型来研究TREM2缺乏对绝经后乳腺癌的影响。TREM2缺乏抑制了瘦小鼠的肿瘤生长,但在肥胖或减肥小鼠中没有效果。肿瘤和肿瘤邻近乳腺脂肪组织免疫细胞的单细胞RNA测序,结合可变多样性连接测序,揭示了不同模型中免疫景观的差异。瘦TREM2缺陷小鼠的肿瘤表现出克隆性CD8+ T细胞从衰竭状态向效应记忆状态的转变,并伴有CD4+ Th1细胞克隆性的增加,这在任何其他饮食基因型组中都没有观察到。值得注意的是,在同一只小鼠的肿瘤和肿瘤邻近乳腺脂肪组织中发现了相同的T细胞克隆型。最后,抗PD-1治疗抑制了瘦小鼠和减肥小鼠的肿瘤生长,但在肥胖小鼠中没有。这些发现表明,体重史可能影响绝经后乳腺癌TREM2抑制的效果。肿瘤和周围脂肪组织之间的免疫相互作用在肥胖和减肥条件下突出了显著差异。该文章于2025年4月发表在《Cancer Research》,IF:12.5。
摘要图:
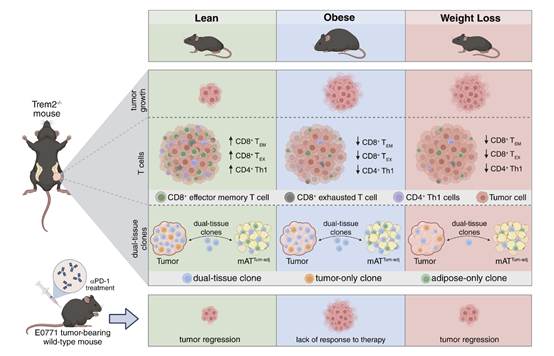
主要研究结果:
1. 绝经后乳腺癌的瘦、肥胖和减肥模型
为了建立绝经后乳腺癌的肥胖和减肥模型,选择了C57BL/6J小鼠品系,因为它有肥胖倾向,并已在代谢研究中建立了应用。在6周龄时,切除小鼠卵巢,以鼠粮喂养2周。随后,瘦小鼠喂食低脂饲料23至24周,肥胖小鼠喂食低脂饲料12周,然后在研究的剩余时间内改为高脂饲料,减肥小鼠喂食高脂饲料12周,然后再喂食低脂饲料(图1A)。每周记录食物摄入量。肥胖和体重减轻可以从身体和oAT质量的变化中看出(图1B和C),终点子宫萎缩证实卵巢切除术成功(图1D)。葡萄糖耐量测试在11周(任何饮食转换之前)和19周的饮食后进行。在服用HFD 11周后,与服用LFD的小鼠相比,减肥组已经肥胖,并且表现出更差的葡萄糖耐量。在第19周的时间点,肥胖组表现出更差的葡萄糖耐量,而减肥小鼠的葡萄糖清除率与瘦对照组相匹配(图1E)。20周后注射E0771细胞,监测肿瘤3周。这种饮食模式赋予了一个重要的优势:瘦鼠、肥胖鼠和减肥鼠在注射肿瘤细胞时处于相同的年龄,这使得从同一批细胞注射肿瘤细胞能够最大限度地减少实验差异。这允许在每个实验组中同时监测肿瘤。肥胖小鼠肿瘤体积和肿瘤质量显著增加,而减肥小鼠与瘦组无显著差异(图1F-H)。
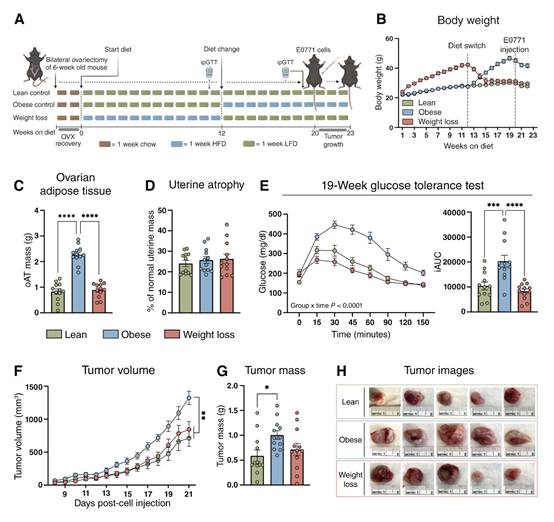
图1 在绝经后乳腺癌模型中,减肥可挽救肿瘤生长
2. 在表达TREM2的mATTum-adj中,LAM标记物上调并与肿瘤质量呈正相关
脂肪组织中的LAM与肥胖有关,并且肿瘤中表达TREM2的巨噬细胞的免疫抑制性质已被报道。因此,作者将先前文献中鉴定的LAM基因在瘦弱、肥胖和减肥小鼠肿瘤中的表达进行了量化。对肿瘤中的CD11b+细胞进行磁分选(图2A)。LAM基因在肿瘤来源的CD11b+细胞中的表达在饮食组之间没有差异(图2B)。接下来,在mATTum-adj和mATContra中对LAM基因进行定量分析(图2C)。与瘦的mATContra相比,肥胖的mATContra中只有TREM2的表达增加。然而,与瘦mATTum-adj和减肥mATTum-adj相比,肥胖mATTum-adj的TREM2和Plin2增加。肥胖的mATTum-adj比瘦的mATTum-adj Cd36增加。此外,在肥胖和减肥组中,相对于mATContra, mATTum-adj中的TREM2、Plin2和Cd36表达上调(图2D-F)。为了确定肿瘤生长与LAM基因表达之间是否存在关系,作者进行了mAT LAM基因与肿瘤大小的相关性分析。在mATContra中,TREM2、Plin2或Cd36的表达与肿瘤质量没有相关性(图2G和H);然而,在mATTum-adj中,TREM2和Plin2基因的表达与肿瘤质量呈正相关(图2G和H)。
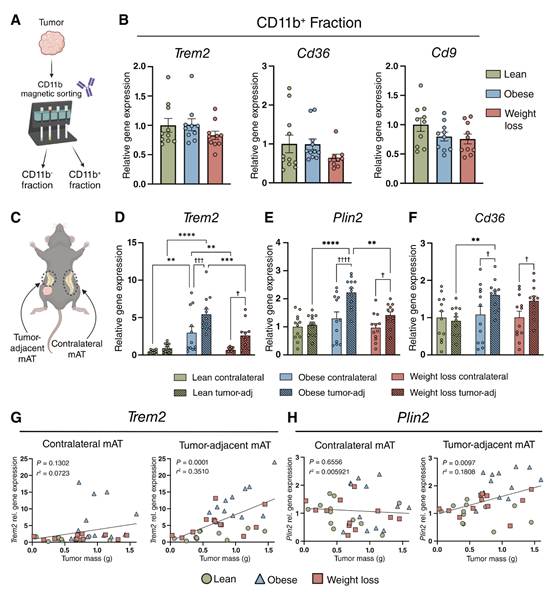
图2 LAM标记基因在肥胖的mATTum-adj中增加,并与肿瘤质量呈正相关
3. 在绝经后乳腺癌模型中,TREM2缺乏可降低肿瘤生长
在各种癌症模型中,TREM2缺乏或用抗TREM2单抗治疗可降低肿瘤生长。为了确定TREM2消融是否能减缓绝经后乳腺癌的肿瘤生长,作者切除了TREM2 +/+和TREM2 -/-雌性C57BL/6J小鼠的卵巢,并以鼠粮喂养(图3A)。正如预期的那样,TREM2-/-动物血浆中不存在sTREM2(图3B)。基因型之间的体重、葡萄糖耐量(图3C)或终点oAT和mAT质量均无差异。卵巢切除术后25周,注射E0771PD-L1细胞,监测肿瘤4周。所有TREM2-/-小鼠都出现了可触及的肿瘤,而只有一只TREM2+/+小鼠没有。与TREM2+/+对照组相比,TREM2-/-小鼠的肿瘤体积和肿瘤质量均显著降低(图3D和E)。TREM2-/-小鼠的oAT中Cd36基因表达显著降低,Plin2和Cd9基因表达略有降低(图3F)。oAT中M1样和M2样巨噬细胞标志物Nos2和Arg1均降低(图3F)。TREM2-/- mATTum-adj表现出从小(直径μm)脂肪细胞向大(直径70-99 μm)脂肪细胞的转变(图3G-I)。先前关于雄性附睾脂肪组织的报道表明,TREM2缺陷小鼠的脂肪细胞严重肥大;然而,这些数据首次表明TREM2缺乏也会导致女性皮下脂肪组织库中的脂肪环境失调。
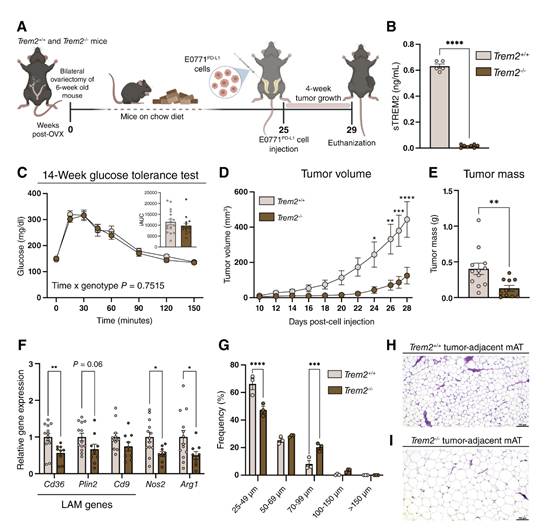
图3 在经周喂养的绝经后乳腺癌模型中,TREM2消融可减缓肿瘤生长,减少LAM,并增加脂肪细胞肥大
4. TREM2消融术在瘦弱动物中减弱肿瘤生长,但在肥胖或减肥动物中没有
为了评估在肥胖和体重减轻的情况下TREM2消融对肿瘤生长的影响,将切除卵巢的雌性TREM2 +/+和TREM2 -/-小鼠置于LFD和HFD组,形成瘦、胖和减肥组,并在饮食20周后注射E0771 PD-L1。在每个饮食组中,基因型之间的体重轨迹没有差异(图4A)。与瘦和减肥TREM2+/+小鼠相比,肥胖TREM2+/+小鼠的血浆中sTREM2水平升高,而TREM2-/-小鼠的血浆中没有sTREM2(图4B)。与瘦TREM2+/+对照相比,瘦TREM2-/-小鼠的肿瘤生长减弱,这一点可以通过终点肿瘤质量和体积随时间的变化来证明(图4C和D)。然而,TREM2缺乏并没有减少肥胖或减肥小鼠的肿瘤生长(图4C、E和F)。
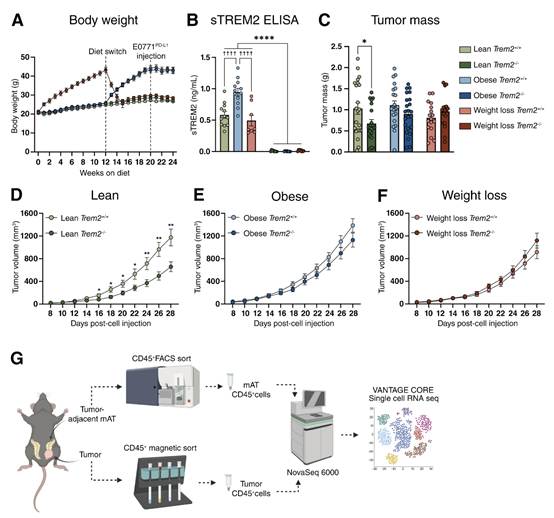
图4 瘦但不是肥胖或减肥,TREM2-/-小鼠表现出肿瘤生长减少
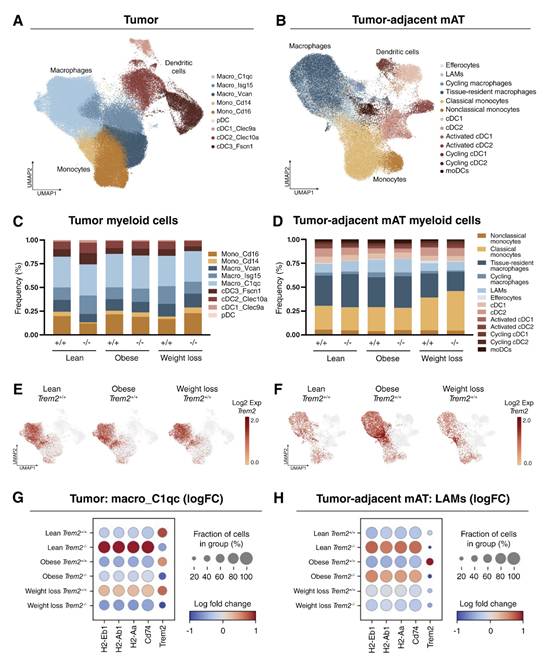
图5 用scRNA-seq分析肿瘤骨髓群和mATTum-adj
5. scRNA-seq显示,瘦TREM2-/-小鼠肿瘤相关巨噬细胞中抗原呈递基因的表达增加
为了探索肿瘤的免疫学景观和mATTum-adj,作者对CD45+免疫细胞进行了scRNA-seq(图4)。UMAP分析在肿瘤中鉴定了21个簇,在mATTum-adj中鉴定了33个簇,显示了每个簇的前3个DEGs。由于TREM2在骨髓细胞上表达,来自两种组织的骨髓群体被亚群化并重新聚集(图5A和B),并计算了每个组织内每个细胞群体的频率(图5C和D)。观察到骨髓群体的一些变化,特别是在瘦TREM2-/-肿瘤中,与瘦TREM2+/+肿瘤相比,Mono_Cd16集群减少,cDC3_Fscn1和Macro_Isg15集群增加(图5C)。作者的RT-PCR数据显示,整个肿瘤的TREM2表达不受肥胖或体重减轻的影响(图2B)。在作者的scRNA-seq数据集中,TREM2主要在Macro_C1qc亚群中表达,这是一个更促炎的巨噬细胞群,参与抗原呈递,在肿瘤的饮食组之间没有变化(图5E)。然而,在mATTumadj中,肥胖增加了巨噬细胞中TREM2的表达,正如在其他脂肪组织库中发生的那样(图5F)。在肿瘤Macro_C1qc群体中测定瘦TREM2+/+和瘦TREM2-/-之间的前5个deg,随后在所有实验组中进行评估(图5G)。与瘦TREM2+/+组相比,瘦TREM2-/- Macro_C1qc(肿瘤)和LAM (mATTum-adj)群体中,前5个DEGs中的4个,H2-Eb1、H2-Ab1、H2-Aa和Cd74相对增加(图5H)。这些基因是抗原呈递的组成部分,这将作者的重点放在T细胞群上。
6. 克隆T细胞群在瘦的TREM2-/-小鼠肿瘤中从疲惫状态转变为效应状态,而不是肥胖或减肥小鼠
肿瘤T细胞群的初步分析包括细胞比例和频率(图6A和B),以及肿瘤T细胞群的亚聚类(图6C)。在瘦小鼠中,与TREM2+/+对照相比,TREM2-/-肿瘤显示CD8+ TEM和CD4+ Th1细胞增加。在肥胖小鼠中,与TREM2+/+相比,这两种T细胞群在TREM2-/-中增加;然而,与瘦肉对照组相比,两种基因型均表现出明显降低的细胞/肿瘤比例。在减肥组中,与饮食匹配的对照组相比,TREM2-/-中的CD8+ TEM和CD4+ Th1细胞减少(图6A和B)。由于T细胞克隆扩增是靶向肿瘤细胞的必要条件,通过克隆细胞计数投影到按饮食和基因型分裂的重组肿瘤T细胞UMAP上,可以看到肿瘤T细胞的克隆性(图6D-I)。在瘦TREM2+/+肿瘤中发现了高度克隆的耗尽CD8+ T细胞(TEX)群体(图6D),而瘦TREM2-/-小鼠的肿瘤则含有高度克隆的CD8+ TEM和CD4+ Th1群体(图6E)。在肥胖动物中,总体克隆群体较少;然而,这两种基因型都含有一些克隆性CD8+ TEX和CD8+ TEM(图6F和G)。在减肥动物中,TREM2+/+肿瘤含有强大的克隆性CD8+ TEX群体,而TREM2-/-肿瘤显示出总体克隆性显著降低(图6H和I)。引人注目的是,在瘦TREM2-/-肿瘤中丰富的高度克隆性CD4+ Th1细胞在其他饮食基因型组中不存在。这表明这些细胞可能在抑制瘦TREM2-/-小鼠肿瘤生长中起关键作用。将T细胞克隆分成单克隆体和低、中等或高克隆体,增强了瘦TREM2-/-肿瘤中CD4+ Th1细胞的增加(图6J)。在瘦和肥胖组中,与饮食匹配的TREM2+/+对照组相比,克隆水平分组统计还强调了TREM2-/-小鼠中高克隆CD8+ TEM的扩增;然而,在减肥动物中没有观察到这种强劲的扩张。考虑到饮食组和基因型组之间肿瘤T细胞克隆性的巨大差异,并考虑到脂肪组织微环境的影响,作者接下来研究了肿瘤和mATTum-adj内的克隆型。
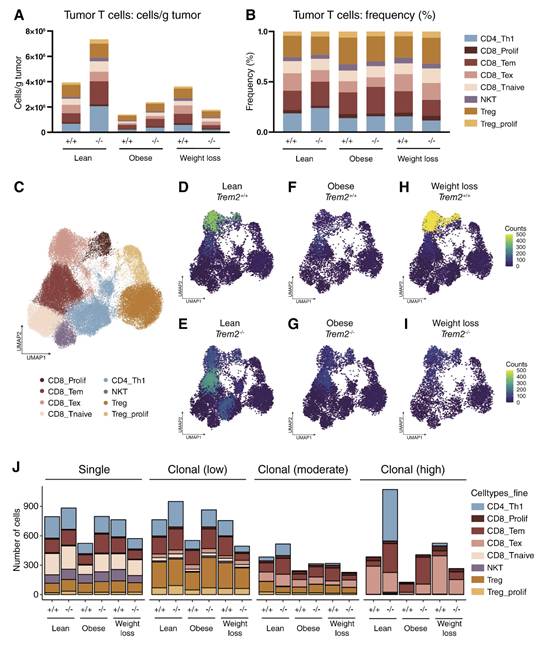
图6 肿瘤T细胞克隆的可视化和分类显示,在瘦TREM2-/-肿瘤中,高度克隆的CD4+ Th1细胞扩增
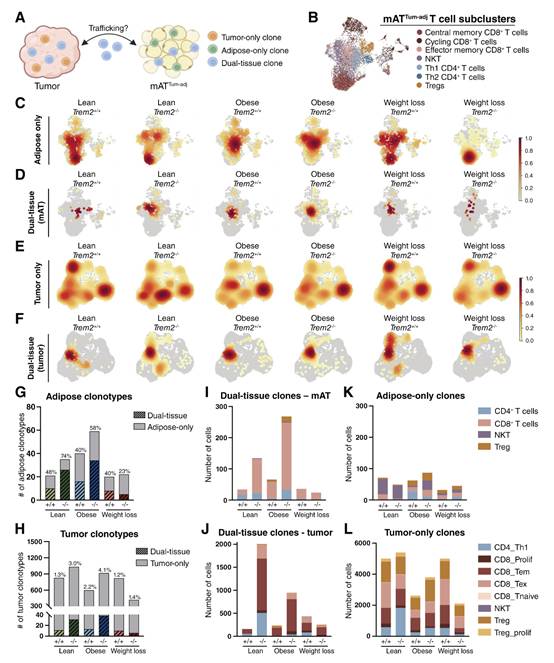
图7 肿瘤及mATTum-adj双组织克隆的鉴定
7. 肿瘤与mATTum-adj相同克隆型的鉴定
克隆扩增的T细胞既可以存在于肿瘤组织中,也可以存在于脂肪组织中,但两者之间是否存在任何共享的克隆是未知的。通过对TCRβ的β链进行测序,作者根据互补决定区3确定了克隆型。T细胞克隆被分为三组:肿瘤克隆,它们只在肿瘤中被识别;仅存在于mATTum-adj;和双组织克隆,通过在肿瘤和mATTum-adj中存在相同的TCRβ来鉴定(图7A)。为了可视化每个类别中代表的T细胞亚群,在脂肪组织中鉴定的脂肪克隆和双组织克隆的热图被投影到mATTum-adj T细胞UMAP上,如图7B-D所示。同样,将肿瘤中发现的肿瘤克隆和双组织克隆(图7E和F)投影到肿瘤T细胞UMAP上,如图6C所示。单组织克隆分布在每个饮食基因型组中所有鉴定的T细胞群中(图7B-D)。瘦TREM2+/+肿瘤主要含有CD8+ TEM双组织克隆,而瘦TREM2-/-肿瘤显示双组织克隆分布在CD8+ TEX、CD8+ TEM和CD4+ Th1人群中(图7E)。两个肥胖基因型组在肿瘤中主要存在CD8+ TEM双组织克隆(图7E)。然而,减肥动物表现出与瘦动物不同的表型,其中TREM2+/+肿瘤在CD8+ TEX、CD8+ TEM和CD4+ Th1群体中表现出双组织克隆的扩散,TREM2-/-肿瘤主要包含CD8+ TEM克隆(图7E)。mATTum-adj双组织克隆的热图显示,与TREM2+/+饮食匹配的对照组相比,苗条和肥胖的TREM2-/- mATTum-adj表现出更多的双组织克隆;然而,两个减肥组都显示mATTum-adj内双组织克隆的减少(图7F)。
随后,作者量化了mATTum-adj中仅脂肪克隆型和双组织克隆型的数量。该分析显示,在几乎每一组中,至少40%在mATTum-adj中鉴定的克隆型也在肿瘤中发现(图7G)。该分析还显示,与饮食匹配的TREM2+/+对照相比,瘦和肥胖TREM2-/- mATTum-adj的双组织克隆型增加,同时两个减肥组的克隆型数量显著减少。肿瘤中克隆型的定量显示,在mATTum-adj中也检测到明显较小比例的克隆型(图7H)。此后,作者量化了每个组织中克隆型的细胞计数,并使用mATTum-adj中的粗T细胞聚类和肿瘤中的细T细胞聚类进一步分类数据。在mATTum-adj中,与瘦TREM2+/+对照相比,瘦TREM2-/-样品中的双组织CD8+ T细胞增加,肥胖TREM2-/-动物中的双组织CD8+ T细胞进一步增加。相比之下,减肥组TREM2-/- mATTum-adj中CD8+ T细胞的数量比减肥组TREM2+/+ mAT中减少(图7I)。同时,在肿瘤中,与饮食匹配的TREM2+/+肿瘤相比,瘦和肥胖TREM2-/-肿瘤中双组织CD8+ TEM、CD8+ TEX和CD4+ Th1细胞计数显著增加,瘦TREM2-/-肿瘤中双组织T细胞数量最多(图7J)。与mATTum-adj相似,减肥肿瘤在TREM2-/-动物中表现出双组织T细胞的减少(图7J)。脂肪克隆细胞计数主要由自然杀伤T细胞(NKT)和Treg克隆组成,表明NKT和Treg群体主要局限于mATTum-adj。相反,CD8+ T细胞似乎更有可能被鉴定为mATTum-adj和肿瘤之间的双组织克隆(图7K)。相比之下,在肿瘤克隆细胞计数分析中,每个饮食基因型组拥有所有T细胞群(图7L)。
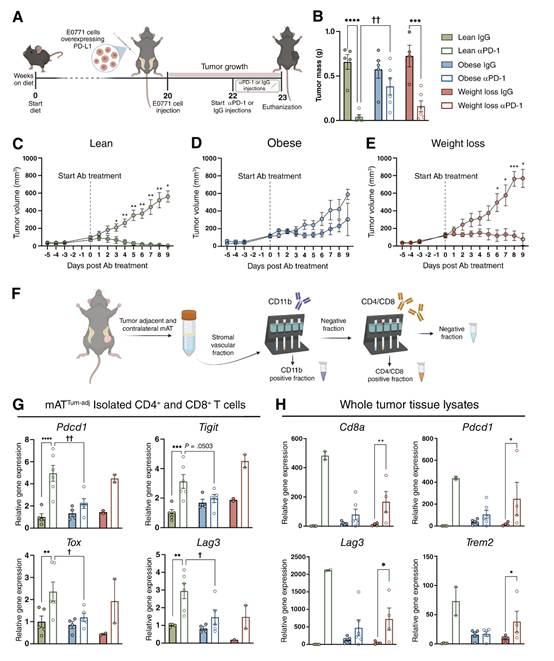
图8 肥胖小鼠对αPD-1治疗没有反应,也没有表现出mATTum-adj或肿瘤中T细胞激活标记物的增加
8. 肥胖小鼠对αPD-1治疗有抗性,并且没有表现出活化T细胞的增加
黑色素瘤和非小细胞肺癌的临床研究表明,肥胖可能会导致免疫检查点抑制剂的“矛盾效应”,肥胖患者的反应比瘦患者更有利;然而,这在绝经后乳腺癌或减肥的情况下还没有得到很好的研究。与肥胖小鼠的肿瘤相比,来自TREM2+/+瘦和减肥小鼠的肿瘤每克肿瘤中所有T细胞群的数量更高,高克隆CD8+ TEX细胞的丰度更高(图6A和J)。为了研究肥胖和减肥对绝经后乳腺癌模型中αPD-1治疗的影响,作者制作了切除卵巢的瘦、肥胖和减肥组,记录食物摄入量和体重。在20周时给小鼠注射E0771PD-L1细胞,在肿瘤监测的最后8天注射IgG或αPD-1抗体(图8A)。瘦小鼠对αPD-1治疗有反应,表现为肿瘤质量和体积减小,多只小鼠的肿瘤质量和体积完全消退(图8B和C)。肥胖IgG组和αPD-1治疗组在任何时间点的肿瘤质量/体积均无统计学差异(图8B和D)。然而,减肥小鼠对αPD-1治疗也有反应,表现为肿瘤质量和体积减小(图8B和E)。通过分离和顺序磁分选从mATTum-adj中分离出CD11b+细胞和T细胞(图8F)。与瘦IgG处理组相比,瘦αPD-1处理的mATTum-adjT细胞中T细胞活化标志物Pdcd1、Tigit、Tox和Lag3的基因表达增加(图8G)。在肥胖组内,抗体治疗组间T细胞活化标记物表达无差异;然而,与瘦α PD -1处理的动物相比,肥胖α PD-1处理组的Pdcd1、Tox和Lag3表达降低(图8G)。肿瘤全组织裂解物显示,减肥αPD-1治疗组Cd8a、Pdcd1、Lag3和TREM2均升高,肥胖组无差异(图8H)。此外,在分离的CD11b+细胞中,LAM基因TREM2、Plin2和Cd36的表达在肥胖的mATTum-adj和mATContra中复制了LAM的增加,而αPD-1治疗不受影响。
结论:
通过研究不同背景下的肥胖和体重减轻,包括TREM2缺乏和免疫检查点治疗,并评估所有研究中的肿瘤和周围脂肪组织,获得了体重史对脂肪组织和肿瘤微环境影响的重要见解。本研究的数据表明这些组织之间存在潜在的串扰,可能涉及T细胞运输。这些发现表明,体重史是临床医生在患者护理中考虑的一个关键因素,因为它的影响可能因具体的临床情况而异。
实验方法:
TREM2+/+和TREM2−/−研究、肿瘤细胞植入、野生型小鼠研究、体组成和糖耐量试验、磁性分选、IgG和αPD-1给药、可溶性TREM2定量、脂肪组织间质血管组分分离、肿瘤单细胞解离、scRNA-seq、scRNA-seq数据处理、降维和数据整合、无监督聚类和细胞注释、差异表达分析、RNA分离、cDNA合成和RT-PCR
参考文献:
Pierro, E. W., Cottam, M. A., An, H., Lehmann, B. D., Pietenpol, J. A., Wellen, K. E., Makowski, L., Rathmell, J. C., Fingleton, B., & Hasty, A. H. (2025). Comparison of Lean, Obese, and Weight-Loss Models Reveals TREM2 Deficiency Attenuates Breast Cancer Growth Uniquely in Lean Mice and Alters Clonal T-cell Populations. Cancer research, 85(7), 1219–1235.






