TRIM3/TLR3轴克服IFN-β的反馈抑制作用,从而抑制非小细胞肺癌的进展
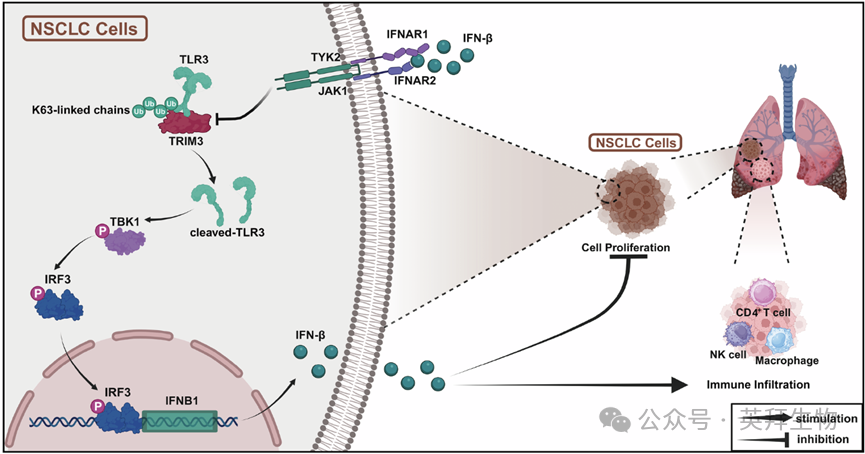
干扰素-β(IFN-β)具有强大的抗肿瘤活性,但其临床治疗潜力受到抑制IFN-β产生的内在负反馈环路的影响。然而,调控非小细胞肺癌(NSCLC)中IFN-β稳态的反馈机制仍不明确。本研究发现,三重基序蛋白3(TRIM3)可促进IFNB1的转录及mRNA表达。相反,过量的IFN-β会抑制TRIM3的表达,形成二者的相互反馈环路。质谱分析显示,触发IFN-β产生的关键传感器——Toll样受体3(TLR3)是TRIM3的相互作用伙伴。在阐明TRIM3与TLR3的相互作用模式后,作者发现激活TRIM3/TLR3轴可诱导IFN-β分泌,并突破该反馈抑制。持续的IFN-β分泌随后通过提高CD4+T细胞、M1型巨噬细胞和自然杀伤(NK)细胞的浸润水平,抑制NSCLC细胞增殖并重塑肿瘤微环境。本研究结果揭示了IFN-β信号调控中的相互负反馈环路,强调了TRIM3/TLR3轴在抑制NSCLC进展中的作用,并为抑制肿瘤生长和提高NSCLC免疫治疗效果提供了一种有前景的策略。这篇文章于2026年1月发表于《Cell Death & Disease》期刊上,IF:9.6。
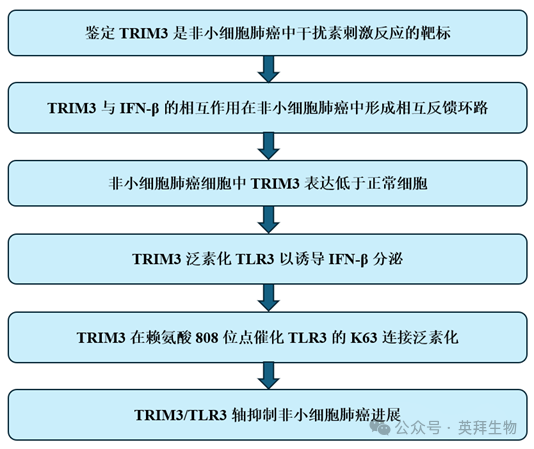
研究技术路线:
主要实验结果:
1、鉴定TRIM3是非小细胞肺癌中干扰素刺激反应的靶标
为鉴定与干扰素分泌相关的潜在泛素修饰酶,作者对GEO数据库中干扰素刺激的肺癌细胞RNA测序数据集进行了筛选。GSE226667数据集揭示了经复合干扰素处理的A549肺癌细胞全基因组表达谱。作者选取排名前500的差异表达基因(DEGs),并与655个已知的泛素-蛋白酶体系统相关基因进行交集分析,得到7个干扰素应答候选基因(图1A、B)。在这些基因中,由于TRIM3在非小细胞肺癌(NSCLC)中的表达差异最为显著,因此被选为进一步研究的对象。TRIM3 mRNA的表达在包括肺腺癌(LUAD)和鳞状细胞癌(LUSC)在内的大多数癌症类型中也显著下调(图1C)。在多种肿瘤的皮下肿瘤模型中,与程序性死亡受体1(PD-1)、程序性死亡配体1(PD-L1)、细胞毒性T淋巴细胞相关蛋白4(CTLA-4)抑制剂或其他细胞因子的应答不同,在路易斯肺癌(LLC)模型中,TRIM3 mRNA表达仅在干扰素-β(IFN-β)刺激后降低(图1D、E)。这些发现表明,TRIM3在NSCLC中对IFN-β刺激表现出独特的应答。
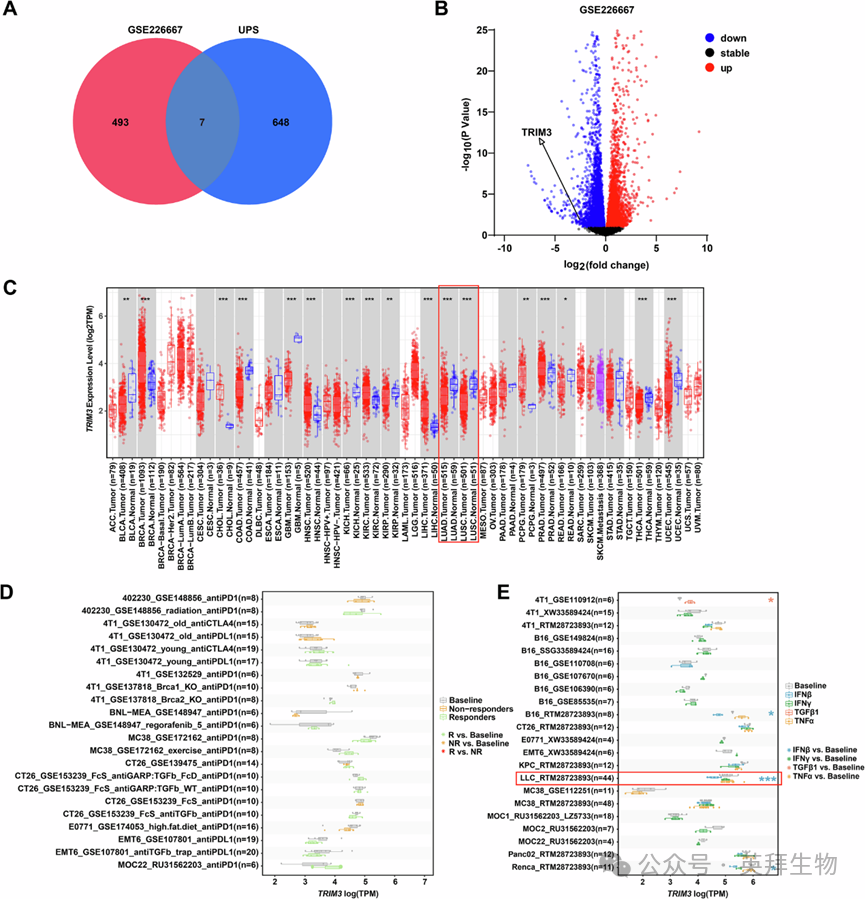
Fig. 1 鉴定TRIM3是非小细胞肺癌中干扰素刺激反应的靶标
2、TRIM3与IFN-β的相互作用在NSCLC中形成相互反馈环路
基于LLC小鼠模型中TRIM3 mRNA表达在IFN-β刺激后下调这一发现,作者接下来进行了体外实验,以验证IFN-β对TRIM3表达的影响。IFN-β刺激后,H1299、PC-9和A549细胞中TRIM3 mRNA表达下调(图2A)。使用酪氨酸激酶2(TYK2)抑制剂BMS-986165抑制I型IFN通路,以及通过基因敲除干扰素α和β受体亚基1(IFNAR1)和IFNAR2,均逆转了这种抑制作用,恢复了A549、H1299和PC-9细胞中TRIM3蛋白和mRNA的水平(图2B-D和S2A-C)。基于已有研究报道的I型IFN与泛素修饰酶之间的负反馈作用,作者推测TRIM3可能反过来调控IFN-β的产生。慢病毒介导的TRIM3敲除或过表达实验表明,TRIM3表达增加会提高IFNB1 mRNA水平,而其缺失则会降低A549、H1299和PC-9细胞中的IFNB1水平(图2E-H)。荧光素酶报告基因实验进一步证实了TRIM3依赖的IFNB1启动子转录激活(图2I-L)。这些发现表明,尽管TRIM3在NSCLC中增强IFNB1的转录,但过量的IFN-β会通过反馈抑制来抑制TRIM3的表达。
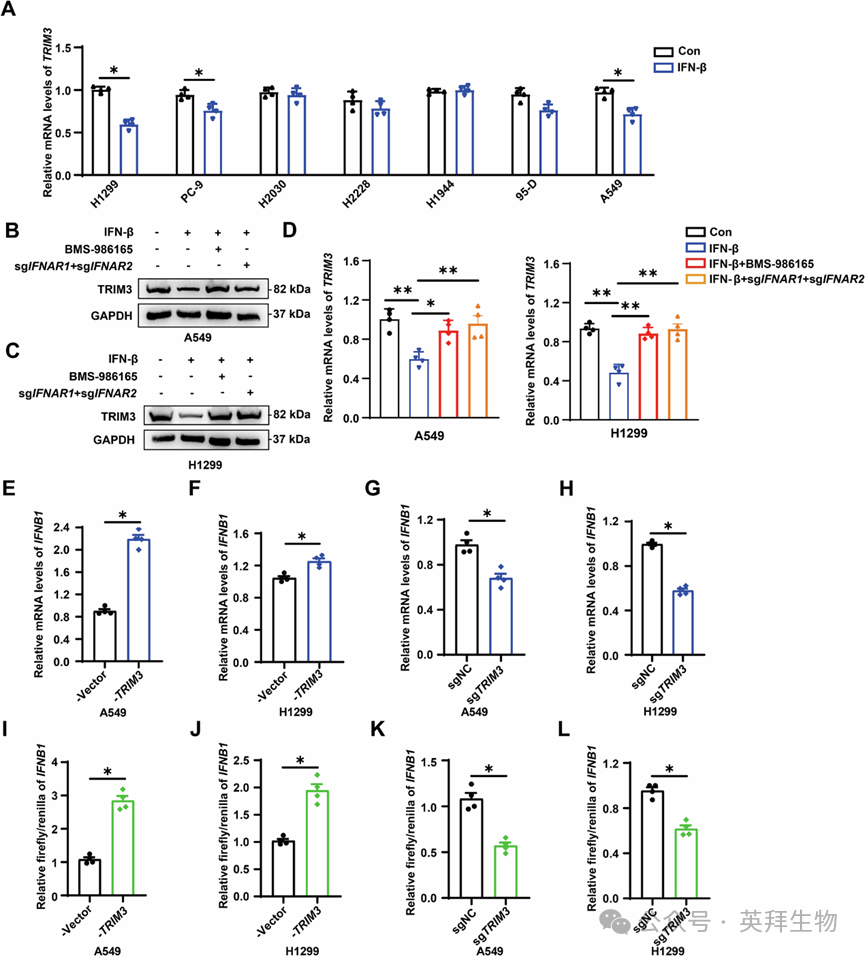
Fig. 2 TRIM3与IFN-β的相互作用在非小细胞肺癌中形成相互反馈环路
3、NSCLC细胞中TRIM3表达低于正常细胞
为研究TRIM3在NSCLC进展中的作用,作者首先分析了其在不同肿瘤分期和淋巴结转移状态(N分期)的肺腺癌(LUAD)和肺鳞癌(LUSC)患者中的mRNA水平。在LUAD和LUSC中,随着肿瘤分期和N分期的增加,TRIM3 mRNA表达逐渐降低(图3A-F)。蛋白质印迹法(WB)和实时定量聚合酶链反应(qPCR)分析证实,肺癌细胞中的TRIM3表达低于正常的BEAS-2B支气管上皮细胞(图3G、H)。与这些发现一致,人NSCLC组织的免疫组织化学结果显示,肿瘤组织中的TRIM3蛋白水平低于邻近的正常组织(图3I)。值得注意的是,TRIM3表达降低与NSCLC患者的不良临床结局呈正相关(图3J)。此外,在LUAD和LUSC中,TRIM3表达与肿瘤浸润性CD4+T细胞、巨噬细胞和自然杀伤(NK)细胞的数量呈正相关,这表明TRIM3在促进免疫细胞向肿瘤微环境募集方面发挥作用(图3K-P和S3)。综上所述,这些数据表明TRIM3在NSCLC进展中具有抑癌作用。然而,细胞计数试剂盒-8(CCK-8)和集落形成实验结果显示,TRIM3的过表达或敲除均不影响H1299和A549细胞的增殖能力。综上,上述发现表明,如前所述,IFN-β对TRIM3的反馈抑制可能会抑制TRIM3对NSCLC进展的抑制作用。
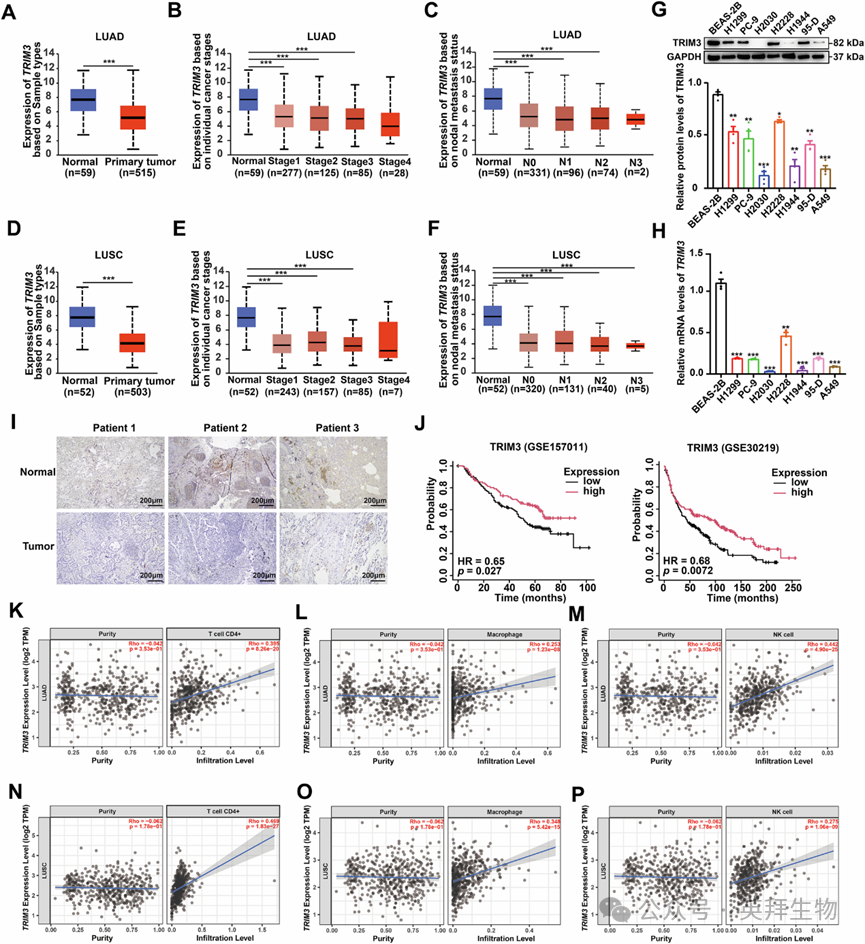
Fig. 3 非小细胞肺癌细胞中TRIM3表达低于正常细胞
4、TRIM3泛素化TLR3以诱导IFN-β分泌
为研究调控IFN-β分泌和打破反馈抑制的机制,作者在H1299细胞中过表达TRIM3后,进行了免疫共沉淀(Co-IP)实验结合质谱分析,从而系统地绘制TRIM3相互作用组。根据独特肽段计数对免疫沉淀中富集的蛋白质进行排序,并将排名前100的候选蛋白与通过GeneCards鉴定的排名前100的IFNB1相关蛋白进行交叉比对(图4A)。Toll样受体3(TLR3)是触发IFN-β产生的关键双链RNA(dsRNA)传感器,且已知其受到泛素依赖性调控,最终成为仅有的重叠基因。TLR3可被合成dsRNA类似物聚肌苷酸-聚胞苷酸(poly(I:C))激活。双向Co-IP实验验证了A549和H1299细胞中TRIM3与TLR3的体外物理相互作用(图4B-E和S5)。邻近连接测定(PLA)信号(红色)证实了A549和H1299细胞中TRIM3与TLR3的相互作用(图4F)。与其他TRIM家族泛素连接酶一样,TRIM3包含保守的环指结构域(RING)、B盒结构域(B-box)和卷曲螺旋结构域(coiled-coil),以及一个可变的C端区域。Co-IP实验表明,RING结构域对于TRIM3-TLR3相互作用至关重要(图4G)。关键的是,与野生型(WT)TRIM3相比,RING结构域缺失的TRIM3突变体和催化失活突变体(C22/25S)均未表现出TLR3泛素化活性(图4H)。鉴于TLR3驱动的IFN-β产生需要TANK结合激酶1(TBK1)和干扰素调节因子3(IRF3)的磷酸化,作者还观察到在WT TRIM3组(而非C22/25S突变体组)中,磷酸化TBK1和IRF3伴随上调(图4I)。在A549和H1299细胞中进行的补充qPCR和酶联免疫吸附测定(ELISA)分析证实,在poly(I:C)刺激下,TRIM3上调IFNB1转录并增强IFN-β分泌。值得注意的是,TLR3调控逆转了这些效应,恢复了基础IFNB1 mRNA和IFN-β水平(图4J和S6)。对NSCLC队列中TLR3表达的生物信息学分析显示,随着肿瘤分期和N分期的进展,TLR3表达逐渐下调。TLR3表达降低与NSCLC患者的不良预后呈正相关。这些结果表明,TRIM3通过其RING结构域促进TLR3泛素化,从而在NSCLC中诱导IFN-β分泌。
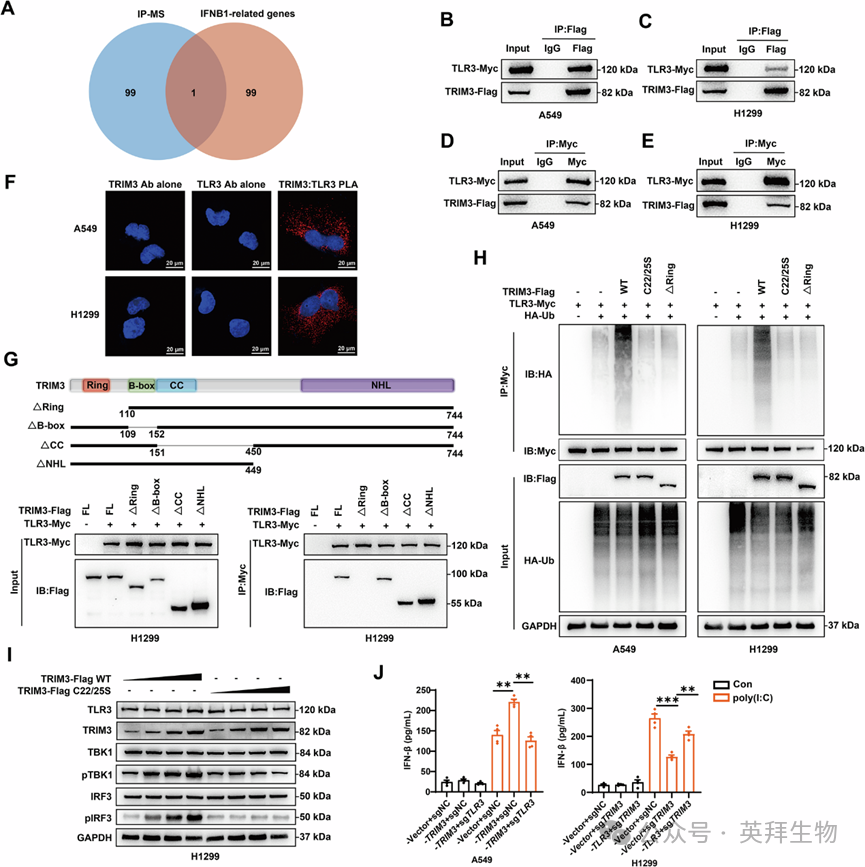
Fig. 4 TRIM3泛素化TLR3以诱导IFN-β分泌
5、TRIM3在赖氨酸808位点催化TLR3的K63连接泛素化
为阐明泛素化机制,作者进行了泛素化特异性Co-IP实验。与连接特异性泛素构建体共转染表明,TRIM3选择性地催化TLR3的K63连接泛素化(图5A)。在后续实验中,作者证明TRIM3以剂量依赖方式通过K63连接(而非K63R突变体)泛素化促进TLR3泛素化(图5B、C)。TLR3/TBK1/IRF3信号轴的激活导致IFN-β分泌,这严格要求TLR3的切割。作者的结果还表明,poly(I:C)刺激增强了TLR3泛素化和切割型TLR3的积累,且这些效应通过TRIM3过表达得到放大(图5D)。结构域定位显示,TLR3中633-904位残基对于TRIM3结合至关重要(图5E)。使用GPS-Uber平台,作者预测了该区域内的四个候选赖氨酸泛素化位点。TLR3 K808残基的突变消除了TRIM3介导的TLR3泛素化(图5F)。WT TLR3显著增加了IFNB1 mRNA表达和IFN-β分泌,而K808R突变体则没有这些效应(图5G)。综上所述,这些发现表明,TRIM3在K808位点催化TLR3的K63连接泛素化,从而激活NSCLC中IFN-β的分泌。
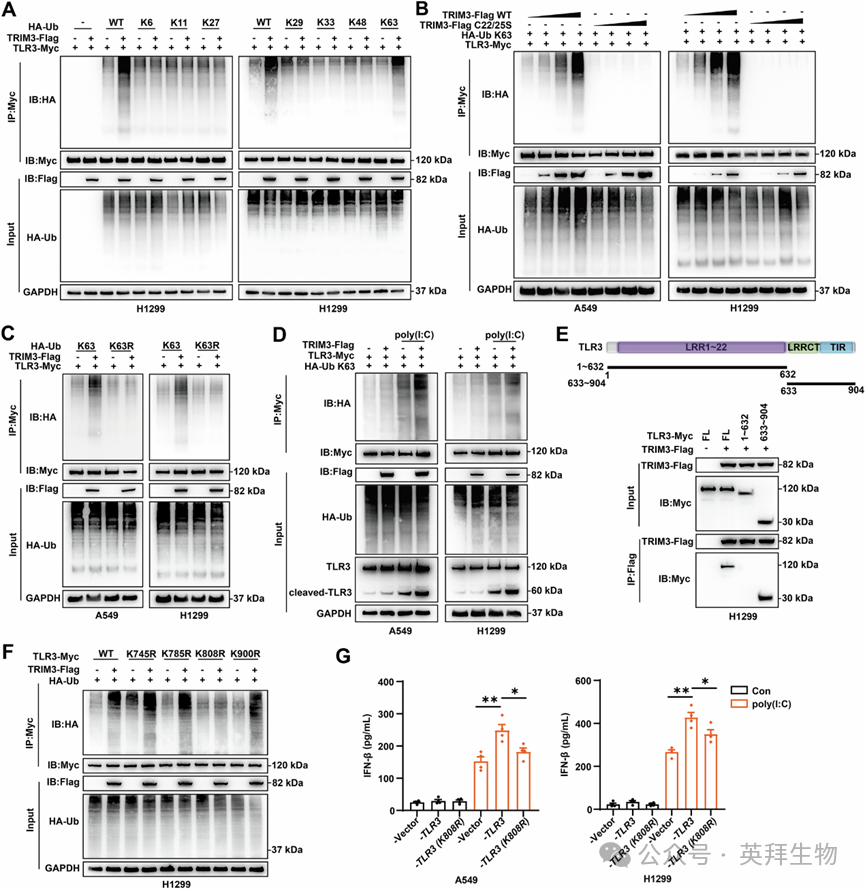
Fig. 5 TRIM3在赖氨酸808位点催化TLR3的K63连接泛素化
6、TRIM3/TLR3轴抑制NSCLC进展
为研究TRIM3/TLR3轴在NSCLC进展中的功能作用,作者进行了体外和体内实验。在poly(I:C)刺激下激活TLR3信号,进行增殖实验(CCK-8和集落形成)。TRIM3过表达抑制了A549细胞增殖,而TLR3敲除则逆转了这种效应(图6A、B)。此外,TRIM3敲除增强了H1299增殖,而TLR3过表达则逆转了这种效应(图6C、D)。在LLC细胞中也观察到了一致的结果(图6E、F和S8)。在作者的同基因小鼠模型中,每3天腹腔注射一次poly(I:C)。15天后,切除肿瘤、称重并拍照(图6G)。作者发现TRIM3过表达显著抑制了肿瘤生长,但TLR3敲除逆转了这种效应(图6H-J)。肿瘤组织的免疫组织化学结果显示,TRIM3过表达增加了IFN-β水平,并提高了CD4⁺T细胞、CD49b⁺NK细胞和CD86⁺M1巨噬细胞的浸润水平,但CD163⁺M2巨噬细胞的浸润水平降低(图6K),这与先前的免疫浸润分析结果一致(图3K-P)。生物信息学分析还证实了TLR3表达与LUAD和LUSC中CD4⁺T细胞、巨噬细胞、NK细胞(图7A-H)、CD8⁺T细胞和树突状细胞浸润的相关性。临床上,TRIM3和TLR3的下调与NSCLC患者的不良预后呈正相关(图7I)。总体而言,TRIM3/TLR3轴通过直接抑制肿瘤细胞增殖并通过IFN-β分泌调节免疫细胞的浸润水平,从而抑制NSCLC进展(图7J)。
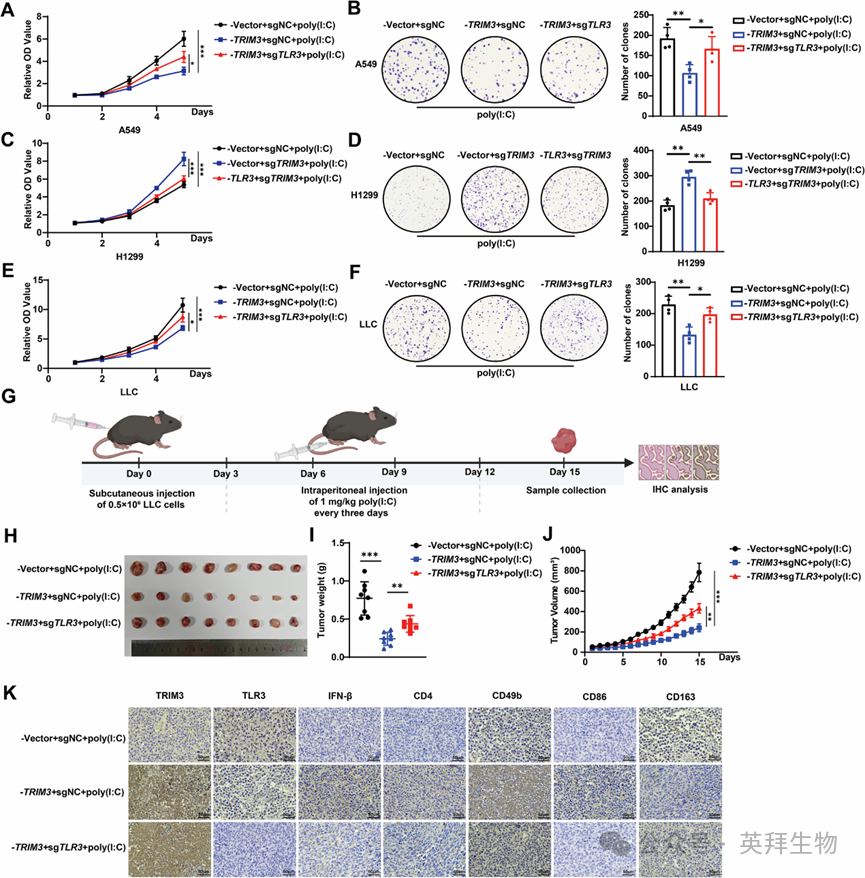
Fig. 6 TRIM3/TLR3轴抑制非小细胞肺癌进展
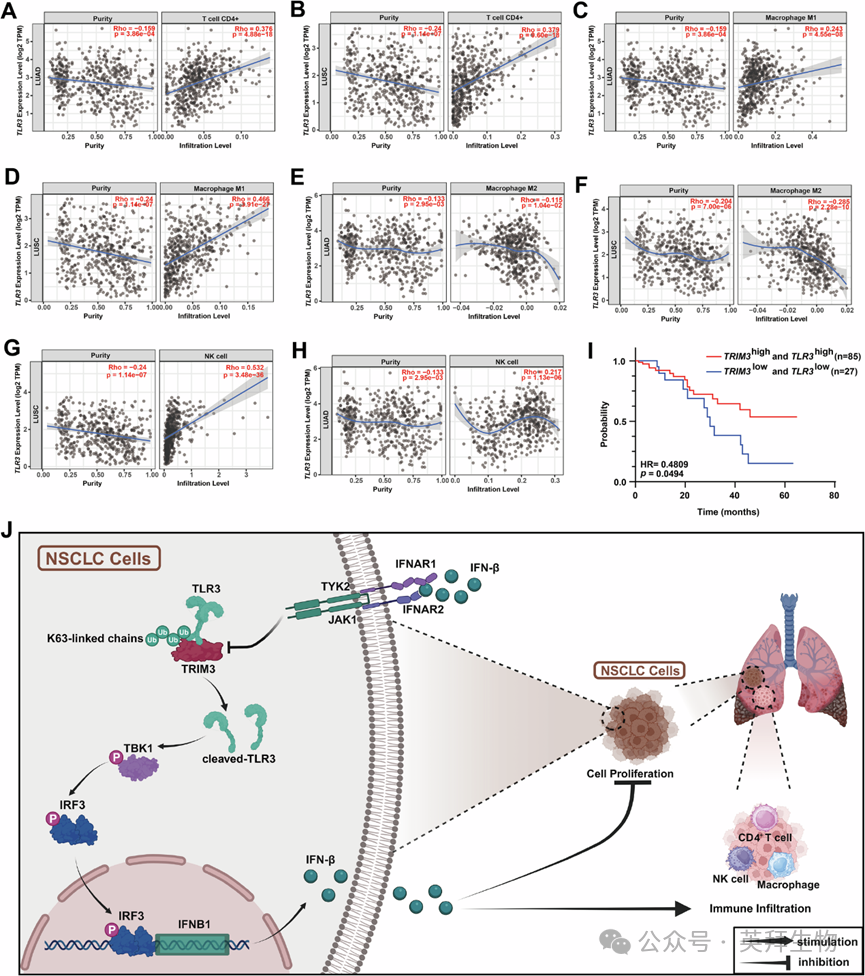
Fig. 7 TLR3与免疫浸润的关联及TRIM3/TLR3联合表达在非小细胞肺癌中的预后价值
结论
总而言之,本研究揭示了NSCLC中调控IFN-β分泌的相互反馈环路。TRIM3可促进IFNB1的表达,而过量的IFN-β则通过反馈抑制诱导TRIM3下调。值得注意的是,TLR3轴通过TRIM3介导的、K808位点发生的TLR3 K63连接泛素化,突破了这种反馈抑制,进而抑制NSCLC细胞增殖并阻碍肿瘤生长。这些发现深化了对IFN-β信号动态调控的机制理解,并证实TRIM3/TLR3轴是NSCLC中一个具有潜力的治疗靶点。
参考文献
Xu J, Hu Q, Zhu Y, Liu Q, Wang F, Yu Y, Wang W, Ding X. The TRIM3/TLR3 axis overrides IFN-β feedback inhibition to suppress NSCLC progression. Cell Death Dis. 2026 Jan 16;17(1):44. doi: 10.1038/s41419-025-08265-w. PMID: 41545343; PMCID: PMC12811290.






