通过CD117抗体预处理后进行胰岛和造血细胞移植治愈小鼠自身免疫性糖尿病
异基因造血干细胞移植(HCT)后形成的混合造血嵌合状态,可促进移植供体匹配实体器官的耐受性,纠正自身免疫异常,并有望改变自身免疫性1型糖尿病(T1D)的治疗策略。然而,为扩大临床应用,亟需开发无毒性的骨髓预处理方案。我们开发了一种无化疗、非髓消(NMA)的预处理方案,可在NOD小鼠中实现跨越MHC屏障的混合嵌合状态和移植物耐受性。通过在移植MHC不匹配的B6造血细胞前,采用抗c-Kit单克隆抗体、T细胞耗竭抗体、JAK1/2抑制剂及低剂量全身照射,我们在糖尿病前期NOD小鼠中获得了持久的混合造血嵌合状态,使100%嵌合NOD:B6小鼠成功预防糖尿病。在显性糖尿病NOD小鼠中,经NMA预处理后联合进行B6造血干细胞移植与胰岛移植,100%嵌合小鼠的糖尿病获得持久纠正,且未出现慢性免疫抑制或移植物抗宿主病(GVHD)。嵌合小鼠通过血细胞计数恢复及对第三方异源胰岛的排斥反应,证实其免疫功能正常。移植物转移实验及自身反应性T细胞分析证实了自身免疫的纠正。对嵌合NOD小鼠的分析揭示了胸腺中央清除和外周耐受机制。因此,通过NMA预处理和细胞移植,我们实现了无移植物抗宿主病(GVHD)的持久造血嵌合状态,促进了胰岛移植物的耐受性,并逆转了已确诊的T1D。该研究于2025年11月发表在《JOURNAL OF CLINICAL INVESTIGATION》,IF:13.6。
技术路线

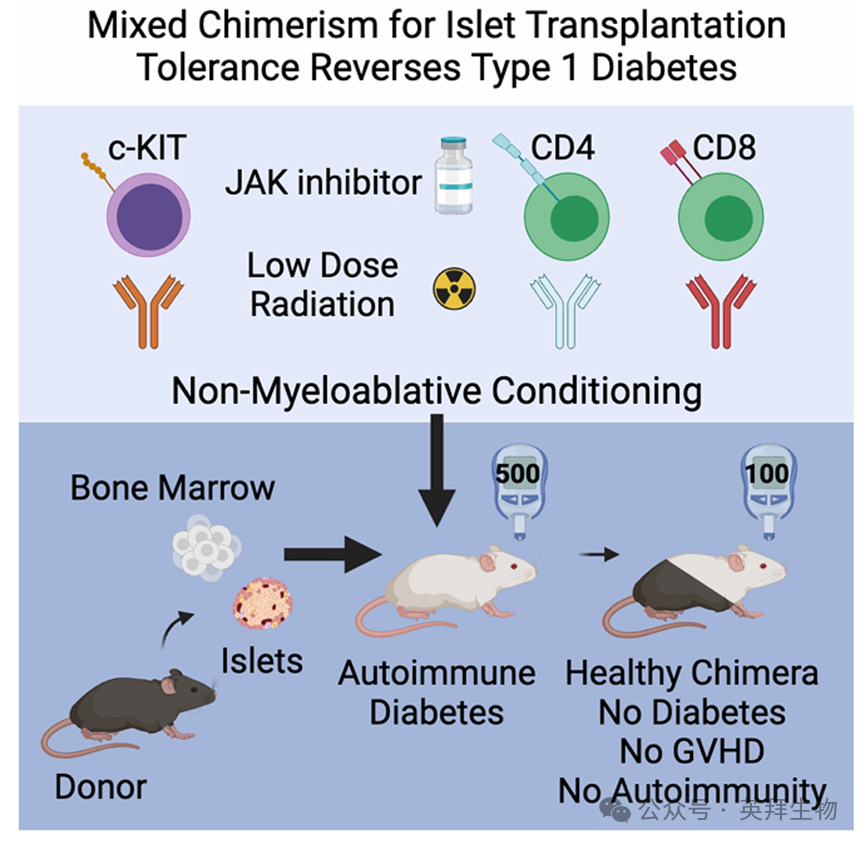
Graphical Abstract
主要研究结果:
1.非清髓条件作用促进强健和持久的同种异体供体嵌合
NOD 小鼠对辐射的免疫抑制作用具有抵抗力,这使得它们难以接受造血干细胞的移植。此前,我们通过使用非清髓性(NMA)预处理方案(全身总辐射剂量 300 cGy、αCD117 抗体以及短暂的 T 细胞去分化处理,包括使用αCD4 和αCD8 抗体)在 B6 小鼠中进行了异基因造血干细胞移植,并成功实现了持久的造血嵌合现象。然而,在对 8 周龄的糖尿病前期 NOD 小鼠使用该预处理方案进行预处理后,再移植异基因 B6 供体骨髓(图 1A 和补充图 1A),我们未能实现长期的多系嵌合(补充图 1B)。对 NOD 外周血和淋巴器官的分析表明,该预处理方案可能未能充分抑制宿主的 NK 细胞和 T 细胞(补充图 1C)。为了验证这一假设,我们每天给予巴利替尼(一种靶向 NK 细胞和 T 细胞的 JAK1/2 抑制剂),该药物在非糖尿病宿主的异基因造血干细胞移植的临床前和临床研究中已被证明具有良好的耐受性(总共 12 天;图 1B 和补充图 1C)。糖尿病前期 NOD 小鼠从第 -4 天至第 +8 天接受 225 或 250 cGy 的全身照射处理(在第 -2 天进行),第 0 天进行全骨髓移植,并持续观察至 20 周(图 1B)。在造血细胞移植 4 周后进行的分析显示,无论辐射剂量如何,所有外周血细胞系均存在明显的供体嵌合现象(总体:83.8 ± 5.9%,CD3+:76.6 ± 3.8%,CD19+:91.3 ± 2.2%,CD11b+:81.7 ± 6.6%,CD49b+:79.6 ± 6.4%;n = 15;图 1C)。在15名受体中,有14名在整个20周的实验期间维持了稳定的混合嵌合状态,这里将其称为“糖尿病前期 NOD:B6”(图 1D)。同样,对脾脏和骨髓的终点分析显示嵌合水平很高(图 1E 和 F)。我们还证实了供体 Lin–Sca1+cKit+(LSK)造血干细胞的植入以及宿主 LSK 造血干细胞的持续存在(供体 LSK 嵌合率:61.5 ± 6.5%;图 1F)。使用线粒体缺失的造血干细胞和祖细胞代替全骨髓,我们获得了相似的结果(补充图 1D)。此外,我们确定了一个“低于最低剂量”的辐射剂量,在此剂量下不再实现植入(200 cGy;补充图 1E)。因此,我们利用一种结合了低剂量肿瘤免疫治疗、抗 CD117 抗体以及巴利昔单抗的 NMA 方案,在糖尿病前期的 NOD 小鼠体内成功实现了持久的混合造血嵌合现象。
在进行 WBM 移植后,我们未观察到移植物抗宿主病(GVHD)的临床症状(如黏膜变化、皮疹或体重减轻),也未检测到肠道浸润的迹象(补充图 2A、B)。纵向体重测量显示,从造血干细胞移植(HCT)到实验终点期间体重显著增加(39.0 ± 2.1%;补充图 2A)。此外,完整的和分类血细胞计数(CBC)在 HCT 后 4 周显示出良好的恢复情况,包括白细胞计数(WBC)和免疫细胞亚群,无需额外的支持治疗,如输血,表明骨髓和造血干细胞功能得到了健康的重建(补充图 2C 和 D)。因此,在 NMA 预处理后,多个指标显示嵌合的 NOD:B6 小鼠具有良好的功能状态和健康状况,造血功能恢复良好,且未出现 GVHD。
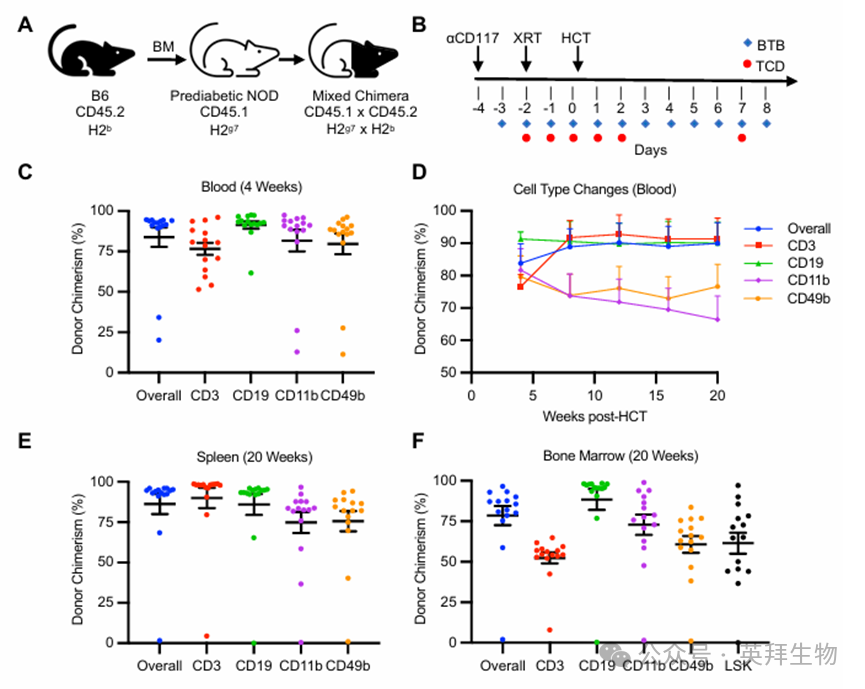
图1.非髓系预处理能够使在放射抵抗型NOD 模型中产生强大的且持久的同种异体供体嵌合现象
2.混合嵌合可预防自身免疫性糖尿病并建立供体特异性胰岛耐受性
造血细胞嵌合现象能够预防和纠正自身免疫反应。因此,我们提出一个问题:基于 CD117 的 NMA 预处理后产生的混合嵌合状态能否预防 NOD 小鼠的自身免疫性糖尿病?尽管 8 周龄的未患病且处于预发病期的 NOD 小鼠血糖水平正常,但它们通过胰腺胰岛组织学检查显示出胰岛炎,其中以 B 细胞和 T 细胞浸润为主(补充图 3,A 和 B)。在 14 至 24 周龄期间,我们实验群中的 60% 的 NOD 小鼠患上了糖尿病(n = 9/15;图 2,A 和 B)。在未进行 HCT 的预处理 NOD 小鼠(“预处理对照组”)中,我们观察到糖尿病发病时间延迟,从预处理后 16 周开始,糖尿病发病率降低至 30%,并且胰腺组织学检查显示有胰岛炎(n = 3/10;图 2,A-C)。这些特征,包括糖尿病发病的时间,很可能反映了预处理的 NOD 小鼠在随后未进行 HCT 时骨髓和免疫功能的延迟恢复情况。胰腺组织的胰岛炎评分显示,未接受条件处理的 NOD 小鼠和接受条件处理的对照组中,胰岛发生胰岛炎的比例(70%-75%)基本相同(尽管病情进展较慢且发病率降低,见图 2C),且不同细胞类型的浸润成分无差异(补充图 3B)。相比之下,NMA 条件处理和 HCT 防止了 100%的 NOD:B6 小鼠(n = 19/19;图 2,A 和 B)的糖尿病发作。在 HCT 后 20 周的嵌合 NOD:B6 小鼠的胰腺组织中,大部分胰岛在胰岛周围区域没有 CD45+免疫细胞,只有少数胰岛有轻微的胰岛周围炎(图 2C),与 B6 小鼠相似(补充图 3A)。胰腺组织的胰岛炎评分显示,仅有不到 15%的胰岛有胰岛周围炎(图 2C)。对这些胰岛周围免疫细胞的分析表明,大多数来自供体(CD45.2+)(图 2D),可能表明这些细胞抑制了自身免疫反应。这些胰岛周围细胞大多为 B 细胞和 T 细胞,少量为髓样细胞(图 2D)。因此,在基于 aCD117 的 NMA 预处理条件下产生的混合造血嵌合现象纠正了自体免疫反应,并防止了糖尿病的发作以及胰岛炎症在糖尿病前期NOD 小鼠中的发生。
为检验在糖尿病前期 NOD 小鼠体内存在的混合造血异质性是否能促进供体匹配的胰岛同种异体移植以及自身抗原耐受,我们在 HCT 后 14 周将来自 B6 或第三方 FVB(H2q)性别匹配的对照小鼠的胰岛移植到糖尿病前期的 NOD:B6 异质性小鼠体内(图 2E)。移植两周后,恢复的 B6 胰岛移植体在糖尿病前期的 NOD:B6 异质性小鼠体内保持完整,几乎没有免疫细胞浸润(图 2F)。相比之下,第三方 FVB 胰岛移植体容易被排斥,有大量免疫细胞浸润,并且不含可检测到的 INS+ 细胞(图 2F)。在胰岛移植后长达 14 周评估的供体匹配的 B6 胰岛移植体也保持完整,几乎没有免疫细胞浸润(图 2G)。因此,糖尿病前期的 NOD 小鼠体内的混合造血异质性能够预防自身免疫性糖尿病,维持自身耐受,促进长期的供体匹配胰岛同种异体耐受,并保持对外来抗原的免疫能力。
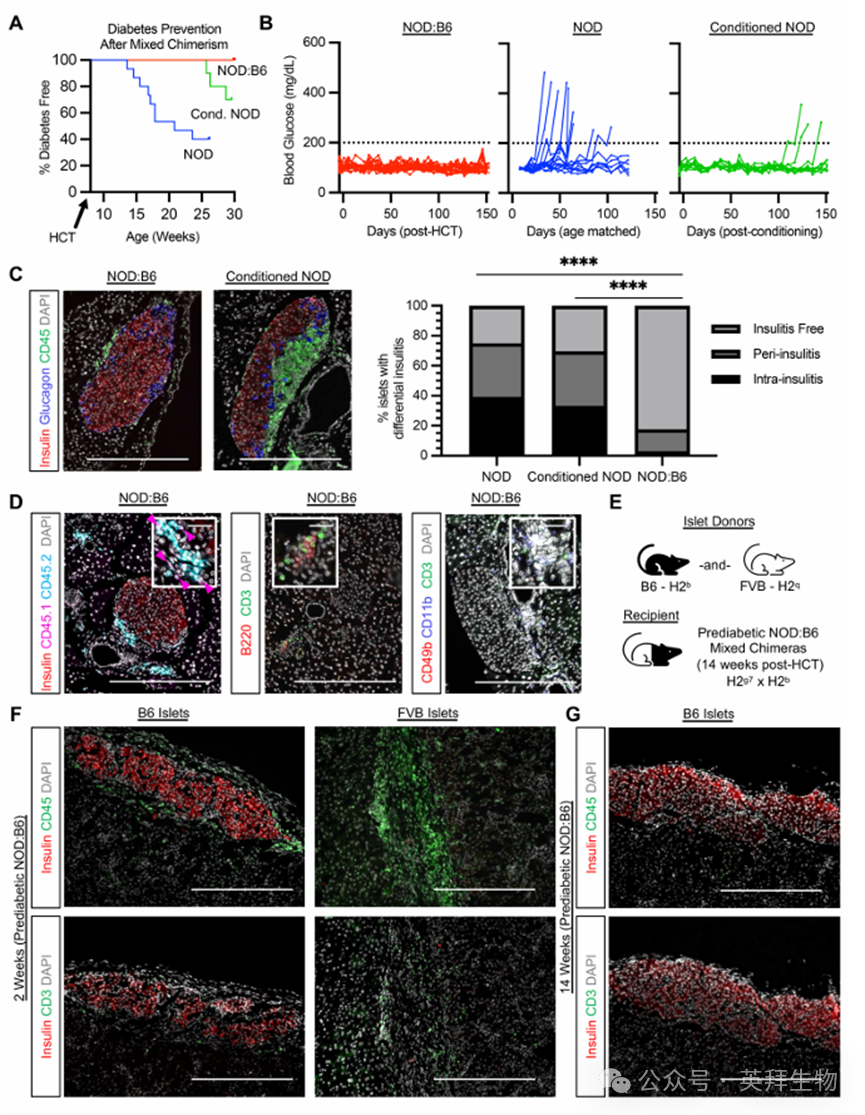
图2.混合嵌合可预防自身免疫性糖尿病并建立供体特异性胰岛耐受性
3.异体造血细胞和胰岛移植治疗自身免疫性糖尿病
为探究联合进行HCT和胰岛移植是否能够逆转 NOD 小鼠(血糖持续升高超过两周)的明显糖尿病症状,我们将同种异体的 B6 脐血细胞和来自 B6(供体匹配)或 FVB(第三方)供体的胰岛细胞移植到肾包膜下的肾腔内(图 3A)。在进行 NMA 预处理之前,糖尿病小鼠一直接受外源性胰岛素治疗(方法见下文)。在同时进行 HCT 和胰岛移植(约 400 个胰岛单位)后的第 0 天停止预处理(HCT 和胰岛移植总时长约为 4 周)。4 周后,在糖尿病 NOD 受体的外周血中观察到了多系混合嵌合现象(总体比例:74.9 ± 6.4%,CD3+:67.5 ± 4.8%,CD19+:80.0 ± 6.8%,CD11b+:59.9 ± 7.6%,CD49b+:66.1 ± 7.3%;n = 19;图 3B)。在 9 只接受 400 个胰岛单位移植并长期随访的小鼠中,所有小鼠在移植后 20 周内均表现出持久的混合嵌合现象(图 3C)。这一结果也通过 20 周时骨髓的终点分析得到了进一步证实(供体 LSK 混合比例:45.0 ± 8.1%;图 3D)。在 2 只对照的 NOD:B6 小鼠中,我们移植了约 200 个 B6 脐血单位,导致移植前后血糖未得到纠正的升高。这两只小鼠均未实现长期的混合造血嵌合现象。此前的研究表明,高血糖会改变骨髓微环境,并可能延缓骨髓移植,因此这一点可能是临床转化研究中需要考虑的重要因素。
患有糖尿病且具有持久混合造血异质性的 NOD 小鼠(以下简称为“糖尿病 NOD:B6”)在整个 20 周的随访期间均保持了正常的血糖水平,无需额外的免疫抑制或补充胰岛素(9/9;图 3E)。为了确保供体匹配的胰岛移植完全负责控制糖尿病,将携带胰岛的 9 个肾脏切除(“肾切除术”),结果导致糖尿病复发(3/3;图 3E)。此外,没有 HCT 的糖尿病条件对照组在移植后平均 39 天内迅速排斥了 B6 胰岛移植,表明仅进行条件处理并不能促进耐受(3/3;补充图 4,A 和 B)。与接受 B6 胰岛的嵌合体相比,接受第三方 FVB 胰岛的嵌合体小鼠最初稳定了血糖水平,但在平均 50 天后又恢复了高血糖状态,这表明排斥了 FVB 胰岛,并表明 NOD:B6 小鼠保持了免疫能力(8/8;图 3F 和补充图 4C)。在实验终点处回收的胰岛移植组织的组织学检查显示,在 NOD:B6 宿主体内,恢复的 B6 胰岛保持完整,其中仅有少量 CD45+免疫细胞;而 FVB 胰岛移植组织中则出现了严重的免疫细胞浸润,并且检测不到 INS+细胞(图 3,G 和 H)。同样,在 NOD:B6 小鼠的自身胰腺组织中也未检测到 INS+细胞(图 3I)。
与糖尿病前期的 NOD:B6 组情况相同,我们未观察到移植物抗宿主病(GVHD)的临床指标。此外,纵向体重测量显示,从造血干细胞移植(HCT)到实验终点期间平均体重增长良好(15.4 ± 2.1%),全血细胞计数表明造血功能正常且已成功重建(补充图 4,D 和 E)。因此,多项指标(血糖、体重增加、全血细胞计数、免疫功能)均显示糖尿病 NOD:B6 组具有良好的功能状态和糖尿病逆转的情况。
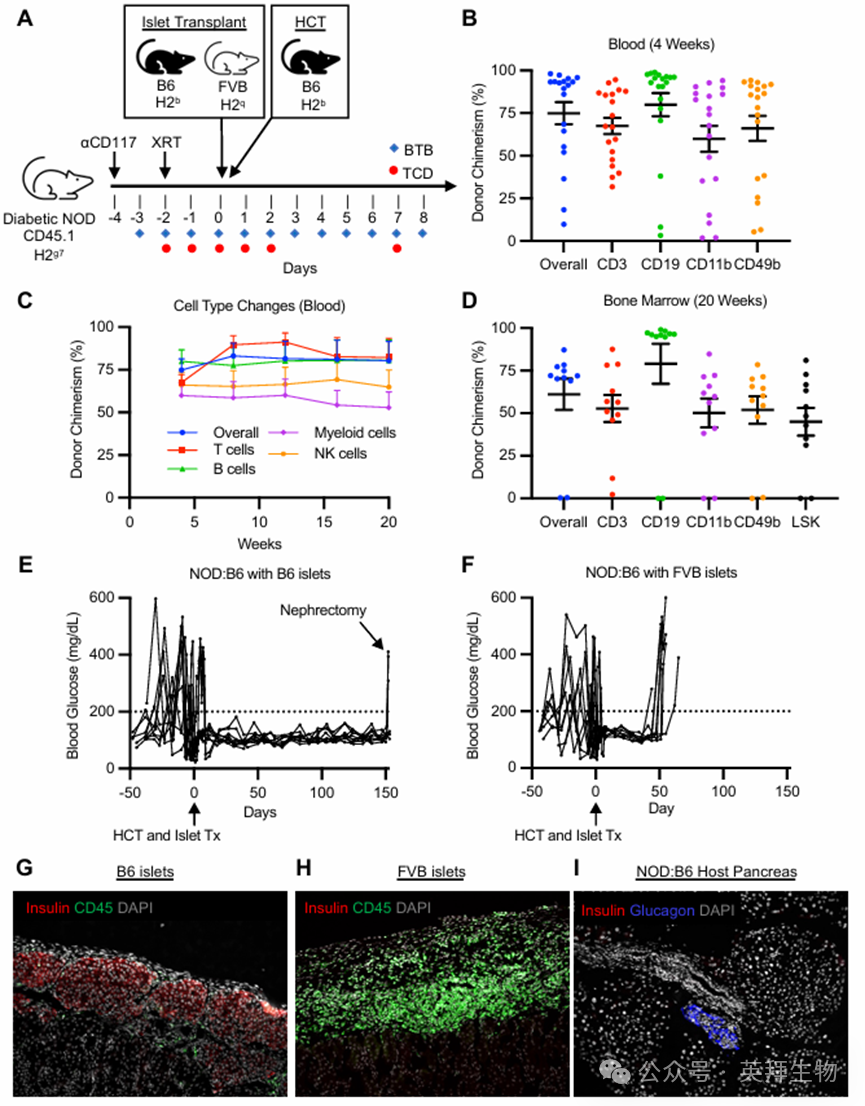
图3.异体造血细胞和胰岛移植治疗自身免疫性糖尿病
4.T细胞自身免疫在糖尿病前期和糖尿病NOD:B6嵌合体中得到纠正
为评估 NOD:B6 小鼠自身免疫纠正的机制,我们对处于糖尿病前期和糖尿病阶段的 NOD:B6 同种异体嵌合小鼠体内自身反应性细胞毒性 T 细胞的缺失情况进行了评估。针对存在于 NOD 小鼠和患有 1 型糖尿病的人类患者体内、与胰岛相关且具有抗原特异性的葡萄糖-6-磷酸酶催化亚基相关蛋白(IGRP)的抗原特异性 CD8+ T 细胞,我们使用 MHC I 类(H-2Kd)IGRP 四聚体染色法进行了检测(方法;补充图 5A)。处于糖尿病前期的 NOD 和条件控制的 NOD 小鼠(条件处理后 20 周)在胰腺淋巴结(pancLN)和脾脏中发现的 IGRP 双四聚体+ CD8+ T 细胞水平相似(图 4A)。然而,在条件处理后 20 周的糖尿病前期 NOD:B6 小鼠中,这些细胞几乎完全缺失(图 4A)。我们在糖尿病前期的 NOD:B6 外周血中也观察到了类似的趋势(补充图 5B)。这种缺失现象在糖尿病 NOD:B6 小鼠中也十分显著;我们观察到胰腺淋巴结、脾脏和外周血中的 IGRP 双四聚体+ CD8+ T 细胞几乎完全消失。相比之下,糖尿病 NOD 控制组表现出自身反应性 T 细胞的显著增加(图 4B)。
将适应性免疫细胞移植到免疫缺陷的 NOD Rag1 KO 小鼠体内,可以评估来自糖尿病前期和糖尿病 NOD 小鼠的 T 细胞的自身反应性和致糖尿病潜能;受体 NOD Rag1 KO 小鼠缺乏内源性 T 细胞和 B 细胞,且易患自身免疫性糖尿病。我们通过移植方法评估了 NOD:B6 小鼠中自身免疫的纠正情况(图 4C)。从 12 周龄的糖尿病前期 NOD 小鼠、经过条件处理的糖尿病前期 NOD 小鼠(条件处理后 12 周)或糖尿病前期 NOD:B6 同种异体小鼠(供体 T 细胞比例 45%;造血干细胞移植后 12 周)的脾脏中分离出 2×106个 MACS 分选的 CD3+T 细胞,然后将其移植到正常血糖的 7-8 周龄 NOD Rag1 KO 雌性小鼠体内,并监测糖尿病的发生情况。糖尿病前期和糖尿病的 NOD 小鼠将自身免疫传递给了 100%的 NOD Rag1 KO 受体小鼠(n = 6/6),移植后分别在 50 至 75 天或 25 至 40 天内发展为糖尿病(图 4,D 和 E)。经过条件处理的糖尿病前期 NOD 对照小鼠也将自身免疫传递给了 100%的 NOD Rag1 KO 受体小鼠,并且长期存在(n = 4/4),移植后 60 至 80 天内发展为糖尿病。相比之下,来自糖尿病前期 NOD:B6 小鼠或糖尿病 NOD:B6 小鼠的细胞并未导致糖尿病的转移,所有接受这些细胞移植的小鼠在 11 天至 100 天内(每组 n = 6)均保持无糖尿病状态(图 4,D 和 E)。胰腺组织学显示,当将来自未受刺激的 NOD 或条件培养 NOD 供体的 T 细胞移植到 Rag1 基因敲除受体中时(图 4F),胰腺出现了明显的胰岛炎。相比之下,在从 NOD:B6 同种异体小鼠中进行适应性 T 细胞移植后(图 4F),我们观察到胰腺中胰岛形态正常,无胰岛炎。因此,我们得出结论,在糖尿病前期和糖尿病 NOD 小鼠中建立混合造血嵌合体后,胰岛自身免疫和致糖尿病潜能已被消除。
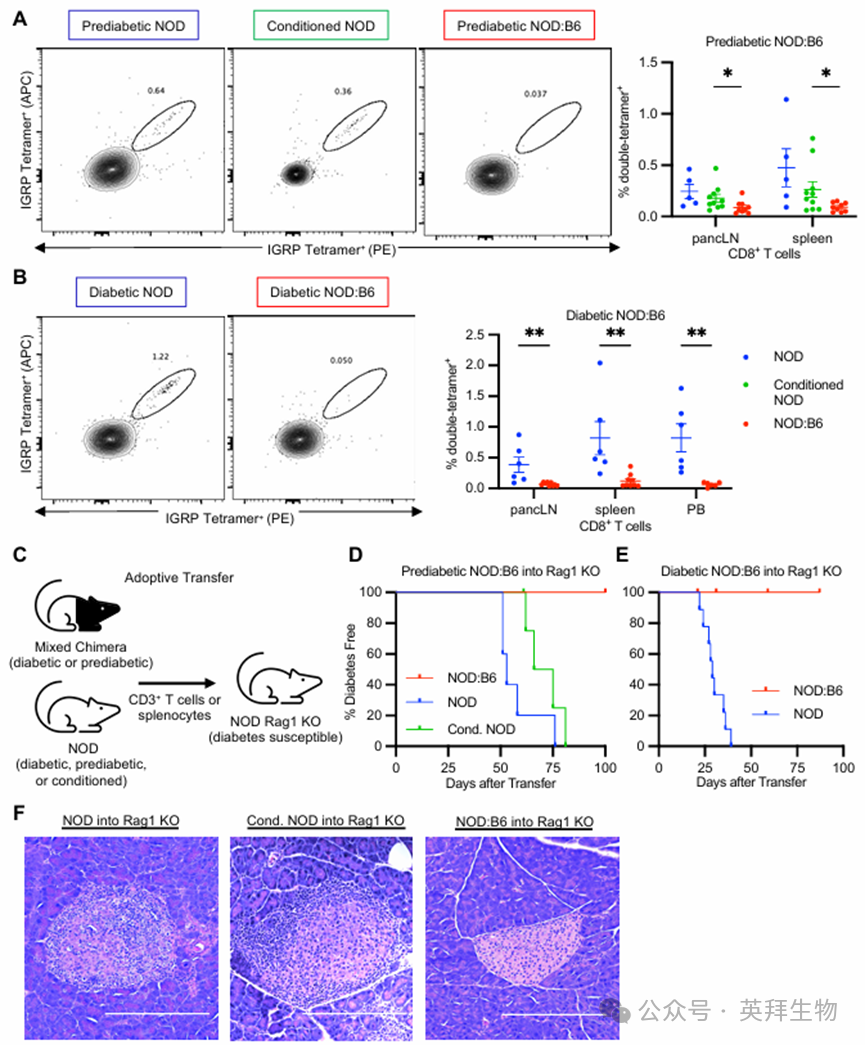
图4.T细胞自身免疫在糖尿病前期和糖尿病嵌合体中得到纠正
5.供体胸腺细胞与中枢缺失和胸腺Treg发育有关
在混合嵌合体中对自身和异体抗原的耐受性主要是通过发育中的胸腺细胞接受供体和自身抗原的“教育”而建立的,这一过程是通过供体抗原呈递细胞(APC)来实现的。我们确认了已知参与负选择的供体 B6 APC 亚型的存在,包括 CD11c+ DC 子集、胸腺驻留树突状细胞(tDCs;CD8+ Sirpa-)、迁移性 DC(mDCs;CD8- Sirpa+)和浆细胞样 DC(pDCs;PDCA-1+ B220+),以及 B 细胞(图 5A)。mDCs 和 pDCs 参与将外周(即供体)抗原运输至胸腺,从而实现反应性 T 细胞的克隆性删除,并且这两种亚群在糖尿病前期的混合嵌合体中比条件性的 NOD 和无免疫记忆的供体对照组更为丰富(图 5B;补充图 6A 和 B)。为了评估在胸腺负选择过程中发生自身反应性细胞的情况,我们评估了宿主胸腺细胞上的程序性细胞死亡蛋白 1(PD-1),该蛋白已被证明在识别自身抗原后能够实现细胞的删除。事实上,我们观察到糖尿病前期的 NOD:B6 小鼠的宿主胸腺细胞中 PD-1 表达增加(图 5C,补充图 6C)。虽然所有的胸腺抗原呈递细胞都能进行负向选择,但只有髓样树突状细胞(mDCs)已被证实能在体内促进胸腺调节性 T 细胞(tTregs)的生成。有趣的是,我们观察到 NOD:B6 小鼠中 mDC 的频率有所增加,且与对照组相比,其宿主 tTreg 的频率显著提高(图 5D)。与之前的研究结果一致,混合嵌合体中并未观察到供体 tTreg 的生成增加。
尽管总体的供体 Treg 细胞生成量并未增加,但我们仍观察到在我们的混合嵌合体中存在对供体抗原的耐受现象,这从没有发生移植物抗宿主病(GVHD)这一结果中得以体现。我们推测,增强供体 B6 Treg 细胞的生成将会在特定于宿主反应性 T 细胞克隆的糖尿病前期 NOD:B6 小鼠中观察到。为了验证这一点,我们测量了具有已知的 NOD 反应性 Vb3 结构域的 T 细胞,该结构域在 NOD 小鼠中由基因编码的超抗原呈递所删除,而在 B6 小鼠中则不会。因此,未经训练的 B6 T 细胞库应包含 Vb3+细胞,而经过针对 NOD 抗原训练的 T 细胞库则不应包含此类细胞。正如预期的那样,我们观察到在糖尿病前期 NOD 和条件性糖尿病 NOD 小鼠的外周血中,Vb3+ T 细胞的删除率约为 90%,而与未受训练的 B6 小鼠相比(NOD:0.34 ± 0.03%,条件性 NOD:0.37 ± 0.02%,B6:2.80 ± 0.09%;图 5E)显著降低。在糖尿病前期的 NOD:B6 小鼠中,约 80%的宿主反应性供体 Vb3+ T 细胞被清除,而与 B6 小鼠相比,这表明供体 T 细胞已被教育以识别宿主抗原。相比之下,在 NOD 或 B6 品系中不受选择压力影响的 Vb11+ T 细胞的频率在所有对照组和混合嵌合体中保持一致。尽管 Vb3 的缺失并非完全彻底,但在混合嵌合体中,我们观察到 Vb3+供体 T 细胞中的调节性 T 细胞(Tregs)出现频率高于 NOD 和 B6 对照组,而 Vb11+供体 T 细胞中的 Tregs 则保持不变(图 5E)。混合嵌合体患者外周血中 Vb3+ T 细胞和 Tregs 的频率差异在长期内保持一致(补充图 6D)。这些观察结果还通过分析糖尿病前期 NOD:B6 小鼠的胸腺 T 细胞发育情况得到了进一步证实(图 5F)。随着胸腺细胞从双阳性 CD4+CD8+(DP)阶段向单阳性(SP)CD4+或 CD8+阶段转变,供体 Vb3+细胞的频率会降低,这一现象在混合嵌合体和 NOD 小鼠中均可见,而 Vb11+细胞则在整个过程中保持不变。然而,混合嵌合体中的胸腺 Vb3+供体 Tregs 比 NOD 小鼠中的更丰富。因此,我们观察到在胸腺负选择过程中宿主的 13 种反应性供体(B6)T 细胞被删除,并且宿主反应性的供体 Treg 的产生得到了增强。总之,我们发现了预防移植物排斥反应、建立同种异体耐受以及重建自身耐受的中央耐受机制的证据,这些机制在混合嵌合的 NOD:B6 小鼠中对于预防移植物排斥反应、建立同种异体耐受以及重建自身耐受至关重要。
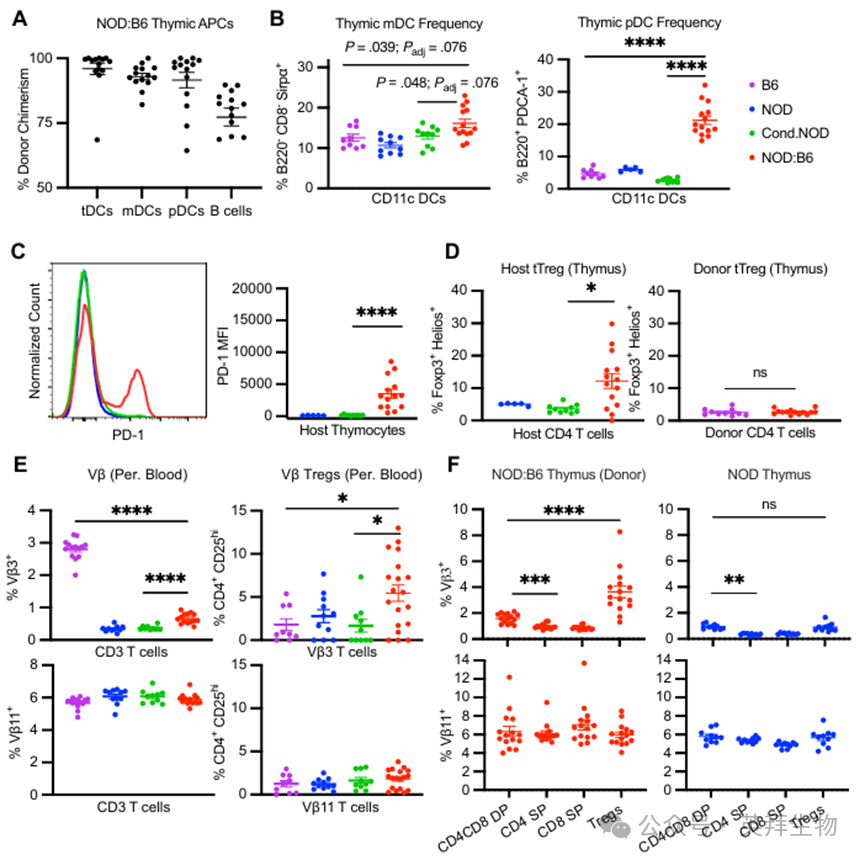
图5.供体胸腺细胞与中枢耐受和胸腺Treg发育有关
6.外周耐受机制与外周宿主效应细胞的能量有关
外周耐受机制对于抑制那些逃过胸腺筛选的同种异体和自身反应性 T 细胞,以及对剩余的条件抵抗型组织驻留宿主 T 细胞进行耐受至关重要。与基于 CD117 的预处理和造血干细胞移植后胸腺中的 tTreg 频率相似,我们观察到糖尿病前期 NOD:B6 小鼠脾脏中的宿主 tTreg 频率有所增加,但供体 tTreg 频率与对照组相比没有差异(图 6A)。此外,宿主和供体的 Tregs 都上调了诱导性共刺激分子(ICOS),这与更高的 IL-10 分泌和抑制潜力相关(图 6B)(45)。其他抑制活性标志物,如 CTLA4 和 LAG3 没有差异(补充图 7A)。这些供体和宿主的 tTregs 已被证明通过直接和间接的抑制机制来介导同种异体和自身反应性 T 细胞的外周耐受,从而促进宿主树突状细胞的耐受性状态。与宿主的常规树突状细胞(cDCs)不同,我们发现宿主的浆细胞样树突状细胞(pDCs)上表达的程序性死亡配体 1(PD-L1)标志物有所上调(图 6C 和补充图 7B),这是具有耐受性的 pDCs 的特征,这些 pDCs 在移植和自身免疫中是外周耐受的关键组成部分。耐受性宿主树突状细胞与宿主常规 T 细胞(Tcon)之间的 PD-L1/PD-1 信号传导可以启动抑制性信号并促进 T 细胞无反应性,这是外周自身反应性 T 细胞的关键耐受机制。事实上,我们观察到在糖尿病前期的 NOD:B6 小鼠中,与对照组相比,CD73hi FR4hi 细胞有所增加,这表明宿主 CD4+ Tcon 细胞处于无反应状态(图 7A)。为了进一步确定这些细胞对 14 种刺激信号的反应能力,我们在体外将用细胞标记剂紫罗兰色标记的宿主型糖尿病前期 NOD:B6 脾脏 T 细胞与 CD3/CD28 刺激珠粒以特定稀释比例孵育(图 7B 和补充图 7C)。尽管所有组都显示出剂量依赖性的反应,但来自条件性 NOD 和 NOD 对照组的细胞表现出强烈的增殖,而混合嵌合宿主细胞的反应则减弱(图 7B)。因此,我们的研究揭示了相关的作用机制,这些机制能够促进 NOD:B6 小鼠自身免疫的长期纠正以及同种异体免疫耐受的形成。
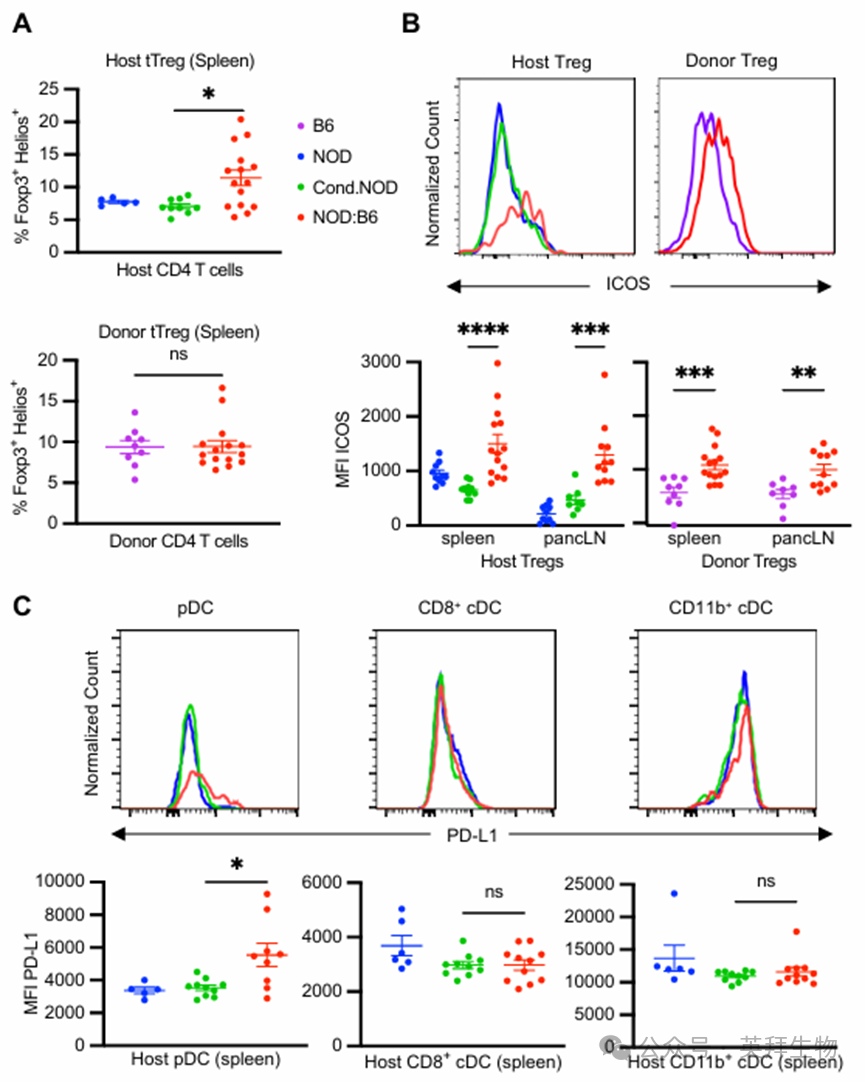
图6.外周调节性T细胞与耐受性树突状细胞类型相关
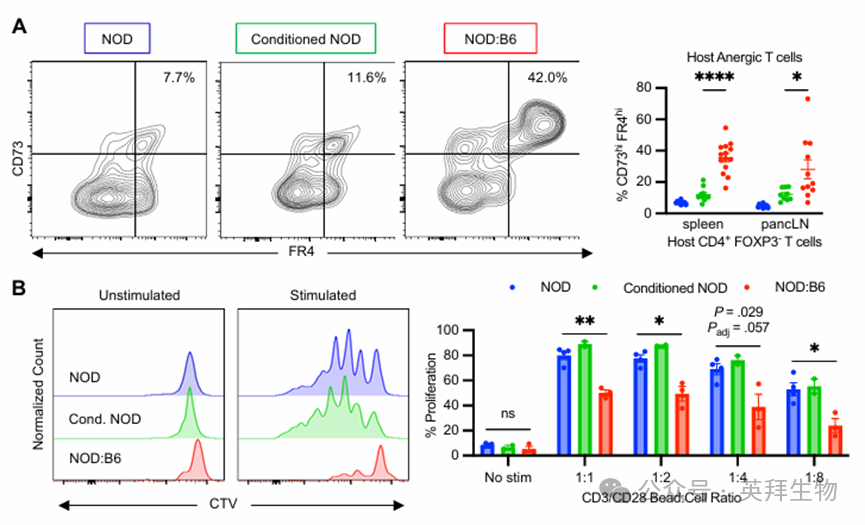
图7.外周耐受机制与外周宿主效应细胞的能量有关
结论
总之,本研究确定了一种我们认为适用于自身免疫性糖尿病模型中骨髓移植的新型 NMA 诱导方案。一系列 aCD117 抗体和基于巴利替尼的 NMA 诱导步骤,随后进行异基因 WBM 和胰岛移植,实现了持久的造血嵌合、胰岛异体移植耐受、胰岛自身免疫的抑制以及 1 型糖尿病的逆转,且未出现移植物抗宿主病。原则上,这些发现可应用于其他组织和细胞的耐受诱导,包括移植的干细胞衍生的替代 β细胞。
参考文献
Bhagchandani P, Ramos SA, Rodriguez B, Gu X, Pathak S, Zhou Y, Moon Y, Nourin N, Chang CA, Poyser J, Velasco BJ, Zhao W, Kwon HS, Rodriguez R, Burgos DM, Miranda MA, Meyer E, Shizuru JA, Kim SK. Curing autoimmune diabetes in mice with islet and hematopoietic cell transplantation after CD117 antibody-based conditioning. J Clin Invest. 2025 Nov 18:e190034. doi: 10.1172/JCI190034. Epub ahead of print. PMID: 41252212.






