Mdivi-1促进脂滴与线粒体的接触,并减轻高脂饮食小鼠的心脏脂毒性
心肌脂质超载引发过度的线粒体分裂并损害脂滴(LDs)-线粒体接触,从而促进脂毒性心肌病的发展。本研究旨在探讨线粒体分裂抑制剂 Mdivi-1 是否可以通过恢复高脂饮食(HFD)喂养小鼠的 LDs-线粒体接触来减轻心脏脂毒性。在体内,对雄性 C57BL/6 HFD 喂养小鼠腹腔注射线粒体分裂抑制剂 Mdivi-1,持续 8 周。在体外,将 H9C2 心肌母细胞暴露于棕榈酸(PA),然后用 Mdivi-1 处理。进行了心脏功能的综合评估,以及分子、生化、组织学、细胞和形态学分析。结果显示,Mdivi-1 处理对 HFD 喂养小鼠的代谢紊乱和心功能不全发挥了保护作用。Mdivi-1 通过上调 Plin2 和 Plin5 的表达促进 LDs-线粒体接触,从而减轻心脏脂毒性。此外,PA 以剂量依赖性方式破坏了 H9C2 心肌母细胞中的 LDs-线粒体接触并诱导脂毒性。Mdivi-1 有效抑制了 PA 诱导的线粒体分裂,恢复了 LDs-线粒体接触,并促进了 H9C2 细胞中脂肪酸从 LDs 向线粒体的转运以进行脂肪酸氧化。总之,该研究确定 Mdivi-1 作为一种新型的心脏保护剂,能够改善心脏脂毒性并促进 LDs-线粒体接触。该研究于2025年11月发表于《Pharmacological research》上,影响因子10.5。
技术路线

研究思路
1. Mdivi-1改善HFD喂养小鼠的代谢紊乱和心功能不全
研究表明,长期HFD摄入会刺激线粒体分裂,并增加小鼠心脏中Drp1蛋白水平及其在丝氨酸 616(S616)位点的磷酸化 [7]。为了阐明线粒体分裂在 HFD 诱导的心功能不全中的作用,我们向HFD喂养的小鼠腹腔注射线粒体分裂抑制剂 Mdivi-1,持续8周(图 S2)。我们的结果显示,Mdivi-1 处理显著降低了 HFD 喂养小鼠的体重、脂肪含量、血清 TG、TC 和 LDL-C 水平,并增加了 HDL-C 水平(图 S3)。Drp1 在 S616 位点的磷酸化在有丝分裂和氧化应激期间促进线粒体分裂 [18]。正如预期的那样,Mdivi-1处理下调了Drp1在S616位点的磷酸化,表明 Mdivi-1 抑制了HFD喂养小鼠的心肌线粒体分裂(图 1A-C)。
接下来,我们研究了Mdivi-1处理是否能改善HFD诱导的心功能不全。超声心动图评估表明,与HFD+溶剂组小鼠相比,HFD+Mdivi-1 组小鼠的心收缩和舒张功能均显著增加,表现为 EF、FS、E/A 比值和 IVCT 的增加,以及 IVRT 的降低(图 1D-I)。此外,H&E 和 Masson 染色显示,Mdivi-1 处理改善了 HFD 诱导的肌原纤维断裂和心肌纤维化(图 1J-L)。
总的来说,这些结果表明线粒体分裂抑制剂 Mdivi-1 对 HFD 喂养小鼠的代谢紊乱和心功能不全发挥了保护作用。
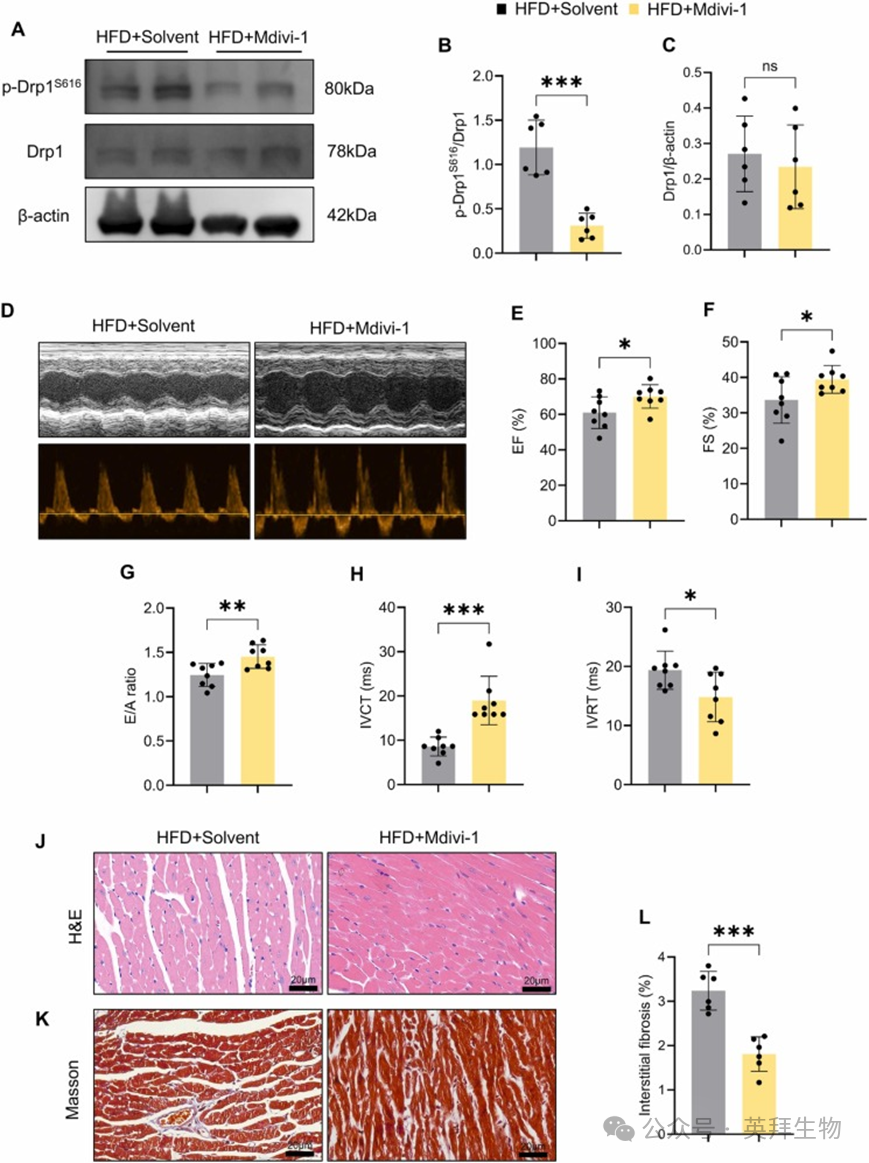
图1 Mdivi-1改善HFD喂养小鼠的代谢紊乱和心功能不全
2. Mdivi-1促进LDs-线粒体接触并改善HFD喂养小鼠的心脏脂毒性
先前研究证明,HFD 喂养导致心肌 LDs 积累,并减少 LDs-线粒体接触,从而导致心脏脂毒性 [5]。为了评估 Mdivi-1 对 HFD 喂养小鼠心脏中 LDs-线粒体接触的影响,我们进行了 TEM 分析。结果显示,Mdivi-1 处理增加了 LDs-线粒体接触膜的长度和与线粒体接触的 LDs 百分比,并减少了 LDs 的数量,这有助于促进 LDs-线粒体相互作用并改善 HFD 喂养小鼠的心脏脂毒性(图 2A-D)。此外,油红 O 染色进一步证实,Mdivi-1 处理有效抑制了 HFD 诱导的心脏脂质沉积(图 2E-F)。鉴于 PPARα 和脂肪甘油三酯脂肪酶(ATGL)是脂质代谢的关键调节因子,并且与 LDs 动力学密切相关,我们进一步研究了 Mdivi-1 处理后它们的表达。Western blot 分析显示,Mdivi-1 处理上调了 PPARα 和 ATGL 的表达水平(图 2G-I),进一步支持了其在促进脂肪酸氧化和脂质分解中的作用。此外,Mdivi-1 处理显著增加了心肌 ATP 水平(图 2J)。总之,这些结果表明 Mdivi-1 促进了 HFD 喂养小鼠的 LDs-线粒体接触并改善了心脏脂毒性。
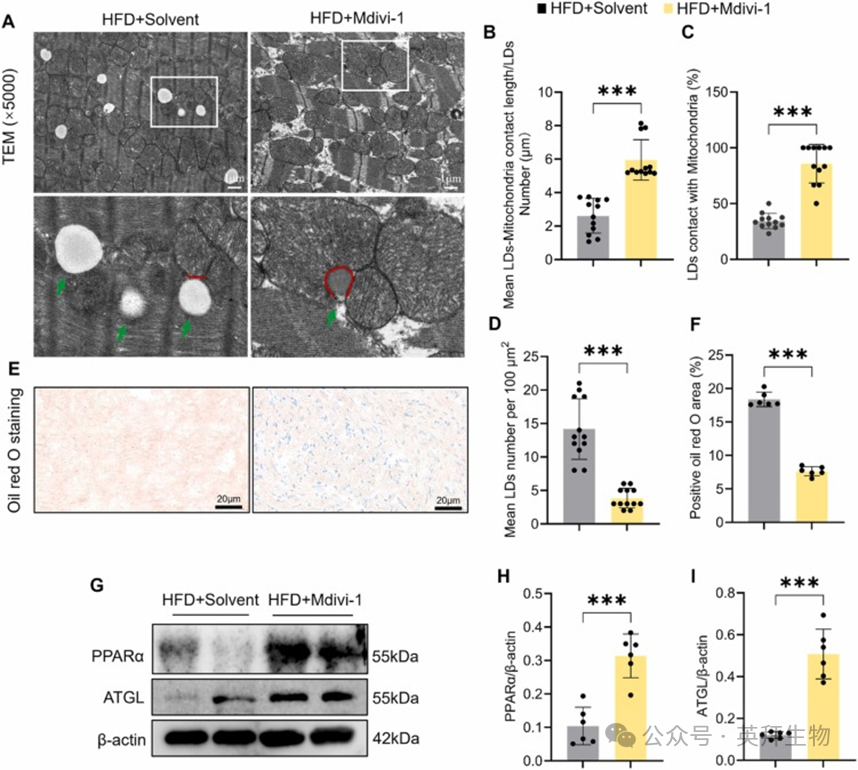
图2 Mdivi-1促进LDs-线粒体接触并改善HFD喂养小鼠的心脏脂毒性
3. Mdivi-1在HFD喂养小鼠心脏中上调Plin2和Plin5
Plins 家族(包括 Plin1-5)是 LDs 周围的特异性包被蛋白,据报道在 LDs 形成以及 LDs 与线粒体的连接中起着关键作用 [19]。基于此,本研究采用 qRT-PCR 检测 Plins 家族的 mRNA 表达水平。我们的结果表明,Mdivi-1 处理显著上调了 HFD 喂养小鼠心脏中 Plin2 和 Plin5 的 mRNA 表达,而对 Plins 家族的其他成员(Plin1/3/4)没有显著影响(图 3A)。此外,Western blot 分析进一步证实,Mdivi-1 显著增加了 Plin2 和 Plin5 的蛋白表达(图 3B-D)。这些结果表明 Plin2 和 Plin5 可能作为 Mdivi-1 增强 LDs-线粒体接触的关键介质。
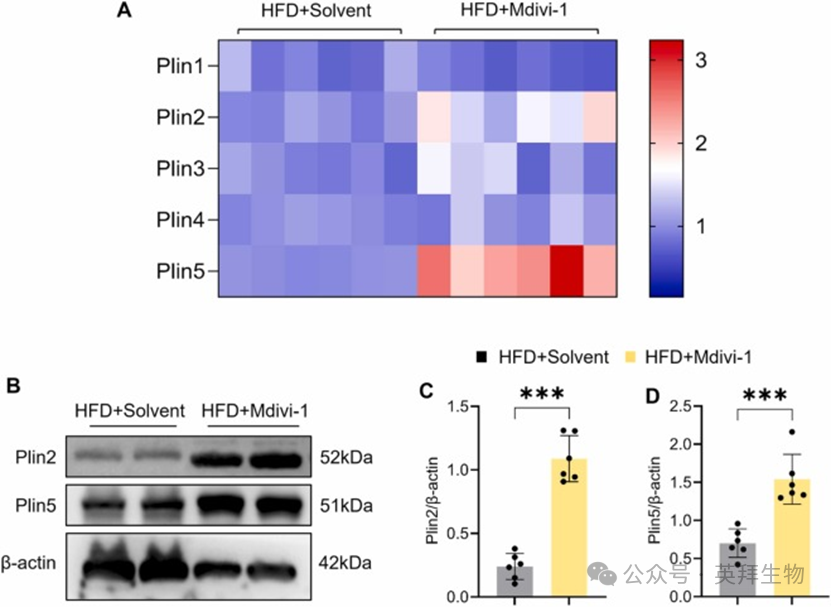
图3 Mdivi-1在HFD喂养小鼠心脏中上调Plin2和Plin5
4. PA以剂量依赖性方式破坏H9C2心肌母细胞的LDs-线粒体接触并诱导脂毒性
为了在体外模拟富脂肪酸环境,用 PA 处理 H9C2 心肌母细胞。通过用不同浓度的 PA(100、200、400 和 800 μM)处理 H9C2 细胞 24 小时,并对线粒体(红色)和 LDs(绿色)进行荧光标记来评估 LDs-线粒体接触。荧光成像结果显示,在对照培养基中培养的 H9C2 细胞表现出细长的丝状线粒体和少量 LDs,超过 60% 的 LDs 与线粒体连接(图 4A-D)。在用 100 μM PA 处理的细胞中,线粒体分裂和 LDs 面积增加,而 LDs-线粒体接触减少,这些效应在 200 μM 或 400 μM 或 800 μM PA 处理下进一步加剧(图 4A-D)。一致地,Western blot 分析显示,随着 PA 浓度的增加,p-Drp1S616 显著增加,而 Plin2、Plin5、PPARα 和 ATGL 蛋白水平显著降低(图 4E-J)。这些数据表明,过度的脂质超载促进了线粒体分裂,损害了 LDs-线粒体接触,并在 H9C2 心肌母细胞中诱导了脂毒性。
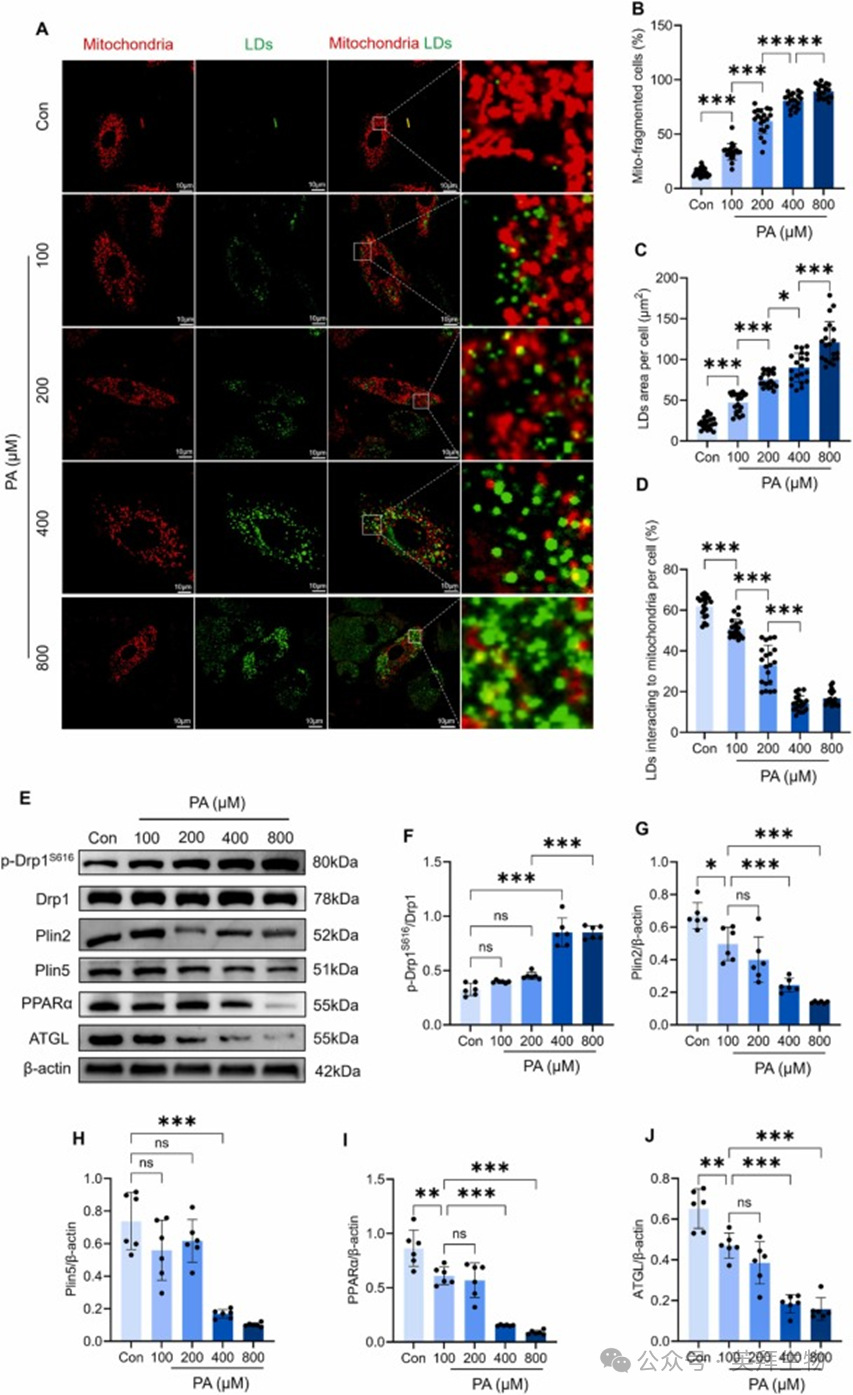
图4 PA以剂量依赖性方式破坏H9C2心肌母细胞的LDs-线粒体接触并诱导脂毒性
5. Mdivi-1恢复H9C2细胞中的LDs-线粒体接触
为了研究 Mdivi-1 是否在体外直接恢复 PA 诱导的 LDs-线粒体接触障碍,我们在用 400 μM PA 处理的 H9C2 细胞中加入 Mdivi-1。正如预期的那样,线粒体形态分析显示,Mdivi-1 有效抑制了 PA 诱导应激下心肌细胞的线粒体分裂和碎片化(图 5A-B)。重要的是,Mdivi-1 处理显著减少了 LDs 面积并恢复了 LDs-线粒体接触(图 5C-E)。此外,Western blot 显示,Mdivi-1 显著降低了 PA 处理的 H9C2 细胞中 p-Drp1S616 的表达,并增加了 Plin2 和 Plin5 的表达(图 5F-I)。这些结果表明,Mdivi-1 处理抑制了 PA 诱导的线粒体分裂,并恢复了 H9C2 细胞中的 LDs-线粒体接触障碍。
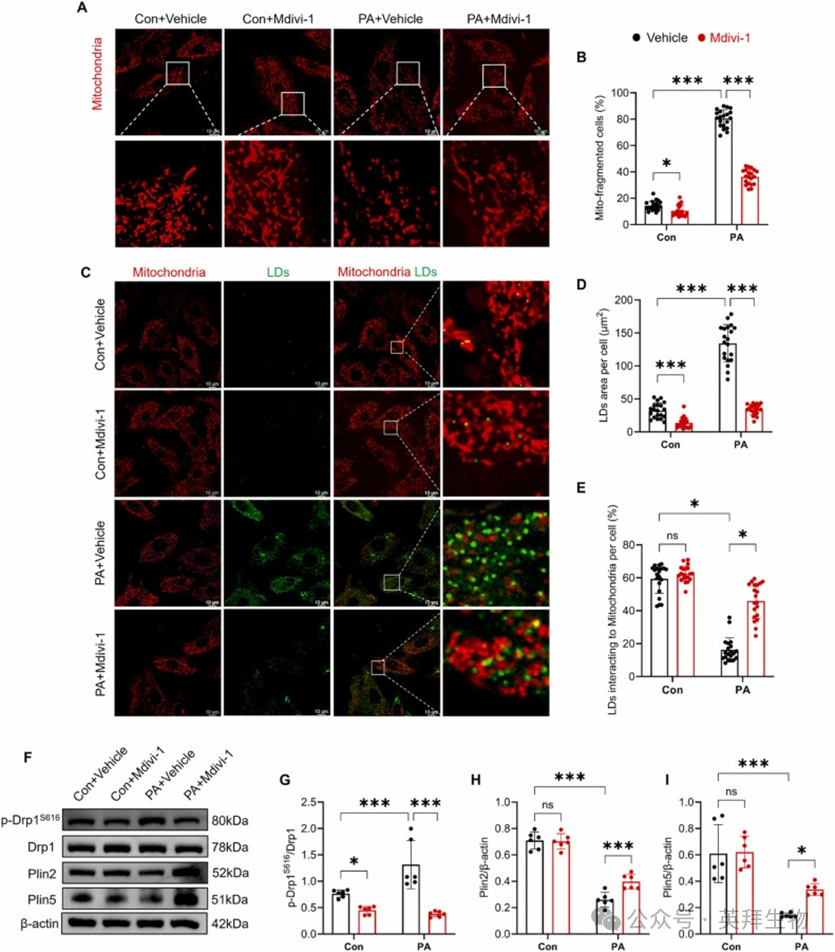
图5 Mdivi-1 恢复 H9C2 细胞中的 LDs-线粒体接触
6. Mdivi-1 促进脂肪酸从 LDs 向线粒体的转移
先前研究表明,LDs-线粒体接触为脂肪酸从 LDs 向线粒体的转移提供了结构基础 [20]。接下来,我们采用脉冲追踪实验,使用荧光脂肪酸 Bodipy 558/568 C12(Red C12)来检查脂肪酸在 LDs 和线粒体之间的分布。荧光染色结果显示,在正常培养的心肌细胞中,脂肪酸主要定位于线粒体,仅有极少量沉积在 LDs 中(图 6A)。PA 处理后,尽管部分脂肪酸继续进入线粒体,但相当一部分被隔离在 LDs 中。有趣的是,Mdivi-1 促进了脂肪酸从 LDs 向线粒体的转移,这表现为 Red C12 与 LDs 的共定位减少,以及 Red C12 与线粒体的共定位增强(图 6A-C)。此外,Western blot 显示,Mdivi-1 显著上调了 PPARα 和 ATGL 的表达(图 6D-F),表明 Mdivi-1 处理促进了 H9C2 细胞中的脂肪酸氧化和脂质分解。为了研究 Mdivi-1 对线粒体功能的影响,使用 Seahorse XFe24 分析仪评估了线粒体呼吸。我们的结果表明,PA 处理显著降低了线粒体基础呼吸和最大呼吸,而 Mdivi-1 有效减轻了这种损伤(图 6G-I)。
总之,这些结果表明 Mdivi-1 促进了脂肪酸从LDs向线粒体的转运以进行脂肪酸氧化。
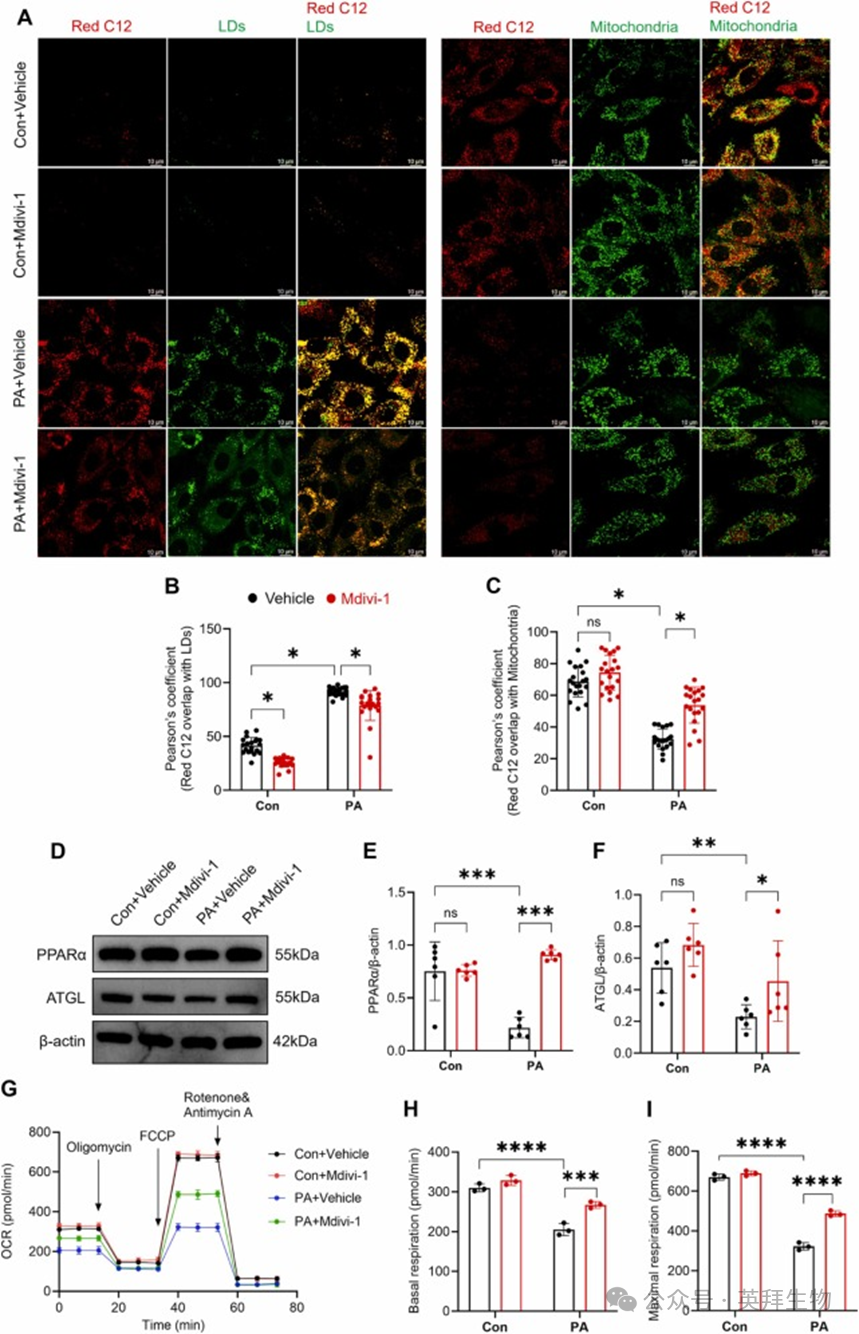
图6 Mdivi-1 促进脂肪酸从 LDs 向线粒体的转移
参考文献
1、Xu Z, Ma Z, Ren H, Yang Y, Zhao X, Zhang B. Mdivi-1 promotes lipid droplets-mitochondria contact and ameliorates cardiac lipotoxicity in high-fat diet-fed mice. Pharmacol Res. 2025 Nov 6:108028.






