花青素功能化硒代半胱氨酸纳米疗法通过抑制氧化应激和铁死亡来缓解顺铂肾毒性
尽管顺铂(CDDP)仍然是临床癌症治疗中广泛使用的化疗药物,但CDDP诱导的严重氧化应激和炎症反应仍然是患者急性肾损伤(AKI)的主要原因。我们之前的研究表明,花青素和硒代半胱氨酸(SeC)具有强大的抗氧化和抗炎特性。在这里,我们成功合成了一种协同纳米治疗的 cyanide-3-O-糖苷官能化SeC纳米粒子(C3G@SeCNP),其通过抑制氧化应激和铁死亡显著减轻CDDP诱导的HK-2细胞损伤。在体内,C3G@SeCNP通过调节MAPK和铁死亡途径缓解AKI。此外,C3G@SeCNP调节AKI小鼠肾脏和脾脏组织中受CDDP破坏的M2巨噬细胞、Treg细胞、CD4+T细胞、MDSC和NK细胞的数量,最终抑制炎症反应。总之,本研究综合了一种协同纳米治疗剂,并系统地阐明了其抗AKI机制,表明C3G@SeCNP可能是缓解CDDP肾毒性的理想纳米粒子。该研究于2025年11发表在《Journal of Nanobiotechnology》,IF 12.6分。
技术路线:
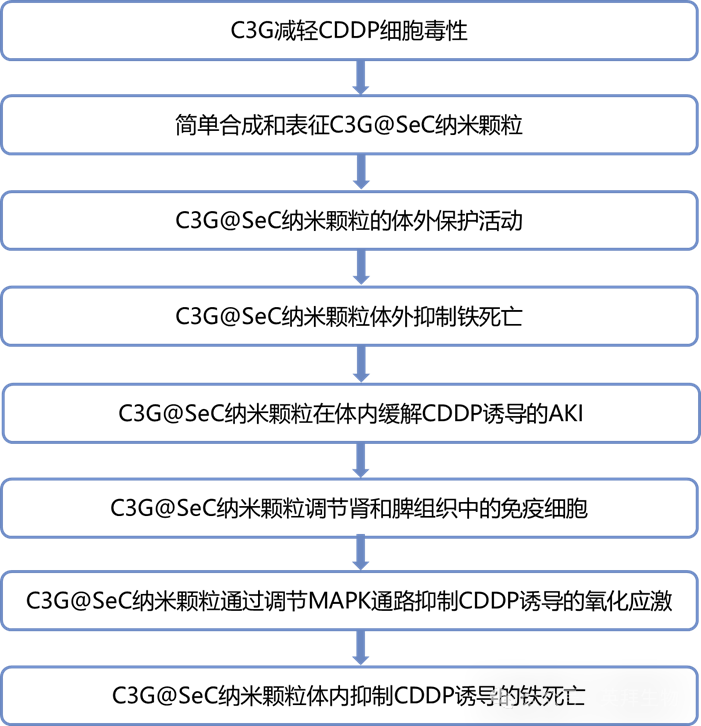
主要研究结果:
1、C3G减轻CDDP细胞毒性
通过CCK-8实验在体外测量了CDDP的细胞毒性。如图2A所示,CDDP显著降低了HK-2细胞的活性,且呈浓度依赖性,在6μg/mL时细胞活性下降约54.7%。因此,选择6μg/mL这一接近IC50值的浓度用于后续实验,以建立CDDP诱导的细胞毒性模型。本研究中使用了三种花青素来评估其保护作用:矢车菊素-3-O-葡萄糖苷(C3G)、锦葵素-3-O-葡萄糖苷(M3G)和矢车菊素-3-O-葡萄糖苷(P3G)(化学结构见图2B)。这些花青素B环上的不同取代基赋予了它们不同的颜色、稳定性和生物活性。值得注意的是,只有C3G显示出显著的保护效果,40μg/mL的C3G处理可将细胞活性损失从49.0%恢复至近36.5%(图2C)。从结构上看,C3G的邻二酚羟基结构比P3G的单酚羟基结构和M3G的结构(3'和5'位置含有两个甲氧基)具有更强的自由基清除能力,这一特性可能是C3G具有更强抗氧化活性的原因。
先前的研究已证实CDDP可导致细胞周期阻滞和凋亡。进一步采用PI染色评估花青素介导的细胞周期分布变化。流式细胞仪的结果显示,CDDP诱导HK-2细胞显著阻滞于G0/G1期,这一现象可被C3G处理缓解(图2D和E)。相比之下,M3G和P3G均无显著效果。此外,CDDP显著增加了亚G1期的细胞比例(图2F),而这一增加可被C3G抑制。值得注意的是,C3G将亚G1期细胞比例降低至8.3%,显著低于单独使用CDDP(19.7%)或CDDP+M3G(12.5%)。单独使用C3G、M3G或P3G处理均未影响细胞活性或周期分布。综上所述,这些结果表明C3G作为一种有前景的辅助治疗候选药物,可用于缓解CDDP诱导的细胞毒性。
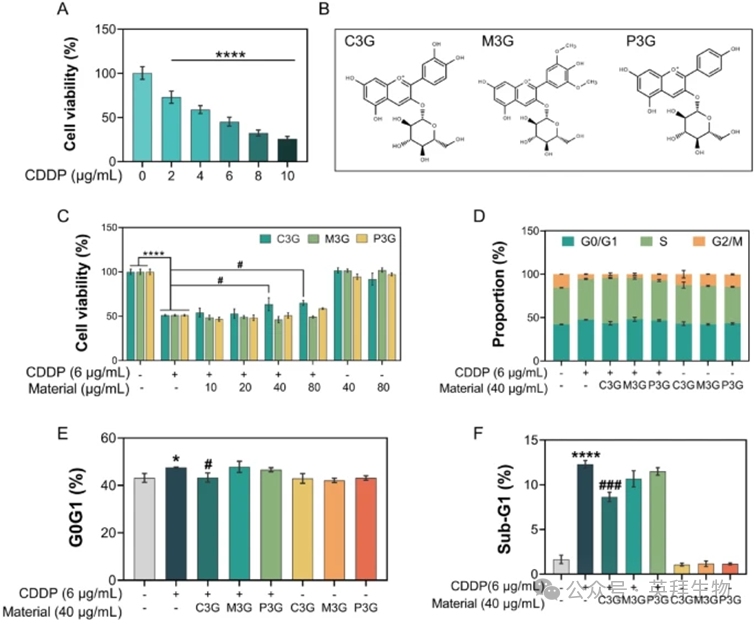
图2:C3G、M3G和P3G对CDDP细胞毒性的保护作用
2、简单合成和表征C3G@SeC纳米颗粒
纳米技术在疾病治疗中的应用可增加天然化合物或其他生物活性化合物的溶解度和生物利用度。在本研究中,采用一系列聚合物基质(PLGA-PEG、PF127/TA和PAA/PVP)制备负载SeC和C3G的纳米颗粒。如图3A所示,基于PAA/PVP的C3G@SeC NPs展现出优越的包封效率,分别达到10%(SeC)和60%(C3G),从而实现了SeC与C3G的质量比为1:25。相比之下,PLGA-PEG和PF127/TA配方的SeC包封率极低(<1%)。对比分析显示,单载C3G和SeC的纳米颗粒的包封效率分别为75%和67%(图3B),而双载C3G@SeC NPs保持了61%的C3G包封率和10%的SeC包封率。SeC包封率的降低可能是由于C3G和SeC之间对PAA/PVP基质中带负电的羧基的竞争性结合。动态光散射分析(图3C-E)显示,C3G NPs、SeC NPs和C3G@SeC NPs的流体动力学直径分别为1400±120nm、240±30nm和570±45nm。C3G@SeC NPs的zeta电位为-32.0±0.6mV,C3G NPs为-18.3±0.6mV,SeC NPs为-13.6±0.5mV,所有颗粒均表现出负zeta电位(图3F)。在水溶液中进行的稳定性评估确认,在7天内纳米颗粒的流体动力学直径变化小于5%(图3G),表明其具有优异的结构完整性和潜在的持续释放能力。
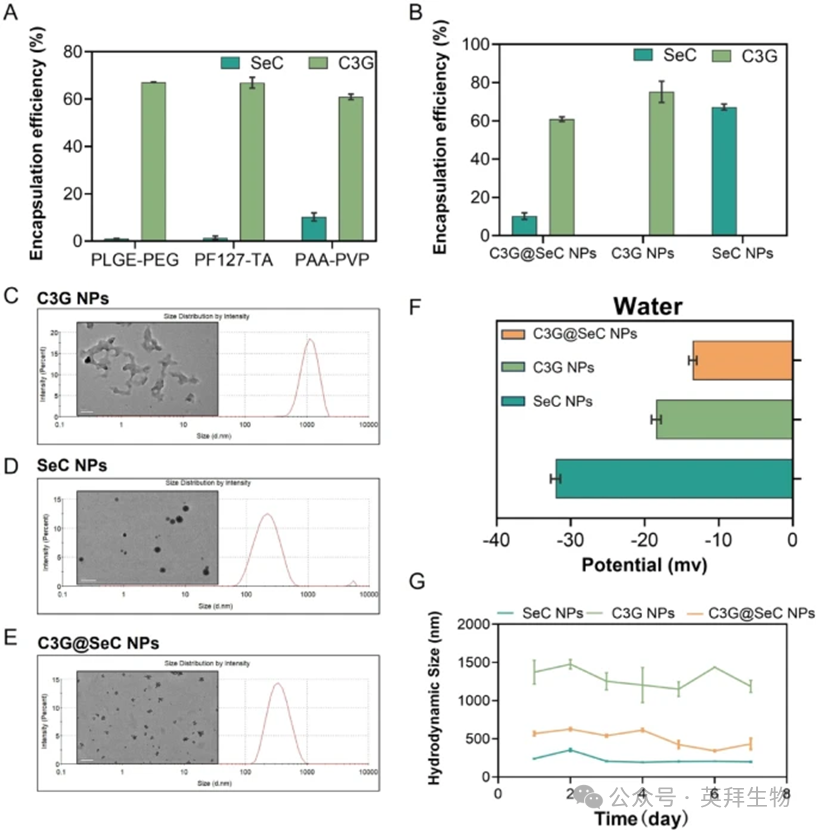
图3:C3G纳米颗粒、SeC纳米颗粒和C3G@SeC纳米颗粒的合成和表征
3、C3G@SeC纳米颗粒的体外保护活动
为评估新合成的纳米颗粒对CDDP细胞毒性的保护作用,我们在CDDP暴露前对HK-2细胞进行纳米颗粒预处理。如图4A所示,所有纳米颗粒均以剂量依赖性方式挽救了CDDP诱导的活性损失,只有C3G@SeC NPs(5μg/mL)显著恢复了细胞活性,从68.0%提高至近86.6%。当HeLa和HepG2细胞用3μg/mL的CDDP处理时,细胞活性分别下降约22.3%和22.0%(图4B和C)。值得注意的是,单独使用C3G@SeC NPs(5μg/mL)处理也分别降低了HeLa和HepG2细胞的活性约20.8%和22.5%。当与CDDP联合使用时,C3G@SeC NPs协同增强了CDDP的抗肿瘤活性,细胞活性分别下降约26.8%和30.0%,这表明C3G@SeC NPs处理并未影响CDDP的抗肿瘤效果。采用DCFH-DA探针测量ROS的产生,并通过共聚焦显微镜拍摄荧光图像。结果表明,C3G@SeC NPs处理12小时显著减少CDDP诱导的ROS产生(图4D),DCFH-DA荧光强度随时间的变化分析结果见图4E。与CDDP组相比,随后用C3G@SeC NPs、SeC NPs或C3G NPs处理可分别降低ROS水平约19.8%、15.7%和11.4%,只有C3G@SeC NPs组显示出统计学上的显著差异。此外,单独使用C3G@SeC NPs处理组的ROS水平甚至比对照组降低了14%。先前的研究已报告ROS可破坏线粒体结构和功能,从而加剧肾毒性。我们进一步通过流式细胞仪采用JC-1探针分析线粒体膜电位(MMP)。结果表明,CDDP处理诱导JC-1(绿色)阳性细胞显著增加,表明MMP显著去极化,这一现象可被C3G@SeC NPs、C3G NPs和SeC NPs缓解(图4F和G)。C3G@SeC NPs展现出最佳的MMP恢复效果。综上所述,这些结果表明合成的纳米颗粒,特别是C3G@SeC NPs,有效地缓解了CDDP的细胞毒性,通过抑制ROS介导的线粒体损伤。
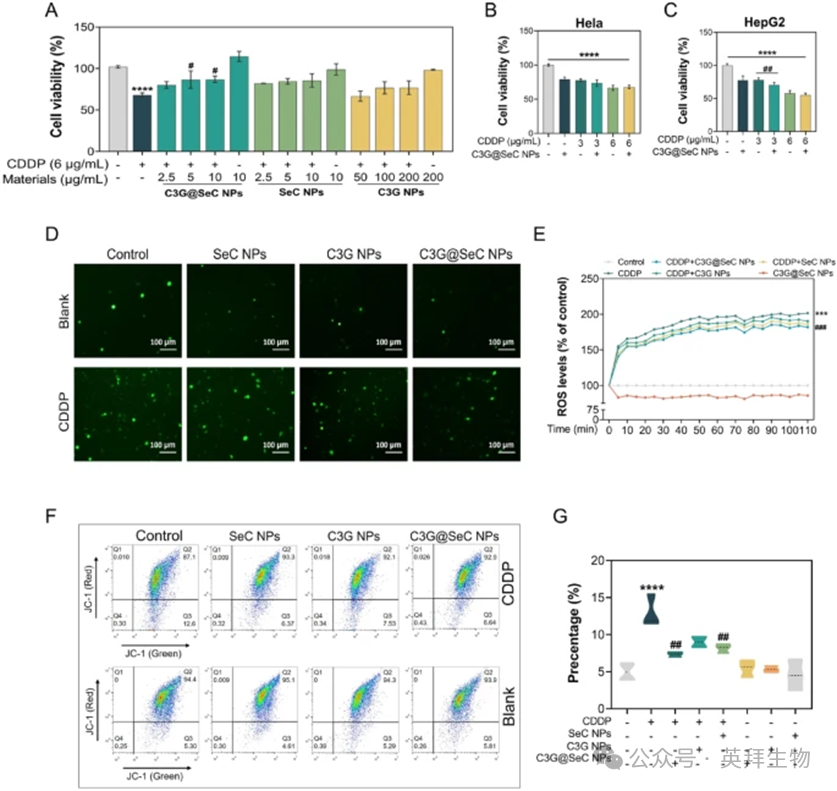
图4:C3G@SeC纳米颗粒通过减少ROS生成和线粒体损伤来减轻CDDP细胞毒性
4、C3G@SeC纳米颗粒体外抑制铁死亡
越来越多的证据表明,CDDP通过扰乱铁代谢诱导AKI,导致大量铁离子积累,随后触发脂质过氧化介导的铁死亡。我们采用系统的药理学干预措施研究C3G@SeC NPs的铁死亡抑制潜力。如图5A所示,用铁螯合剂去铁胺(DFO)、铁死亡抑制剂铁抑素-1(Fer-1)或C3G@SeC NPs(5μg/mL)预处理可有效挽救CDDP诱导的HK-2细胞活性降低,从43.32%恢复至31.51%、35.87%和27.89%,缓解CDDP的细胞毒性。此外,C3G@SeC NPs(5μg/mL)、DFO和Fer-1显著挽救了RSL3(4μg/mL)诱导的细胞活性降低,从53.57%恢复至23.23%、37.56%和40.64%,从而缓解了HK-2细胞中的铁死亡(图5B)。RSL3是一种已知的铁死亡激活剂。值得注意的是,与DFO和Fer-1相比,C3G@SeC NPs展现出更强的保护效果。鉴于铁死亡对线粒体功能障碍的影响,我们采用JC-1探针测量MMP。正如预期,RSL3处理诱导了严重的MMP去极化,这一现象可被C3G@SeC NPs和DFO缓解(图5C和D)。Mito-Tracker成像进一步证实了这些结果(图S1)。此外,采用RhoNox-1探针(红色)检测RSL3诱导的铁离子积累,与对照组相比,RSL3处理诱导了强烈的红色荧光,这一现象可被C3G@SeC NPs或DFO显著抑制(图5E和F)。随后,Liperfluo荧光强度的定量分析(图5G)和相应成像(图S2)表明,C3G@SeC NPs和DFO有效抑制了RSL3诱导的脂质过氧化。丙二醛(MDA)是脂质过氧化的终产物之一,结果表明C3G@SeC NPs抑制了RSL3诱导的MDA升高(图5H)。此外,C3G@SeC NPs挽救了RSL3诱导的抗氧化蛋白GSH(图5I)和GPX4(图5J)的耗竭。综上所述,C3G@SeC NPs通过减少MDA产生和恢复抗氧化蛋白的表达,缓解了RSL3诱导的脂质过氧化依赖性铁死亡。
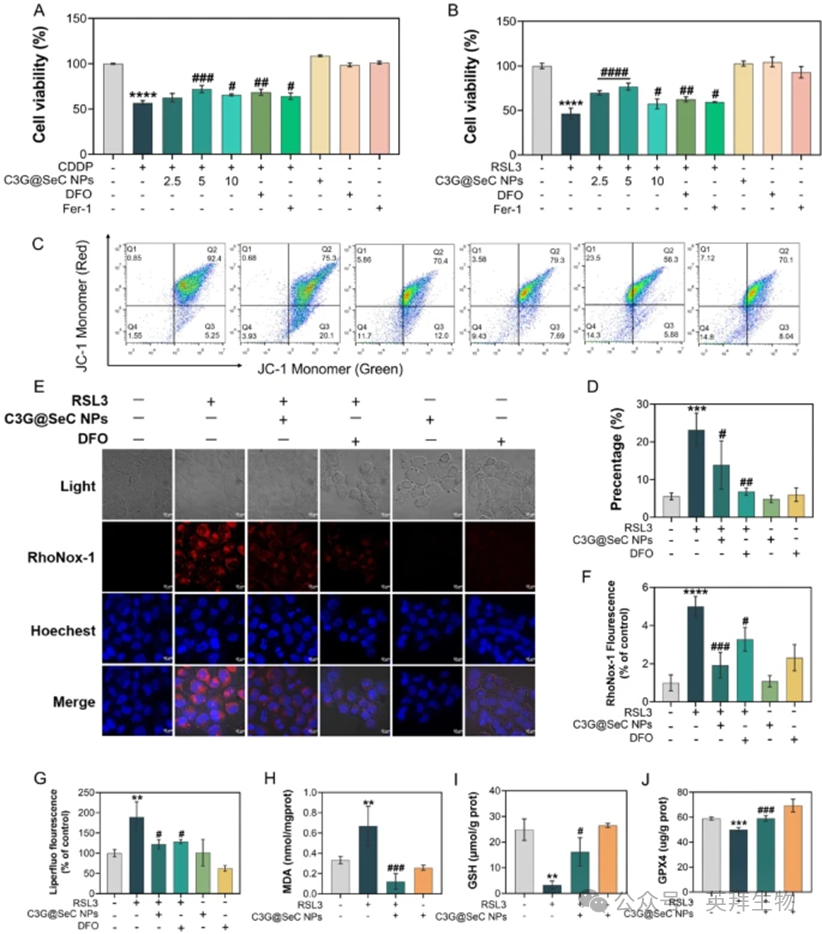
图5:C3G@SeC纳米颗粒通过减少脂质过氧化诱导的铁死亡来减轻CDDP细胞毒性
5、C3G@SeC纳米颗粒在体内缓解CDDP诱导的AKI
为评估纳米颗粒对CDDP诱导的AKI的肾脏保护功效,我们建立了小鼠AKI模型(图6A)。如图6B所示,用生理盐水(对照组)、C3G@SeC NPs、C3G NPs或SeC NPs预处理的小鼠在4天内与对照组相比体重无显著差异。然而,腹腔注射CDDP(15mg/kg)导致所有处理组小鼠体重显著下降。值得注意的是,口服C3G@SeC NPs、C3G NPs或SeC NPs部分缓解了CDDP诱导的体重下降。hematoxylin-伊红(H&E)染色的组织病理学分析显示,CDDP组小鼠肾脏损伤严重,表现为肾小管上皮细胞坏死、肾小球淤血和间质水肿,而纳米颗粒处理显著改善了肾脏组织损伤(图6C)。此外,CDDP诱导的肾功能生化标志物升高,包括尿素(UREA)、肌酐(CREA)和尿酸(UA),在纳米颗粒处理后降低(图6D–F)。C3G@SeC NPs(2mg/kg)展现出最强的保护效果。肝功能标志物(AST、ALT)也通过纳米颗粒处理降低(图6G和H)。综上所述,这些结果表明纳米颗粒,特别是C3G@SeC NPs,对CDDP诱导的AKI具有显著的保护作用。
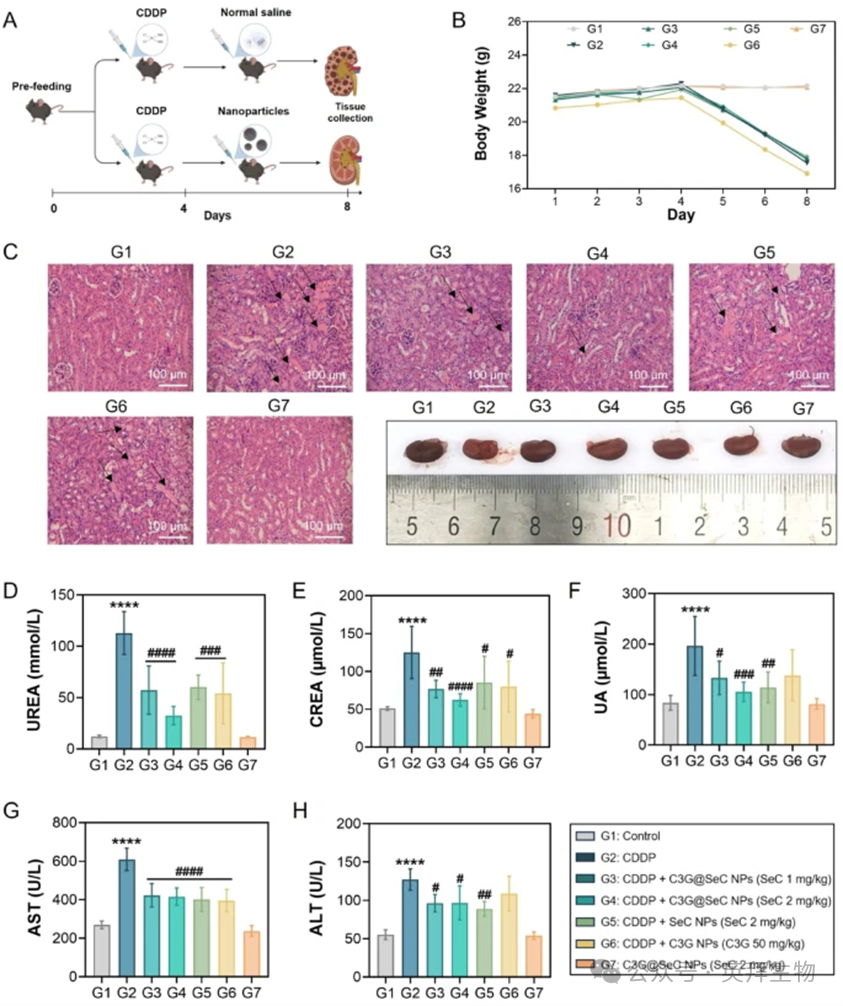
图6:C3G@SeC NPs可改善AKI小鼠的肾损伤
6、C3G@SeC纳米颗粒调节肾和脾组织中的免疫细胞
AKI的文献指出,在CDDP治疗期间,免疫细胞浸润到肾脏中引发炎症反应,这可能加剧组织损伤并促进AKI的进展。大量免疫细胞被招募到受损肾脏组织中,其中巨噬细胞在先天免疫系统中发挥关键作用。在这些细胞中,M1(促炎性)和M2(抗炎性/修复性)表型代表了两种经典的极化状态,它们在肾脏损伤过程中发挥相反的作用。在肾脏损伤的早期阶段,M1巨噬细胞占主导地位,释放大量炎症因子并招募更多免疫细胞到损伤部位。在肾脏损伤的中晚期,巨噬细胞逐渐向M2表型极化。这些M2巨噬细胞分泌抗炎因子,如IL-10和TGF-β,它们不仅能抑制过度的炎症反应,还能抑制肾小管细胞凋亡。T细胞,包括CD4+T细胞,可分化为不同的亚型,如Th1细胞或Th2细胞,并分泌细胞因子以维持炎症。调节性T细胞(Tregs)对免疫抑制至关重要,可减轻炎症并调节氧化应激。此外,NK细胞通过细胞毒性介质(如穿孔素和颗粒酶)靶向受损肾小管上皮细胞,从而加剧肾脏损伤。在本研究中,我们采用流式细胞仪分析肾脏组织中不同类型免疫细胞的分布(图S3A)。如图7B和C所示,与对照组相比,CDDP组小鼠肾脏中M2巨噬细胞(CD45+CD11b+F4/80+CD206+)和Tregs(CD3+CD25+FOXP3+)的比例显著降低。值得注意的是,C3G@SeC NPs、C3G NPs或SeC NPs处理部分恢复了M2巨噬细胞和Tregs的比例,其中C3G@SeC NPs(2mg/kg)展现出最强的恢复效果。此外,CDDP组小鼠肾脏中CD4+T细胞(CD3+CD4+)的比例显著增加(图7E),而C3G@SeC NPs处理显著降低了这一比例。在所有组中,MDSCs(CD45+CD11b+Gr-1+)(图7A)和NK细胞(CD45+CD3−NK1.1+)(图7D)的比例均无显著差异。脾脏是免疫细胞的重要储存库,用于维持免疫稳态。脾脏组织中免疫细胞的流式细胞仪分析(图S3B)表明,各组间M2巨噬细胞(CD45+CD11b+F4/80+CD206+)的比例无显著差异(图7G)。然而,CDDP处理显著降低了MDSCs(图7H)和NK细胞(图7F)的比例,这一现象可被C3G@SeC NPs处理逆转。此外,我们采用ELISA分析肾脏组织中炎症因子的表达。结果表明,与对照组相比,CDDP组小鼠肾脏中促炎因子TNF-α、IL-6和IL-1β的水平显著上调,而这些炎症水平可被C3G@SeC NPs显著抑制(图7I、J和L)。在所有组中,抗炎因子IL-10(图7K)的水平均无显著差异。此外,单独使用C3G@SeC NPs处理并未影响免疫细胞比例或炎症因子的产生。综上所述,这些结果表明C3G@SeC NPs通过调节免疫细胞浸润和炎症反应缓解AKI。
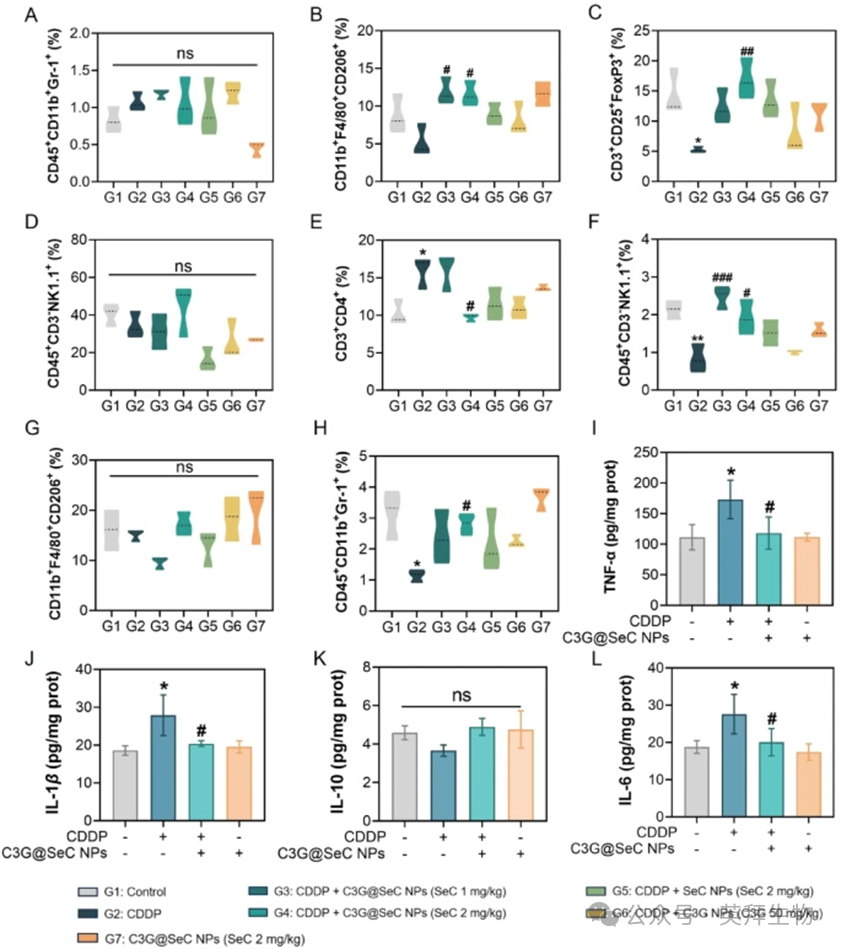
图7:C3G@SeC NPs在体内调节免疫细胞和炎症细胞因子
7、C3G@SeC纳米颗粒通过调节MAPK通路抑制CDDP诱导的氧化应激
CDDP在肾脏中代谢产生的过量ROS是AKI的关键机制,它参与了包括线粒体功能障碍、铁死亡和炎症细胞激活在内的病理过程。为表征这一现象,我们首先测量了肾脏组织中抗氧化蛋白的表达。如图8A和B所示,与对照组相比,CDDP处理显著降低了GSH和SOD的水平,而C3G@SeC NPs(2mg/kg)将它们恢复至接近正常水平。ELISA分析进一步表明,CDDP处理显著下调了肾脏组织中TrxR1、GPX4和GPX1的表达(图8C-E),这一现象可被C3G@SeC NPs逆转。此外,Western blot(WB)分析(图8F)显示,C3G@SeC NPs挽救了CDDP诱导的SOD2(图8G)和CAT(图8H)蛋白表达下降。为了探索C3G@SeC NPs的保护机制,我们通过WB分析了JNK、ERK和P38的磷酸化水平(图8F)。如图1所示,在氧化应激条件下,MAPK通路会被激活,并参与调节抗氧化反应和细胞损伤。值得注意的是,C3G@SeC NPs显著抑制了CDDP诱导的p38、JNK和ERK的磷酸化(图8I-K)。单独使用C3G@SeC NPs处理并未影响基础抗氧化蛋白或与MAPK相关的蛋白表达。
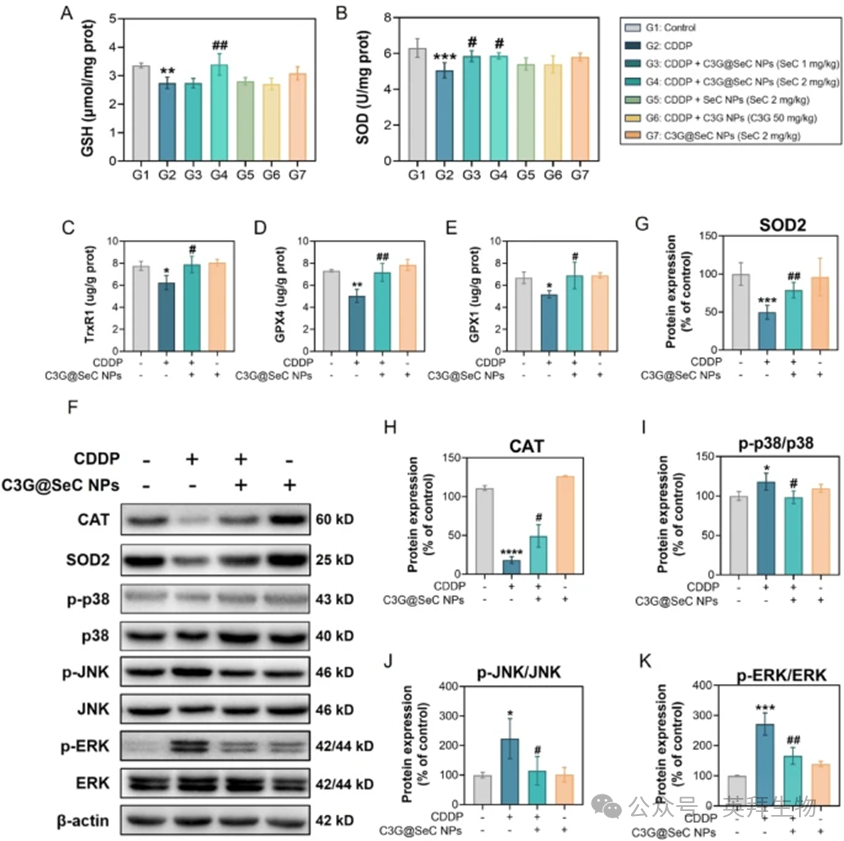
图8:C3G@SeC NPs调节肾组织中的抗氧化蛋白表达和MAPK通路
8、C3G@SeC纳米颗粒体内抑制CDDP诱导的铁死亡
铁死亡已被报道通过铁依赖性脂质过氧化诱导AKI。DAB增强的普鲁士蓝染色显示CDDP组小鼠肾脏铁水平显著升高,这一现象可被C3G@SeC NPs降低(图9A)。4-HNE(脂质过氧化标志物)的免疫组化染色显示出与铁积累相似的趋势,脂质过氧化水平在CDDP组增加,而纳米颗粒处理后降低。此外,ELISA分析表明,CDDP组小鼠肾脏中MDA水平上调,而纳米颗粒处理,特别是C3G@SeC NPs处理,将其恢复至接近对照组水平(图9C)。如图1所示,CDDP通过调节铁依赖性脂质过氧化和相关蛋白诱导铁死亡。因此,我们采用WB分析评估铁死亡相关蛋白,结果表明,与对照组相比,CDDP处理显著下调了Nrf2、HO-1、xCT和GPX4的表达(图9B和D),而C3G@SeC NPs挽救了这些蛋白的表达。相反,CDDP处理显著上调了Keap1和ACSL4的表达(图9B和D)。Keap1被报道为Nrf2的调节因子,而ACSL4通过增强花生四烯酸掺入膜磷脂促进铁死亡。Keap1和ACSL4均被C3G@SeC NPs下调,进一步证实了C3G@SeC NPs通过铁死亡抑制缓解AKI的作用。硒在人体中主要以SeC和硒代蛋氨酸(Se-Met)的形式存在,它通过调节铁代谢抑制AKI。具体而言,SeC通过调节铁蛋白和转铁蛋白受体的表达抑制铁过载诱导的芬顿反应和铁死亡。采用高效液相色谱-电感耦合等离子体质谱(HPLC-ICP-MS)测量,与对照组相比,CDDP组小鼠肾脏中SeC水平下降了近50%(图9E和F),而C3G@SeC NPs、SeC NPs和C3G NPs处理后显著增加。值得注意的是,C3G@SeC NPs处理使SeC水平增加了约4倍。这一SeC水平的恢复对于缓解CDDP诱导的AKI至关重要。此外,单独使用C3G@SeC NPs处理并未影响铁死亡相关蛋白的基础表达、MDA水平或SeC水平。
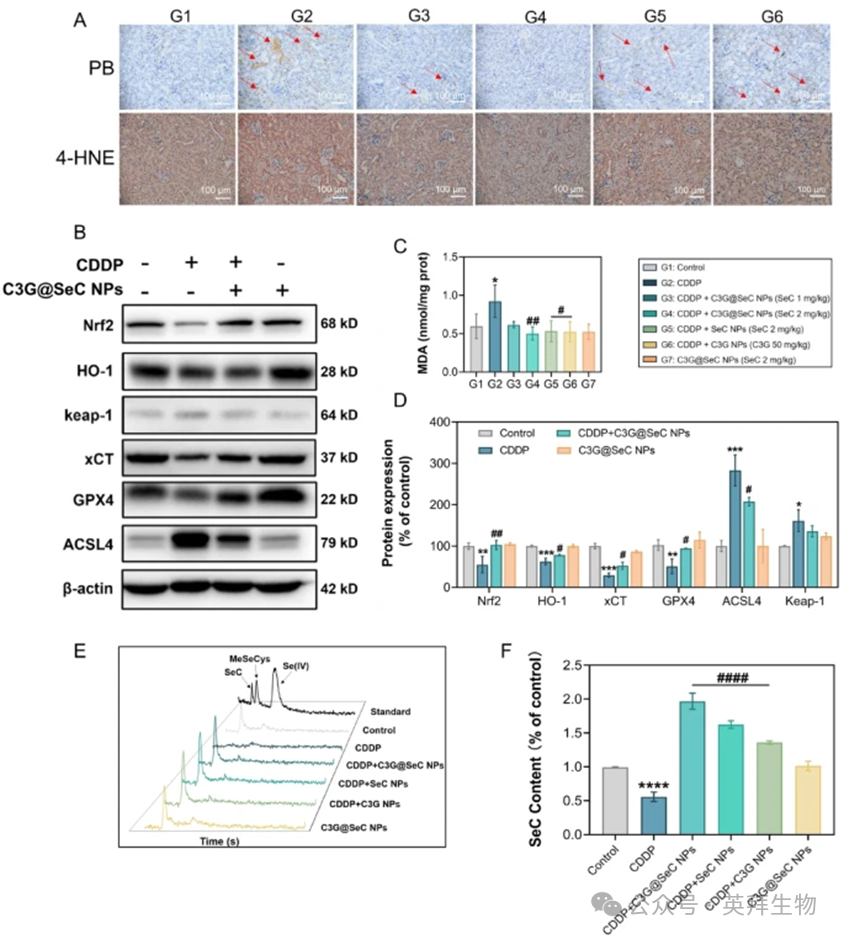
图9:C3G@SeC NPs通过调节肾组织中铁死亡相关蛋白的表达来抑制脂质过氧化诱导的铁死亡
结论:
总之,本研究成功合成了一种新型功能纳米颗粒,旨在减轻癌症治疗过程中CDDP的肾毒性。体外实验表明C3G@SeC与CDDP组相比,NPs处理减少了HK-2细胞的损伤,并显著恢复细胞活力。体内研究进一步证实C3G@SeC NPs治疗显著减轻AKI小鼠的肾组织损伤,改善肾功能的生化标志物。机制上,保护作用C3G@SeCNP主要与氧化应激的改善、MAPK途径蛋白磷酸化的调节、铁死亡相关蛋白表达的调节以及对肾脏免疫微环境的影响有关。这种基于C3G和SeC协同调节机制的功能性纳米药物干预策略为预防和治疗CDDP相关AKI提供了一种极具前景的治疗方法。
参考文献:
Zhu H, Wu X, Tan Y, Shi L, Bai W, Li X. Anthocyanin-functionalized selenocysteine nanotherapeutics alleviate cisplatin nephrotoxicity by inhibiting oxidative stress and ferroptosis. J Nanobiotechnology. 2025 Nov 5;23(1):703. doi: 10.1186/s12951-025-03741-z. PMID: 41194109.






