《Cell Research》重磅:自闭症相关蛋白如何“塑造”大脑左右差异?
左右半球之间的结构和功能差异是大脑组织的基本方面,并且在进化上是保守的。在哺乳动物,特别是人类中,大脑偏侧化在高级神经功能中起着至关重要的作用,例如语言、言语、记忆、意识和认知。例如,160多年前就发现左半球布罗卡区的损伤会导致表达性失语症。后来,发现右半球的病变会导致情绪表达减退和不适当的冷漠。脑偏侧化异常与各种神经精神疾病有关,包括自闭症谱系障碍(ASD)、精神分裂症和帕金森病。尽管科学家们一直努力揭开大脑偏侧化的奥秘,但直到最近的研究才揭示了斑马鱼上丘脑不对称的一些机制。在更复杂的哺乳动物物种中,大脑偏侧化的分子基础及其异常与自闭症谱系障碍等疾病之间的因果关系仍然是一个谜。
自闭症谱系障碍的特征是社交互动受损和重复的刻板行为,是儿童最常见的精神障碍之一。新出现的证据表明,ASD患者的非典型脑偏侧化可能代表核心症状的神经生物学基础。神经影像学研究揭示了灰质和白质偏侧化的广泛异常,包括高阶关联皮层和语言相关区域的不对称性减少。在功能水平上,ASD患者在与语言相关的大脑区域(例如布罗卡区和颞上回)表现出显着减少的左侧化,通常表现出双侧甚至右侧化激活,更大的减少与症状的严重程度相关。此外,患有自闭症谱系障碍的人经常表现出社交认知网络的异常功能活动,同时右半球默认模式网络内的连接性降低。值得注意的是,据报道,自闭症谱系障碍患者纹状体内的偏侧化模式发生了改变。人类尾状核,类似于啮齿动物的背内侧纹状体(DMS),表现出固有的向右体积偏侧化。这种特征性的神经不对称在自闭症谱系障碍人群中变得明显减弱,涉及纹状体功能障碍的发病机制。然而,目前的研究在很大程度上仍然是现象学研究,机制见解有待阐明。该研究2025年9月发表在《Cell Research》,IF:25.9。
技术路线:

主要研究结果:
1、双侧纹状体蛋白质磷酸化的不对称性
鉴于纹状体在协调多方面神经功能方面的关键作用及其与ASD的密切关联,我们使用综合蛋白质组学和最近改进的磷酸蛋白质组学分析对双侧纹状体差异进行了研究。在野生型(WT)小鼠的背侧纹状体中,共鉴定出5942种蛋白质和21630个磷酸化位点,涵盖3897种磷蛋白(图1a)。考虑到纹状体两侧之间的细微差异,仅在一侧(至少两个样品中)检测到或显示倍数变化>1.25或< 0.8且P值<0.05的蛋白质和磷酸化位点被认为显着差异。我们鉴定出左纹状体有688个磷酸化水平较高的磷酸化位点,右纹状体有558个磷酸化位点(图1b)。对325个左上磷酸化蛋白和275个右上磷酸化蛋白的基因本体(GO)分析表明,这两组蛋白质都参与磷酸化、突触传递调节、细胞内信号转导、大脑发育、化学突触传递和肌动蛋白细胞骨架组织过程,强调了双侧纹状体的神经活动差异(图1c)。值得注意的是,纹状体的每一侧都有一些偏侧化的生物学过程,例如左侧的学习和右侧的GTP酶活性的激活。此外,我们发现左侧纹状体的基础磷酸化水平更高。
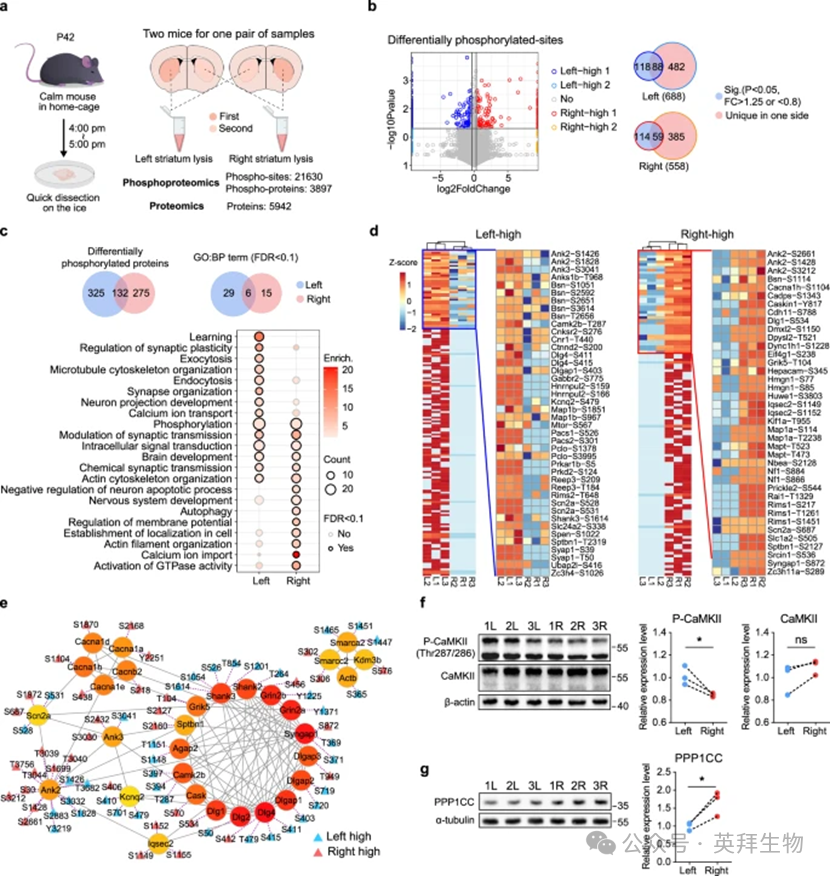
图1. 蛋白质组学和磷酸蛋白质组学揭示的双侧纹状体蛋白质磷酸化的不对称性
2、双侧纹状体之间ASD相关蛋白的不对称磷酸化
为了研究自闭症谱系障碍与半球不对称之间的关系,我们重点关注自闭症相关蛋白质。在142种自闭症相关蛋白中,我们鉴定出178个左侧纹状体磷酸化水平较高的磷酸化位点,右侧有124个磷酸化位点,包括ANK2、CaMK2B和SHANK3(图1d)。然后,我们查询了 STRING 数据库中这些不对称磷酸化的自闭症相关蛋白质的蛋白质-蛋白质相互作用(PPI),并进行了中心分析。值得注意的是,大多数突触后蛋白(如SHANK2、SHANK3和CaMK2B)的不对称磷酸化偏高(图。CaMKII是PSD中的关键激酶,CaMKII β亚型的Thr287(对应于α亚型中的Thr286)是自磷酸化位点,对于在Ca2+没有升高的情况下维持酶活性至关重要并诱导神经元的长期增强。我们证实,CaMK2B-Thr287在左侧纹状体中的磷酸化水平较高(图1f),而右纹状体的PP1催化亚基γ(PPP1CC)水平较高。鉴于PPP1CC特异性集中在PSD中,并负向调节CaMK2B-Thr287的磷酸化,这一结果表明右侧纹状体的磷酸化过程受到更严格的调节。
3、SH3RF2参与纹状体MSN的突触后信号传导
由于SH3RF2调节PP1活性,并且可能与偏侧化大脑功能有关,因此我们继续检查其在小鼠大脑中的时空表达模式。在SH3RF2中+/–(杂合子,HET)小鼠,抗LacZ抗体用于检测SH3RF2的表达,因为其第一个外显子被β-半乳糖苷酶基因取代(图。免疫荧光和蛋白质印迹结果显示,SH3RF2主要在纹状体中表达,包括背侧(dStr)、伏隔核(NAc)和嗅结节(OT)(图2b)。在纹状体内,>90%的纹状体神经元是表达多巴胺受体1型(DRD1)或2型(DRD2)的GABA能中棘神经元(MSN)。我们越过了SH3RF2+/–用Drd1a-Cre/Ai14或Drd2-Cre/Ai14菌株的小鼠荧光标记MSN亚型,发现95.8%的DRD1-MSNs和90.1%的DRD2-MSNs是LacZ,90.8%的LacZ细胞包括DRD1-MSNs(33.8%)和DRD2-MSN(57.0%)(图2c,d)。为了确定SH3RF2的亚细胞定位,我们在培养的MSN中过表达了SH3RF2,发现SH3RF2定位于树突中并集中在PSD中,表现出类似于CaMKII和PPP1CC的模式(图2e)。
为了研究SH3RF2的分子功能,我们通过CRISPR/Cas9生成了SH3RF2-3×标志敲入小鼠,并验证了SH3RF2蛋白主要在纹状体中表达。然后,我们通过免疫共沉淀(co-IP)和质谱法鉴定了SH3RF2-3标志敲入小鼠纹状体中潜在的SH3RF2×相互作用蛋白(图2F)。PPI网络结合GO分析表明,一组SH3RF2相互作用蛋白参与蛋白质磷酸化和去磷酸化,主要靶向丝氨酸/苏氨酸位点。KEGG通路分析显示,SH3RF2与多巴胺能突触通路中的多种激酶(包括CaMK2B和PKC)以及PPP1CC和PPP2CB(PP2A)等磷酸酶的关联(图2g,h)。值得注意的是,24.3%(54/222)的SH3RF2 相互作用蛋白由 ASD 风险基因编码,这一显着富集由χ2证实分析,大多数(49/54)具有至少一个磷酸化位点(图2i)。
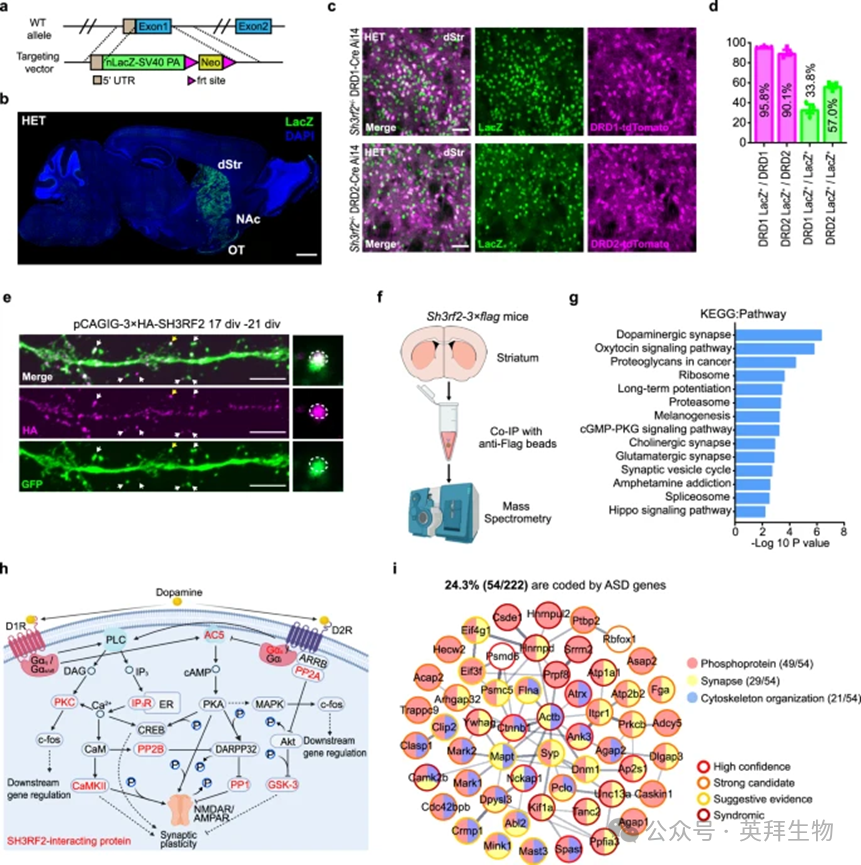
图2. SH3RF2的表达谱及其潜在功能
4、SH3RF2缺失破坏双侧纹状体之间CaMKII的不对称磷酸化
我们的研究结果表明,CaMK2B-Thr287磷酸化和PPP1CC表达在双侧纹状体之间存在不对称分布。因此,我们研究了SH3RF2是否通过调节该 CaMKII/PP1“开关”来促进纹状体偏侧化。内源性co-IP证实SH3RF2可以与纹状体中的CaMKII和PPP1CC相互作用(图3a)。与这些相互作用一致,培养纹状体神经元中的免疫染色表明,SH3RF2在体细胞和树突棘中与PPP1CC和Thr287/286磷酸化的CaMKII高度共定位(图3b)。这些发现表明SH3RF2 在促进 CaMKII 的 PP1 依赖性去磷酸化中发挥作用。为了确定SH3RF2是否充当支架蛋白介导PSD中PPP1CC对CaMKII的去磷酸化,我们检查了CaMKII-PPP1CC与co-IP的相互作用。与WT小鼠相比,SH3RF2 KO小鼠的纹状体组织在CaMKII-PPP1CC复合物形成方面表现出显着减少(~80%)(图3c)。值得注意的是,CaMKII-Thr287/286 的磷酸化水平在 KO 小鼠的双侧纹状体中变得相当,从而消除了在WT小鼠中观察到的双侧纹状体的内在不对称磷酸化模式特征(图3d,e)。
总的来说,这些发现意味着SH3RF2/CaMKII/PPP1CC复合物协调纹状体内各种突触后蛋白的不对称磷酸化,包括那些与 ASD 有关的蛋白。我们提出了一个模型,其中SH3RF2的缺失导致CaMKII即使在Ca没有升高的情况下也能维持Thr287/286的磷酸化和激酶活性2+水平,可能诱导α-氨基-3-羟基-5-甲基异恶唑-4-受体(AMPAR)亚基 GluR1 的磷酸化,GluR1是CaMKII的直接靶标。由于GluR1-Ser831的磷酸化可以促进AMPAR靶向PSD并募集到突触后膜,SH3RF2的缺失可能会影响AMPAR功能(图3f)。
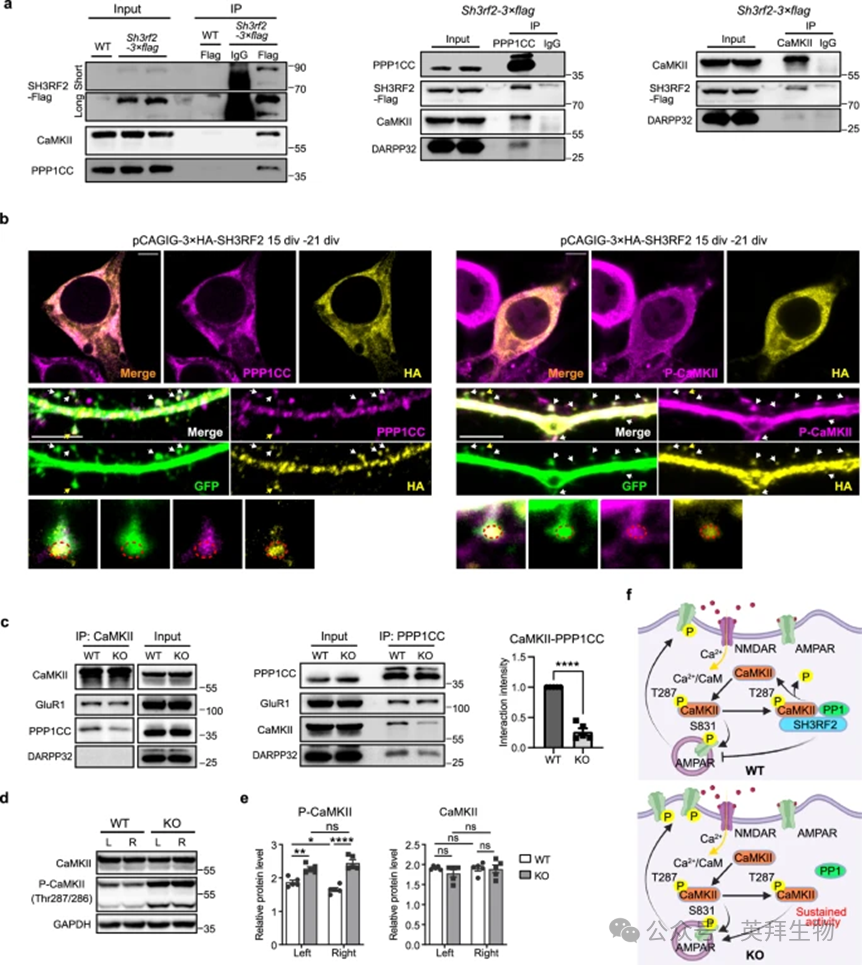
图3. SH3RF2/CaMKII/PPP1CC蛋白复合物
5、SH3RF2缺失消除了双侧纹状体之间PSD中GluR1的不对称表达
为了研究AMPARs是否受到SH3RF2缺失的影响,我们对纹状体组织进行了亚细胞分离。我们的研究结果表明,PSD定位的GluR1(PSD-GluR1)在WT小鼠的右纹状体与左纹状体中表达水平更高(图4a,b)。值得注意的是,在SH3RF2 KO小鼠中,PSD-GluR1在左侧纹状体中的表达显着升高,达到与右侧纹状体相当的水平,从而破坏了在WT小鼠中观察到的PSD-GluR1的不对称表达(图4a,b)。其他突触后蛋白(包括 PSD-95、GluR2和N-甲基-D-天冬氨酸受体(NMDAR)亚基 NR1、NR2A和NR2B)的表达水平在左右纹状体之间没有显着差异,并且不受SH3RF2缺失的影响(图4a,c-g)。有趣的是,相对于 WT 对照,SH3RF2 KO小鼠左纹状体中的GluR1-Ser831磷酸化特异性升高,而总GluR1水平保持不变(图4h,i)。
总之,我们提出SH3RF2通过与CaMKII和PPP1CC形成复合物参与纹状体偏侧化的分子机制(图4j)。与左纹状体相比,PPP1CC表达较高,右侧纹状体中CaMKII-Thr287/286的基础磷酸化水平较低。此外,右纹状体中的MSN具有更多的突触后 AMPAR。当SH3RF2不存在时,CaMKII失去PPP1CC的调节,导致CaMKII-Thr287/286的磷酸化水平升高。激活的CaMKII进一步磷酸化 AMPAR亚基GluR1的Ser831。然而,由于PPP1CC在右侧纹状体中的表达较高,磷酸化过程受到更严格的调节,可能导致GluR1-Ser831磷酸化的增加仅发生在左侧纹状体。这促进了AMPAR向突触后膜的募集,从而破坏了AMPAR的原始不对称性,从而损害了纹状体功能偏侧化。
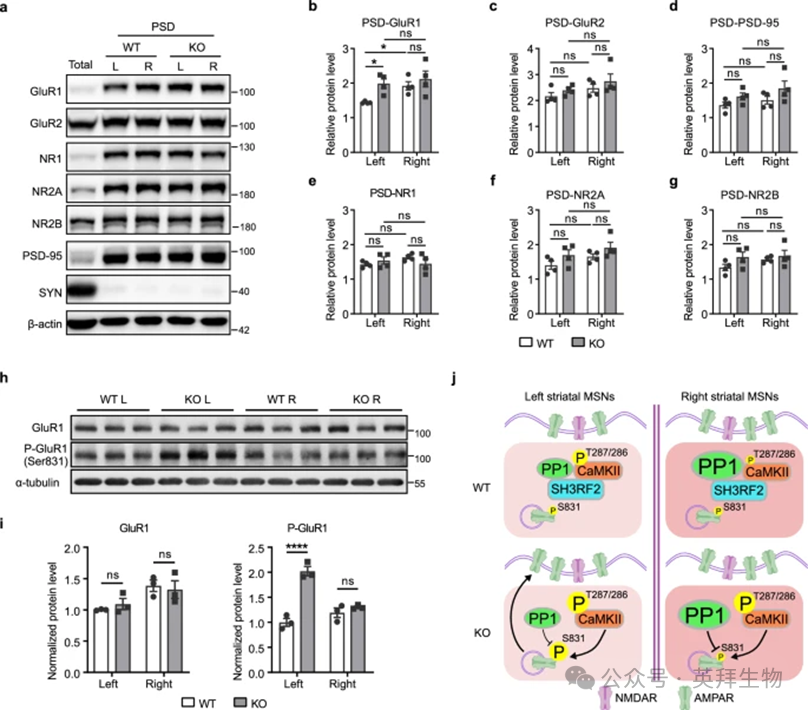
图4. SH3RF2/CaMKII/PPP1CC复合物调节GluR1在PSD上的不对称表达
6、SH3RF2缺失破坏纹状体DRD1-MSN的右侧化
接下来,我们检查了SH3RF2是否在纹状体偏侧化中发挥作用。利用腺相关病毒(AAV),我们在DMS中分别稀疏标记纹状体DRD1-MSN和DRD2-MSN。在SH3RF2 KO小鼠中,左侧纹状体中DRD1-MSNs的树突复杂性显着增加,而在右侧纹状体中没有观察到这种增加(图5a)。这种变化消除了右纹状体与左纹状体中DRD1-MSNs显着更高的树突复杂性,这是WT小鼠的一个特征(图5b)。相比之下,SH3RF2 KO小鼠中DRD2-MSNs的树突复杂性在左纹状体中显着降低,但在右纹状体中保持不变,在WT或KO小鼠中没有明显的左右差异(图5c,d)。
随后,重建了DRD1-MSNs和DRD2-MSNs的树突棘,并评估了它们的密度和体积。在SH3RF2 KO小鼠中,左侧纹状体的DRD1-MSN脊柱密度显着增加,而右侧纹状体的脊柱体积呈下降趋势(图5e,f)。对于DRD2-MSN,WT和KO小鼠的左右纹状体中,总脊柱的密度和体积以及四种特定脊柱类型的密度和体积保持一致(图5g,h)。
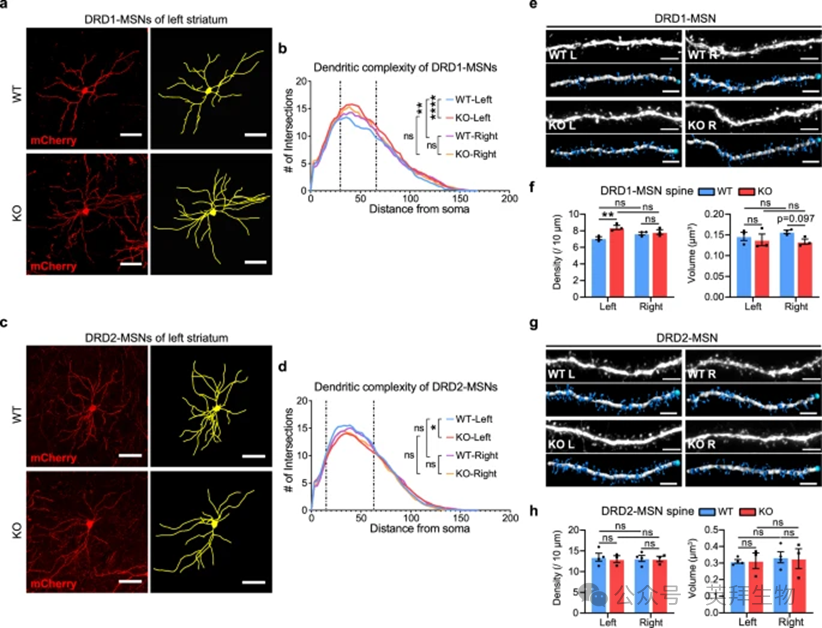
图5. SH3RF2缺陷导致左右纹状体DRD1-MSN和DRD2-MSN的树突复杂性和脊柱形态发生不同的改变
为了探索SH3RF2缺失在突触传递中的功能意义,我们对成年小鼠DMS中的DRD1-MSN和DRD2-MSN进行了全细胞膜片钳记录(图6a,f)。在KO小鼠中,AMPAR介导的诱发兴奋性突触后电流(EPSC)与NMDAR介导的DRD1-MSNs的EPSCs的比率在左侧纹状体中显着增加,反映了右侧纹状体中的比例,并破坏了AMPAR / NMDAR比率的不对称性,如WT小鼠中所见(图6b,c)。此外,在 D-AP5 阻断NMDAR后,AMPAR介导的EPSC在-70mV与+40 mV 时的 EPSC 之比确定的整流指数在KO小鼠的左纹状体中也显着增加,但在右侧纹状体中没有显着增加(图6d,e)。然而,左右纹状体的AMPAR/NMDAR比值或DRD2-MSNs的AMPAR校正指数没有显著差异,并且SH3RF2缺失没有改变这两个指标(图6g-j)。
AMPAR是由GluR1-GluR4亚基组合组成的四聚体谷氨酸门控离子通道。缺乏GluR2的AMPAR(主要是GluR1同源体)表现出钙通透性,电导率高,向内整流强,从而增强突触传递。因此,整流指数的升高意味着SH3RF2 KO小鼠左侧纹状体DRD1-MSNs的病理性亢奋。
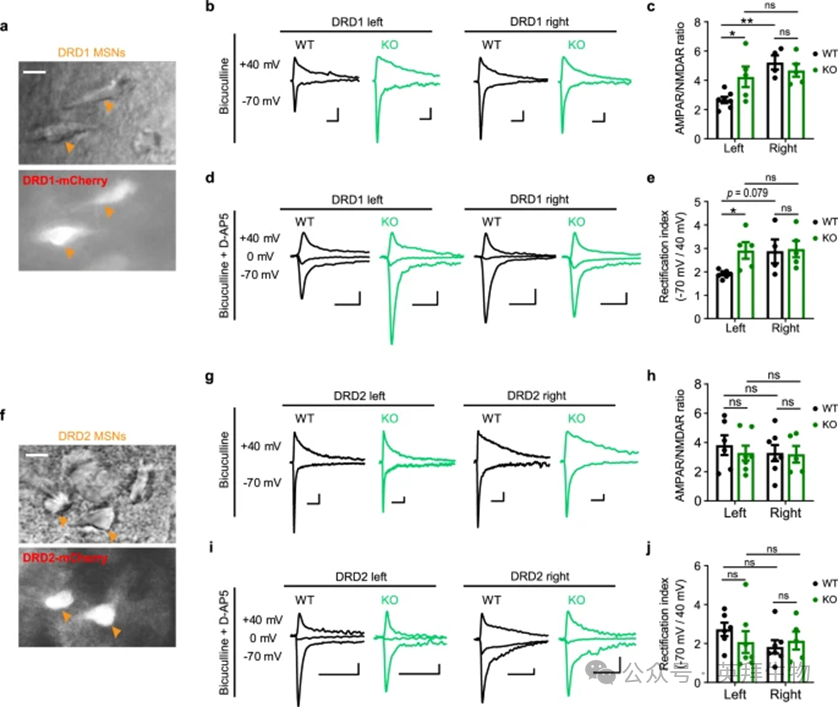
图6. SH3RF2缺陷诱导左侧纹状体DRD1-MSN的AMPAR功能障碍
7、DRD1-MSN左纹状体活性升高有助于SH3RF2 KO小鼠的自闭症样行为
上述发现表明,SH3RF2 KO小鼠的左侧纹状体DRD1-MSN表现出一些右侧特征,如树突复杂度增加、AMPAR/NMDAR比值和AMPAR整流指数增加,从而破坏了纹状体偏侧化(图7a)。我们进行了一系列行为实验,以证实SH3RF2 KO小鼠表现出类似自闭症的症状,包括社交缺陷和重复的刻板行为,同时保持正常的运动能力和记忆力。随后,我们研究了左纹状体中DRD1-MSNs活性的升高是否有助于SH3RF2 KO小鼠的自闭症样行为。
我们使用仅由设计药物(DREADD)激活的设计受体抑制左侧纹状体中 DRD1-MSN 的神经元活动。携带Cre依赖性hM4D(Gi)的AAV被注射到左侧DMS,这是一个与重复刻板行为和部分社会行为密切相关的亚区域,在Drd1a-Cre小鼠中(图7b,c)。病毒注射两周后,在给予载体或氯氮平-N-氧化物(CNO)后,在WT和KO小鼠中进行行为实验。CNO处理的KO小鼠的重复梳理时间减少到正常水平,而令我们惊讶的是,CNO处理显着诱导了WT小鼠的重复梳理(图7d)。在左侧DMS中抑制DRD1-MSN不会导致小鼠运动活动减少,排除了梳理行为减少源于运动能力受损的可能性(图7e)。此外,在CNO处理的KO小鼠中,社会互动被部分挽救,而社交新颖性保持不变(图7f,g)。总之,这些结果表明,左侧纹状体中DRD1-MSNs活性的增强是导致SH3RF2缺失小鼠自闭症样行为的原因。
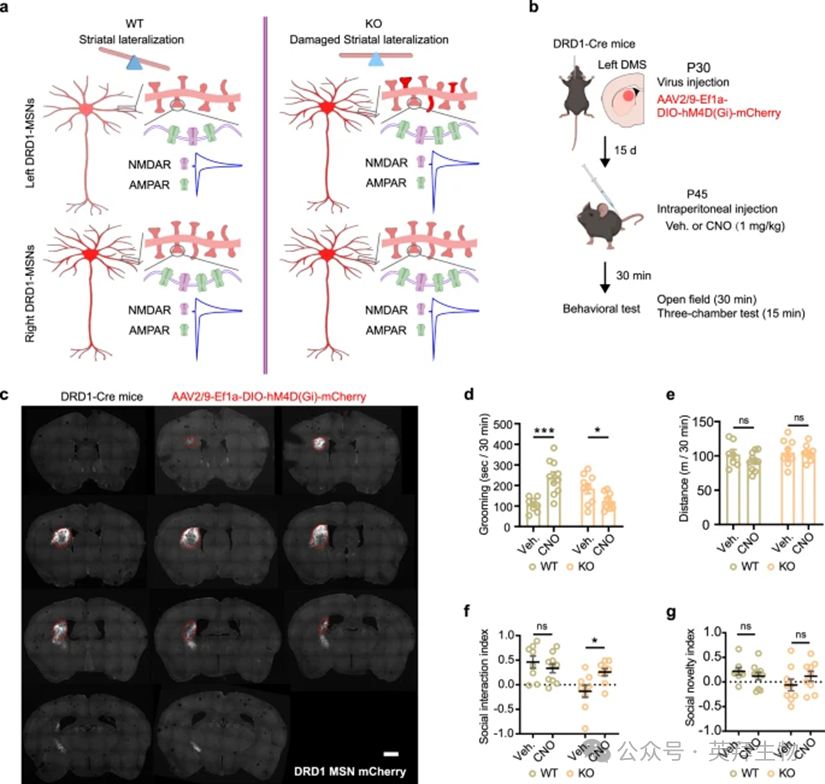
图7. SHED的SH3RF2缺失小鼠自闭症样行为的拯救
结论:
该研究不仅发现了一种新的ASD相关蛋白复合物,而且从细胞和分子的角度阐明了其在维持大脑功能偏侧化中的重要作用。通过揭示SH3RF2介导的纹状体不对称破坏和ASD样行为的分子机制获得的见解将有可能重塑对大脑功能和神经发育障碍的看法。
参考文献:
Jiang Y, Zhu F, Zhong J, et al. Autism-related proteins form a complex to maintain the striatal asymmetry in mice. Cell Res. 2025 Sep 2. doi: 10.1038/s41422-025-01174-9. Epub ahead of print. PMID: 40890295.






