泛癌唾液酸Tn靶向将CAR治疗扩展到实体瘤
准确鉴定肿瘤特异性标志物对于开发基于嵌合抗原受体(CAR)的疗法至关重要。虽然细胞表面抗原很少受到癌症的限制,但它们的翻译后修饰(PTM),特别是异常的碳水化合物结构,提供了有吸引力的替代品。其中,唾液酸Tn(STn)抗原因其在各种上皮肿瘤中的普遍存在而脱颖而出。尽管已经开发出针对STn的单克隆抗体(mAb),但由于对特异性的担忧,它们的临床应用受到了阻碍。在此,作者描述了AM52.1,这是一种对STn具有特异性且与健康组织缺乏反应性的单克隆抗体。将AM52.1的单链可变片段(scFv)组装成第二代CAR支架。AM52.1CAR T细胞有效靶向表达STn的癌症细胞系和患者来源的类器官(PDO),同时保留STn阴性细胞。在进一步的临床前模型中,AM52.1CAR T细胞有力地控制了胃和输卵管卵巢肿瘤,以及结直肠癌癌症黏液性腹膜转移,突出了其靶向和管理复杂实体瘤的强大治疗潜力。该研究于2025年9月发表在《Cell Reports Medicine》,IF 10.6分。
技术路线:
主要研究结果:
1、AM52.1是一种特异性识别唾液酸Tn的泛癌抗体
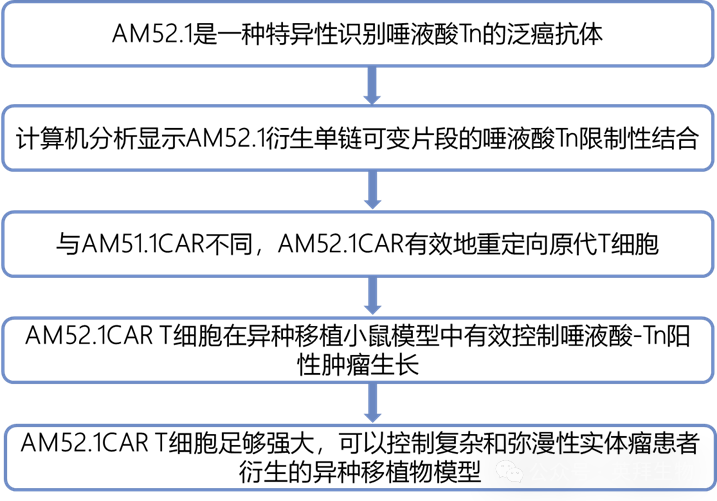
STn导向的单克隆抗体是通过使用绵羊颌下粘蛋白(OSM)作为免疫原产生的,OSM是一种高度糖基化的蛋白质,含有98%的STn作为聚糖含量(图1A)。对1000个杂交瘤克隆进行的初步酶联免疫吸附试验(ELISA)筛选确定AM51.1和AM52.1为表现出最高特异性结合的克隆(数据未显示)。将这些克隆分别与已建立的抗STn和抗Tn单克隆抗体B72.3和CC49以及1E3进行比较分析,证实AM51.1和AM52.1以剂量依赖的方式特异性结合STn糖基化OSM,而不与Tn发生交叉反应(图1B)。为确定每种抗体的确切结合表位,AM单克隆抗体针对含有94种不同化学合成和特征良好的与STn相关的O-聚糖结构的O-聚糖阵列进行探测(图S1A)。AM52.1对STn显示出显著的特异性,与糖基化氨基酸无关,即使在较低浓度下也是如此(图1C和S1B)。相比之下,AM51.1也在聚-N-乙酰基乳糖胺序列的背景下识别α2,6-连接的唾液酸。作为对照,平行检测B72.3抗体,并确认其对丝氨酸残基内STn的特异性。
评估AM mAbs在不同癌症细胞系模型中检测STn的能力。通过使用簇状规则间隔的短回文重复序列(CRISPR)-Cas9.31敲除核心1β1,3-半乳糖基转移酶(C1GalT1),实现了截短O-聚糖表达的模拟。两种AM抗体都表现出对C1GalT1缺陷细胞的选择性结合,同时对亲本细胞没有反应性(图1D)。这些发现得到了蛋白质印迹分析和免疫荧光标记的支持(图S2A和S2B)。此外,为确认AM mAb结合对唾液酸存在的依赖性,作者在蛋白质印迹中使用了神经氨酸酶处理的COLO205蛋白裂解物印迹,结果显示在处理条件下信号急剧丧失(图S2C)。然后,作者确认了几种细胞系中内源性STn的表达,包括癌症(GC)细胞系SNU-16和OC细胞系OV-90和OVCAR-3(图1E)。这些细胞在神经氨酸酶消化后也用不同的抗STn单克隆抗体进行染色(图S2D–S2F),AM52.1对唾液酸缺失的敏感性高于B72.3或CC49,表明对唾液酸化GalNAc结构的特异性增加。此外,AM51.1mAb对所测试的天然表达STn的细胞系显示出最小的反应性。这些观察结果进一步得到蛋白质印迹和免疫染色分析的证实(图S2G和S2H),其中AM51.1显示了最低的STn检测。
接下来,作者研究AM单克隆抗体在正常和肿瘤环境中对人类上皮组织的选择性。在相同的癌组织标本中,观察到的受试单克隆抗体的染色模式在细胞类型和亚细胞位置方面是一致的(图1F)。重要的是,尽管在不同的肿瘤类型中观察到异质性组织反应(图1G;表S1),但B72.3和AM52.1的染色模式明显重叠。尽管如此,AM52.1在很大一部分癌症中显示免疫反应性,包括胃癌(80%)、结肠癌(60%)、胰腺癌(60%),前列腺癌(60%,以及输卵管卵巢癌(80%)。AM51.1虽然显示出较弱的检测能力,但也染色了癌症组织(50%)、结肠(60%)、胰腺(80%)和输卵管卵巢(33%)。重要的是,AM52.1不与任何健康的上皮组织、免疫组织(脾脏)或外周血单核细胞(PBMCs)反应(图1H-1J),而AM51.1与大部分B细胞群交叉反应(图1I和1J)。
总之,这些数据表明,与目前可用的抗STn抗体相比,AM52.1对癌症相关的STn抗原表现出更高的特异性,而AM51.1尽管是从同一筛选中分离出来的,但表现出与其他唾液酸化结构的交叉反应性,并似乎依赖于特定的STn呈现环境。
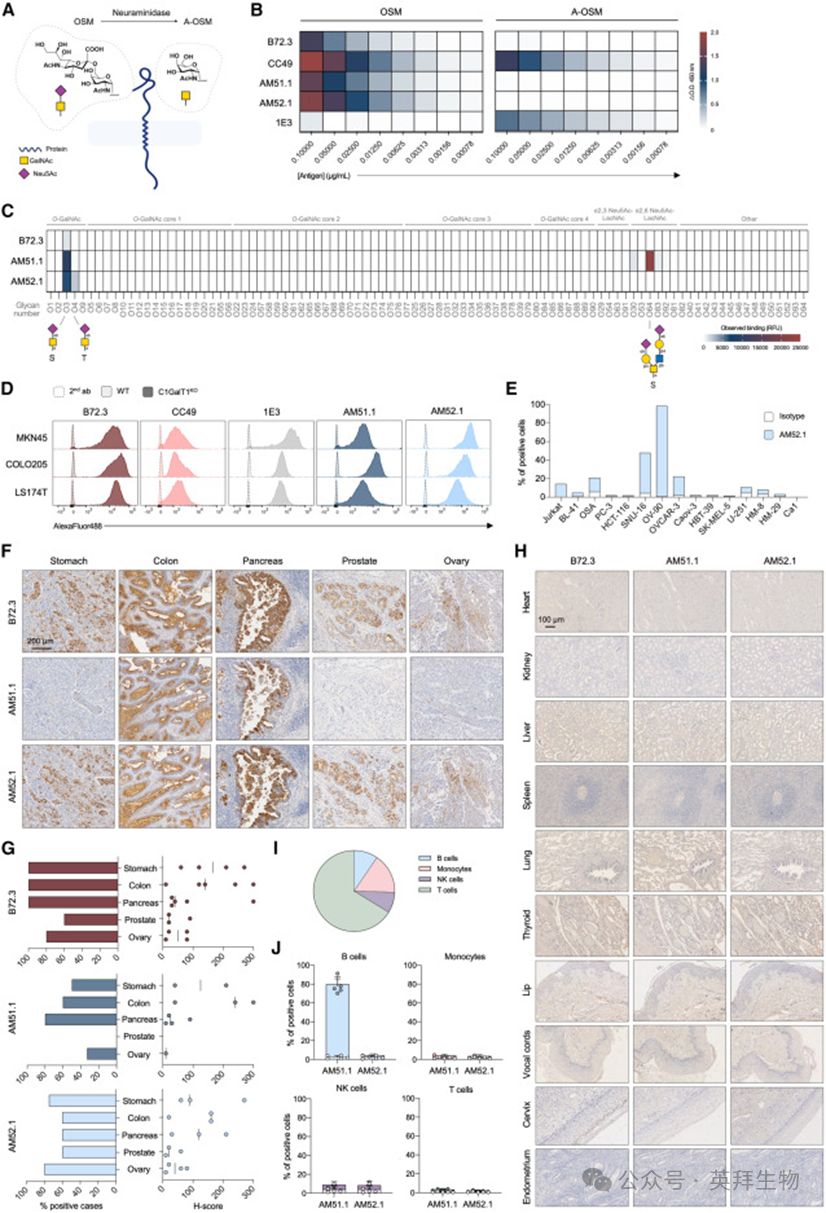
图1:AM52.1抗体显示与唾液酸-Tn的特异性结合
2、计算机分析显示AM52.1衍生单链可变片段的唾液酸Tn限制性结合
为进一步评估AM单克隆抗体的治疗前景,作者设计了基于AM单克隆抗体用于后续CAR生成的scFvs,并将其序列和结构与研究良好的天然CC49克隆(小鼠CC49,mCC49)及其人源化版本(huCC49)的序列和结构进行比较分析。这些序列与ImMunoGeneTics(IMGT)数据库鉴定的种系序列显示出非常高的相似性。多重序列比对(MSA)显示,互补决定区3(CDR3)的轻链和重链存在显著差异(图2A)。然而,AM52.1衍生的scFv与mCC49表现出更大的相似性(两条链的序列同一性≥80%)(图2B)。关于AM51.1衍生的scFv,虽然轻链的序列相似性相对中等(≥50%),但它与重链中的其他scFv的序列相似度较低(≤43%)(图2B)。进一步研究序列变异对结构相似性的影响,作者使用ABodyBuilder233和IgFold34对每种抗体构建的scFv结构进行建模。值得注意的是,两种方法预测的scFv结构表现出极好的一致性(均方根偏差[RMSD]<0.5 A˚)(图S3)。随后,ABodyBuilder2生成的结构因其最小的预测误差(所有scFv的框架区域和CDR的平均0.23 A˚)而被进一步用作每个scFv的代表性模型(表S2)。出乎意料的是,与mCC49衍生的scFv(图2D)相比,比较分析揭示AM52.1衍生的scFv(图2C)和huCC49之间明显更大的结构相似性。总之,作者的计算机分析显示,来源于AM52.1抗体的scFv与基于充分研究的CC49的scFv之间存在高度的序列和结构相似性,无论是小鼠还是人源化的,这增强了其对表达STn的肿瘤进行靶向免疫治疗的潜力。
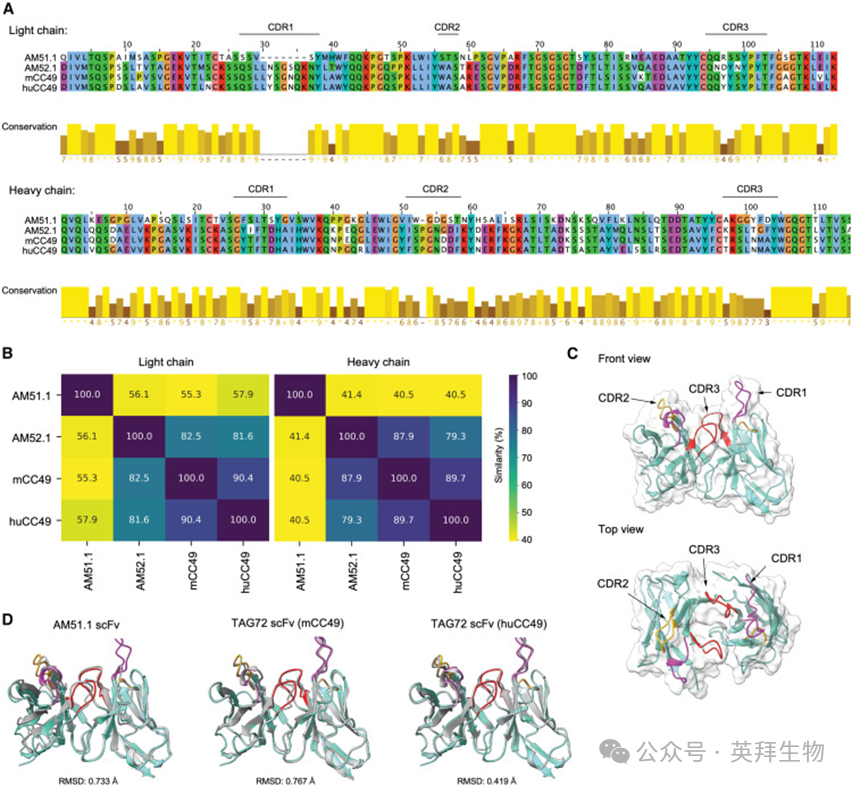
图2:序列和结构分析表明基于AM52.1的单链可变片段的唾液酸-Tn限制性结合
3、与AM51.1CAR不同,AM52.1CAR有效地重定向原代T细胞
为评估AM抗体的治疗效果,设计scFvs并将其亚克隆到CAR支架载体中,以获得第二代构建体(图3A)。通过将CAR编码序列与截短的CD34(tCD34)标签连接来监测转染效率。为进行比较,作者将已发表的STn导向的TAG72CAR(来源于CC49抗体)和一种无关的CAR靶向CD19(CD19CAR)克隆到同一载体中。使用抗Fab和抗CD34抗体在J-76-NFAT-GFP和原代人T细胞中验证了CAR表达(图3B和3C)。所有构建体在膜上均均匀表达,不影响T细胞扩增(图S4A和S4B),表明scFvs稳定、折叠正确且无毒。使用与J-76-NFAT-GFP细胞共培养的功能评估STn阴性和STn阳性癌症细胞显示,AM衍生的CAR均具有活性和特异性(图S4C)。同时,原代T细胞的脱颗粒测定显示抗原识别后T细胞活化,AM521.CAR T细胞上调CD107a以响应STn-阳性癌症细胞,但不响应STn-阴性癌症或正常细胞系(图3D和S4D)。相比之下,AM51.1CAR T细胞没有CD107a表达,而TAG72CAR T细胞对STn阳性细胞有反应,尽管程度低于AM52.1CAR T淋巴细胞,并且对STn阴性的HULEC-5a微血管内皮细胞系有中度反应。细胞毒性试验进一步证明AM52.1CAR T细胞对STn表达的靶向性,显示出优于TAG72CAR T细胞的优势,特别是在较低的效应物:靶(E:T)比率下,而AM51.1CAR T细胞没有反应性(图3E)。重要的是,AM52.1CAR T细胞对ST阴性靶点保持无活性(图3E和S4E)。接下来,作者使用17倍免疫测定法分析CAR结合后的细胞因子分泌。AM52.1CAR T细胞产生促炎细胞因子,包括巨噬细胞炎症蛋白1β(MIP-1β)、白细胞介素(IL-8)、干扰素γ(IFN-γ)、肿瘤坏死因子α(TNF-α)和IL-13,以响应STn阳性的癌症细胞(图3F和S4F)。值得注意的是,AM52.1CAR T细胞足够敏感,能够分泌细胞因子来响应表达相对低STn水平的癌症细胞,如OVCAR-3。重要的是,暴露于STn阴性癌症或正常细胞系后,没有释放细胞因子。这些功能数据共同证实,AM52.1单克隆抗体可以成功转化为有效的CAR,保留其对STn的特异性。
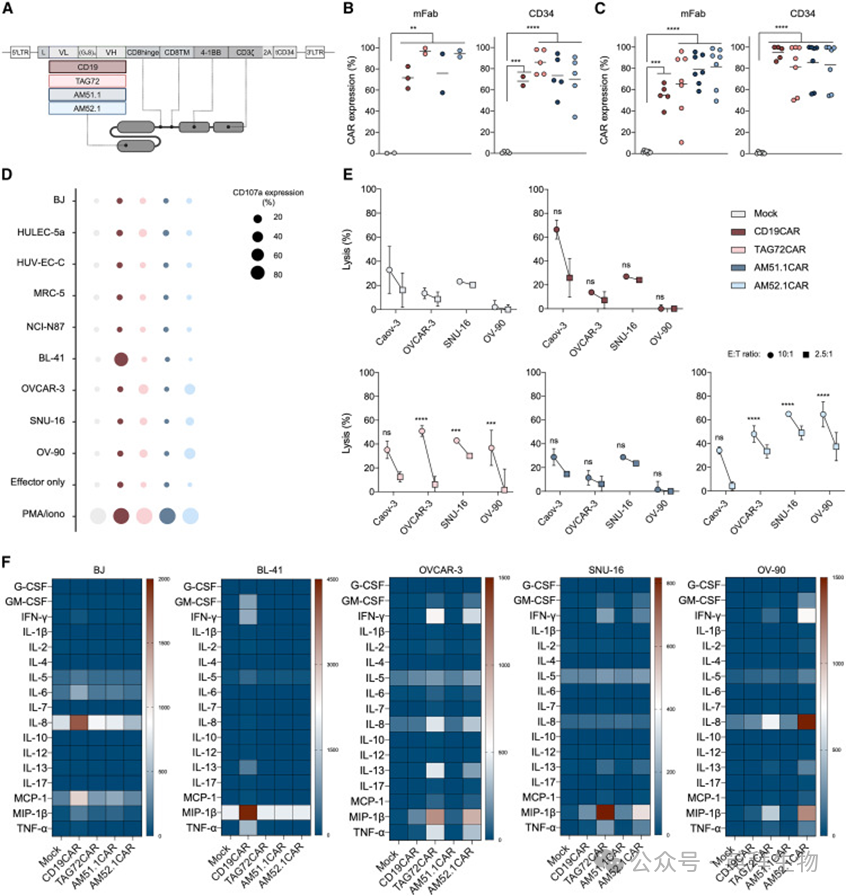
图3:AM52.1衍生的CAR T细胞显示出对唾液酸-Tn表达癌细胞系的特异性细胞毒性
为在生理相关环境中评估CAR T细胞的功能,作者进一步测试了AM52.1CAR T细胞与GC PDO的复杂3D培养物的对比。作者使用了一种来自正常胃黏膜的类器官(PDO1),以及来自STn阴性(PDO2)和STn阳性肿瘤的GC衍生的PDO,这些肿瘤具有异质性的STn表达水平(PDO3-5)(图4A)。如图4B所示,进行了CAR T细胞与胃PDO的共培养试验,并评估了类器官存活率。最初,进行STn阴性和STn阳性PDO(分别为PDO2和5)的测试,以确定后续实验的最佳E:T比。作者观察到,AM52.1CAR T细胞和TAG72CAR T细胞以10:1的E:T比率有效地消除了富含STn表达的PDO,同时保留了缺乏靶抗原的类器官(图4C)。这些发现得到了切割的半胱氨酸天冬氨酸蛋白酶-3(CC3)的免疫荧光检测的证实,这表明与STnnegative PDO相比,STn阳性PDO与AM52.1CAR T细胞孵育导致细胞内CC3水平升高(图4D)。值得注意的是,所有GC衍生的STn表达PDO,即使是那些STn表达水平较低的PDO,都被AM52.1CAR T细胞有效杀死,这与TAG72CAR T细胞形成鲜明对比,后者主要影响高度STn表达的PDO(图4E)。重要的是,AM52.1CAR T细胞治疗对来自正常胃黏膜的类器官没有影响(图4E)。在光学显微镜下对类器官进行培养后检查时,这些观察结果很明显,其中AM52.1CAR T处理的STn表达GC PDO,细胞密度明显降低,凋亡迹象明显(图S4G)。这些数据证实,AM52.1CAR T细胞具有极其强大的特异性,甚至可以对抗结构化靶标。
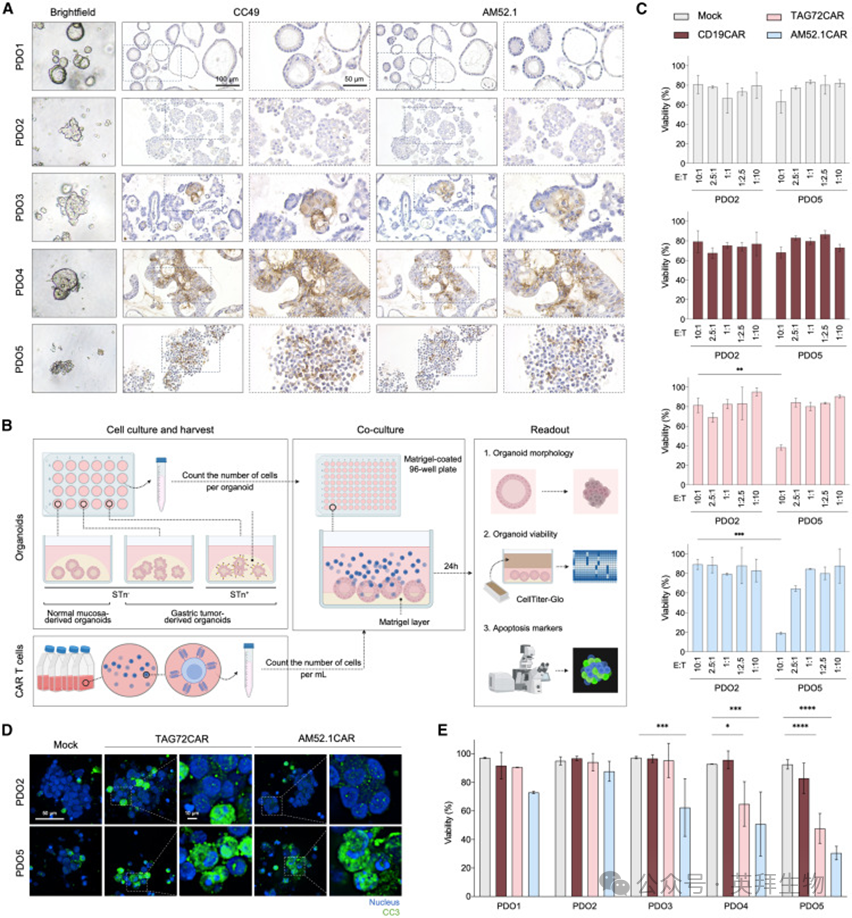
图4:AM52.1CAR T细胞在患者来源的类器官的临床前模型中有效且特异性
4、AM52.1CAR T细胞在异种移植小鼠模型中有效控制唾液酸-Tn阳性肿瘤生长
作者进一步研究AM衍生的CAR T细胞在不同异种移植物小鼠模型中的疗效。三种不同的侵袭性人上皮来源的癌症细胞系-OV-90、OVCAR-3和SNU-16用于验证基于AM51.1和AM52.1的CAR T细胞功能。TAG72CAR T细胞、CD19CAR T细胞和Mock T细胞分别用作阳性对照和阴性对照。首先,作者测试了STn高度阳性的OC细胞系OV-90(>80%,图1E)。如图5A所示,将小鼠腹腔注射肿瘤细胞,随机分组(图S5A),并用CAR T细胞腹腔注射(i.p.)治疗。值得注意的是,AM52.1CAR T细胞有效地控制了肿瘤生长(图5B和5C),并显著提高生存率(图5D)。相比之下,TAG72CAR T细胞在肿瘤控制和生存改善方面的疗效降低。正如预期的那样,AM51.1CAR T细胞对肿瘤进展的影响很小。接下来,如图5E所示,将小鼠腹腔注射低STn表达的OVCAR-3 OC细胞(<20%,图1E),随机分组(图S5B),并腹腔注射不同的CAR T细胞制剂。AM52.1CAR和TAG72CAR T细胞均显示出有效的肿瘤生长控制(图5F和5G)和改善的存活率(图5H)。值得注意的是,在实验结束时,AM52.1CAR T治疗组中的两只小鼠和TAG72CAR T治疗组的一只小鼠表现出非常低的肿瘤负荷,尽管TAG72CAR T细胞对生存的影响比AM52.1CAR T细胞更大。如前所述,AM51.1CAR T细胞对肿瘤的反应很温和。因此,作者在最后一次实验中排除了AM51.1CAR T细胞,并使用CD19CAR T细胞作为非特异性对照。最后,将SNU-16细胞(>40%STn+,图1E)腹腔注射(图5I),将小鼠随机分组(图S5C),随后用CAR T细胞治疗。AM52.1CAR T细胞显示出很强的肿瘤控制能力(图5J和5K),并提高小鼠的存活率(图5L)。相比之下,TAG72CAR T细胞仅表现出适度的肿瘤生长抑制作用,生存益处不太明显。这些发现强调了AM52.1CAR T细胞在不同表达水平上靶向STn阳性癌症细胞的治疗潜力。重要的是,如实验过程中稳定的体重所证明的那样,没有一种CAR构建体在动物中进行了诱导毒性试验(图S5D–S5F)。
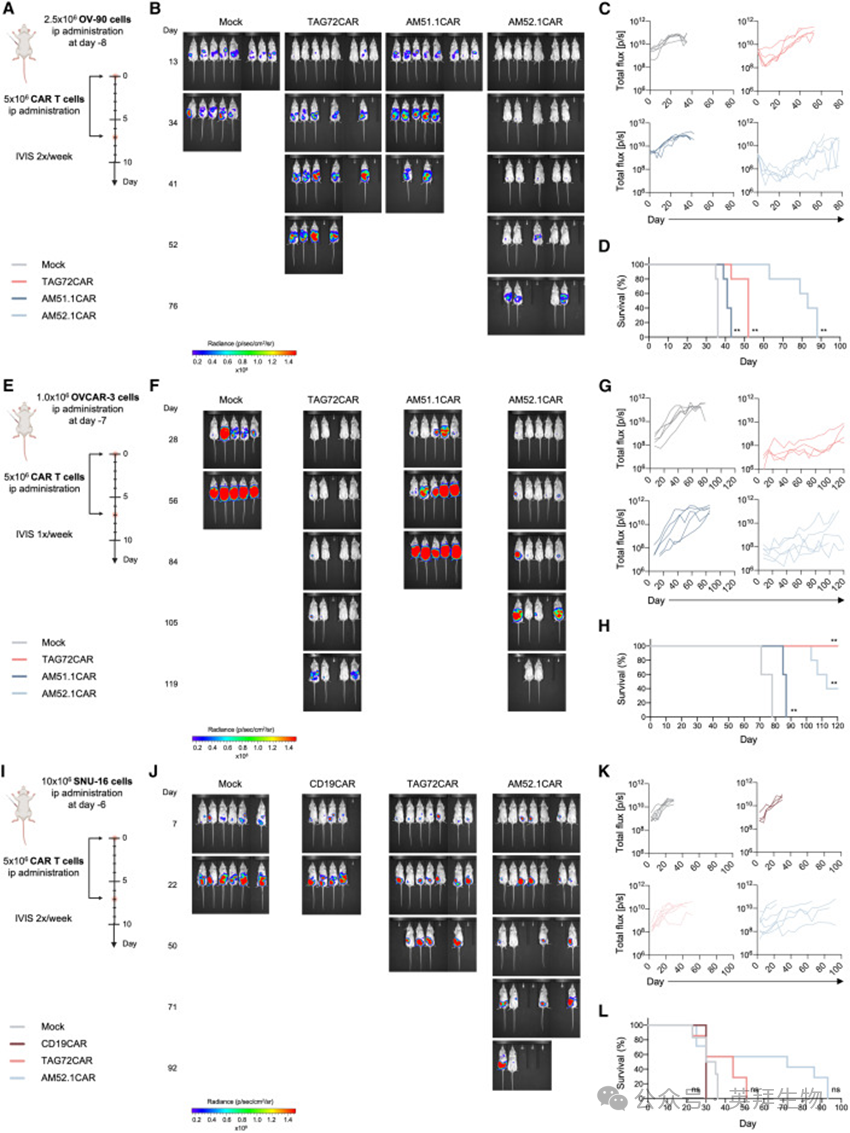
图5:AM52.1CAR T细胞有效控制异种移植小鼠模型中的肿瘤生长
5、AM52.1CAR T细胞足够强大,可以控制复杂和弥漫性实体瘤患者衍生的异种移植物模型
作者还挑战了AM52.1CAR T细胞在从CRC腹膜转移(PM)建立的PDX小鼠模型中的稳健性。36,37用mAb AM52.1对患者来源的PM-CRC样本,特别是从腹膜腔分离的粘液组织进行免疫组织化学(IHC)染色。预期分泌的粘液内容物严重唾液酸化,并被AM52.1强烈染色(图S6)。选择患者1的腹膜粘液癌,其表现出中等水平的AM52.1顶膜染色(图S6),用于研究AM52.1CAR T细胞的体内疗效。如图6A所示,PM材料经腹膜内递送,与PM患者的观察结果一样,疾病进展的小鼠在腹膜腔内可见粘液组织的积聚(图6B)。与未经治疗和模拟T细胞治疗的小鼠相比,经AM52.1CAR T细胞处理的小鼠表现出显著更高的存活率(图6C)。此外,未经治疗的小鼠(图6D和6E)和模拟T细胞治疗的小鼠(图6F和6G)显示,与AM52.1CAR T细胞处理组(图6H和6I)相比,粘液含量的积累更快、更大。这些结果突显了AM52.1CAR T细胞在具有挑战性的临床前体内模型中的效力,该模型的特点是高度异质性和由于大量粘蛋白分泌而造成的不利环境。
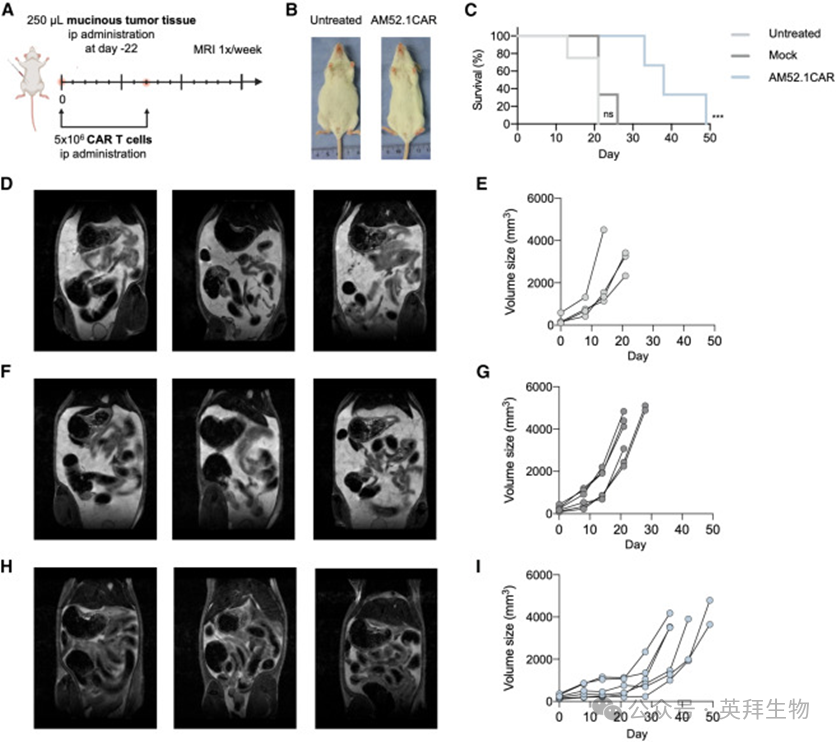
图6:AM52.1CAR T细胞控制结直肠癌患者来源的异种移植模型的复杂腹膜转移
结论:
综上所述,作者已成功制备两种单克隆抗体,即AM51.1和AM52.1。虽然AM51.1对STn和α2,6-唾液酸化聚-N-乙酰氨基乳糖结构的O-聚糖表现出双重识别,但AM52.1在精确靶向癌症相关的STn抗原方面表现出色,克服了以前的抗STn抗体的关键限制,这些抗体通常与结构相关的聚糖表现出交叉反应性。作者预计AM52.1可以解决现有抗STn抗体在诊断方面的特定缺口,但主要用于治疗应用,因为其精细的特异性能够实现更安全和更具选择性的癌症靶向。基于它们在癌症免疫疗法中的临床潜力,由于它们对STn表达癌症的选择性和改进的安全性,作者设计了基于AMmAbs的CAR T细胞。值得注意的是,AM52.1CAR T细胞在体外和体内对不同的实体瘤表现出强大的功能。考虑到STn对免疫逃避的贡献,未来的工作可以通过将AM52.1CAR T细胞与检查点抑制剂或调节TME的药物结合来改善治疗结果。此外,对AM52.1CAR T细胞反应不佳的肿瘤的免疫景观进行详细分析,可以确定预测性生物标志物,作为指导个性化治疗策略。总之,作者的研究介绍了一种具有高特异性、强效抗肿瘤活性和强安全性的CAR-T细胞疗法。作者建议将AM52.1CAR T细胞作为一种有前景且有效的治疗STn表达上皮源性实体瘤的方法,为其临床转化铺平道路。
参考文献:
Abrantes R, Forcados C, Warren DJ, Santos-Ferreira L, Fleten KG, Senra E, Costa AF, Krpina K, Henrique R, Liberg AM, Rawat P, Gelebart P, McCormack E, Bjørge L, Davidson B, Greiff V, Costea DE, Pinto F, Flatmark K, Gomes C, Inderberg EM, Reis CA, Wälchli S. Pan-carcinoma sialyl-Tn-targeting expands CAR therapy to solid tumors. Cell Rep Med. 2025 Sep 1:102350. doi: 10.1016/j.xcrm.2025.102350. Epub ahead of print. PMID: 40925376.






