DDX1甲基化介导的MATR3 剪接通过启动染色质重编程来调节椎间盘退化
下腰痛(LBP)主要由椎间盘退变(IVDD)驱动,已成为公共卫生领域的核心挑战。RNA结合蛋白DDX1在RNA代谢中起关键作用,但其在IVDD中的功能尚不明确。本研究发现DDX1是甲基转移酶EZH2的底物,EZH2对DDX1第234位赖氨酸(K234)的甲基化修饰可促进体外和体内IVDD进程。抑制EZH2能恢复髓核(NP)细胞的基质稳态并延缓IVDD发展。DDX1 K234位点的甲基化会破坏其与剪接因子及RNA靶标的相互作用,导致MATR3基因外显子14跳跃。由此产生的截短型MATR3会破坏核结构、增加染色质可及性,进而激活Wnt等信号通路,引发NP细胞衰老和凋亡。值得注意的是,通过阳离子脂质纳米颗粒递送过表达MATR3-L的mRNA可显著减轻NP细胞退变并有效缓解IVDD,这为IVDD的发病机制研究和潜在治疗策略提供了重要依据。该研究于2025年7月发表在《Nature Communications》,IF:15.7。
技术路线:
主要研究结果:
1.椎间盘退变过程中髓核细胞DDX1的K234甲基化水平升高
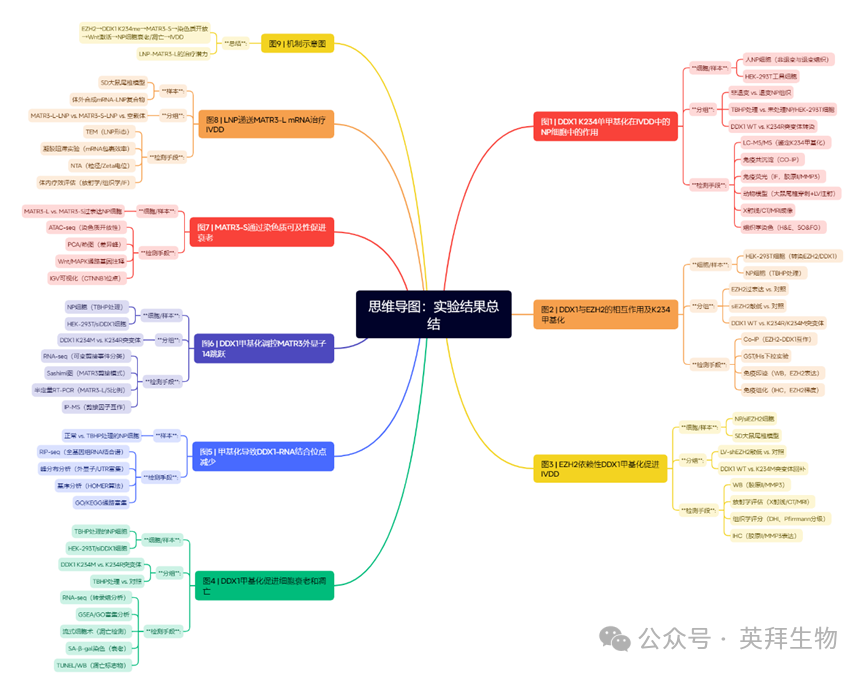
为探究赖氨酸甲基化调控的关键非组蛋白[17],本研究获取腰椎骨折、特发性脊柱侧凸或IVDD患者的非退变与退变髓核组织进行细胞培养,裂解后采用泛赖氨酸甲基化抗体孵育,并通过LC-MS/MS进行组分分析(图1A)。基于MRI影像的Pfirrmann分级评估显示:随着IVDD进展,T2加权像的高信号白色区域逐渐减少并呈现异质性,最终被高信号黑色区域取代,提示髓核组织退变[18]。培养基中水分含量下降而纤维化程度增加,番红O-固绿染色进一步证实退变髓核组织的表型变化——基质降解、钙化、软骨样增生及细胞簇状聚集现象在严重退变组(IV级)尤为显著[19](附图1A)。免疫组化结果显示退变髓核组织中Ⅱ型胶原阳性(合成代谢)细胞减少,而MMP3表达(分解代谢)细胞相应增加(附图1B、E)。值得注意的是,质谱分析在退变髓核组织中特异性鉴定出DDX1衍生肽段,其SPRY结构域(231-240aa)内进化保守的赖氨酸残基(K234)存在甲基化修饰(附图1C)。鉴于SPRY结构域的功能重要性,该位点甲基化可能具有生物学意义。LC-MS证实K234为单甲基化修饰(图1B),且该位点在多个物种DDX1蛋白中高度保守(附图1D),暗示其潜在功能价值。在髓核细胞和HEK-293T工具细胞中均检测到K234甲基化(图1C、D,附图1F)。由于DDX1作为RNA结合蛋白,其功能可能受赖氨酸甲基化调控,进而影响细胞内信号通路和基因表达网络。
为研究氧化应激损伤是否导致DDX1 K234甲基化差异表达[20],我们采用叔丁基过氧化物(TBHP)处理髓核细胞构建体外退变模型。TBHP处理后,Ⅱ型胶原和聚集蛋白聚糖表达下降,而MMP3和ADAMTS5呈现相反趋势(附图1H、I)。免疫荧光显示TBHP处理的髓核细胞中Ⅱ型胶原阳性信号减少、MMP3增加(图1E,附图1G),证实该模型能模拟IVDD的退变特征[21,22]。值得注意的是,TBHP处理的髓核细胞和HEK-293T细胞中DDX1 K234甲基化水平显著升高(图1F,附图1J)。为进一步验证,我们将SPRY结构域第234位赖氨酸替换为精氨酸构建DDX1突变体[23,24]——精氨酸(R)在保留正电荷的同时可阻断甲基化,从而模拟非甲基化蛋白状态。在TBHP处理的HEK-293T细胞中,DDX1 K234R突变体始终未检测到甲基化(图1G)。这些结果共同证实SPRY结构域Lys234是DDX1特异的甲基化位点,且与髓核细胞退变密切相关。
鉴于K234甲基化是通过非偏向性质谱分析鉴定的内源性修饰,我们进一步探究其单甲基化如何影响DDX1功能并促进IVDD。为验证SPRY结构域甲基化的生物学效应,我们在DDX1敲低的髓核细胞中外源性表达野生型DDX1(WT)和甲基化缺陷突变体(K234R)。与对照组(siControl)相比,DDX1敲除可逆转TBHP诱导的髓核细胞合成代谢下降与分解代谢升高;而重新表达DDX1(而非K234R突变体)则显著加剧TBHP诱导的细胞退变(附图1K、L)。为避免脱靶效应,我们通过Western blot验证了另一种siDDX1在髓核细胞中的敲低效率(附图2B、C),同时检测到DDX1 WT和K234R突变体的重新过表达量均达到对照组的约两倍。
为探究赖氨酸甲基化的体内作用,我们建立了SD大鼠针穿刺诱导的IVDD动物模型[25,26]。通过携带DDX1靶向shRNA的慢病毒(shDDX1-LV)在体内敲低DDX1后,每周向尾椎间盘髓核区注射shRNA抗性的DDX1 WT-LV或DDX1 K234R-LV,持续4周[27](图1H、J)。X射线和CT分析显示,shDDX1-LV显著缓解尾椎间盘狭窄和软骨下骨破坏,而重新表达DDX1-LV(非K234R-LV)会导致椎间盘高度进一步丧失(图1K、L)。更敏感的MRI检测显示,DDX1敲低组尾椎间盘T2加权信号增强[28],表明椎间盘水分得以保留;而重新表达野生型(非精氨酸突变体)则导致水分减少(图1M)。HE和SO&FG染色证实,慢病毒介导的DDX1缺失可缓解椎间盘退变表型——改善退变椎间盘中紊乱的细胞外基质(ECM)、纤维环(AF)与髓核的模糊界面,并减少纤维环内炎症细胞浸润(图1I、N、O,附图1M)。免疫组化显示shDDX1-LV组椎间盘Ⅱ型胶原增加而MMP3减少,提示IVDD进程被抑制(附图1N、O)。值得注意的是,重新注射DDX1 WT-LV(非K234R-LV)会导致髓核组织萎缩、髓核与纤维环边界模糊、基质结构紊乱,并加速尾椎间盘进行性退变(图1I)。此外,野生型DDX1的重新表达(非K234R突变体)还引起Ⅱ型胶原阳性髓核细胞减少和MMP3阳性细胞增加(附图1N、O)。通过免疫组化验证另一种shDDX1-LV在椎间盘中的敲低效率以排除脱靶效应(附图2H、I),同时检测到DDX1 K234R-LV按预期实现过表达(约为对照组的2倍)。这些结果共同证实,DDX1 K234甲基化可能通过诱导髓核退变在体内外促进IVDD进展。
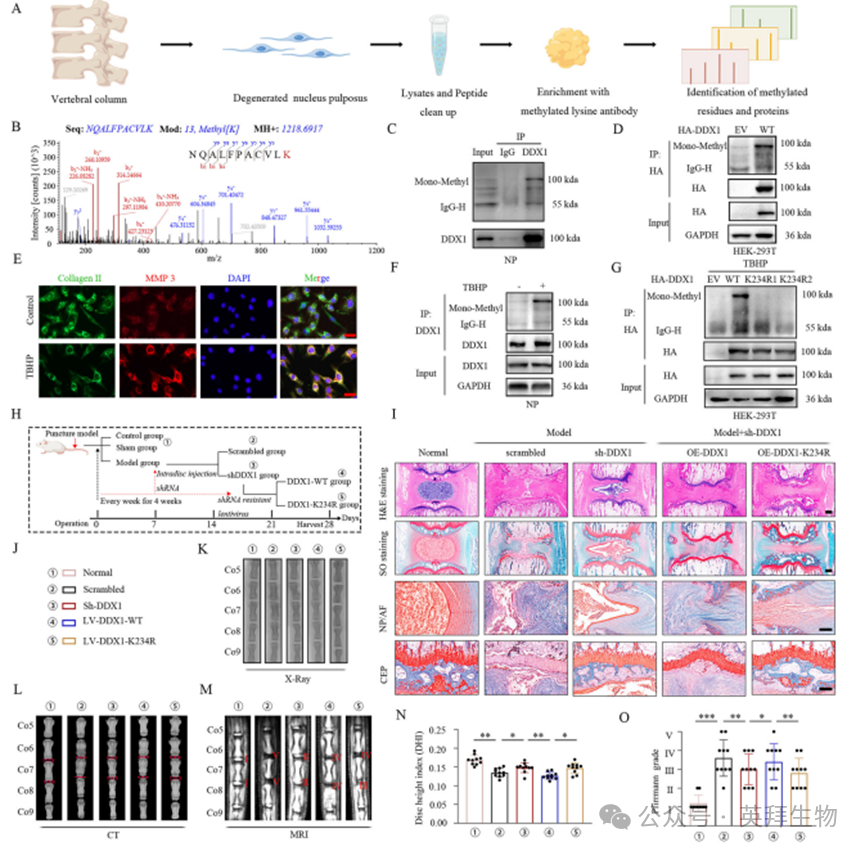
图1.椎间盘退变过程中髓核细胞DDX1的K234甲基化水平升高
2.DDX1通过EZH2介导的赖氨酸234位点甲基化
为鉴定调控该修饰的生理性甲基转移酶,我们在HEK-293T细胞中进行免疫共沉淀(Co-IP)实验筛选DDX1互作蛋白。根据丰度>10且P值<0.05的标准,确定KMT5A、SMYD3、SETD7、EZH2和G9a为候选赖氨酸甲基转移酶(图2A、B)。随后在EZH2质粒转染的HEK-293T细胞中,抗DDX1免疫沉淀物显示出显著的赖氨酸甲基化信号(图2C)。通过Flag抗体IP结合DDX1免疫印迹(IB)分析发现,EZH2与DDX1的相互作用最强(图2D)。
EZH2在骨关节炎和类风湿性关节炎中均存在异常激活[29,30],但其在IVDD中的调控作用尚不明确。我们发现,TBHP诱导的髓核细胞体外退变模型中,氧化应激可显著上调EZH2表达(图2E、I,附图2F)。免疫组化显示退变髓核组织中EZH2阳性细胞呈梯度增加(图2G、H),提示IVDD进程中髓核细胞的退变状态与EZH2表达升高相关。免疫荧光证实TBHP处理的退变髓核细胞中,DDX1与EZH2在细胞核内共定位(图2F,附图2G)。
进一步通过His标签DDX1与GST-EZH2的pull-down实验验证了两者的直接物理结合(图2L,附图2A)。在髓核细胞和HEK-293T细胞中,内源性与外源性DDX1均能与EZH2强烈互作(图2J、K、N),表明二者存在直接关联。这种互作提示甲基化调控的可能性——siEZH2处理的髓核细胞中,泛甲基化抗体检测显示DDX1甲基化水平降低(图2O);反之,EZH2过表达细胞中DDX1赖氨酸甲基化显著增强(图2P)。
鉴于DDX1在SPRY结构域K234位点发生单甲基化,我们预测EZH2的甲基化位点即为此位点。通过将赖氨酸234替换为精氨酸构建DDX1突变体,Co-IP结合抗赖氨酸甲基化抗体证实该突变显著减弱DDX1甲基化(图2Q)。值得注意的是,K234R和K234M突变均未影响EZH2与DDX1的相互作用(图2M),这表明EZH2作为DDX1的甲基转移酶,特异性负责其K234位点的甲基化修饰。
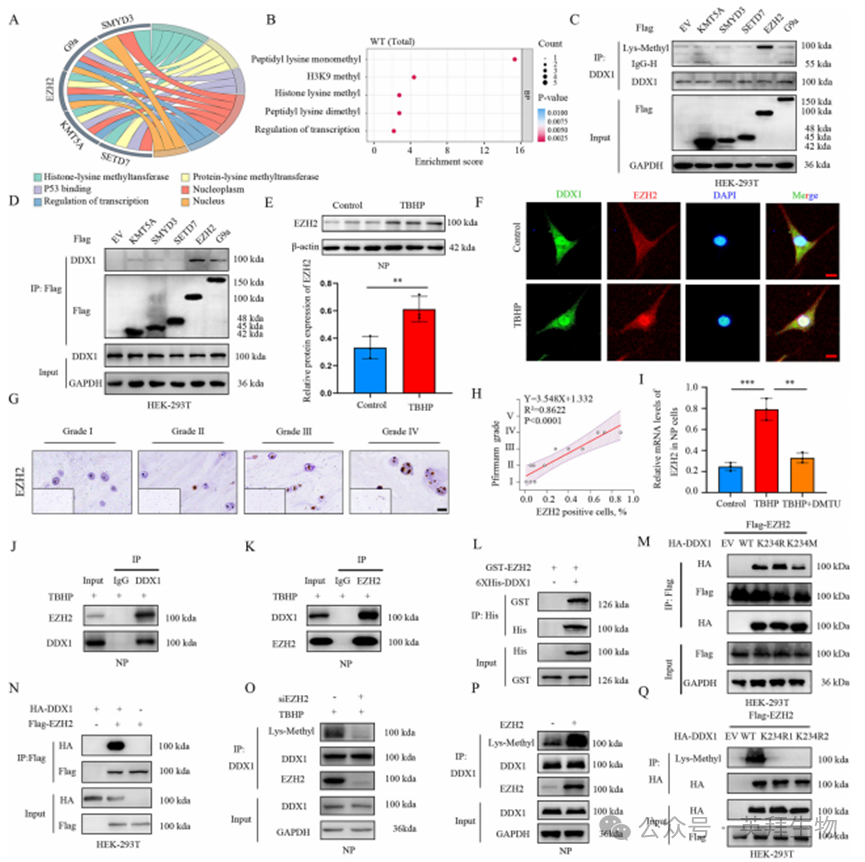
图2.DDX1通过EZH2介导的赖氨酸234位点甲基化
3.EZH2介导的DDX1 K234甲基化促进椎间盘退变进程
为探究EZH2依赖性DDX1甲基化在IVDD调控中的作用,我们在NP/siDDX1细胞中重新表达DDX1 WT或K234M突变体。值得注意的是,赖氨酸(K)替换为甲硫氨酸(M)可模拟蛋白质的甲基化状态[13,14,23]。与对照组相比,EZH2敲低能逆转TBHP诱导的髓核细胞合成代谢下降与分解代谢升高;而重新表达DDX1 K234M突变体(非野生型)则显著加剧TBHP驱动的髓核细胞退变(图3A-D)。
为深入解析EZH2依赖性DDX1甲基化在IVDD中的影响,我们采用shEZH2慢病毒敲低SD大鼠体内EZH2后,每周向尾椎间盘髓核区注射DDX1 WT-LV或K234M-LV,持续4周(图3E、I)。实验显示shEZH2-LV显著缓解尾椎间盘高度丢失和软骨下骨破坏,而重新表达DDX1 K234M-LV(非野生型)会导致椎间盘高度进一步丧失(图3F、G、J)。MRI检测表明EZH2敲低后椎间盘T2加权信号增强(提示水分保留),但K234M突变体重表达(非野生型)则引起水分丢失(图3H)。HE与SO&FG染色证实,慢病毒介导的EZH2缺失可挽救尾椎间盘退变表型——改善纤维环与髓核间紊乱的ECM结构及模糊界面,并减少纤维环内炎症细胞浸润(图3K-M)。
与体内结果一致,shEZH2-LV处理的椎间盘表现为Ⅱ型胶原阳性细胞增加和MMP3阳性细胞减少,提示IVDD进程被抑制(图3N、O)。关键的是,重新注射携带DDX1 K234M突变体的慢病毒(非野生型)会导致髓核组织萎缩、髓核-纤维环边界模糊、ECM结构破坏,并加速尾椎间盘退变(图3K)。此外,K234M突变体(非野生型)的重表达会抑制Ⅱ型胶原阳性细胞而促进MMP3阳性细胞(图3N、O)。这些结果证实,EZH2依赖性DDX1甲基化可通过诱导髓核退变在体内外促进IVDD进展。
图3.EZH2介导的DDX1 K234甲基化促进椎间盘退变进程
4.DDX1甲基化促进细胞衰老和凋亡
为了阐明DDX1甲基化的功能意义,我们进行了mRNA转录组测序(bulk RNA-seq)分析,比较了正常培养和TBHP培养的NP细胞,以及重新表达siRNA抗性DDX1 K234M或DDX1 K234R突变的NP/siDDX1和HEK-293T/siDDX1细胞的基因集合(图4A)(补充数据1)。与对照组相比,在TBHP培养的NP细胞中共鉴定出3205个下调基因和3618个上调基因(补充图3A)。与DDX1 K234R相比,在DDX1 K234M组的HEK-293T细胞中确定了217个下调基因和172个上调基因(补充图3B、D)。与DDX1 K234R组相比,在DDX1 K234M组的NP细胞中鉴定出349个下调基因(P < 0.05)和486个上调基因(P < 0.05)(补充图3C)。综合分析显示,正常NP细胞中66个上调基因在过表达DDX1 K234R的NP和HEK-293T细胞中重叠(补充图3E),TBHP处理的细胞中71个上调基因在过表达DDX1 K234M的NP和HEK-293T细胞中重叠(补充图3F)。随后,GSEA揭示了细胞衰老和凋亡通路与TBHP处理的NP细胞退行性表型之间的明确相关性(图4B)。有趣的是,GSEA表明DDX1 K234M过表达同样调控了细胞衰老和凋亡信号通路(图4C,补充图4A、C)。GO分析显示,DDX1 K234M介导的基因富集于有丝分裂细胞周期、凋亡调控、G2/M转换、细胞增殖和分裂(图4D,补充图4B、D)。先前的研究已在多种细胞类型(包括NP细胞)中鉴定出数百至数千个衰老和凋亡相关基因。其中,与对照组相比,TBHP刺激的NP细胞中有29个经典的衰老和凋亡相关基因表达升高(图4E)。值得注意的是,这些基因(AIFM1、TNFRSF10A、RELA、BAX、BCL2L1)的表达水平在NP/siDDX1细胞和HEK-293T/siDDX1细胞中重新表达siRNA抗性DDX1 K234M与DDX1 K234R相比具有相似的趋势(图4F,补充图4E)(补充数据2)。这些结果表明,高水平的DDX1 K234甲基化可能在NP细胞中发挥促衰老和促凋亡作用。
与此一致,我们接下来通过Annexin V-FITC/碘化丙啶-PE染色和流式细胞术(FC)检测了DDX1 K234甲基化介导的NP细胞和HEK-293T细胞凋亡。结果显示,与对照组相比,siDDX1在体外显著抑制了NP细胞凋亡。然而,重新表达siRNA抗性的正常DDX1(而非K234R突变体)明显加剧了TBHP诱导的NP细胞凋亡(图4G、J,补充图4G)。HEK-293T细胞中也观察到类似现象(图4H、J)。
进一步通过TUNEL和P53染色发现:DDX1敲低可抑制TBHP刺激的NP细胞衰老与凋亡,而重新表达野生型DDX1(非K234R突变体)会促进这两个过程(补充图3H、K)。Western blot分析显示,DDX1失活降低了CASP3和Bax水平,同时增加Bcl-2表达;而过表达野生型DDX1(非K234R突变体)则产生相反效应(补充图3G、I)。
此外,siRNA敲低DDX1减少了TBHP刺激NP细胞中SA-β-gal染色阳性率,而过表达野生型DDX1(非K234R突变体)增加了SA-β-gal阳性细胞,表明DDX1甲基化促进溶酶体衰老活性(图4I,补充图4F)。蛋白水平分析进一步证实,与突变体相比,转染野生型DDX1的NP细胞中衰老相关蛋白表达增加(补充图3J、L)。
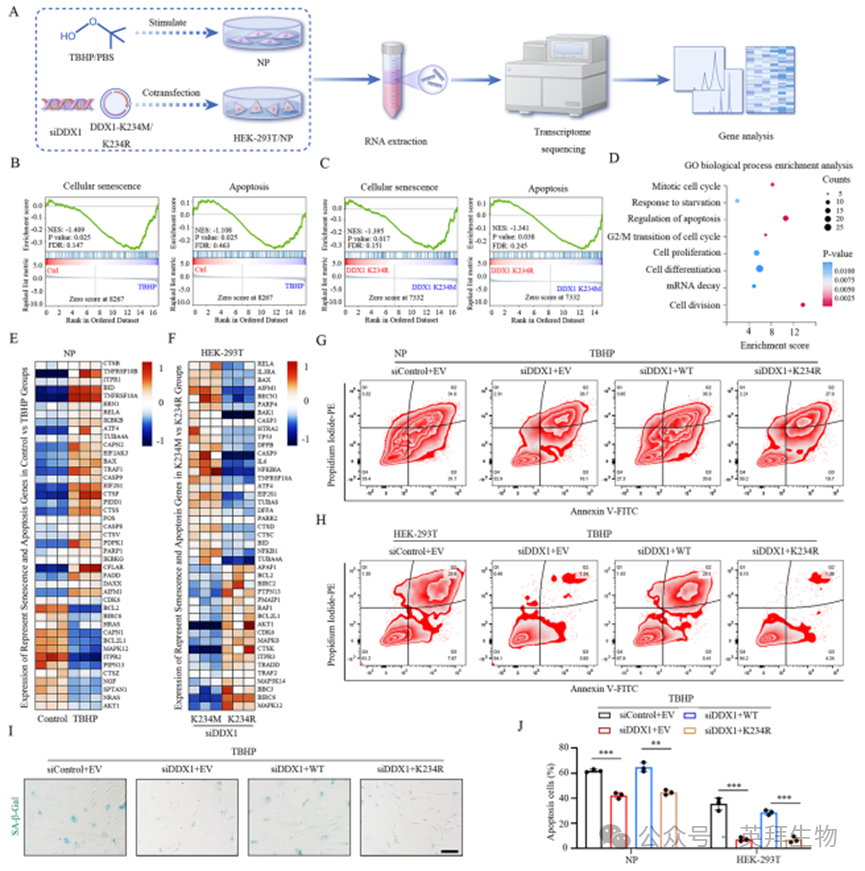
图4. DDX1甲基化促进细胞衰老和凋亡
5.甲基化导致DDX1在RNA上的结合位点转录组减少
为了构建赖氨酸甲基化介导的DDX1-RNA相互作用的基因组图谱,我们在正常和TBHP处理的髓核细胞中对正常和甲基化DDX1进行了RNA免疫沉淀结合新一代测序(RIP-seq)[33]。对照RIP组共获得6,724,986条reads,而TBHP-RIP组获得5,783,158条reads。值得注意的是,Ctrl-RIP组中93.75%的reads和TBHP-RIP组中95.86%的reads被比对到注释的人类基因组上。由于RNA降解,可能无法在转录本上获得reads的均匀分布,这表明与非结合位点相比,蛋白质在其直接结合位点相对富集,这也使得RIP-seq可以通过peak calling进行分析。peak分布分析显示DDX1在外显子、3'UTR和5'UTR区域富集(图5A、B),最高富集位于外显子5'UTR末端附近(图5C、G)。RIP-seq共在对照组和退变组髓核细胞转录本中分别鉴定出22,477和10,517个DDX1富集peak(排除了转录本自发表达减少引起的误差)(图5D)。随后使用RPKM对基因表达进行定量。聚类分析显示,与未甲基化DDX1相比,甲基化DDX1结合的注释人类基因数量减少了约2000个(图5E)。考虑到非特异性序列结合[34],蛋白质-RNA相互作用位点分析表明,相对于TBHP-RIP,Ctrl-RIP在共享结合区域表现出更强的富集(图5F、G)。RIP-seq与RNA-seq数据的相关性探索进一步表明,DDX1优先结合在外显子-内含子连接处附近,特别是在3'和5'剪接位点周围,其结合强度受赖氨酸甲基化调节(图5H)。
为阐明DDX1富集峰的功能意义,GO分析显示甲基化介导的DDX1差异靶基因主要定位于细胞质核周区及核仁区域,这些基因通过结合多种底物在DNA损伤修复、细胞分裂及细胞周期等过程中显著富集(图5I、J、M)。为进一步解析DDX1-RNA相互作用,采用HOMER算法鉴定了DDX1结合的RNA基序,发现AGUGGAA七聚体[35]是最显著富集的元件(图5K、L、P)。值得注意的是,超过81.5%的这些基序位于外显子和内含子区域内(图5N)。在得分最高的四个基序中,基序1和4富集于5'剪接位点的内含子-外显子连接处附近,而基序2和3则定位于外显子内部(图5O)。这些结果共同表明赖氨酸甲基化会减弱DDX1与前mRNA底物的直接结合能力。
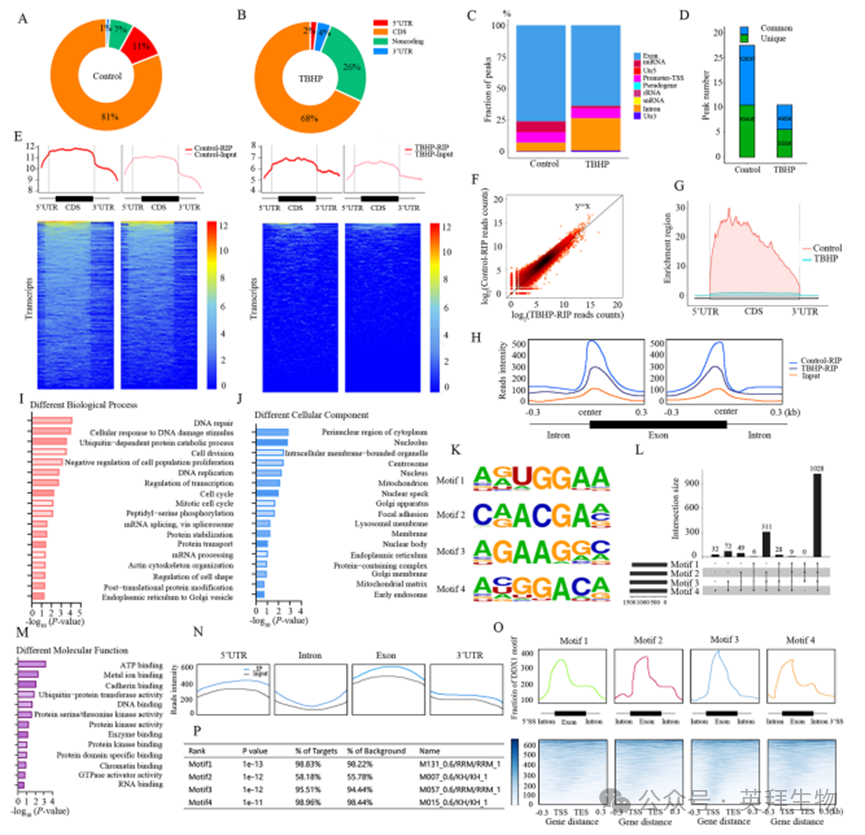
图5. 单细胞转录组测序揭示ASH1L调控转移性骨微环境中巨噬细胞可塑性
6.甲基化DDX1减少剪接因子招募并促进MATR3外显子14跳跃
为探究DDX1调控的可变剪接(AS),我们对正常和TBHP处理的NP细胞、以及重新表达siRNA抗性DDX1 K234M和K234R突变的HEK-293T/siDDX1与NP/siDDX1细胞进行了转录组分析。AS变异事件包括外显子跳跃(SE)、内含子保留(RI)、5'和3'位点选择性切换(A5SS和A3SS)以及外显子互斥(MEX)表达模式(图6A)。在TBHP处理的NP细胞中,外显子跳跃事件占主导(72%),而在过表达DDX1 K234M的HEK-293T细胞和NP细胞中分别降至68%和67%(图6B,补充图5A)。值得注意的是,两类基因谱中第二常见的AS事件均为占比相同(17%)的互斥外显子。总体而言,NP细胞与HEK-293T细胞中各类AS事件比例相似。
通过整合DDX1结合基因与SE相关基因的转录组及RIP数据,我们筛选出与椎间盘退变(IVDD)相关的功能靶点。综合分析显示,仅六个外显子跳跃基因在TBHP处理的NP细胞、以及过表达DDX1 K234M的NP和HEK-293T细胞中与DDX1结合存在重叠(图6C)(补充数据3)。鉴于RNA-seq结合功能实验已证实DDX1赖氨酸甲基化通过激活衰老和凋亡信号通路导致NP细胞退变,同时基于RIP-seq的GO分析发现DDX1靶基因富集于核周区域的生物学过程(BP),如DNA损伤修复、细胞分裂与周期调控(图5I,J)。
在DDX1结合且发生可变剪接的转录本中,核基质蛋白编码基因MATR3(Matrin3)引起了我们的关注。Matrin3蛋白在细胞核内具有维持核基质结构、调控基因转录、参与mRNA代谢、DNA修复及凋亡调控等关键功能,其异常可能加剧多种疾病发生发展。RNA-seq分析发现,TBHP处理和DDX1 K234M过表达(NP与HEK-293T细胞)均促进外显子14跳跃,产生更短的MATR3亚型(MATR3-S)。RIP-seq数据进一步显示DDX1结合于MATR3外显子14邻近区域,证实MATR3是DDX1的直接靶标(图6D,E;补充图5C,D)。
序列分析表明,外显子14跳跃导致读码框移位但未引入提前终止密码子,提示该亚型通过结构而非表达量变化影响功能(图6F)。使用亚型特异性引物检测发现,TBHP处理显著降低NP细胞中MATR3-L/MATR3-S比值,DDX1 K234M过表达产生相同效应(图6G,补充图5B)。半定量RT-PCR证实TBHP处理增加外显子14跳跃率,生成更多MATR3-S而减少全长亚型,该现象在DDX1 K234M过表达组中同样存在(图6H,补充图5E)。这些结果共同证实DDX1通过直接结合pre-mRNA调控MATR3可变剪接。
为阐明DDX1调控可变剪接(AS)的机制,我们在过表达DDX1 K234R和K234M突变的siDDX1/HEK-293T细胞中,通过DDX1抗体免疫共沉淀结合质谱(MS)进行分析。GO富集分析显示,DDX1互作蛋白显著富集于剪接体介导的mRNA剪接及RNA剪接调控相关通路(图6I)。与甲基化DDX1相比,正常DDX1中多种RNA剪接因子(如HNRNPA2B1、RBM26和SF3B2)丰度更高(图6J,补充图5F-H)。已知DDX1互作蛋白HNRNPK2和DHX36在两种条件下均被富集,验证了数据可靠性(图6J)。
RNA解旋酶通过水解ATP获得能量来解开RNA双链或二级结构。通过检测反应体系中ATP的消耗速率,可间接评估解旋酶活性或RNA结合蛋白对解链过程的调控作用。K234R和K234M突变体对非特异性结合RNA探针的解旋酶活性无影响,但DDX1 K234M与MATR3的相互作用较野生型(WT)和K234R显著减弱(补充图5I)。值得注意的是,基于GO和KEGG分析发现,DDX1 K234R邻近蛋白在mRNA剪接通路中呈现更高富集度(图6K-M),而rRNA加工相关蛋白在K234R与K234M间无显著差异,表明DDX1与剪接调控因子的相互作用独立于其解旋酶活性。这些结果共同证明,甲基化通过阻碍DDX1招募mRNA加工相关蛋白来调控可变剪接过程
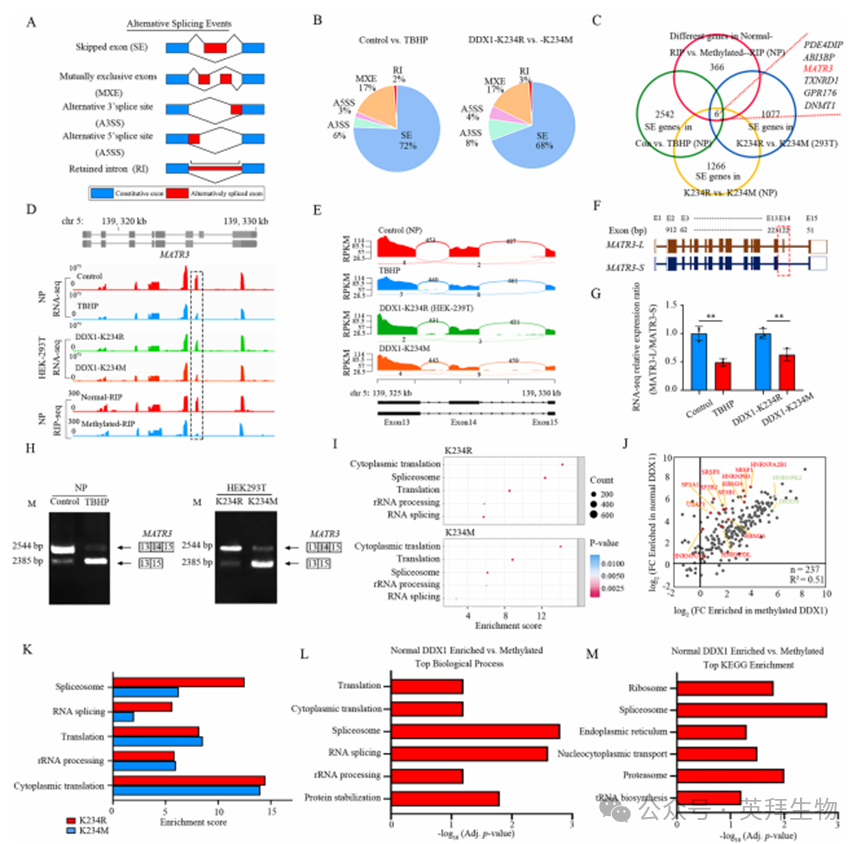
图6.甲基化DDX1减少剪接因子招募并促进MATR3外显子14跳跃
7.MATR3-S通过触发染色质过度开放参与衰老和凋亡区域调控
为评估MATR3外显子14跳跃的功能意义,我们通过ATAC-seq检测了过表达MATR3-L(含外显子14)或MATR3-S(缺失外显子14)的NP细胞基因组染色质可及性。两种NP细胞的ATAC-seq数据集均显示约200 bp的相似片段长度,双峰分布提示存在不同的染色质结构或特定DNA序列区域(图7A)。与转录研究一致,过表达MATR3-S的NP细胞染色质peak变化数量显著多于MATR3-L组,且MATR3-L组人类NP细胞中重复元件的ATAC peak信号较弱,表明其染色质结构更为致密(图7B,补充图6A)。基于可及染色质peak的主成分分析(PCA)和相关分析明确区分了两类NP细胞(补充图6B、C)。染色质peak主要定位于内含子、外显子、启动子和远端区域(通常包含增强子等非编码调控元件)(图7C)。值得注意的是,NP细胞中受MATR3亚型变化影响的染色质peak几乎全部位于远端区域(补充图6D),提示非编码调控元件对MATR3亚型变化具有特殊响应性。研究发现,MATR3亚型对NP细胞染色质可及性动态变化具有相反效应:随着MATR3-L增加,多数动态染色质peak呈现关闭状态;而MATR3-S增加则导致这些peak开放(图7D-F)。这些数据表明,在NP细胞退变过程中,MATR3-L诱导抑制性染色质状态,而MATR3-S导致染色质结构松弛化。网络分析揭示Wnt通路作为细胞周期、凋亡和分化等生物过程的核心调控枢纽,与MAPK通路存在复杂交叉对话(图7G)。β-连环蛋白(β-catenin)激活后可转位并与转录因子互作,促进Cyclin D1等细胞周期基因表达,驱动细胞进入S期。虽然Wnt/β-catenin通常促进细胞存活与增殖,但其过度激活在某些条件下可诱导凋亡。
GO和KEGG分析显示,过表达MATR3-S的退变NP细胞中,衰老与凋亡相关区域(包括"应激激活的MAPK级联"、"Ras蛋白信号转导"、"Wnt信号通路"及"Wnt介导的细胞间信号")的染色质可及性普遍升高(图7I,补充图6E)。相反,过表达MATR3-L的正常NP细胞中,抑制细胞周期与生长发育相关区域(如"有丝分裂细胞周期G/M转换"、"细胞形态发生"和"骨骼系统发育")的染色质可及性显著降低(图7J,补充图6F)。网络分析揭示Wnt通路作为细胞周期、凋亡和分化等生物过程的核心调控枢纽,与MAPK通路存在复杂交叉对话(图7G)。β-连环蛋白(β-catenin)激活后可转位并与转录因子互作,促进Cyclin D1等细胞周期基因表达,驱动细胞进入S期。虽然Wnt/β-catenin通常促进细胞存活与增殖,但其过度激活在某些条件下可诱导凋亡。
GO和KEGG分析显示,过表达MATR3-S的退变NP细胞中,衰老与凋亡相关区域(包括"应激激活的MAPK级联"、"Ras蛋白信号转导"、"Wnt信号通路"及"Wnt介导的细胞间信号")的染色质可及性普遍升高(图7I,补充图6E)。相反,过表达MATR3-L的正常NP细胞中,抑制细胞周期与生长发育相关区域(如"有丝分裂细胞周期G/M转换"、"细胞形态发生"和"骨骼系统发育")的染色质可及性显著降低(图7J,补充图6F)。具体而言,过表达MATR3-S的NP细胞呈现以下特征:Wnt通路相关区域(如WNT2/3、CTNNB1、GSK3B)染色质开放度增加(图7H、K-N;补充图6J);MAPK通路成员(MAPK1/3)调控区域可及性上升(图7K);促凋亡基因(RIPK1、CASPASE3)调控元件可及性增强(补充图6K、M);细胞周期相关基因(如CDK1)染色质可及性下降(补充图6L)。而过表达MATR3-L的NP细胞在上述调控区域呈现完全相反的染色质可及性变化(补充图6G-I)。这些结果表明,MATR3不同亚型通过塑造相反的染色质景观,对衰老和凋亡相关调控区域产生拮抗性调控作用。
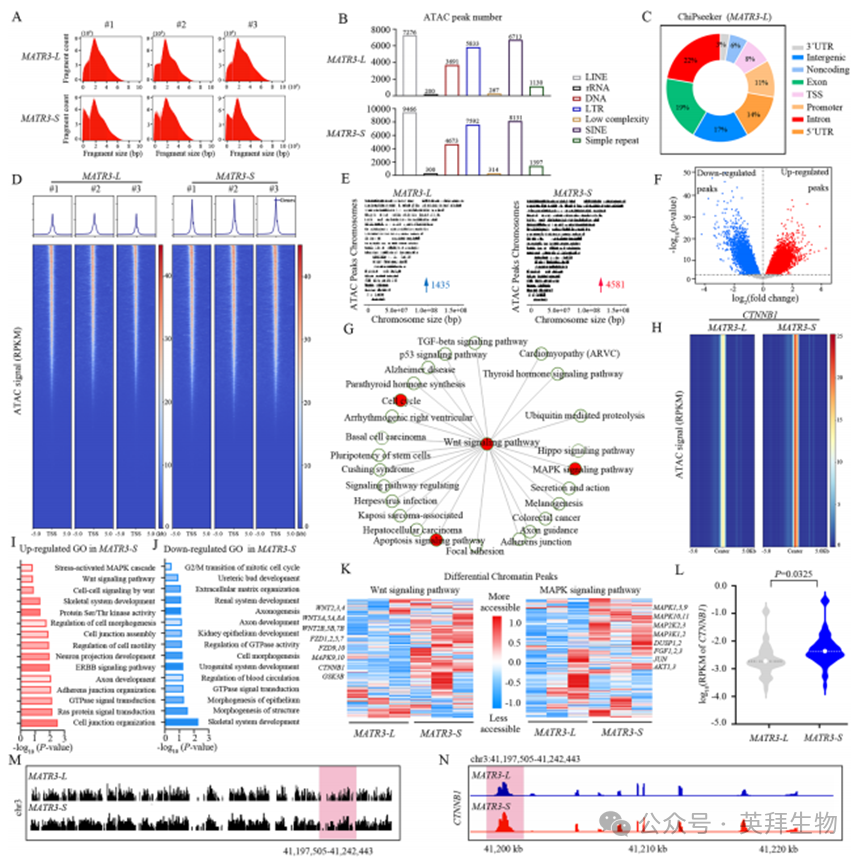
图7. MATR3-S通过触发染色质过度开放参与衰老和凋亡区域调控
8.阳离子LNP递送MATR3-L mRNA有效延缓椎间盘退变进程
鉴于MATR3核苷酸序列较长且可行包装方案有限,结合脂质纳米颗粒(LNP)在相邻细胞间侧向转运中的优异性能,我们基于微流控技术构建了过表达MATR3-L或MATR3-S的阳离子脂质LNP(补充图7A)。微流控技术通过精确分配纳升级体积、以轴向扩散混合为主及低体积连续操作等特性,可有效控制粒径并生成多种LNP类型。该体系中:DOTAP通过静电相互作用直接结合细胞表面,胆固醇增强脂质稳定性,DOPE提高核酸递送效率,聚乙二醇(PEG)则通过限制血浆蛋白结合与非特异性摄取延长体内循环半衰期。
为构建功能性mRNA转录本,我们制备了含MATR3基因的DNA载体。转录产物中MATR3-L长度约2544个核苷酸,MATR3-S约2385个核苷酸,与预测长度一致。透射电镜(TEM)显示MATR3-L-LNP、MATR3-S-LNP及空载体LNP均呈分散良好的不规则球形或杯状形态,与其粒径分布相符(图8A)。为评估mRNA转录本克服核酸酶敏感性、抗原呈递障碍及载体介导递送效率等挑战的能力,琼脂糖凝胶电泳证实当阳离子脂质体与mRNA重量比(w/w)>8:1时,MATR3-L与MATR3-S可实现完全包裹(图8B)。纳米颗粒追踪分析(NTA)显示:空载体LNP平均粒径80.94±12.28 nm,Zeta电位59.56±5.41 mV;MATR3-L-LNP平均粒径193.73±10.30 nm,Zeta电位27.56±7.81 mV;MATR3-S-LNP平均粒径168.19±11.61 nm,Zeta电位35.78±6.11 mV(图8C、D)。
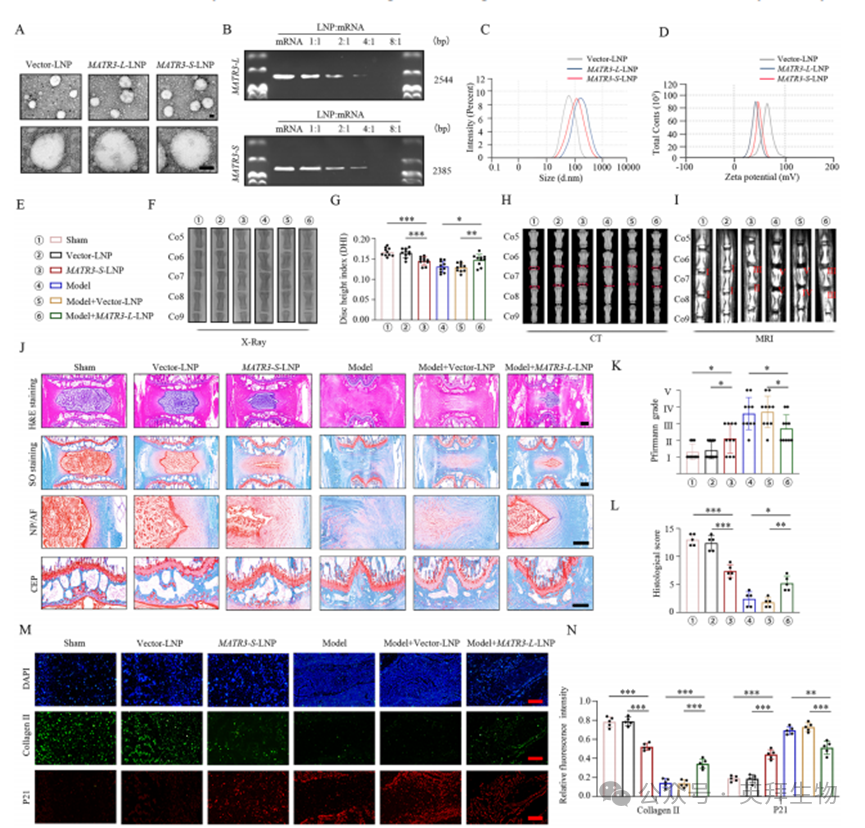
图8. 阳离子LNP递送MATR3-L mRNA有效延缓椎间盘退变进程
8.分子机制
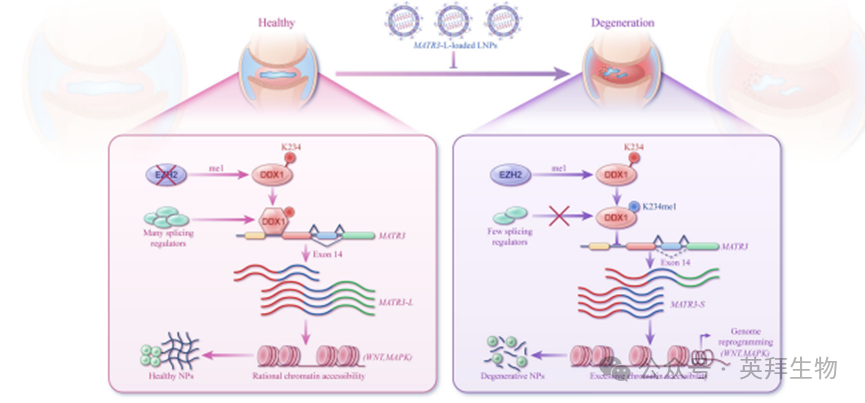
在退变的髓核细胞中,上调的EZH2增强了DDX1第234位赖氨酸的甲基化修饰。甲基化DDX1与MATR3的相互作用减弱,导致剪接位点处剪接因子富集度降低,从而通过外显子14跳跃促进MATR3-S亚型的生成。MATR3-S通过过度开放染色质可及性,异常激活Wnt信号通路进而促进髓核细胞衰老与凋亡。基于阳离子脂质纳米颗粒递送过表达MATR3-L mRNA的治疗策略,可有效延缓椎间盘退变进程。
结论:
本研究发现EZH2介导的RNA结合蛋白DDX1在赖氨酸234位点的甲基化,通过削弱其与剪接因子的相互作用,促进MATR3基因外显子14跳跃,产生短型MATR3-S,进而引发椎间盘髓核细胞染色质过度开放,激活Wnt等衰老凋亡信号通路,加速椎间盘退变;而利用阳离子脂质纳米颗粒递送MATR3长型mRNA可逆转这一过程,为椎间盘退变的基因治疗提供了新策略。
参考文献:
Zhu D, Liang H, Tong B, Du Z, Li G, Zhang W, Wu D, Zhou X, Lei J, Zhang X, Ma L, Wang B, Feng X, Wang K, Tan L, Song Y, Yang C. DDX1 methylation mediated MATR3 splicing regulates intervertebral disc degeneration by initiating chromatin reprogramming. Nat Commun. 2025 Jul 4;16(1):6153.






