肿瘤源性外泌体LINC01812诱导M2巨噬细胞极化促进胆管癌的神经周围浸润
M2型巨噬细胞在侵袭性实体瘤的肿瘤微环境中发挥着关键作用。它们与神经周围浸润(PNI)密切相关,且常与不良预后相关联。在此背景下,肿瘤源性外泌体是细胞间通讯的重要介质。然而,肿瘤细胞诱导的M2型巨噬细胞与胆管癌中的PNI之间的关系尚未得到探究。在本研究中,我们运用多重免疫荧光和转录组测序技术,证明了LINC01812在胆管癌组织中表达上调,且其与M2型巨噬细胞浸润呈正相关。外泌体lncRNA测序、外泌体摄取实验、RNA下拉实验以及质谱分析表明,巨噬细胞能够摄取含有LINC01812的外泌体,并促进胆管癌细胞向M2型表型转化。此外,肿瘤微环境可通过M2型巨噬细胞显著增强胆管癌细胞的神经浸润能力。本研究结果表明,源自胆管癌的含LINC01812的外泌体可诱导M2型巨噬细胞极化,并促进神经浸润,从而为治疗胆管癌中的PNI提供了新的潜在治疗靶点。本文于2025年3月发表于“Cancer Letters”(IF=9.1)上。
技术路线:

结果:
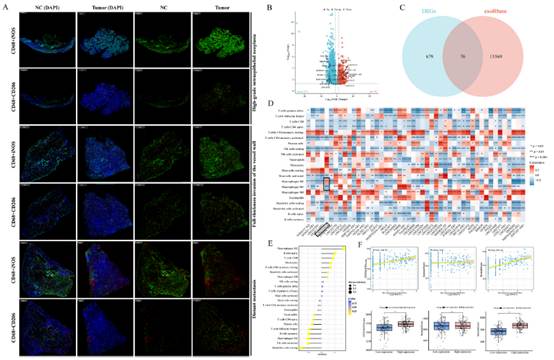
1)CCA不同浸润阶段M1/M2巨噬细胞密度
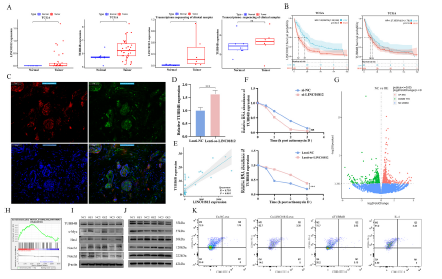
我们采用多重荧光染色技术,检测了CD68、iNOS和CD206之间的关系。结果显示,M1型巨噬细胞呈广泛阳性信号,且在腺体组织中显著聚集。相比之下,M2型巨噬细胞在肿瘤侵袭前沿的微环境中分布更为弥散。为验证免疫荧光染色结果,我们对iNOS和CD206的荧光强度与细胞密度进行了定量分析。结果表明,与邻近正常组织相比,肿瘤组织中iNOS的荧光强度和M1型巨噬细胞的密度均显著降低,而CD206的荧光强度和M2型巨噬细胞的密度则显著升高(图1A)。随后,我们对12例胆管癌(CCA)患者的样本进行了全转录组测序。我们与exoRbase数据库进行了联合分析,并鉴定出76个差异上调的差异表达基因(DEGs)(图1B和C)。其中,LINC01812尤为引人关注,因为它在胆管癌组织中的表达显著升高,且在胆管癌患者来源的外泌体中富集,提示其在肿瘤-免疫细胞通讯中可能发挥作用。我们观察到LINC01812的表达与M2型巨噬细胞浸润呈正相关,与M1型巨噬细胞水平呈负相关,这支持了其可能参与免疫细胞分化和功能调节(图1D)。此外,我们利用公共数据库验证了LINC01812与M2型巨噬细胞之间的正相关性(图1E)。此外,我们证实了LINC01812高表达患者的基质评分和ESTIMATE评分显著高于LINC01812低表达患者(图1F)。基于这些结果,我们选择LINC01812进行进一步研究,以阐明其在胆管癌中的功能作用和分子机制。
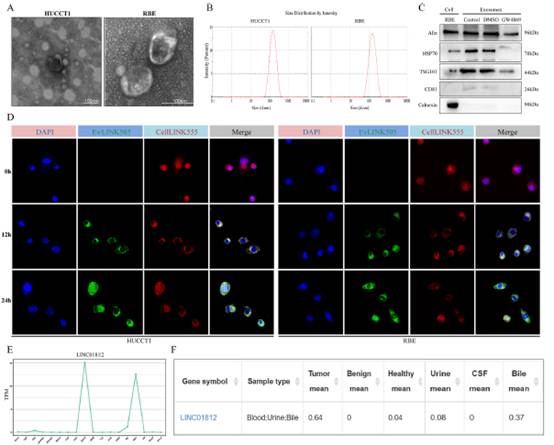
2)THP-1细胞外泌体的分离、表征和摄取
TEM图像显示,外泌体呈现出典型的杯状形态(图2A)。NTA显示,分离得到的外泌体的平均直径约为110 nm,与典型外泌体的特征一致(图2B)。Western blot实验证实了外泌体标志物(包括Alix、HSP70、TSG101、CD81)以及阴性标志物calnexin的表达(图2C)。共聚焦显微镜显示,随时间推移,积累在THP-1细胞周围的外泌体数量显著增加(图2D)。用于分析外泌体中LINC01812表达的exoRbase数据库显示,其在胆汁、食管鳞状细胞癌和黑色素瘤中的表达水平升高(图2E)。此外,肿瘤患者血液、尿液和胆汁样本中的LINC01812表达显著高于健康对照组(图2F)。
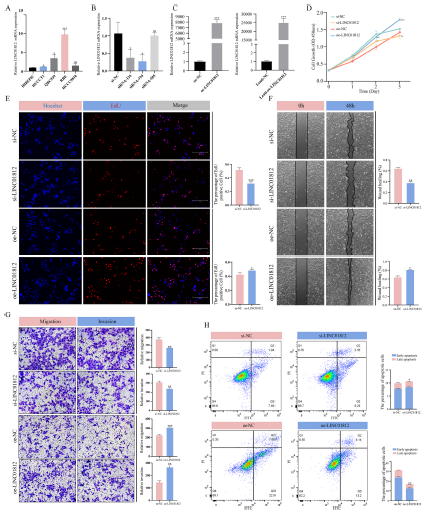
3)LINC01812促进CCA细胞的增殖、迁移和侵袭
为探究LINC01812在CCA中的功能作用,我们首先评估了其在HIBEPIC、HUCCT1、QBC939、RBE和HCCC9810细胞中的表达水平(图3A)。根据qPCR分析结果,选择RBE细胞系进行LINC01812敲低实验,并利用慢病毒载体在HUCCT1细胞中建立了LINC01812的稳定过表达细胞系(图3B和C)。CCK-8和EdU实验结果显示,LINC01812敲低显著抑制了RBE细胞的增殖(图3D和E)。划痕愈合实验和Transwell实验进一步表明,LINC01812敲低显著降低了CCA细胞的迁移和侵袭能力(图3F和G)。流式细胞术结果显示,LINC01812敲低后细胞凋亡显著增加。相反,在HUCCT1细胞中过表达LINC01812则产生了与敲低相反的效果;LINC01812过表达显著促进了细胞增殖(图3D)、迁移和侵袭(图3F和G);此外,还降低了细胞凋亡率。
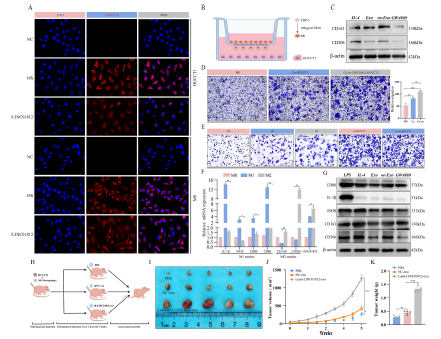
4)CCA细胞外泌体衍生的LINC01812诱导M2巨噬细胞极化,促进肿瘤进展
通过FISH技术检测了LINC01812在CCA细胞和巨噬细胞中的亚细胞定位。结果显示,LINC01812主要定位于细胞质中(图4A)。采用Transwell共培养模型将HUCCT1细胞与M0型巨噬细胞共培养(图4B和D)。与LINC01812过表达的HUCCT1细胞共培养后,M0型巨噬细胞的迁移能力显著增强。Western blot分析证实,在此共培养条件下,M0型巨噬细胞发生了M2型极化(图4C)。仅与外泌体共培养的结果显示,Lenti-oe-LINC01812-exo显著诱导M0型巨噬细胞分化为M2型而非M1型巨噬细胞(图4E和G)。此外,添加外泌体抑制剂GW4869显著抑制了CCA细胞来源的外泌体诱导的M0型巨噬细胞极化。qPCR证实,M2型巨噬细胞中LINC01812的表达显著上调(图4F)。在裸鼠皮下成瘤实验中,研究了外泌体来源的LINC01812在CCA体内的作用(图4H)。结果显示,与NC-exo组相比,Lenti-oe-LINC01812-exo组的肿瘤体积和重量显著增加;而NC-exo组的肿瘤大小和重量相对于PBS组也显著增加(图4I、J、4K)。
5)外泌体LINC01812通过与TUBB4B相互作用促进M2巨噬细胞极化
我们使用生物素标记的LINC01812探针或阴性对照(NC)探针与来自THP-1 M0型巨噬细胞的总蛋白提取物进行孵育,以探究LINC01812的作用机制。利用链霉亲和素磁珠进行下拉分析后,通过SDS-PAGE分离蛋白产物(图5A)。采用质谱(MS)技术鉴定LINC01812结合蛋白,并选取至少两条独特鉴定的肽段进行进一步分析。候选蛋白包括TUBB4B、CNBP、RPF1、DDX54、PGAM2和HSPD1。利用基因表达综合数据库的单细胞数据对肿瘤微环境(TME)中的巨噬细胞浸润情况进行表征。首先,将所有细胞聚类为六个亚群(图5D),并将髓系亚群进一步重新聚类为单核细胞、M1型巨噬细胞和M2型巨噬细胞(图5E)。随后,我们分析了重新聚类的巨噬细胞亚群中TUBB4B、CNBP、RPF1、DDX54、PGAM2和HSPD1的表达水平。结果显示,与邻近组织相比,TUBB4B和HSPD1在癌组织中显著高表达,而PGAM2的表达无显著差异。因此,我们对剩余五个基因进行了拟时序分析。拟时序分析用于模拟CCA中髓系细胞的分化过程(图5G和H),结果显示单核细胞处于分化的早期阶段;经过分支点4后,它们逐渐分化为M1型和M2型巨噬细胞。随后,我们分析了这些结合蛋白在M2型巨噬细胞分化拟时序轨迹上的表达趋势(图5I)。结果表明,TUBB4B是LINC01812调控M2型巨噬细胞分化过程中的关键基因。分析了TUBB4B高表达组和低表达组之间的配体-受体介导的细胞相互作用(图5J)。Western blot分析验证了TUBB4B与LINC01812之间的相互作用(图5C),二级质谱图如图5B所示。
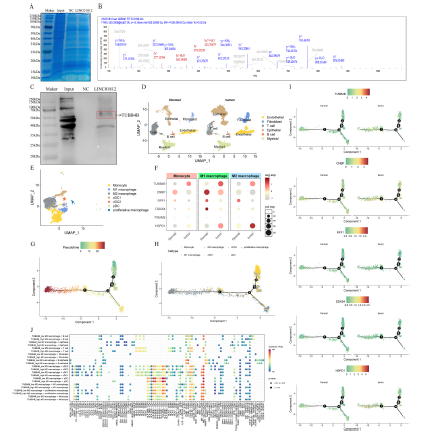
6)外泌体LINC01812通过结合TUBB4B调控Notch通路
与邻近的非癌组织相比,在12例CCA样本和TCGA数据库的肿瘤组织中,LINC01812和TUBB4B均显著上调(图6A)。在TCGA-CHOL队列中,LINC01812的高表达与较差的总生存率相关;然而,TUBB4B的表达并未显示出显著的预后差异(图6B)。随后,我们进行了原位杂交和双重免疫荧光染色,以确定LINC01812和TUBB4B在CCA组织中的共定位情况。我们还使用免疫荧光技术分析了TUBB4B和M2型巨噬细胞极化标志物CD206的定位情况。结果显示,LINC01812和TUBB4B在肿瘤组织中共定位(图6C)。然而,由于CD206在肿瘤组织中广泛分布,TUBB4B与CD206的共定位并不显著。这些发现表明LINC01812和TUBB4B的表达水平之间可能存在相关性。对来自患者的40例CCA组织样本进行的qPCR验证了这些结果(图6E)。在THP-1 M0型巨噬细胞中过表达LINC01812可增加TUBB4B的表达(图6D)。我们用放线菌素D处理了LINC01812过表达和敲低的M0型巨噬细胞,以探究LINC01812在调控TUBB4B中的作用。如图6F所示,在放线菌素D处理下,LINC01812过表达显著增加了TUBB4B的mRNA表达。相反,在相同实验条件下,LINC01812的敲低导致TUBB4B表达显著降低(图6F)。利用siRNA转染THP-1来源的M0型巨噬细胞,以敲低TUBB4B。转染48小时后,进行RNA测序分析,鉴定出1626个差异表达基因(DEGs)(图6G)。GSEA显示,在TUBB4B过表达组中,Notch通路基因集的表达水平较高(图6H)。Western blot分析显示,与NC组相比,在Lenti-oe-LINC01812过表达组中,TUBB4B和Notch通路成分(包括c-Myc、Hes1、Notch1和Notch3)的表达显著增加(图6I)。LINC01812诱导的Notch通路激活依赖于TUBB4B的表达,且敲低TUBB4B可有效阻断LINC01812诱导的Notch通路激活。这表明LINC01812与TUBB4B之间存在线性调控轴(图6J)。最后,流式细胞术显示,与NC组相比,用Lenti-oe-LINC01812-exo处理的M0型巨噬细胞显著向M2表型分化;然而,在M0型巨噬细胞中敲低TUBB4B显著抑制了Lenti-oe-LINC01812-exo的作用(图6K)。
7)外泌体LINC01812通过诱导M2巨噬细胞极化促进PNI
外泌体可被神经元细胞摄取,并影响特定神经营养因子的分泌。因此,我们评估了在不同处理条件下PC12细胞的分化水平以及四种特定神经营养因子的分泌情况。外泌体可促进低分化PC12细胞的分化,而Lenti-oe-LINC01812-exo可进一步增强这种效果。与M2型巨噬细胞共培养可放大分化效应,使分化水平显著升高(图7A)。qPCR结果显示,与NC-exo处理组相比,经Lenti-oe-LINC01812-exo处理的PC12细胞中神经营养因子的分泌水平略有增加,尽管差异无统计学意义;然而,当PC12细胞与M2型巨噬细胞共培养时,这种效应显著增强(图7B)。我们建立了体外CCA周围神经浸润(PNI)模型,通过观察CCA细胞在基质胶中的迁移情况,进一步探索外泌体的作用。外泌体可促进CCA细胞向背根神经节(DRG)的侵袭。与M2型巨噬细胞共培养可显著增强这种侵袭能力,而预先用GW4869处理CCA细胞则可有效抑制这一过程(图7C)。这表明外泌体LINC01812和M2型巨噬细胞可以通过独立和协同机制促进PNI。TCGA-CHOL数据显示,PNI患者的LINC01812表达水平显著升高(图7D)。在确认巨噬细胞中的Notch通路可被外泌体LINC01812激活后,我们进行了ELISA以测量巨噬细胞上清液中CCL2的表达水平。经Lenti-oe-LINC01812-exo处理后,CCL2表达增加了约五倍。相比之下,经NC-exo处理的巨噬细胞中CCL2表达仅增加了1.6倍,这可能是由于其他补偿机制对CCL2的调控所致(图7E)。此外,本研究的作用机制示意图如图7F所示。
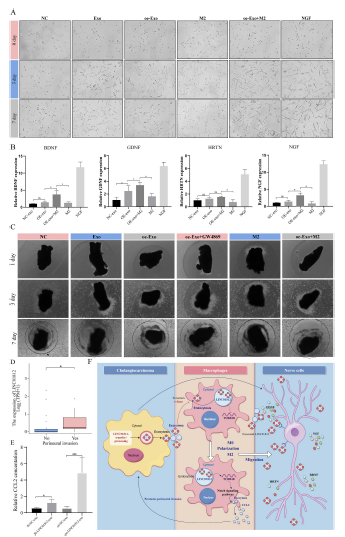
结论:
本研究证明,CCA细胞来源外泌体可通过LINC01812-Notch-CCL2轴介导M2型巨噬细胞极化并促进神经浸润。这一过程形成了有利于肿瘤侵袭的免疫微环境,并突显了LINC01812作为胆管癌神经浸润预测生物标志物的潜力。
实验方法:
qPCR,CCK8,伤口愈合试验,Transwell,流式,FISH,Western blotting,RNA pull-down。
参考文献:
Wang Q, Sun Z, Guo J, Li H, Zhang J, Zhang B, Zhou B, Feng Y. Tumor-derived exosomal LINC01812 induces M2 macrophage polarization to promote perineural invasion in cholangiocarcinoma. Cancer Lett. 2025 May 1;617:217596. doi: 10.1016/j.canlet.2025.217596.






