PD-L1驱动肺癌免疫耐药新机制!IL-6/Jak/Stat3轴成联合治疗靶点
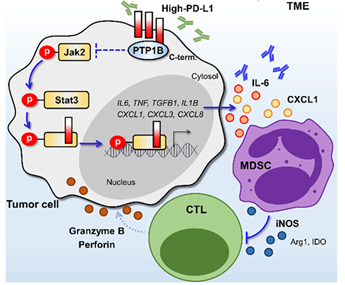
部分非小细胞肺癌(NSCLC)患者尽管存在程序性死亡配体 1(PD-L1)表达,但仍能从免疫检查点抑制剂(ICIs)治疗中获益。为探究 PD-L1 阳性 NSCLC 对 ICIs 耐药的机制,作者研究了肿瘤细胞内 PD-L1 在白细胞介素(IL)-6 介导的免疫抑制中的作用。研究结果显示,肿瘤细胞内的 PD-L1 具备独特的作用机制:它能够通过抑制蛋白酪氨酸磷酸酶 1B,同时与细胞核中 的磷酸化 Stat3 紧密结合,进而成功激活 Jak2/Stat3 信号通路。这一激活过程进一步增强了 IL-6 和 CXCL1 的转录活性。而这些变化会借助髓源性抑制细胞(MDSCs)引发免疫抑制反应,最终导致 PD-L1 高表达的 NSCLC 对 ICIs 产生耐药性。值得关注的是,在肺癌的临床前模型实验中,针对 IL-6 和 PD-1 的联合治疗方案展现出了令人瞩目的效果。该联合治疗通过有效逆转 MDSC 介导的免疫抑制作用,对肿瘤的生长实现了高效控制。综合来看,肿瘤细胞内 PD-L1 的功能通过 PD-L1/Jak/Stat3/IL-6/MDSC 这一复杂的信号轴,推动了免疫抑制的发生以及肿瘤的不断进展。不过,这一信号轴也为提高 PD-L1 高表达 NSCLC 患者 ICIs 的治疗效果提供了潜在的治疗靶点。这篇文章于2025年3月发表于《Journal for ImmunoTherapy of Cancer》期刊上,IF:10.3。
研究技术路线:

主要实验结果:
1、 IL-6可预测PD-L1高表达的非小细胞肺癌对免疫检查点抑制剂治疗的不良应答
为探究PD-L1高表达的非小细胞肺癌(NSCLC)对免疫检查点抑制剂(ICIs)无应答的机制,作者分析了ICI-RNA测序队列(相关数据集可在基因表达综合数据库中获取,登录号为GSE285029)。对RNA测序数据进行基因集富集分析(GSEA)后发现,在CD274(PD-L1)低表达组中,与无应答者(疾病稳定(SD)+疾病进展(PD))相比,IL-6/Jak/Stat3通路在对ICIs有部分缓解(PR)的应答者中更为富集(图1A)。相反,在CD274高表达组中,IL-6/Jak/Stat3通路在无应答者中更为富集(图1B)。IL-6/Jak/Stat3通路核心富集位点的基因热图显示,IL6是CD274高表达组中应答者和无应答者之间差异表达最为显著的基因之一(图1C)。在CD274高表达组中,疾病进展患者的IL6表达水平更高(图1D)。虽然高CD274表达预示着更好的应答和临床结局,但在CD274高表达组中,高IL6表达却与不良应答和临床结局显著相关,而在CD274低表达组中则不存在这种关联(图1E、F)。免疫细胞特征评分显示,在CD274高表达组的无应答者中,细胞毒性T淋巴细胞(CTLs)减少,髓源性抑制细胞(MDSCs)增加(图1G、H)。在PD-L1高表达组的无应答者中,IL6表达与调节性T细胞(Tregs)和MDSCs评分呈正相关(图1H)。
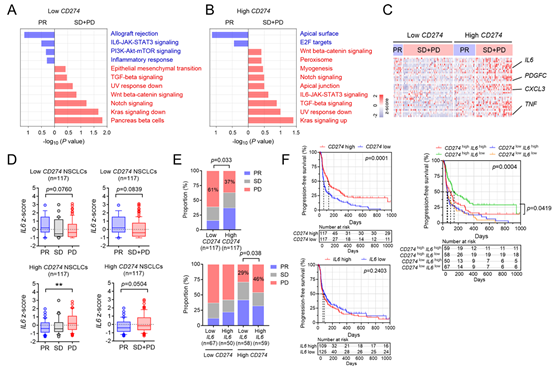
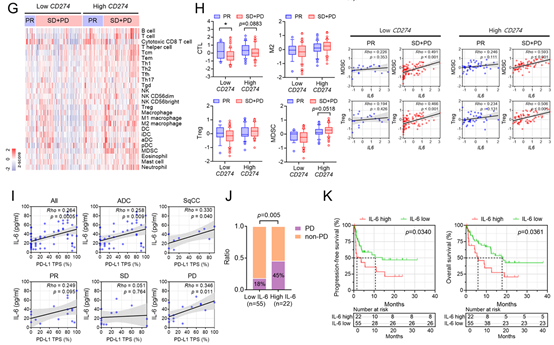
图 1:IL-6 预测 PD-L1 高表达的非小细胞肺癌患者对 ICI 治疗反应不佳
在ICI血清队列中,PD-L1表达(肿瘤比例评分(TPS))与血清IL-6水平呈正相关,在疾病进展的患者中尤为明显(图1I)。血清IL-6水平较高的患者在接受ICI治疗后的应答较差,生存期也较短(图1J、K)。这些研究结果表明,IL-6与PD-L1高表达的NSCLC中具有免疫抑制作用的肿瘤微环境(TME)以及对ICI治疗的不良应答相关。
2、PD-L1过表达激活肺癌细胞中的IL-6/Jak2/Stat3通路
为了确定NSCLC中IL-6与PD-L1之间的关系,作者分析了癌症基因组图谱(TCGA)的数据。结果显示,IL-6/Jak/Stat3通路在PD-L1高表达的肿瘤中更为富集。为了研究PD-L1在IL-6/Jak/Stat3通路中的细胞内在作用,作者对NSCLC细胞系的基础PD-L1表达进行了筛选。将基础PD-L1表达较低的A549和H522细胞转染PD-L1过表达载体,而对基础PD-L1表达较高的H460和H596细胞转染PD-L1小干扰RNA(siRNA)。随后对这些细胞进行RNA测序和体外分析。在RNA测序鉴定出的差异表达基因(DEGs)中,有359个基因在A549细胞过表达PD-L1时上调,在H460细胞敲低PD-L1时下调,其中包括IL6(图2A-C)。通过对差异表达基因进行基因集富集分析发现,在过表达PD-L1的A549细胞中,IL-6/Jak/Stat3通路增强,而在敲低PD-L1的H460细胞中,该通路则减弱(图2D、E)。
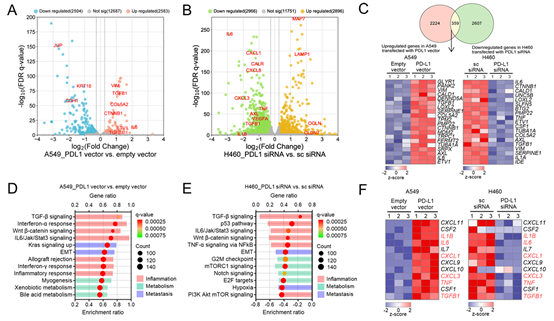
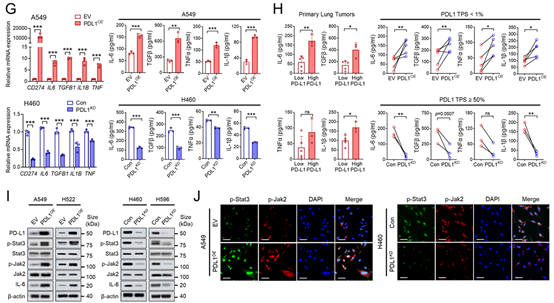
图 2:PD-L1 在肺癌细胞中激活 IL-6/Jak2/Stat3 通路
在由PD-L1调节的IL-6/Jak/Stat3基因集中的细胞因子和趋化因子(图2F)里,作者通过定量实时逆转录聚合酶链反应(qRT-PCR)和酶联免疫吸附测定(ELISA),对NSCLC细胞过表达和敲低PD-L1后,几种细胞因子(如IL6、肿瘤坏死因子(TNF)、转化生长因子-β1(TGFB1)、白细胞介素-1β(IL1B))和趋化因子(如CXCL1、CXCL3和CXCL8)的表达和产生情况进行了验证(图2G)。对于原发性肺癌细胞培养和转染,作者通过荧光激活细胞分选(FACS),从PD-L1低表达(TPS<1,n=5)和PD-L1高表达(TPS≥50,n=3)的NSCLC患者的手术切除肿瘤组织中,分选CD45阴性细胞。在原发性肺癌细胞培养物中,这些细胞因子和趋化因子在培养上清液中的水平,在PD-L1高表达的肿瘤中高于PD-L1低表达的肿瘤,并且会随着PD-L1的过表达而增加,随着PD-L1的敲低而减少(图2H)。IL-6的表达、磷酸化的Jak2和Stat3以及磷酸化Stat3(p-Stat3)的核转位,都会随着PD-L1的过表达而增加,随着PD-L1的敲低而减少(图2I、J)。PD-L1过表达导致的细胞因子表达增加,可被Jak2和Stat3抑制剂阻断。在癌症细胞系百科全书(CCLE)中的NSCLC细胞系里,CD274的表达与JAK2、STAT3和IL6的表达呈正相关。综上所述,这些结果表明,肿瘤细胞内在的PD-L1通过激活Jak2/Stat3,增加了NSCLC中上述细胞因子和趋化因子的表达。
PD-L1过表达会增加A549和H522细胞中p-Jak2、p-Stat3水平以及IL-6的表达,而这种效应会因PD-L1的敲低而减弱。此外,重组PD-1会刺激H460和H596细胞产生细胞因子和趋化因子,但在PD-L1敲低的细胞中,这种反应会受到抑制。这些研究结果表明,PD-L1依赖的Jak2/Stat3/IL-6通路激活,可能发生在肺癌微环境中。
3、PD-L1通过直接结合并抑制蛋白酪氨酸磷酸酶1B(PTP1B),上调Jak2和Stat3的磷酸化水平
作者通过研究能够与PD-L1相互作用的蛋白质,来探究PD-L1激活Jak2/Stat3的机制。先前的一项研究表明,PTP1B在MDA-MB-231细胞中会与PD-L1结合,并且PTP1B会与Jak2相互作用并使其去磷酸化。在人胚肾293T(HEK293T)细胞中,进行了带有Flag标签的PD-L1和带有Myc标签的PTP1B的免疫共沉淀实验。在PD-L1高表达的H460细胞中,内源性PTP1B和PD-L1的相互作用会因PD-L1的敲低而受到抑制,而在过表达PD-L1的A549细胞中,它们的结合则会增加。一项下拉实验表明,PTP1B会直接与PD-L1的细胞质结构域相互作用。在一项以重组p-Jak2为底物的体外磷酸酶实验,以及一项PTP1B磷酸酶活性实验中,结果显示PD-L1会抑制PTP1B的活性。PTP1B抑制剂能够恢复PD-L1敲低的H460和H596细胞中Jak2/Stat3的磷酸化水平,以及IL6的转录水平。这些结果表明,PD-L1会与PTP1B结合并抑制其活性,从而增强Jak2/Stat3的活性和IL-6的表达。
4、 细胞核中的PD-L1与p-Stat3结合,增强其对IL-6的转录效率
作者通过关注PD-L1的定位,来研究PD-L1在Stat3信号通路中的内在作用。在PD-L1高表达的NSCLC细胞中,观察到了PD-L1的核定位现象(图3A、B)。免疫共沉淀和Duolink实验表明,PD-L1和p-Y705-Stat3在细胞核和细胞质中均存在物理相互作用,并且在过表达PD-L1的细胞的细胞核中,这种相互作用更强(图3C、D)。
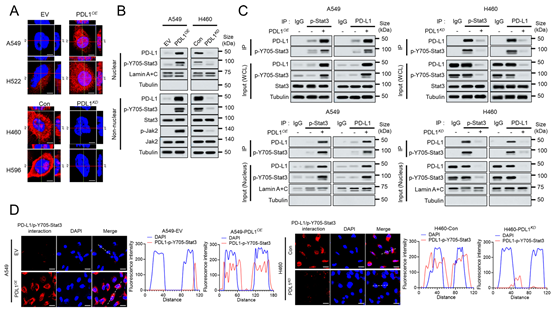
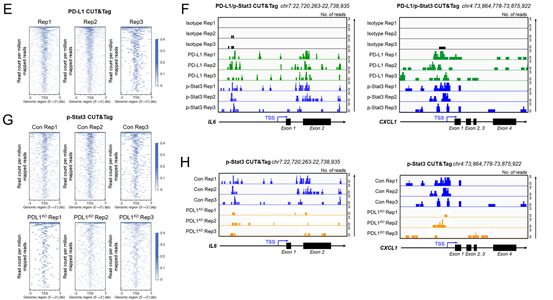
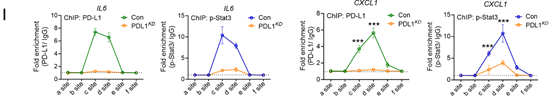
图 3:PD-L1 与细胞核中的 p-Stat3 结合并增强其在 IL-6 转录中的效率
使用H460细胞进行的CUT&Tag实验显示,细胞核中PD-L1的结合位点分布在转录起始位点附近(图3E)。在PD-L1和p-Stat3的CUT&Tag数据中,在IL6和CXCL1启动子上观察到了明确且重叠的峰(图3F)。在p-Stat3的CUT&Tag实验中,敲低PD-L1的细胞中,p-Stat3在全基因组范围内的结合强度下降,并且在IL6和CXCL1启动子上的富集程度也减弱(图3G、H)。这些结果表明,细胞核中的PD-L1会定位于IL6和CXCL1的启动子区域,作为p-Stat3转录这些基因的共激活因子发挥作用。这一结论得到了顺序染色质免疫沉淀-qPCR(ChIP-qPCR)实验的支持,该实验表明,在敲低PD-L1的细胞中,p-Y705-Stat3与细胞因子和趋化因子启动子的结合减少(图3I)。
5、 PD-L1以依赖IL-6的方式,促进MDSCs的迁移和激活
作者假设,肿瘤细胞内在的PD-L1导致上述细胞因子和趋化因子表达增加,会对抗肿瘤免疫产生影响。由于在对TCGA数据进行CIBERSORTx分析时发现,PD-L1低表达和高表达的NSCLC之间,22种免疫细胞组分并没有显著差异,因此作者将研究重点放在了MDSCs上,因为CIBERSORTx分析中并未包含这种细胞。MDSCs的40个特征基因的表达,在PD-L1高表达的NSCLC中普遍升高(图4A)。MDSCs评分与CD274的表达,以及与PD-L1上调的细胞因子和趋化因子的表达,均呈正相关(图4B)。此外,在对患者肿瘤进行的FACS分析中,肿瘤浸润的单核细胞源性MDSCs(M-MDSCs)和多形核MDSCs(PMN-MDSCs)的数量,与PD-L1的表达呈正相关(图4C)。这些研究结果表明,PD-L1的内在功能可能通过IL-6/Jak2/Stat3通路影响MDSCs。作者使用从健康供体的外周血单个核细胞(PBMCs)中分离出的HLA-DR低表达CD11b⁺CD33⁺CD14⁺(M-MDSCs)、HLA-DR低表达CD11b⁺CD33⁺CD15⁺细胞(PMN-MDSCs)和CD15低密度中性粒细胞(以下统称为“人MDSCs”)的混合物,以及T细胞,对这一假设进行了研究。
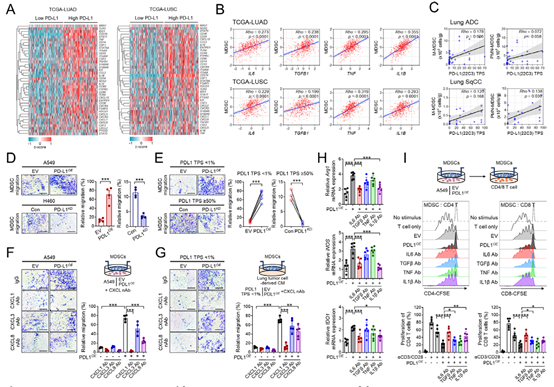
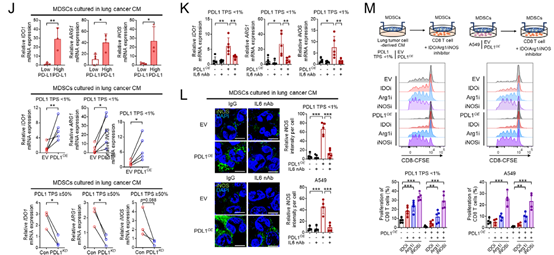
图 4:PD-L1 促进 CXCL1 和 IL-6 依赖性的 MDSC 迁移和激活
当MDSCs与PD-L1高表达的NSCLC细胞共培养,或者在过表达PD-L1的原发性肺癌细胞的条件培养基(CM)中培养时,MDSCs通过Transwell系统的迁移能力会增强,而这种迁移会被CXCL1中和抗体显著抑制(图4D-G)。在使用0.4μm孔径的Transwell系统,将MDSCs与NSCLC细胞共培养的实验中,当MDSCs与过表达PD-L1的A549细胞共培养时,MDSCs中负责发挥抑制功能的基因(包括ARG1、诱导型一氧化氮合酶(iNOS)、TGFB1、吲哚胺2,3-双加氧酶1(IDO1)和IL10)的表达会增加,而当与敲低PD-L1的H460细胞共培养时,这些基因的表达则会减少。在将MDSCs与预先和PD-L1高表达的NSCLC细胞共孵育的实验中,CD4⁺和CD8⁺ T细胞的增殖会减少,而CD4⁺ T细胞向Tregs的分化则会增强。当使用IL-6中和抗体处理共培养体系时,与过表达PD-L1的A549细胞共培养的MDSCs的抑制活性会显著恢复(图4H、I)。
同样,在PD-L1高表达或过表达PD-L1的原发性肺癌细胞的条件培养基中培养的MDSCs中,IDO1、Arg1和iNOS的表达会更高,而这种反应会被IL-6中和作用阻断(图4J-L)。由与过表达PD-L1的A549细胞共培养的MDSCs,或者在过表达PD-L1的原发性肺癌细胞的条件培养基中培养的MDSCs所诱导的CD8⁺ T细胞增殖减少的现象,可通过ARG1和iNOS抑制剂得到恢复(图4M)。综合来看,这些研究结果表明,肿瘤细胞内在的PD-L1功能,以依赖IL-6的方式促进了MDSCs的募集和抑制活性。
6、PD-L1的内在功能通过IL-6介导的免疫抑制作用,在体内促进肿瘤生长,且该过程独立于PD-1
为了在体内验证上述体外实验的结果,作者构建了稳定过表达或敲低PD-L1的LLC细胞系,并将其皮下移植到C57BL/6小鼠的侧腹。LLC细胞中PD-L1的过表达促进了肿瘤生长,增加了肿瘤浸润的M-MDSCs和PMN-MDSCs群体,以及IL-10或iNOS阳性的M-MDSCs和PMN-MDSCs的数量,同时减少了颗粒酶B(GzmB)⁺或干扰素-γ(IFNγ)⁺ CD8⁺ T细胞的浸润。从过表达PD-L1的肿瘤中分离出的MDSCs,能够有效地抑制从无肿瘤小鼠脾脏中分离出的CD8⁺ T细胞的增殖。而在敲低PD-L1的肿瘤中,观察到了相反的效果。从敲低PD-L1的肿瘤中分离出的肿瘤浸润CD8⁺ T细胞,在体外能够有效地杀伤LLC细胞。
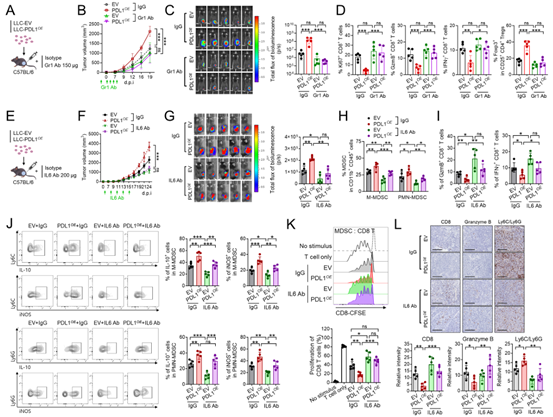
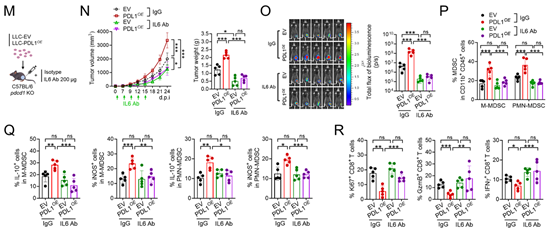
图 5:PD-L1 通过 IL-6 诱导的免疫抑制在体内促进肿瘤生长,且不依赖于 PD-1
为了确定肿瘤中的PD-L1是否通过MDSCs和IL-6促进LLC肿瘤的生长,作者给小鼠注射了抗Gr-1(Ly6C/Ly6G)抗体和抗IL-6抗体。MDSCs的耗竭显著抑制了PD-L1诱导的肿瘤生长,恢复并增加了GzmB⁺、IFNγ⁺或增殖性CD8⁺ T细胞的数量,同时减少了过表达PD-L1的肿瘤中的Tregs数量(图5B-D)。在过表达PD-L1的肿瘤中,阻断IL-6会抑制肿瘤生长,减少MDSCs的募集和激活,并增加GzmB⁺或IFNγ⁺ CD8⁺ T细胞的数量(图5F-J、L)。从接受IL-6阻断处理的肿瘤中分离出的MDSCs,抑制CD8⁺ T细胞增殖的能力较弱(图5K)。
为了证明肿瘤细胞内在的PD-L1通过IL-6诱导的免疫抑制作用促进肿瘤进展,且该过程独立于PD-1的结合,作者使用PD-1(PDCD1)基因敲除小鼠进行了体内实验。PD-L1的过表达会促进肿瘤生长,增加MDSCs的募集和激活,减少CD8⁺ T细胞的增殖和细胞毒性,而这些变化均可通过阻断IL-6得到恢复(图5M-R)。这些结果表明,肿瘤细胞内在的PD-L1通过MDSCs和IL-6诱导的免疫抑制作用,促进了肿瘤进展,且该过程不依赖于PD-1。
7、过表达 PD-L1 的细胞分泌的 IL-6,通过激活 MDSCs 在体内促进肿瘤生长
为了进一步确定由过表达 PD-L1 的细胞分泌的 IL-6 激活的 MDSCs,是否会导致免疫抑制和肿瘤进展,作者从无肿瘤小鼠的脾脏中分离出 CD11b⁺Ly6G⁺和 CD11b⁺Ly6C⁺髓系细胞,并将其在过表达 PD-L1 的 LLC 细胞的条件培养基(LLC-PDL1OE-CM)中培养,同时设置添加或不添加抗 IL-6 抗体的实验组,然后将这些细胞与新鲜的野生型 LLC 细胞一起注射到小鼠的侧腹(图 6A)。在注射了在 LLC-PDL1OE-CM 中培养的髓系细胞和 LLC 细胞的小鼠中,观察到肿瘤生长加快,Tregs 数量增加,GzmB⁺、IFNγ⁺或增殖性 CD8⁺ T 细胞数量减少;而在 LLC-PDL1OE-CM 中添加抗 IL-6 抗体后,这些效果会被逆转(图 6B-F)。此外,在注射了在敲低 PD-L1 的 LLC 细胞的条件培养基(LLC-PDL1KD-CM)中培养的髓系细胞的小鼠中,肿瘤生长的减缓可通过耗竭 CD8⁺ T 细胞得到恢复(图 6G-I)。在注射了在 LLC-PDL1OE-CM 中培养的髓系细胞的小鼠中,肿瘤生长的增加可通过耗竭 Tregs 得到抑制(图 6J-L)。这些研究结果表明,髓系细胞对适应性 T 细胞免疫的免疫抑制作用,介导了与 PD-L1 高表达的 LLC 细胞的条件培养基共孵育的髓系细胞的促肿瘤作用。
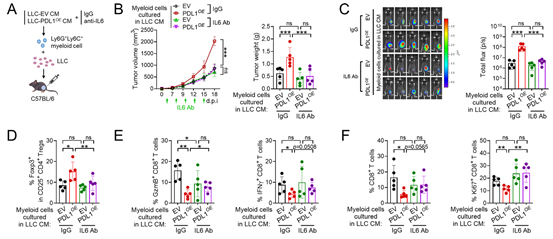
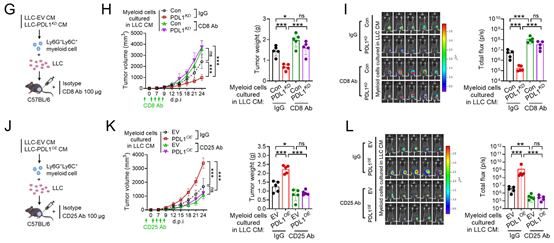
图 6:PD-L1 过表达细胞分泌的 IL-6 通过髓细胞激活和免疫抑制性肿瘤微环境在体内促进肿瘤生长
此外,在 LLC 肿瘤中,与 LLC-PDL1KD 肿瘤相比,IL-6 阻断导致的肿瘤生长抑制、MDSCs 减少和效应 T 细胞增加的效果更为显著。这些研究结果支持了 PD-L1 过表达通过 IL-6 促进 MDSC 介导的免疫抑制作用这一观点。
8、联合阻断 IL-6 和 PD-1 可有效控制肿瘤生长并引发抗肿瘤免疫反应
鉴于阻断 IL-6 可恢复 PD-L1 诱导的免疫抑制,作者研究了联合阻断 IL-6 和 PD-1 的效果。联合治疗有效地抑制了肿瘤生长,并延长了荷瘤小鼠的生存期(图 7A-G)。免疫抑制细胞(包括 MDSCs 和 Tregs)的浸润显著减少,而效应 CD8⁺ T 细胞的浸润则有所增加(图 7H-M)。当进行联合治疗时,从肿瘤中分离出的 MDSCs 抑制 T 细胞增殖的能力较弱,而从肿瘤中分离出的 CD8⁺ T 细胞杀伤 LLC 细胞的能力则更强(图 7N、O)。这些结果表明,针对 IL-6 和 PD-1 的联合治疗,通过恢复由 PD-L1/Jak2/Stat3/IL-6/MDSC 轴介导的免疫抑制作用,具有协同的抗肿瘤活性(图 7P)。
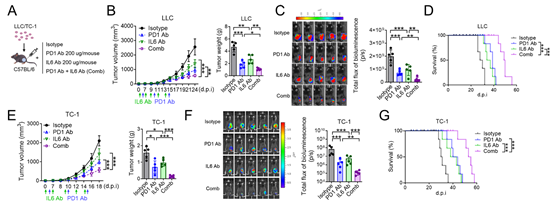
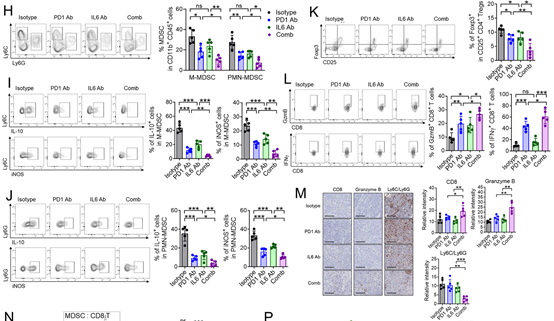
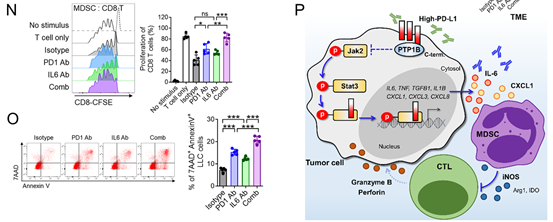
图 7:联合阻断 IL-6 和 PD-1 可有效控制肿瘤生长并引发抗肿瘤免疫反应
最后,在 ICI 免疫组织化学(ICI-IHC)队列中,PD-L1 TPS 与非应答者的 IL-6 H 评分呈正相关。在 PD-L1 高表达(TPS≥50)组中,IL-6 高表达的肿瘤患者对 ICI 治疗的应答和预后较差。在 PD-L1 高表达组中,非应答者的 IL-6 H 评分与肿瘤浸润的 CD8⁺淋巴细胞呈负相关,与 Foxp3⁺细胞和 MDSCs(CD33⁺CD11b⁺细胞)呈正相关。IL-6 高表达 / PD-L1 高表达的肿瘤中,MDSC 免疫组织化学评分最高。ICI-IHC 队列的研究结果与 ICI-RNA 测序队列的结果相似,进一步证明了 PD-L1 高表达的肿瘤细胞产生的 IL-6,通过 MDSCs 抑制了 NSCLC 患者对 ICI 的应答。
结论:
该研究表明,PD-L1 的肿瘤-细胞-内在功能激活 IL-6/Jak/Stat3 通路,进而驱动 MDSC 的免疫抑制。这种细胞内在的 PD-L1/IL-6/MDSC 轴既可以作为 ICI 治疗的潜在生物标志物,也可以作为提高 ICIs 在 PD-L1 高 NSCLC 患者中疗效的靶点。
实验方法:
RNA-seq,CUT&Tag-seq、细胞培养,过表达及siRNA敲低细胞转染、细胞共培养、T 细胞增殖和 Treg 分化检测、细胞凋亡检测、流式细胞术、IHC、免疫荧光染色、免疫共沉淀、Western blot、q-PCR、Pull-down 测定、荧光素酶报告基因检测、Duolink 邻位连接测定、ChIP-qPCR
参考文献:
Jeong H, Koh J, Kim S, Yim J, Song SG, Kim H, Li Y, Lee SH, Chung YK, Kim H, Lee CH, Kim HY, Keam B, Lee SH, Chung DH, Jeon YK. Cell-intrinsic PD-L1 signaling drives immunosuppression by myeloid-derived suppressor cells through IL-6/Jak/Stat3 in PD-L1-high lung cancer. J Immunother Cancer. 2025 Mar 6;13(3):e010612. doi: 10.1136/jitc-2024-010612. PMID: 40050048; PMCID: PMC11887297.






