METTL16促进胆管癌生长
m6A修饰与包括胆管癌(CCA)在内的人类癌症的进展有关。METTL16最近被鉴定为一种新的RNA甲基转移酶,负责m6A修饰,尽管METTL16在CCA中的作用尚未被研究。本研究旨在探讨RNA甲基转移酶METTL16在CCA中的作用及其机制。我们观察到METTL16在人CCA组织中的表达明显增加。METTL16的缺失可显著抑制CCA细胞增殖,降低肿瘤进展。PRDM15被鉴定为CCA细胞中METTL16的关键靶点。从机制上讲,我们的数据表明METTL16通过依赖YTHDF1的翻译调节PRDM15蛋白的表达。我们观察到恢复PRDM15的表达可以挽救METTL16缺失导致的CCA细胞增殖/集落形成缺陷。我们随后的分析显示,METTL16-PRDM15信号调节CCA细胞中FGFR4的表达。我们观察到PRDM15蛋白与FGFR4启动子相关,以调节其表达。此外,我们发现在CCA细胞中,组蛋白乙酰转移酶p300与转录因子YY1共同作用,通过组蛋白H3赖氨酸27 (H3K27)乙酰化调节METTL16基因的表达。本研究描述了一种新的METTL16-PRDM15-FGFR4信号轴,它对CCA生长至关重要,可能具有重要的治疗意义。我们发现,METTL16的缺失显著抑制了CCA细胞的增殖并降低了肿瘤的进展。本文于2023年10月发表于“Journal of Experimental & Clinical Cancer Research”(IF=11.3)上。
技术路线

结果
1)METTL16在CCA中上调
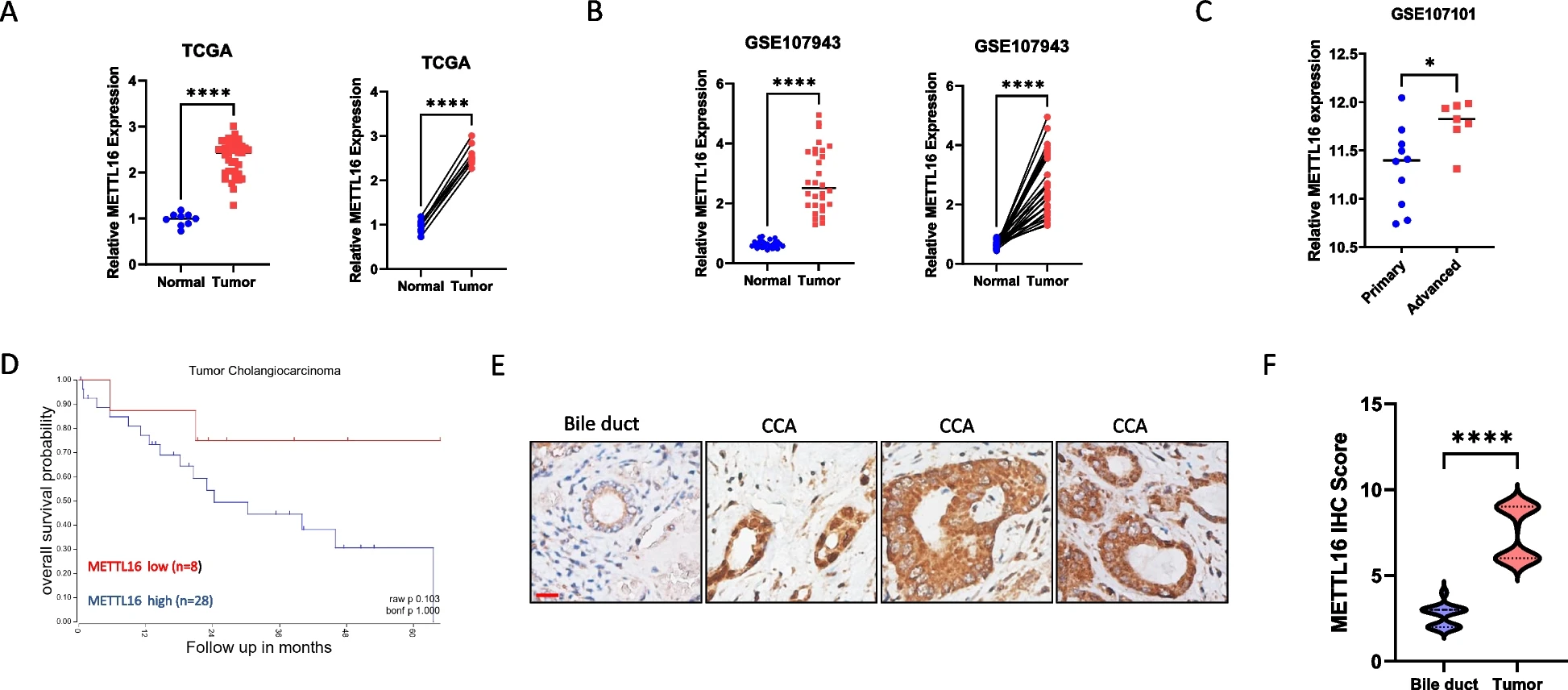
我们分析了METTL16在CCA和非肿瘤组织样本中的表达。我们的分析表明,在TCGA-胆管癌(TCGA-CHOL)(图1A)和GSE107943(图1B)数据集中,与匹配或未匹配的非肿瘤组织相比,METTL16在CCA组织中的表达上调。对GSE107101数据集的分析显示,与原发性CCA组织相比,晚期CCA组织中METTL16的表达水平更高(图1C)。对TCGA-CHOL数据集中现有临床数据的患者进行进一步的生存分析表明,CCA组织中METTL16的高表达往往与患者生存率较差相关(图1D)。通过对人CCA组织中METTL16进行免疫组化(IHC)染色,我们观察到METTL16在CCA中的表达明显高于正常胆管上皮(图1E和1F)。这些临床分析表明METTL16在CCA中具有潜在的致癌作用。
2)METTL16的缺失抑制CCA细胞生长
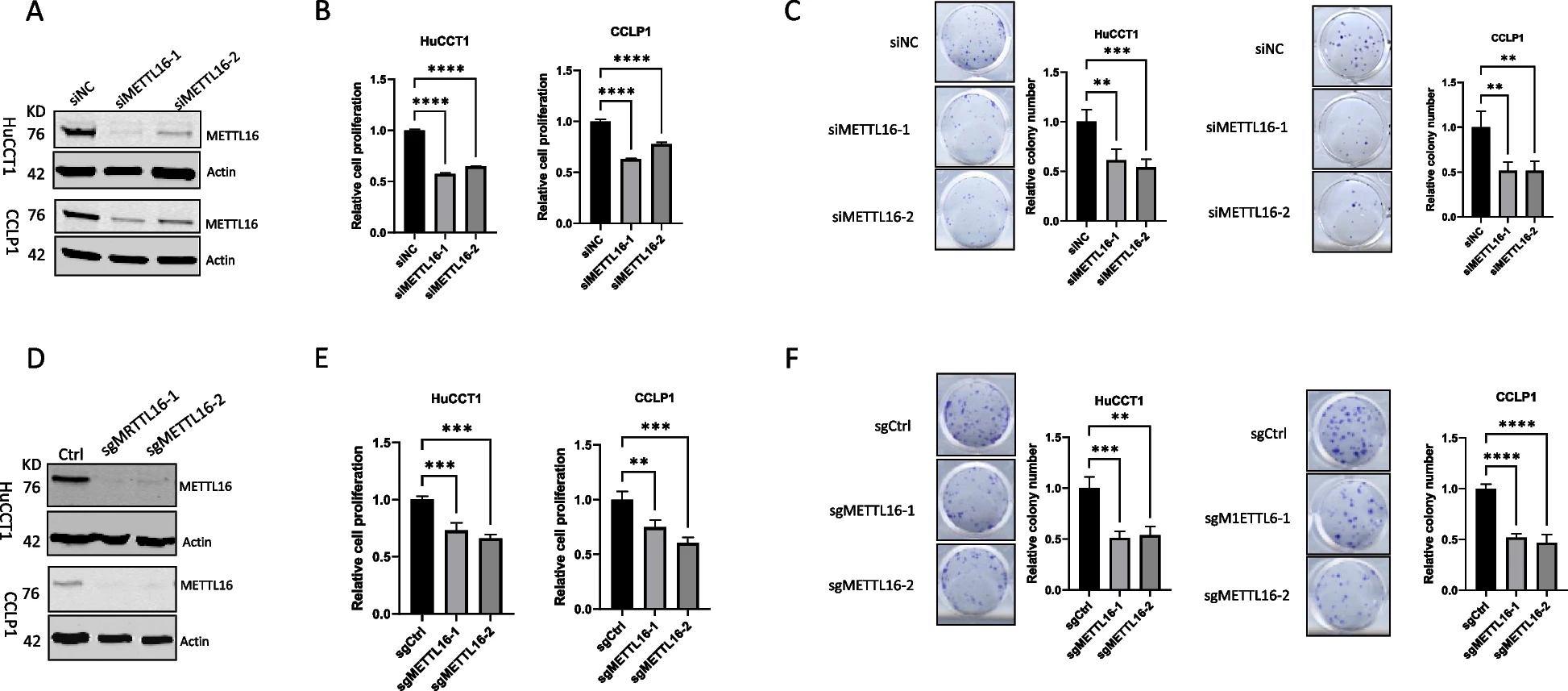
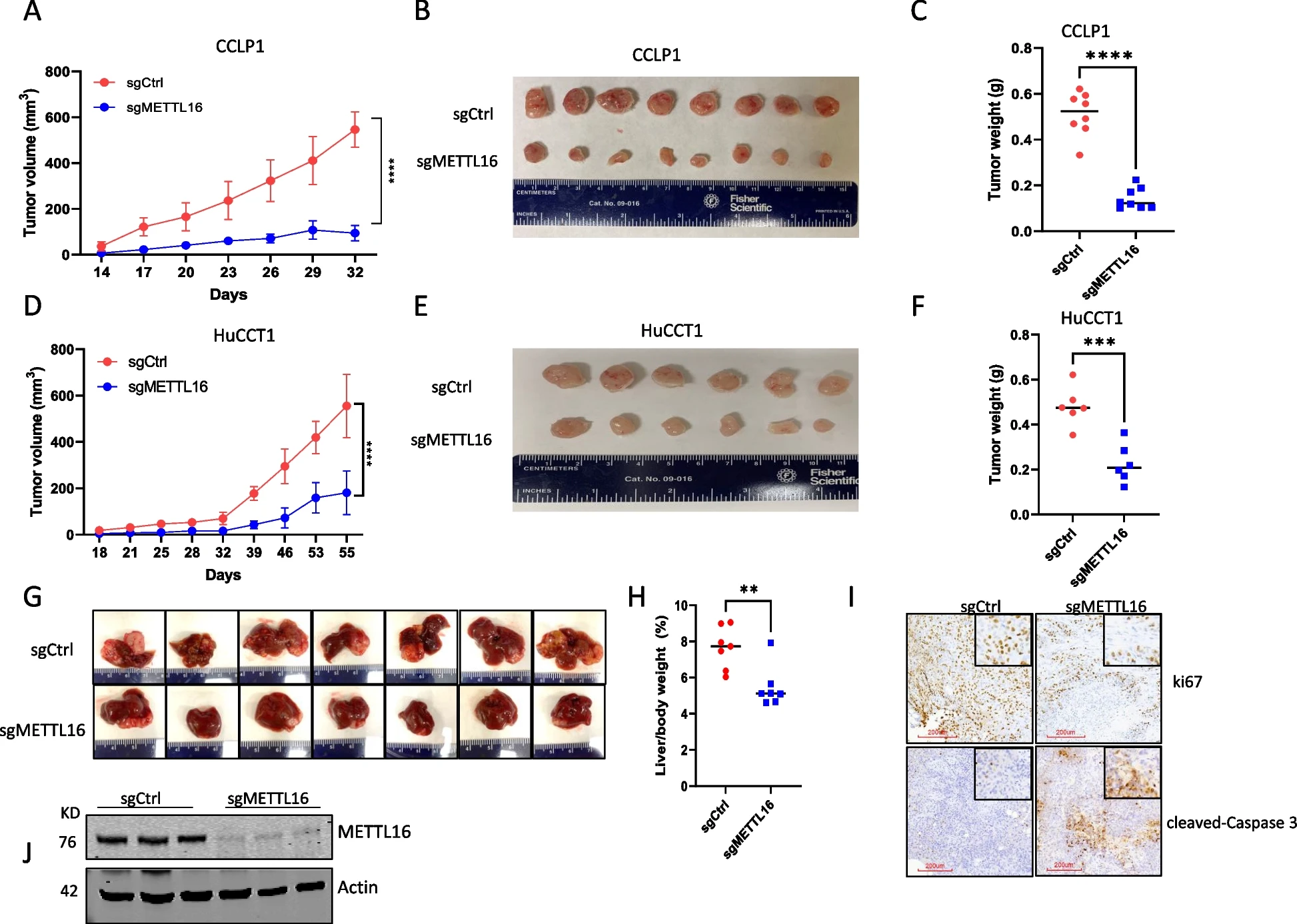
为了确定METTL16在CCA细胞中的功能作用,我们使用两组siRNA在两种人类CCA细胞系(CCLP1和HuCCT1)中敲低METTL16。Western blot分析证实了令人满意的敲除效果(图2A)。我们观察到,METTL16的敲除导致CCA细胞增殖和集落形成能力显著下降(图2B和2C)。同时,我们使用CRISPR/Cas9基因编辑方法删除了CCLP1和HuCCT1细胞中METTL16的表达(图2D)。与siRNA敲低结果一致,CRISPR/Cas9导致METTL16的缺失也显著降低了CCA细胞的增殖和集落形成(图2E和2F)。这些结果证明了METTL16在体外CCA细胞生长中的重要作用。然后,我们将CRISPR/cas9介导的METTL16敲除和对照CCA细胞皮下接种NOD/SCID小鼠。如图3A至3F所示,在这种异种移植肿瘤模型中,METTL16的缺失显著抑制了CCA的生长。同时,我们采用了一种单独的CCA异种移植模型,将人CCA细胞接种到NOD/SCID小鼠的肝脏中。我们观察到,当肿瘤细胞接种到肝脏中时,METTL16缺失也显著抑制了CCA的生长(图3G-3I)。综上所述,这些发现证明了METTL16在体内对CCA生长的重要作用。
3)PRDM15是METTL16的直接靶点
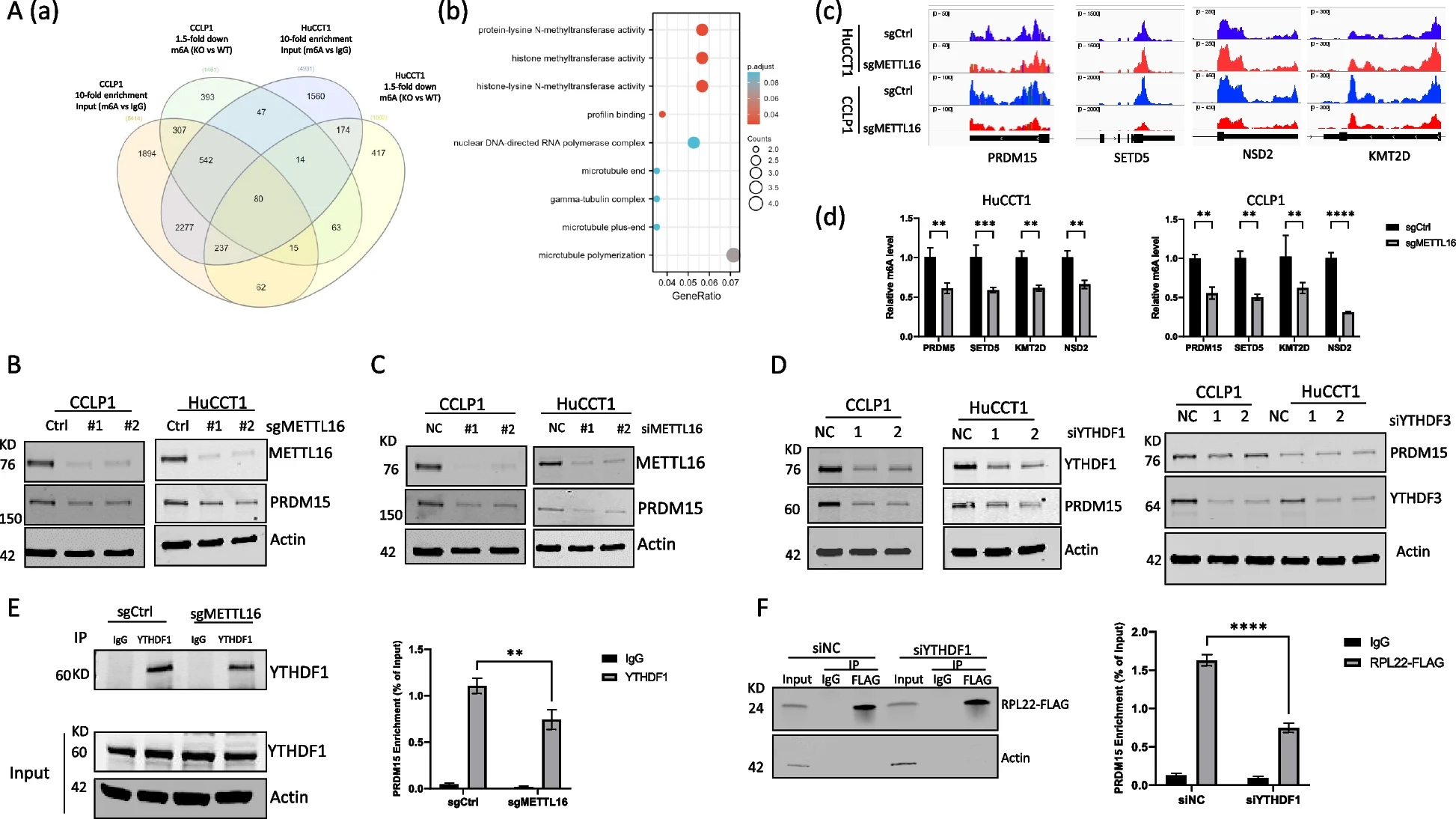
为了确定METTL16在CCA中致癌作用的潜在下游靶点,我们在人CCA细胞(CCLP1和HuCCT1)中进行了m6A甲基化RNA免疫沉淀测序(MeRIP-seq)。通过分析m6A RNA-seq数据,我们鉴定出80个具有m6A RNA修饰的基因,这些基因在METTL16敲除后在这两个细胞系中至少减少了1.5倍(图4A(a))。对鉴定基因的GO富集分析显示,在涉及甲基转移酶活性的生物过程中存在富集(图4A(b))。所鉴定的基因包括PRDM15、SETD5、KMT2D和NSD2,与正常组织相比,这些基因在CCA中的表达均上调。与对照细胞相比,METTL16缺失的细胞中与这4个基因相关的m6A峰的读数降低(图4A(c))。MeRIP-qPCR证实CCLP1和HuCCT1细胞中METTL16缺失后m6A水平显著降低(图4A(d))。Western blotting分析显示,METTL16缺失降低了PRDM15的蛋白表达,而不影响SETD5、KMT2D和NSD2的蛋白水平(图4B,C)。因此,PRDM15是CCA细胞中METTL16的直接靶点。敲低YTHDF1,而不敲低YTHDF3,会降低CCA细胞中PRDM15蛋白的表达(图4D)。这些发现表明,YTHDF1在CCA细胞中调节PRDM15蛋白的表达。我们随后进行了RIP实验。数据显示,YTHDF1蛋白能够在CCA细胞中结合PRDM15 mRNA。值得注意的是,METTL16的缺失显著降低了YTHDF1蛋白与PRDM15 mRNA之间的相互作用(图4E)。为了进一步确定YTHDF1在PRDM15翻译中的作用,我们进行了核糖体免疫沉淀试验。如图4F所示,在对照细胞中,核糖体积累了PRDM15 mRNA,而在YTHDF1缺失的细胞中,PRDM15 mRNA的核糖体占用率显著降低。这些结果表明,在CCA细胞中,METTL16通过RNA m6A修饰和YTHDF1依赖的翻译机制调控PRDM15。
4)PRDM15参与METTL16介导的CCA细胞生长
为了证明PRDM15在CCA中的功能作用,我们分析了PRDM15缺失后CCA细胞的细胞增殖和集落形成能力。我们的数据显示,PRDM15的缺失显著抑制了CCA细胞的增殖和集落形成能力(图5A-5C)。基于这些结果,我们在METTL16缺失的CCA细胞中进行了PRDM15强制过表达的拯救实验。我们观察到,PRDM15的恢复能够部分修复METTL16缺失引起的CCA细胞增殖/集落形成缺陷(图5D-5F)。这些结果表明,PRDM15是CCA细胞中METTL16在功能上的重要靶点。
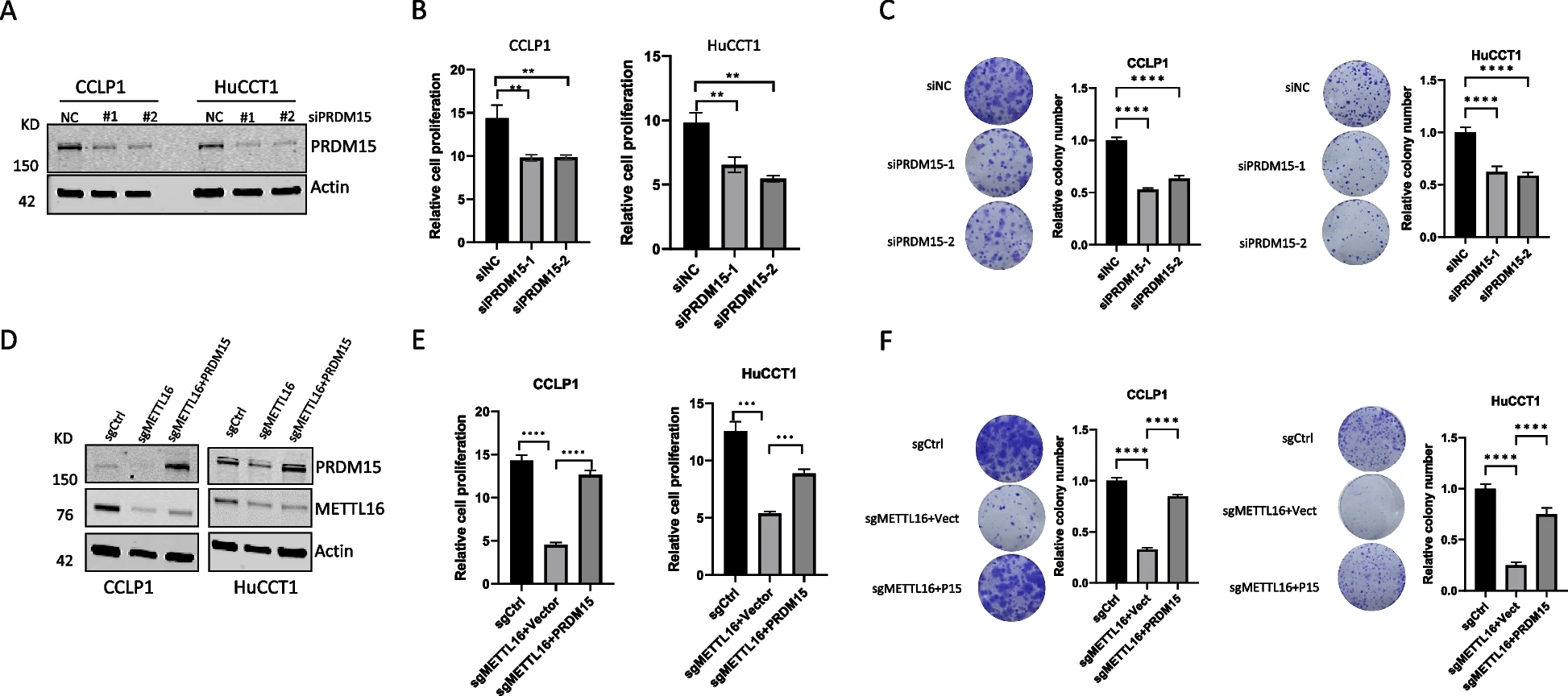
5)METTL16诱导的PRDM15调控FGFR4的表达
由于PRDM15是一种转录调节因子,我们试图进一步确定METTL16诱导的PRDM15在CCA细胞中的潜在下游靶点。为此,我们比较了CCA细胞中METTL16调控的基因(来自我们的RNA-Seq数据)与PRDM15正相关的基因(来自TCGA-CHOL数据库)。这种方法鉴定出19个METTL16调控的基因,它们在CCA中与PRDM15呈正相关(图6A)。在已鉴定的19个基因中,我们选择关注FGFR4,该基因已被充分证明在CCA中发挥重要作用。为了确定PRDM15对FGFR4表达的影响,我们分析了PRDM15缺失的CCA细胞中FGFR4的mRNA和蛋白表达。我们的数据显示,PRDM15的缺失降低了FGFR4的mRNA和蛋白质水平(图6B和6C)。接下来,我们评估了FGFR4是否可能是PRDM15的直接靶点。为此,我们进行了转录因子结合谱分析,以寻找FGFR4基因启动子中可能的PRDM15结合位点。这项工作鉴定出了FGFR4启动子中三个推测的PRDM15结合位点(图6D)。基于这些信息,我们进行了ChIP-qPCR检测,以确定其与FGFR4基因启动子的关联。我们的实验结果证实了PRDM15与CCA细胞中FGFR4基因启动子的结合(图6D)。为了进一步验证METTL16-PRDM15对FGFR4的调控,我们检测了METTL16缺失细胞中FGFR4的表达。我们的数据显示,METTL16的缺失导致FGFR4表达的减少,而这种影响被PRDM15的强制过表达逆转(图6E)。与METTL16介导的PRDM15-FGFR4调节一致,我们的数据显示,METTL16被其GapmeR反义寡核苷酸(ASO)消耗后,降低了CCA细胞中PRDM15和FGFR4的蛋白水平(图6F)。此外,我们发现联合使用FGFR4抑制剂BLU-554和METTL16 GapmeR ASO表现出更强的肿瘤抑制作用(图6G)。
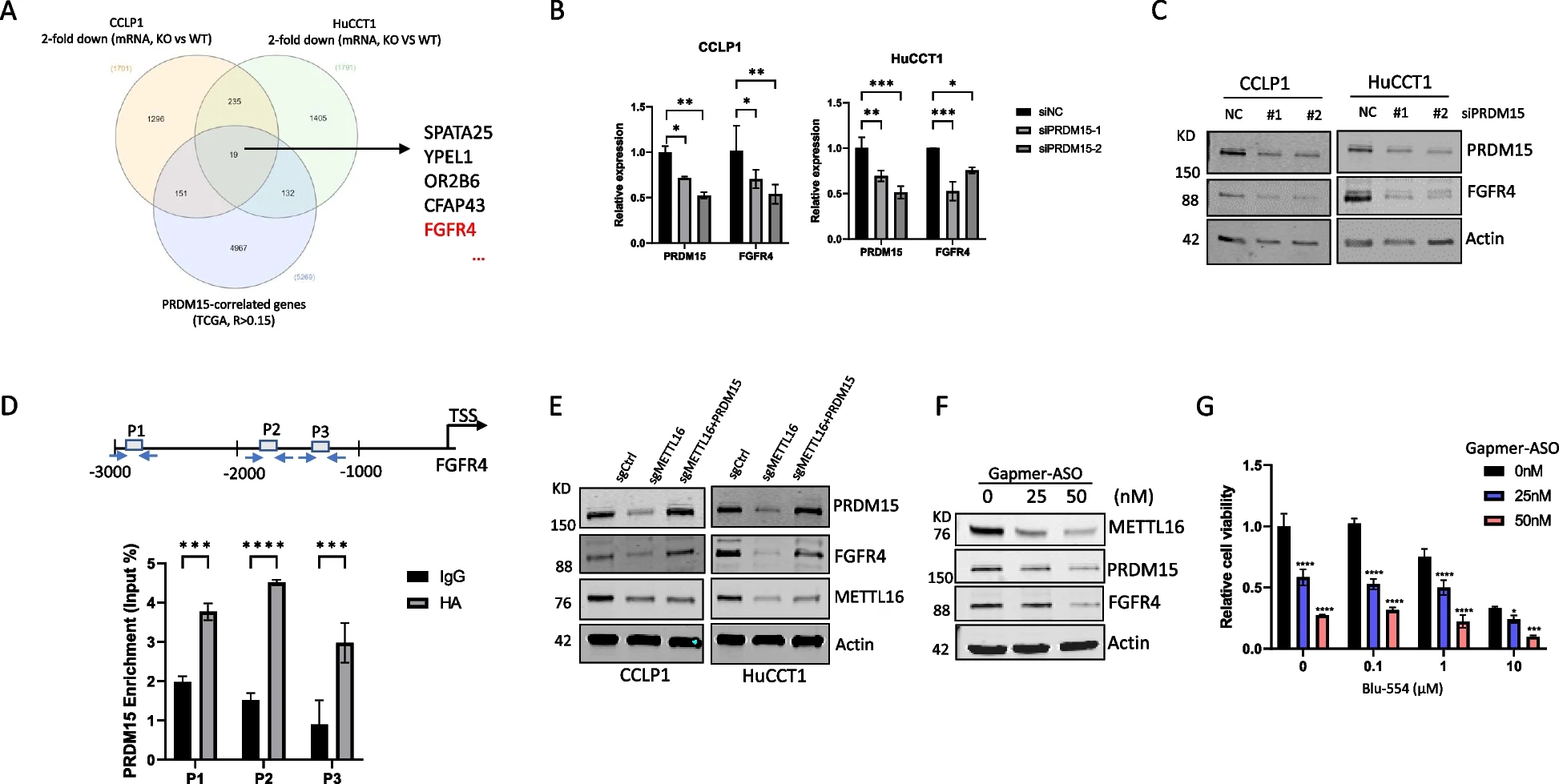
6)H3K27ac介导METTL16表达的调控
鉴于METTL16在CCA细胞中的表达显著增加及其致癌作用,我们进一步研究了METTL16在CCA细胞中的表达上调机制。我们使用UCSC基因组浏览器分析了METTL16启动子。分析显示,METTL16基因的启动子区域高度富集了组蛋白H3赖氨酸27乙酰化(H3K27ac)(图7A)。这一观察结果表明,METTL16的表达可能在转录水平上受到组蛋白乙酰化的控制。通过使用抗H3K27ac进行ChIP-qPCR检测,我们在CCA细胞的METTL16启动子处发现了H3K27ac的增加(图7B)。由于p300(也称为EP300)和CBP是组蛋白乙酰化所必需的,我们使用抗p300和抗CBP分别进行了ChIP-qPCR检测;这些研究的结果证实了METTL16启动子上p300的富集,而不是CBP的富集(图7C)。基于这些结果,我们用p300抑制剂C646处理CCA细胞进行了进一步的实验。我们的数据显示,用p300抑制剂C646处理CCA细胞显著降低了METTL16启动子处的H3K27ac和p300富集(图7D和7E)。相应地,C646处理也降低了CCA细胞中METTL16 mRNA和蛋白水平(图7F和7G)。这些发现表明,在CCA细胞中,p300介导的组蛋白H3赖氨酸27乙酰化调节了METTL16的表达。
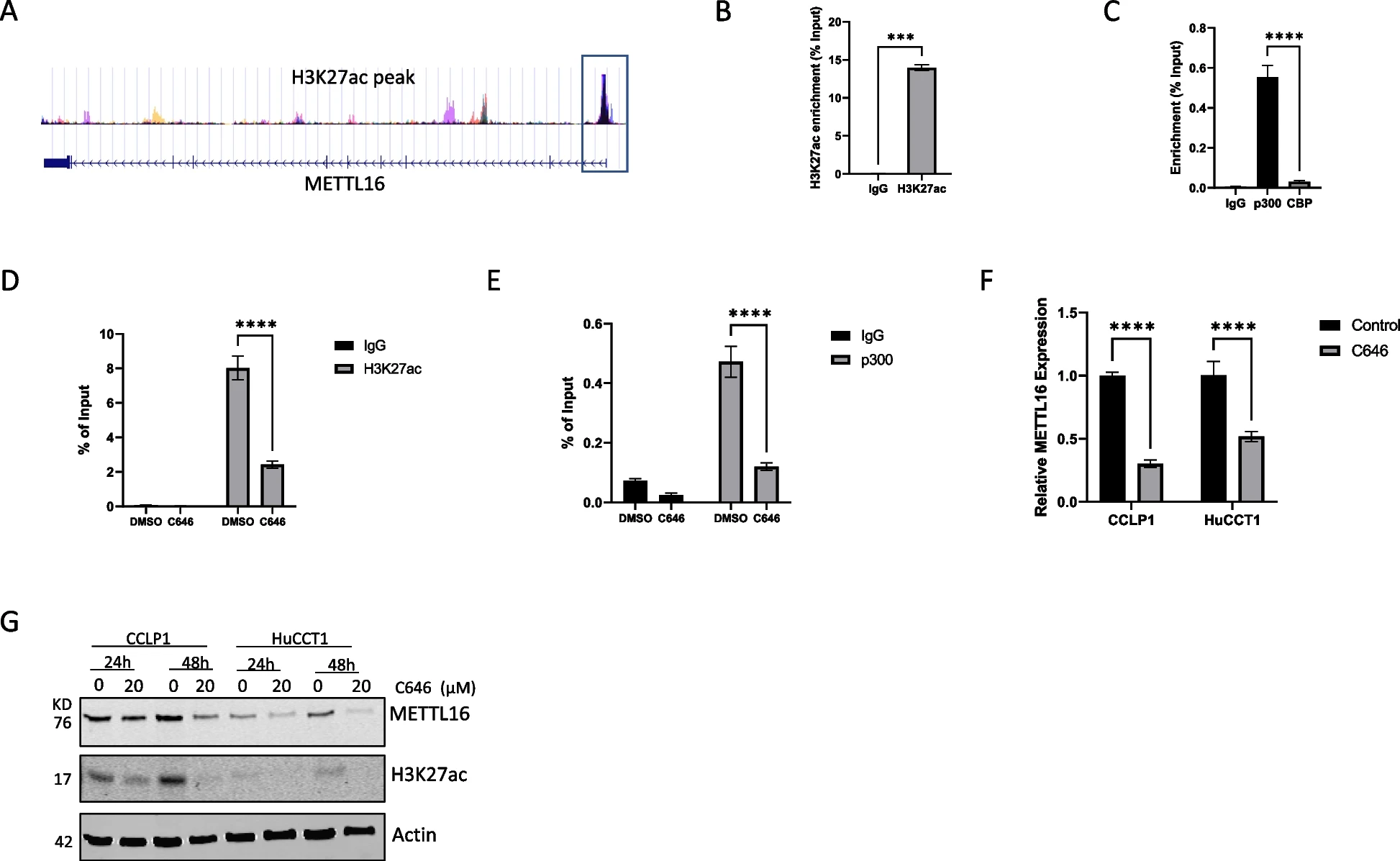
7)YY1与p300合作调控METTL16的表达
由于p300通常被转录因子募集到靶基因启动子,我们进一步研究了可能与p300协同调节CCA细胞中METTL16表达的转录因子。通过分析BioGrid预测的p300相互作用因子和SwissRegulon预测的METTL16推定转录因子,我们检测到这两个数据集中共有13个转录因子(图8A)。通过分析TCGA数据库中METTL16与CCA组织中鉴定的转录因子之间的相关性,我们发现CCA组织中有5个转录因子与METTL16呈正相关,包括SP1、SP3、TBL1XR1、YY1、和ZBTB3(图8B)。与非肿瘤组织相比,上述五种转录因子在CCA中升高(图8C),但在CCA中只有YY1的表达与患者生存相关(图8D)。基于这些分析,我们进行了进一步的实验来证明YY1和P300在CCA细胞中的相互作用。如图8E所示,免疫沉淀法证实p300与YY1在CCLP1和HuCCT1细胞中存在关联。通过对JASPAR数据库的分析,我们在METTL16的启动子区域发现了两个YY1结合位点(图8F)。通过ChIP-qPCR检测,我们发现YY1能够结合METTL16启动子上的这两个位点。此外,我们观察到用p300抑制剂C646处理CCA细胞可显著降低YY1与METTL16启动子的结合(图8F)。综上所述,YY1与p300共同调控CCA细胞中METTL16基因的表达。
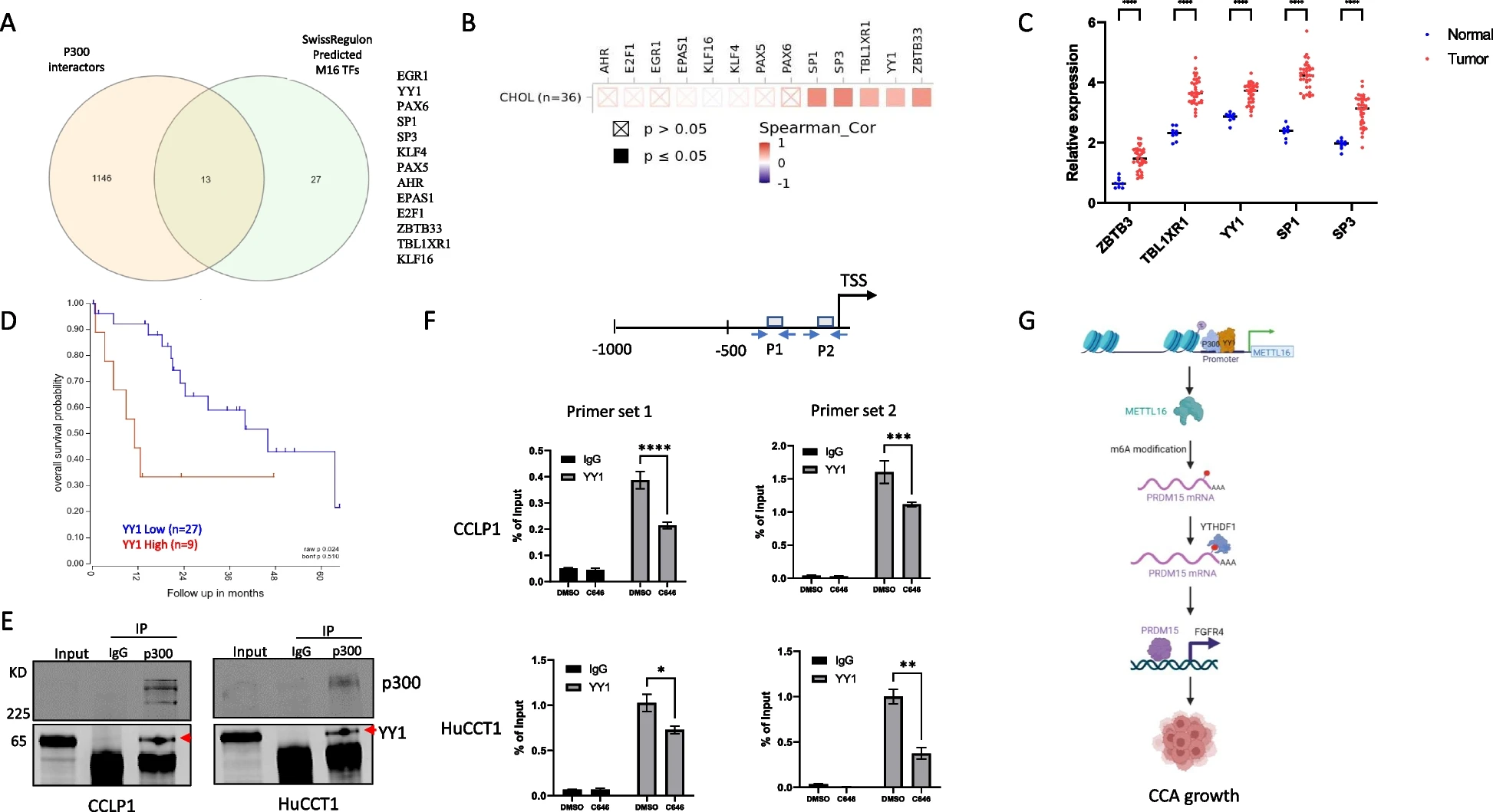
结论
我们的实验发现揭示了一种新的METTL16-PRDM15-FGFR4信号轴,它与CCA有重要关系,可能作为新的治疗靶点。
实验方法
qRT‑PCR,Western blot,IHC,RIP,m6A测序,免疫沉淀,MeRIP-qPCR,ChIP,动物实验。
参考文献
Liu N, Zhang J, Chen W, Ma W, Wu T. The RNA methyltransferase METTL16 enhances cholangiocarcinoma growth through PRDM15-mediated FGFR4 expression. J Exp Clin Cancer Res. 2023 Oct 11;42(1):263. doi: 10.1186/s13046-023-02844-5.






