增强子的舞台 m6A的华丽舞伴
前列腺癌(PC)的骨转移频率最高,且对177Lu-前列腺特异性膜抗原(PSMA)放射性配体疗法的耐药性很强。目前人们对骨转移性前列腺癌(mPCa)对放射治疗的耐药性知之甚少。该研究发现骨特异性m6A修饰的增强子RNA(eRNA)在调控mPCa进展和放疗抵抗中发挥重要作用。本文于2023年1月发表在《Theranostics》IF:12.4期刊。
技术路线

主要实验结果
1、在骨mPCa中鉴定特异性eRNA修饰
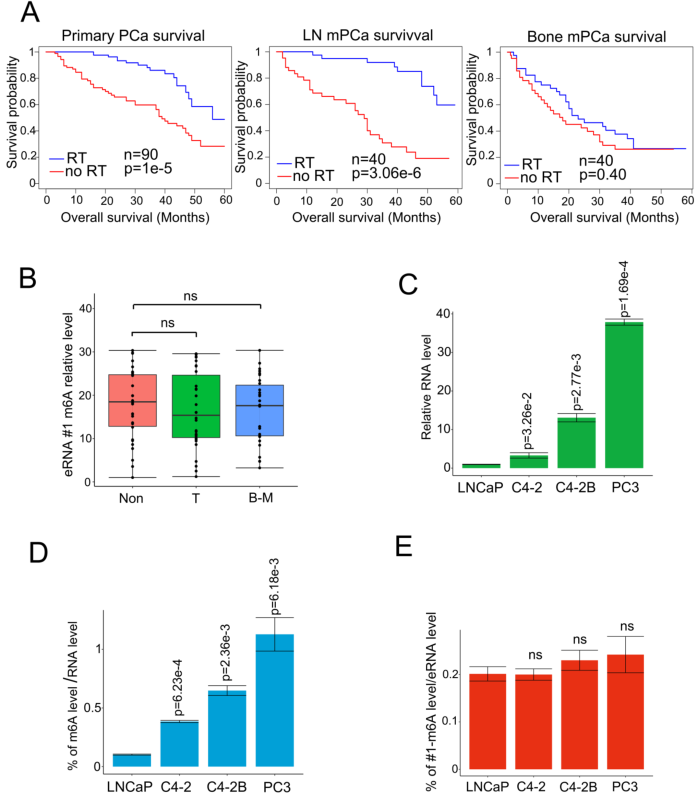
作者比较了有无化疗的患者之间的存活情况以探究化疗抵抗和骨mPCa患者之间的关系。结果发现PSMA放疗延长原发PCa患者和淋巴结(LN)mPCa的存活时间,但是对骨mPCa的作用有限(附图1A)。鉴于增强子和eRNA是组织特异性和功能特异性的元件,作者探索了骨mPCa中的特异性eRNA,并表征了表观转录组的骨mPCa相关功能。在CRPC细胞中通过RNA-seq鉴定的100个差异上调的增强子转录本中,发现43个eRNA在骨mPCa PC3细胞中高表达(图1A)。作者此前检测m6A是否是致癌骨mPCa中eRNA的特异性修饰,发现通过两种不同的m6A抗体结合MeRIP-seq免疫沉淀,发现6个带有m6A信号的eRNA。随后,通过基因间峰选择和qPCR验证筛选6个eRNA,结果在骨mPCa细胞中有一个独特的m6A eRNA上调(图1A-B)。对LNCaP和PC3细胞已发表的ChIP-seq数据的荟萃分析发现,该区域是一个真正的增强子,表现为可富集增强子激活子(BRD4)、增强子标记物(H3K4me1和H3K27ac)和启动子标记物(H3K4me3)(图1B)。根据eRNA的命名规则,作者将该eRNA标记为MLXIPe,因为它与MLXIP mRNA接近。两个推测的m6A位点(#1:TTACA chr12 122502280-122502284;#2: GGACA chr12 122506423-122506427)在MLXIPe中被两个独立的m6A抗体鉴定(图1B)。
附图1 MLXIPe的m6A是患者的不良预后因素
从原发性前列腺癌、邻近正常前列腺组织和骨转移癌的新鲜样本中收集了m6A抗体免疫沉淀的RNA,以证明m6A修饰在临床病理背景下的功能作用。箱形图显示,在该队列中,骨mPCa样本中MLXIPe的#2-m6A水平明显高于原发性PCa或邻近前列腺样本(图1C-D)。然而,在mPCa、原发性PCa和邻近前列腺正常组织样本之间,MLXIPe的#1-m6A水平无显著差异(附图1B)。此外,发现MLXIPe的#2-m6A水平在骨mPCa细胞系PC3和C4-2B中显著升高(附图1C-D),但MLXIPe的#1-m6A水平在所有细胞系中没有差异(附图1E)。在骨转移队列中,进一步确定MLXIPe #2-m6A水平与PCa患者临床特征的生存意义。Kaplan-Meier生存分析发现,在骨mPCa患者中,MLXIPe的RNA和m6A水平升高与较短的生存期相关(图1E-F)。PET分析显示,在前列腺癌患者73 (P-73) mlxipe - m6low中,远端骨转移肿瘤信号在放疗后消失,但在P-90MLXIPe-m6Ahigh中,脊柱两侧和骨盆均检测到较强的信号(图1G),提示MLXIPe-m6Ahigh患者存在放疗耐药。总而言之,MLXIPe的m6A修饰是骨mPCa所特异性的。
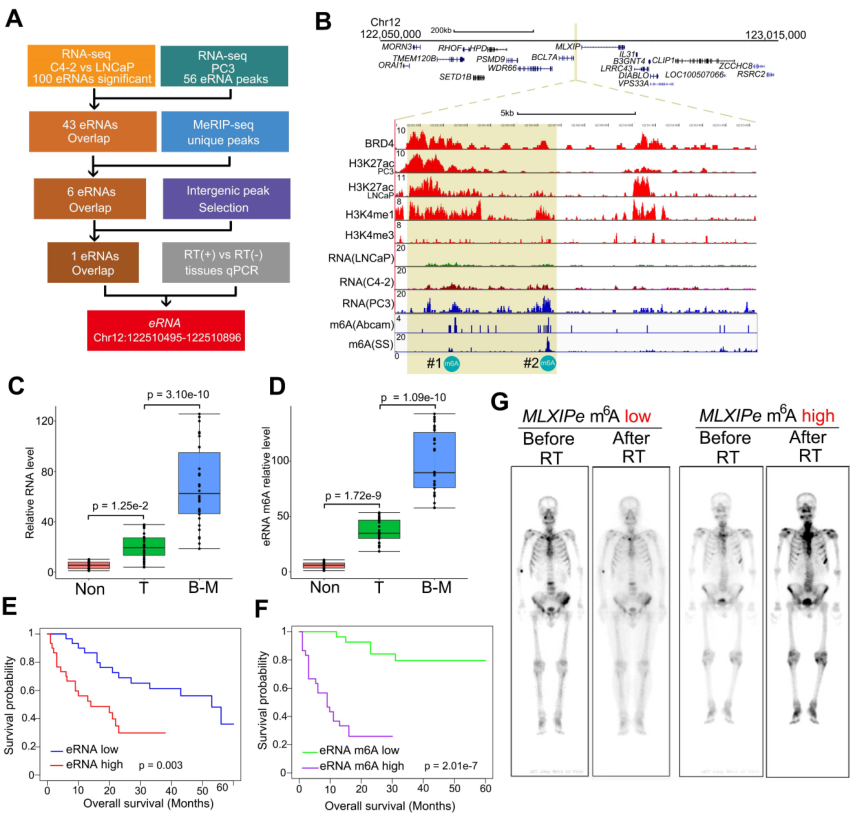
图1 MLXIPe的m6A参与PC的转移和化疗
2、MLXIPe诱导的mPCa放疗抵抗是通过上调PSMD9
eRNA通过增加增强子-启动子环将增强子活性转移到一个或几个相邻的目标启动子上。为确定受MLXIPe增强子调控的下游启动子,使用类似于染色体构象捕获(3C)的策略研究了相邻启动子,并使用捕获Hi-C(cHi-C)技术分析了已发表的数据。通过cHi-C的增强子-启动子环确定了MLXIPe周围的11个mRNA(图2A)。通过RNA-seq数据排除PCa细胞中无表达的4个mRNA,通过3C检测确定了人骨- mPCa患者来源的异种移植(PDX)原代细胞系90 (P-90)中7个启动子的空间组织。3C数据显示,利用反义寡脱氧核苷酸(ASOs)敲除MLXIPe会降低MLXIPe与WDR66、PSMD9、SETD1B和MLXIP位点之间的特异性增强子-启动子相互作用(图2A)。在通过基因组DNA相互作用鉴定出MLXIPe靶基因后,研究MLXIPe是否影响它们的转录。用ASOs敲除MLXIPe,验证eRNA对靶蛋白表达的作用。利用3个独立的ASOs进行逆转录qPCR和RNA-seq数据显示,MLXIPe下调骨- mPCa原代细胞系P-90和PC3细胞中这4个靶基因的表达(图2B-C)。还发现PSMD9是一个特异性的骨- mPCa相关基因,但WDR66、SETD1B和MLXIP是致癌基因(图2D)。较高水平的PSMD9与较低的放疗后无复发生存率相关(图2E)。综上所述,PSMD9作为MLXIPe骨特异性靶基因,与骨mPCa患者的放疗耐药和较短的生存期相关。
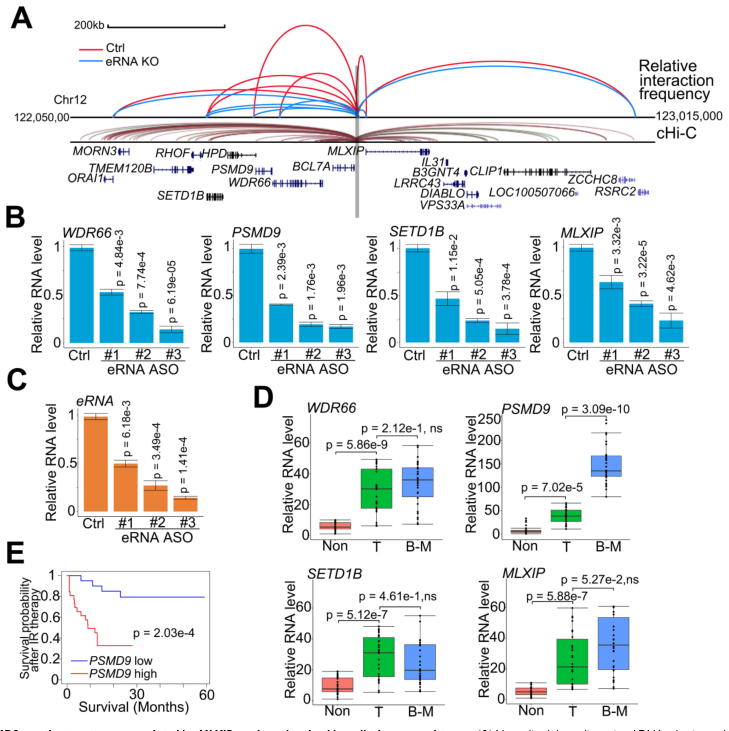
图2 PSDM9是受到MLXIPe调控的靶基因并参与化疗抵抗
3、MLXIPe通过m6A与KHSRP相互作用
通过生成 CRISPR 对照(Ctrl)和 MLXIPe #2-m6A 位点缺失(-del)细胞系,用生物素标记的探针靶向 MLXIPe eRNA 或 PSMD9 mRNA 进行无偏串联亲和纯化,从而探索了m6A在MLXIPe的分子机制。质谱分析结果表明MLXIPe eRNA与多种蛋白质结合,包括对照(Ctrl)细胞中的循环蛋白 MED12和KH结构域蛋白hnRNPK、IGF2BP2或KHSRP,但在MLXIPe -m6A-del细胞中与KH结构域蛋白没有结合(图3A)。类似地,PSMD9 mRNA在Ctrl细胞中与几种蛋白结合,包括翻译蛋白eIF4A1、eIF4G2和KH结构域蛋白KHSRP,但在eRNA-m6A-del 细胞中不与KH结构域蛋白结合(图3A)。KHSRP是一种与多种癌症有关的RNA结合蛋白,是两组引物中的共同蛋白(图3B)。我们敲除了KHSRP蛋白的四个结构域(N-端、KH1/2、KH3/4或C-端缺失),以证实质谱数据(图 3C)。交联免疫沉淀(CLIP)-PCR检测表明,KH1/2缺失结构域阻断了KHSRP蛋白与PSMD9 mRNA的相互作用(图3D),KH3/4缺失结构域显著抑制了KHSRP与MLXIPe的相互作用(图3E)。此后,作者进一步证明KHSRP是m6A和m6Am的双解读器,通过KH1/2结构域与m6Am相互作用,通过KH3/4结构域与m6A相互作用(图4A)。

图3 KHSRP与eRNA和mRNA结合形成一个复合物
4、KHSRP通过与eRNA连接来稳定mRNA
鉴于m6A可调控mRNA的稳定性,所以作者检测了P-90细胞中RNA的半衰期,以确认m6Am与mRNA稳定性的相关性。数据表明,2号m6A 缺失增加了PSMD9 mRNA降解,但在P-90和PC3胞中,1号-m6Am位点缺失未能完成降解(图4B)。用两个独立的shRNA去掉KHSRP能显著下调PSMD9 RNA水平并增强PSMD9 mRNA降解(图4C-D)。据报道,m6Am的writer是PCIF1。PCIF1-KD损害了MLXIPe升高的PSMD9 RNA水平(图4E)。XRN1和XRN2是高度过程性的5' > 3'外切核酸酶。基因敲除试验表明,XRN2而不是XRN1是负责PSMD9 mRNA 降解的5' > 3' 外切核酸酶(图4F)。敲除KHSRP会增加PSMD9 mRNA与XRN2的结合(图4G)。此外,敲除XRN2会提高PSMD9 mRNA的稳定性(图4H)。这些数据表明,MLXIPe-KHSRP-PSMD9阻断了骨 mPCa细胞中XRN2诱导的PSMD9 mRNA降解(图4I)。
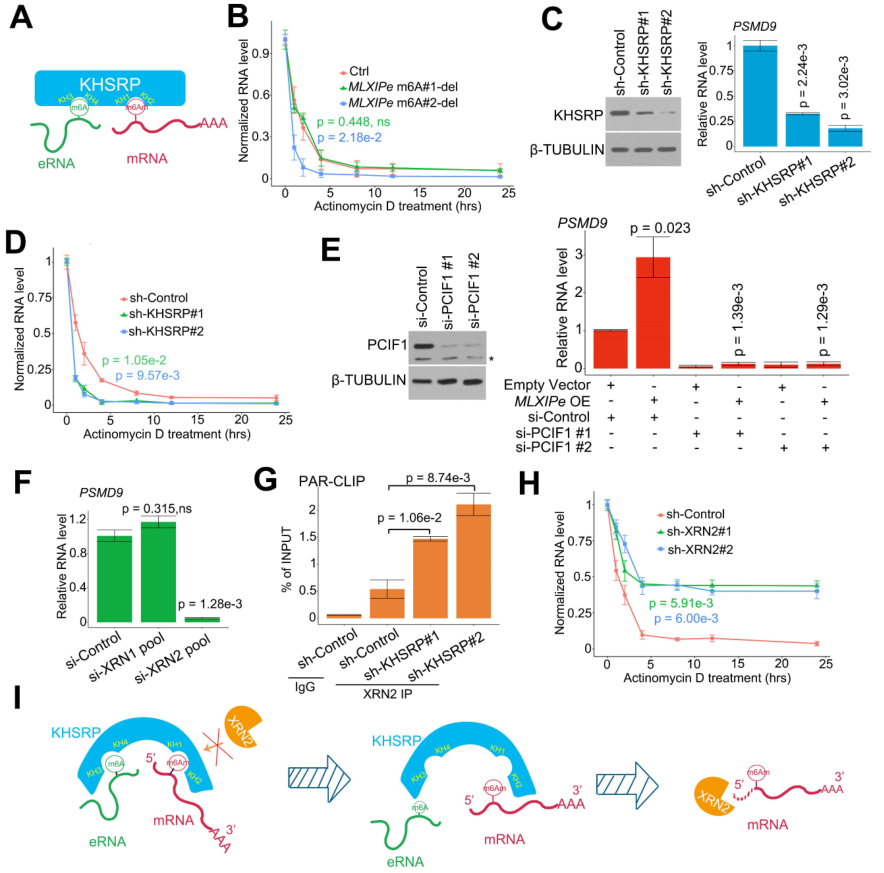
图4 eRNA-KHSPR-mRNA复合物保护PSMD9 mRNA抵抗XRN2
5、MLXIPe通过m6A提高PCa细胞中DNA修复蛋白的水平
文献表明PSMD9是与乳腺癌细胞放疗抗性相关的放疗预测标记物。本研究发现,MLXIPe通过eRNA m6A介导PSMD9 mRNA的稳定性并上调其蛋白水平(图4)。作者从PDX队列中选择了4个MLXIPe m6Ahigh和MLXIP m6Alow的原发性骨-mPCa PDX细胞,以确定MLXIPe m6A是否是骨-mPCa中特异的放疗耐药性标志物。不同剂量辐射曲线数据表明,MLXIPe m6Ahigh的细胞对放疗具有抗性;然而,MLXIPe m6Alow的细胞则以剂量依赖的方式被辐射杀死(图5A)。WB显示,在MLXIPe m6Ahigh细胞中,ATM、DNA-PKcs和p53蛋白水平上调,但ATR的表达不受影响(图5B)。
作者敲除MLXIPe中的m6A,以进一步证实m6A在DNA修复途径中的功能。表达数据显示,MLXIPe WT而非MLXIPe-m6A缺失会提高ATM、DNA-PKcs和p53蛋白水平(图5C)。在MLXIPe m6Alow的P-73细胞和MLXIPe m6Ahigh的P-90细胞中验证了eRNA-KHSRP-mRNA复合物在DNA修复途径中的功能。数据显示,KHSRP的缺失抑制了MLXIPe对ATM、DNA-PKcs和p53蛋白的上调,并降低了MLXIPe m6Alow P-73细胞中γ-H2AX病灶的比例(图5D)。同时,在MLXIPe m6A缺失的细胞中,XRN2敲除可挽救ATM、DNA-PKcs和p53蛋白水平,并提高γ-H2AX病灶的比率(图5E)。这些数据表明,MLXIPe通过m6A和KHSRP复合物提高骨-mPCa细胞中的ATM、DNA-PKcs和p53蛋白水平。
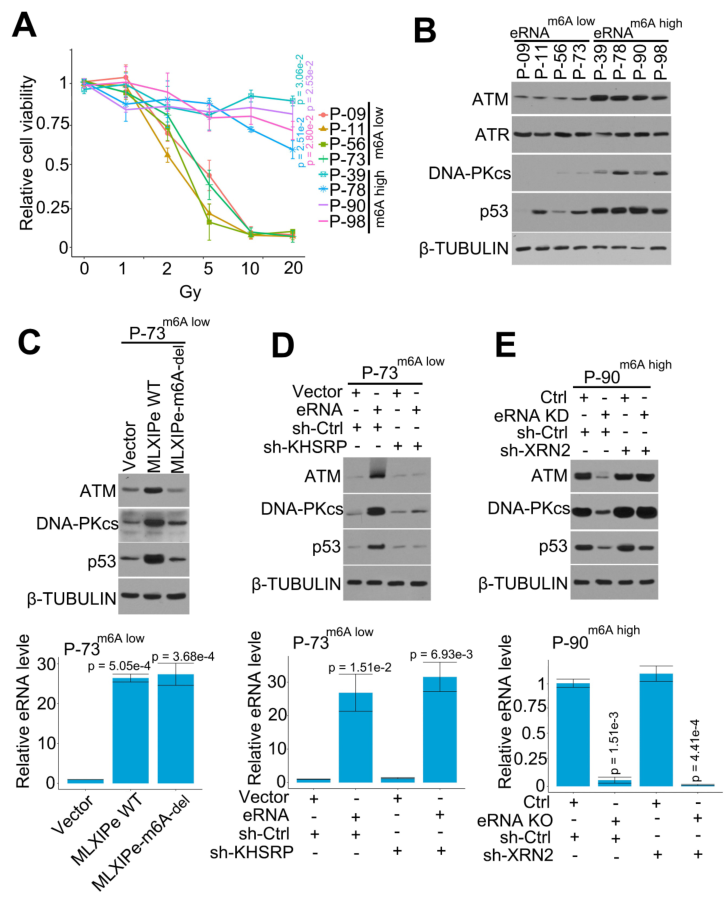
图5 MLXIPe上调DNA修复通路的关键蛋白
6、MLXIPe通过m6A和KHSRP增强前列腺PDX放疗耐药性
通过编辑4个MLXIPe m6Ahigh PDX细胞中的m6A位点,测试MLXIPe的m6A在PDX细胞中的功能。数据显示,在MLXIPe m6A位点缺失(-del)的mPCa细胞中,放疗抗性受损,放射敏感性恢复(图6A-B)。接下来,在体内异种移植模型中测定了MLXIPe的m6A功能,并考察了MLXIPe的m6A调控对前列腺异种移植生长和放射抗性的影响。将MLXIPe-m6A-del细胞注射到小鼠侧腹,数据显示MLXIPe-m6A敲除后,异种移植物的生长略有下降,而KHSRP-KD转染则不影响异种移植物的生长(图6C-D)。值得注意的是,MLXIPe-m6A-del组和KHSRP-KD组在放疗36天后恢复放射敏感性,而Ctrl组没有恢复(图6D)。qPCR数据显示,PSMD9 mRNA与异种移植物的放疗抗性相关(图6E-G)。因此,数据表明,MLXIPe或KHSRP的m6A可提高PDX模型中mPCa的放疗耐受性。

图6 在体内MLXIPe诱导化疗抵抗
总之,本研究提供了有关mPCa RT抗性、eRNA修饰和潜在m6Am阅读器机制的新见解。检测到骨特异性eRNA与m6A,后者促进骨转移前列腺PDXs的 放疗抗性功能。KHSRP能识别eRNA上的m6A和mRNA 5'-UTR上的m6Am并与之相互作用,从而阻断XRN2对5'-UTR上RNA的降解。研究结果表明,骨特异性eRNA-m6 在 mPCa生长和放疗抗性方面至关重要,可能成为癌症治疗的新靶点(图6)。我们的研究强调了MLXIPe是骨-mPCa的潜在预测性生物标记物和治疗靶点。
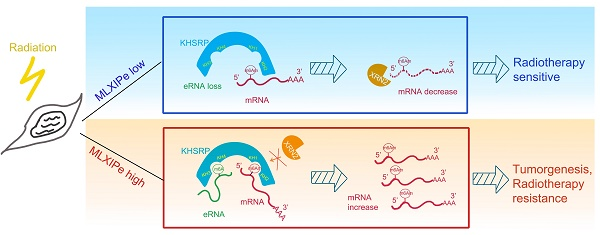
图像摘要
实验方法
临床样本收集,患者来源的异种移植(PDX),正电子发射断层扫描(PET),小鼠异种移植瘤模型,生物素标记的RNA pull down,WB,CRISPR)-Cas9,交联免疫沉淀(CLIP),γ-H2AX染色
参考文献
Zhao Y, Wen S, Li H, Pan CW, Wei Y, Huang T, Li Z, Yang Y, Fan S, Zhang Y. Enhancer RNA promotes resistance to radiotherapy in bone-metastatic prostate cancer by m6A modification. Theranostics. 2023 Jan 1;13(2):596-610. doi: 10.7150/thno.78687. PMID: 36632223; PMCID: PMC9830431.






