USP13去泛素化并稳定细胞周期蛋白D1,促进胃癌细胞周期进程和细胞增殖

蛋白质泛素化和去泛素化的可逆翻译后修饰在细胞稳态中起着至关重要的调节作用。去泛素化酶(DUBs)负责从蛋白质底物中去除泛素。DUBs的失调可能导致肿瘤的发生和发展。在本研究中,我们通过对TCGA和GEO数据库中的胃癌(gastric cancer,GC)数据进行分析,发现泛素特异性蛋白酶USP13在GC样本中显著上调。USP13的高表达与GC患者更差的预后和更短的总生存期(OS)相关。在GC细胞中过表达USP13以酶促依赖的方式促进细胞周期进程和细胞增殖。相反,抑制USP13导致GC细胞周期阻滞在G1期,细胞增殖受到抑制。裸鼠实验表明,在GC细胞中敲除USP13可以显著抑制体内肿瘤的生长。在机制上,USP13与cyclin D1的N端结构域物理结合,并去除其K48 -而不是K63 -连接的多聚泛素化链,从而稳定和增加cyclin D1。此外,cyclin D1的重新表达部分逆转了USP13缺失引起的GC细胞周期阻滞和细胞增殖抑制。此外,在人GC组织中,USP13蛋白丰度与cyclin D1蛋白水平呈正相关。综上所述,我们的数据表明USP13去泛素化并稳定细胞周期蛋白D1,从而促进GC细胞周期进程和细胞增殖。这些发现表明USP13可能是治疗GC的一个有前途的治疗靶点。本研究于2023年6月发表在期刊《ONCOGENE》上,IF:8。
技术路线
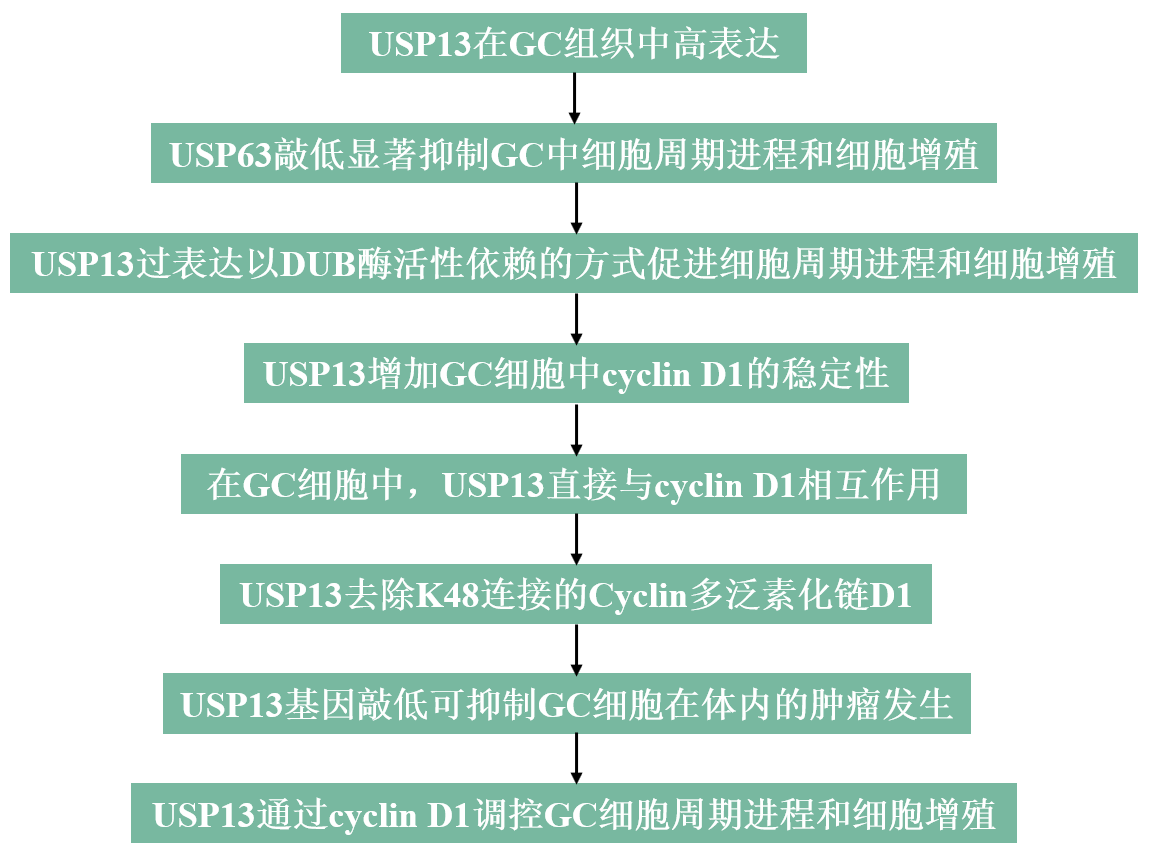
主要研究结果
1、USP13在GC组织中高表达
首先,我们利用癌症基因组学图谱(TCGA)数据库调查了USP13在不同肿瘤组织中的转录水平,发现USP13在包括GC在内的大多数消化系统肿瘤中表达上调(图1A)。GEO数据集(GSE27342)也显示USP13在GC组织中表达上调(图1B)。然后我们分析了USP13在不同GC分级和亚型中的表达情况。结果表明,USP13的表达与肿瘤分级呈正相关(图1C)。与正常相比,USP13在四种不同GC亚型中的表达均显著升高,其中在EBV(epstein-barr virus)亚型中平均表达值最高,在GS(genomeally stable)亚型中表达最低(图1D)。我们进一步用western blot检测了32对GC及癌旁组织中USP13的蛋白水平,发现65.6%(21/32)的GC组织中USP13的蛋白水平升高(图1E)。使用ImageJ软件对蛋白条带进行定量,采用配对t检验对数据进行统计学分析。结果显示,USP13的蛋白水平在GC组织(p < 0.01)中显著升高(图1F)。此外,我们利用Kaplan-Meier绘图机数据库分析USP13表达与GC患者总生存期(overall survival,OS)的相关性。由于Kaplan-Meier绘图机数据库中的数据集GSE62254包含了与其他所有数据集明显不同的特征,因此我们将GSE62254从混合分析中剔除,单独对GSE62254进行分析。3个不同的Affymetrix探针(205356_at、227788_at、226902_at)的结果也显示了类似的趋势,即在不包括GSE62254的合并分析中(图1G)和在单独分析GSE62254(附图S1)中,USP13在GC组织中的高表达导致GC患者的总生存期(overall survival,OS)缩短。
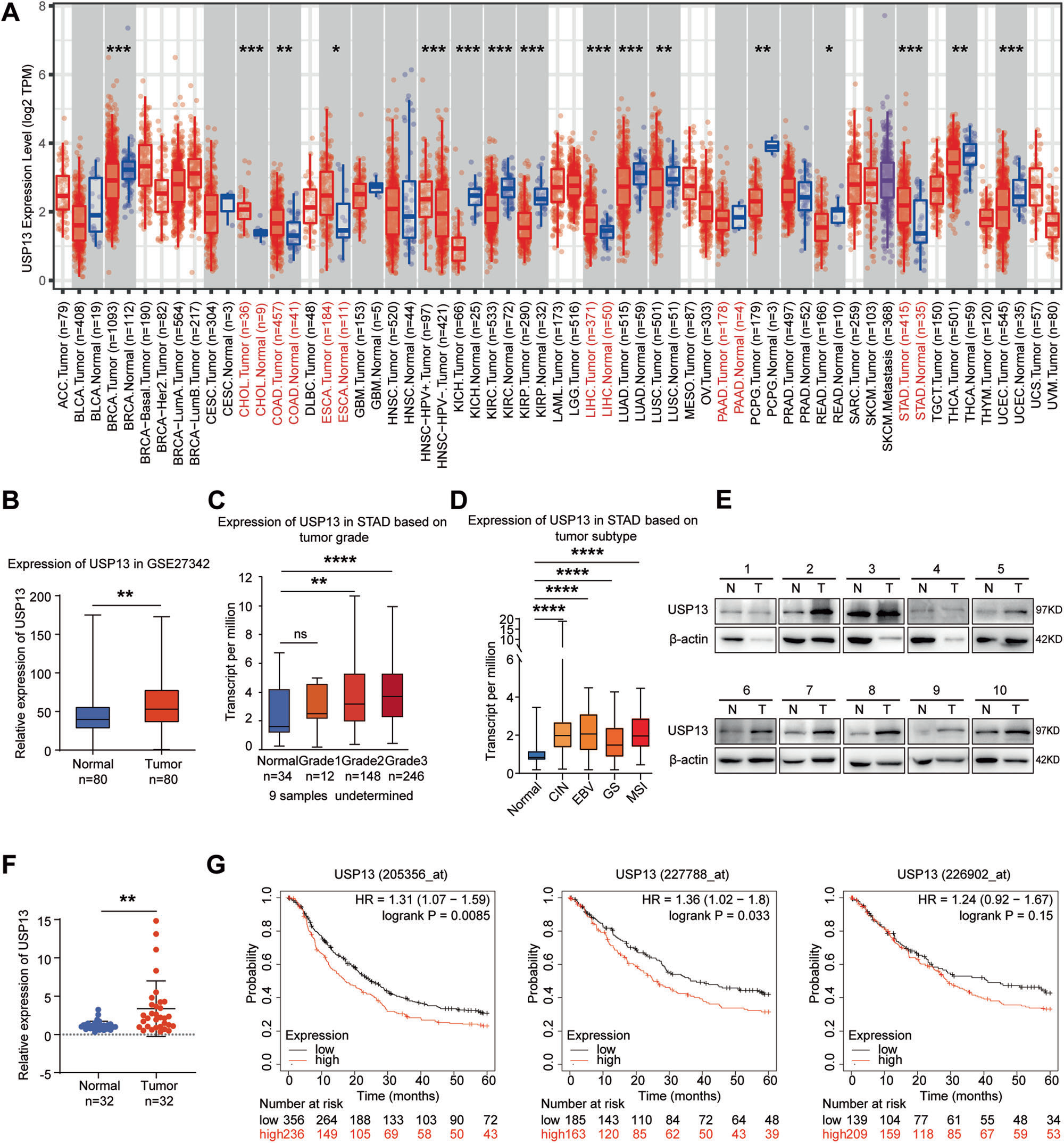
图1 USP13在GC组织中的表达水平升高,且USP13的高表达与GC患者总生存期(OS)缩短相关
2、USP63敲低显著抑制GC中细胞周期进程和细胞增殖
已发表的GC队列的基因富集分析(GSEA)中展示了USP13与细胞周期显著相关(图2A)。因此,我们研究了USP13对GC细胞周期进程和细胞增殖的影响。我们使用携带阴性对照shRNA或USP13 shRNA的慢病毒感染AGS和MKN-45细胞。qRT-PCR和western blot结果证实,携带USP13 shRNA的慢病毒感染GC细胞后,USP13的表达水平明显降低(图2B、C)。随后,我们利用流式细胞仪检测细胞周期分布,发现USP13的缺失导致细胞周期阻滞在G1期(图2D)。克隆形成实验结果显示,USP13的缺失明显降低GC细胞的克隆形成能力(图2E、F)。为进一步验证USP13对GC细胞的作用,我们设计了两条特异性靶向USP13的小干扰RNA(siRNA)并转染GC细胞。通过qRT-PCR和western blot验证USP13在转染的GC细胞中的有效敲低(图2G、H)。EdU和CCK-8法检测细胞增殖能力。结果表明,USP13敲低显著抑制GC细胞的增殖和克隆形成能力(图2I-K)。
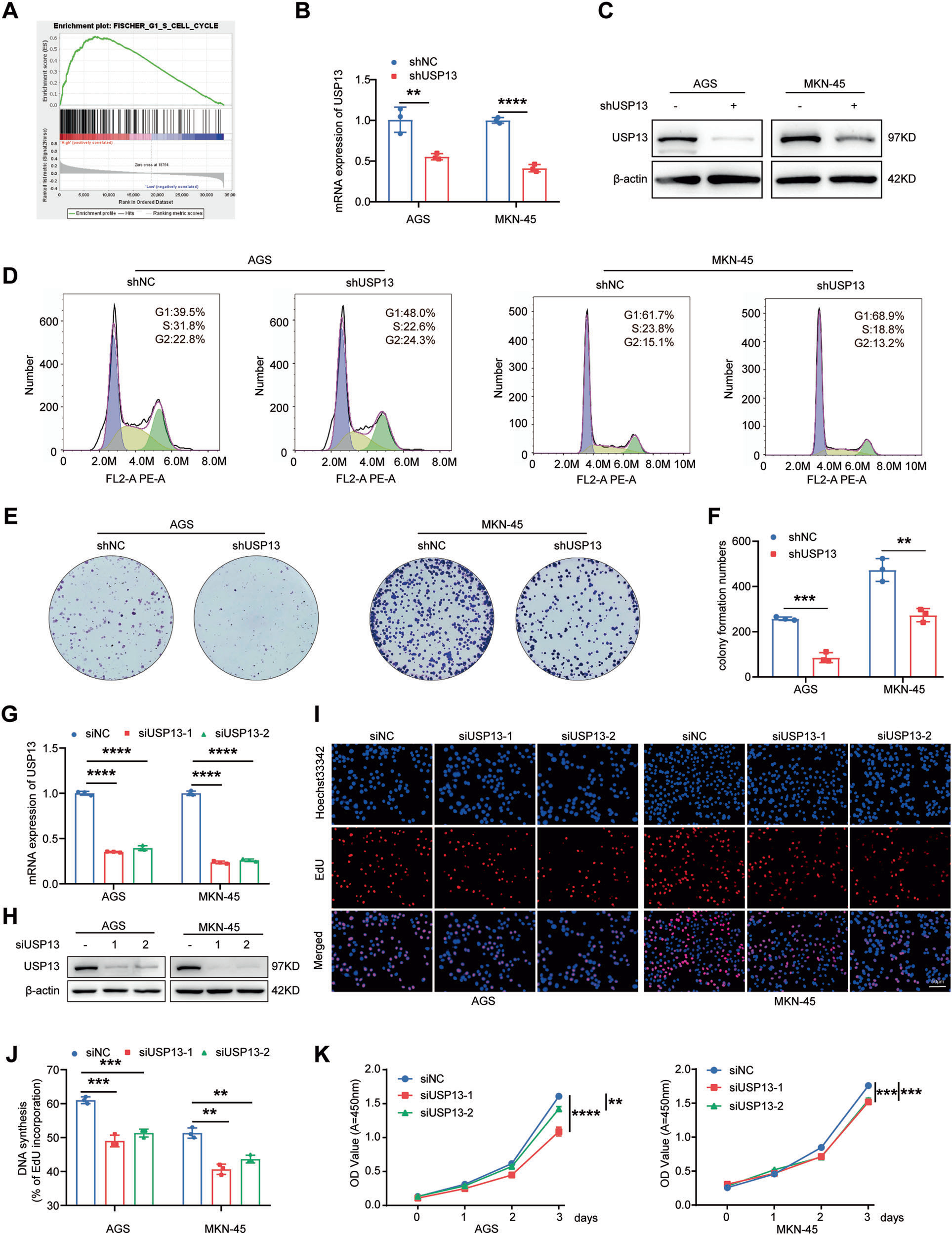
图2 敲低USP13诱导GC细胞周期阻滞于G1期,抑制细胞增殖和集落形成能力
3、USP13过表达以DUB酶活性依赖的方式促进细胞周期进程和细胞增殖
为进一步研究USP13过表达是否具有相反的作用,我们将USP13过表达载体转染到GC细胞(附图S3A、B)中。流式细胞术检测细胞周期分布,EdU和CCK-8法检测细胞增殖能力。结果显示,过表达USP13导致GC细胞(附图S3C)的G1期细胞数量减少,GC细胞(附图S3D-F)的细胞增殖能力增强。
我们接着询问USP13的DUB活性是否对其生物学功能至关重要。我们分别将WT-USP13载体和催化失活突变体USP13-C345A转染GC细胞。验证转染效率(图3A)。然后测定细胞周期分布、细胞增殖能力和克隆形成能力。我们的结果显示,过表达WT-USP13载体显著促进细胞周期进程(图3B)、细胞增殖能力(图3C-E)和克隆形成能力(图3F-G),而过表达USP13-C345A几乎消除了WT-USP13载体转染介导的细胞增殖和克隆形成能力。这些结果表明USP13的DUB活性对其功能至关重要。
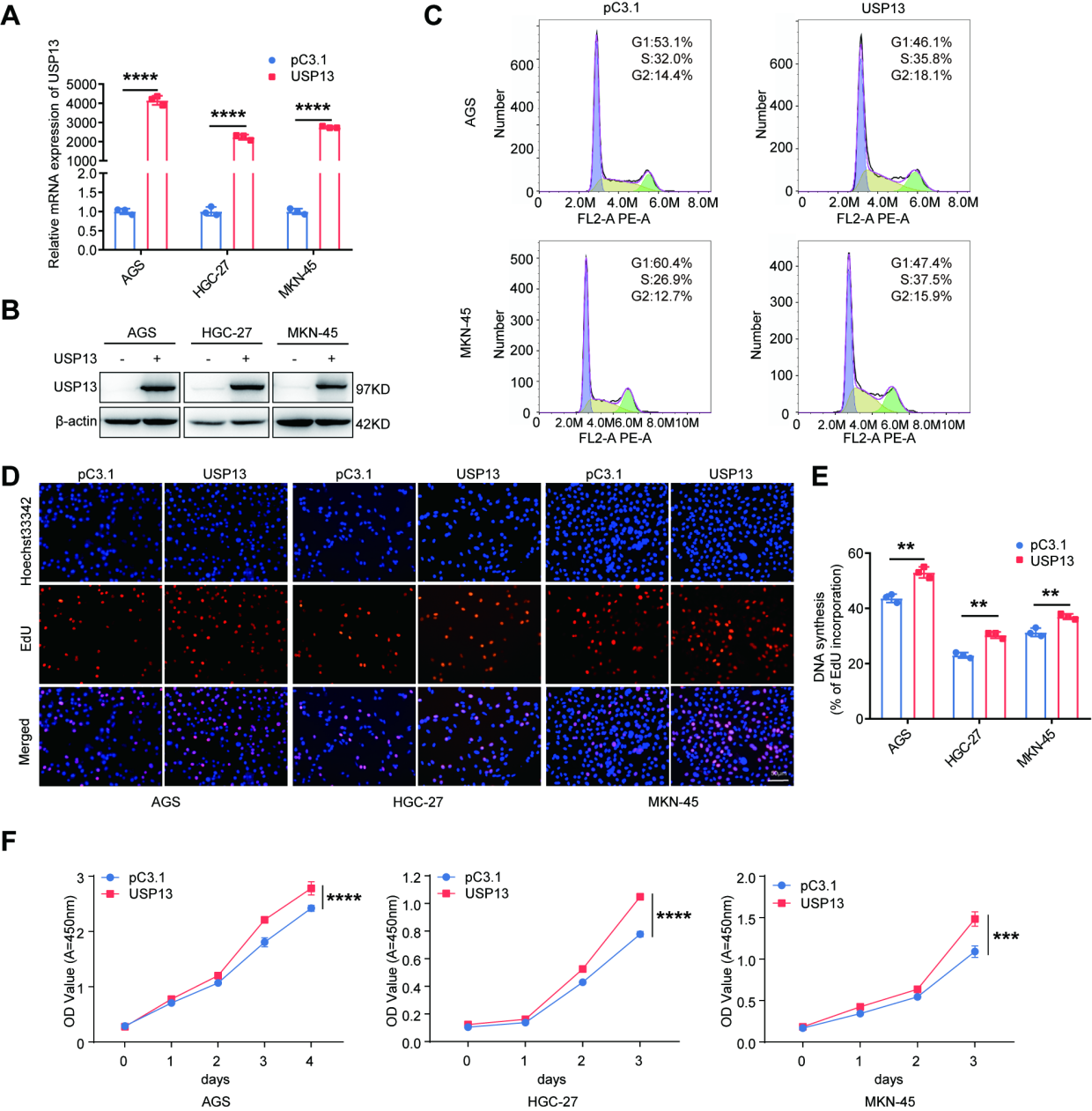
附图3 USP13的过表达促进了GC细胞的细胞周期进程和细胞增殖能力
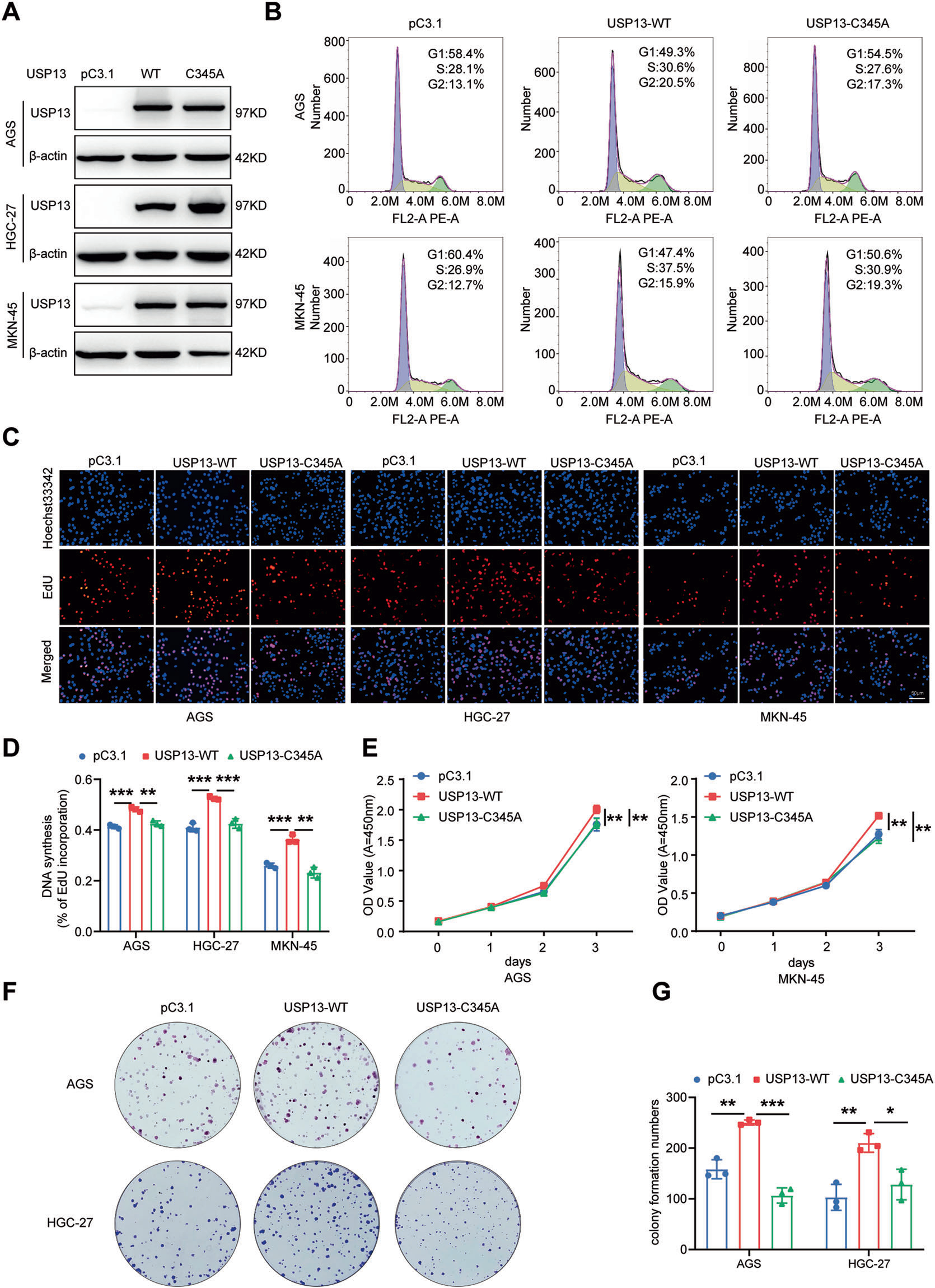
图3 在GC细胞中过表达野生型USP13,而不表达USP13突变体C345A,促进细胞周期进程和细胞增殖能力。
4、USP13增加GC细胞中cyclin D1的稳定性
在明确了USP13在GC中的生物学作用后,我们进一步研究了其潜在的调控机制。由于USP13的功能与细胞周期进程相关,我们研究了USP13对cyclin D1和一系列其他细胞周期相关蛋白的影响,包括cyclin D2、cyclin D3、cyclin E、CDK2、CDK4、p21和p27。如Fig 4A、B所示,USP13 siRNAs显著降低了cyclin D1蛋白水平,而对其他细胞周期相关蛋白无明显影响。相反,USP13的增强表达以剂量依赖的方式增加了cyclin D1的蛋白水平(图4C),而失去酶活性的突变USP13-C345A对cyclin D1的表达无明显影响(图4D)。
在GC细胞(附图S4A , B)中,USP13敲低或过表达均不改变cyclin D1 mRNA水平。为进一步证实USP13调控内源性cyclin D1的稳定性,我们用USP13 siRNA或表达载体转染GC细胞,然后用蛋白合成抑制剂CHX处理细胞不同时间。我们的结果显示,在GC细胞中,敲低USP13降低了cyclin D1的半衰期,促进了cyclin D1的降解,而过表达WT USP13,但不影响USP13 -的表达(图4E、F)。C345A突变体延长了cyclin D1的半衰期,延缓了其降解(图4G、H)。为进一步探究蛋白酶体降解途径是否参与USP13介导的细胞周期蛋白D1的稳定,我们用蛋白酶体抑制剂MG132处理转染细胞,发现MG132缓解了USP13 siRNA诱导的细胞周期蛋白D1下调(图4I)。总的来说,这些结果表明USP13通过抑制其蛋白酶体降解途径稳定cyclin D1。此外,我们测定了34个GC样品中USP13和cyclin D1的蛋白丰度,发现这些GC组织中USP13与cyclin D1呈正相关(图4J、K)。

图4 USP13增加cyclin D1表达,维持其蛋白稳定性
5、在GC细胞中,USP13直接与cyclin D1相互作用
为深入了解USP13对cyclin D1的调控作用,我们检测了USP13是否与cyclin D1存在相互作用。我们将带有Myc标签的cyclin D1(Myc-cyclin D1)和带有Flag标签的USP13(Flag-USP13)转染到HEK293T或不同的GC细胞中,并进行外源性Co-IP实验。如图5A所示,在转染了Myccyclin D1和Flag-USP13的细胞中,用抗FLAG抗体免疫沉淀的Flag-USP13中可以检测到Myc-cyclin D1。与此一致的是,Flag-USP13可以被带有抗Myc抗体的Myc-cyclin D1下调(图5B)。随后我们检测了内源性相互作用,发现cyclin D1可以被USP13抗体下调(图5C),而cyclin D2和cyclin D3不能被USP13抗体下调,USP13也可以被cyclin D1抗体下调(图5D)。为检测USP13与cyclin D1的直接相互作用,我们用GST-USP13重组蛋白进行GST-pulldown实验。结果显示,纯化的GST-USP13蛋白可以将cyclin D1蛋白拉下来(图5E)。此外,免疫荧光实验结果显示,USP13可以与GC细胞中的cyclin D1共定位(图5F)。
为确定cyclin D1的哪个区域是与USP13相互作用的关键区域,我们构建了两个cyclin D1缺失突变体(图5G),并进行了Co-IP实验。结果表明,cyclin D1的N端可以与USP13相互作用,而C端不能与USP13相互作用(图5H)。USP13由一个UBP(泛素特异性加工蛋白酶)型锌指、一个USP和两个UBA(泛素相关/翻译延伸因子EF1B ,氨基端)结构域组成。我们构建了5个USP13截短突变体(图5G),并将Myc-cyclin D1与不同Flag标签的USP13突变体共同转染HEK293T细胞。如图5I所示,USP13 UBA结构域的缺失破坏了USP13与cyclin D1的相互作用,含有UBA结构域的突变体能够与Myc-cyclin D1相互作用,但不含USP和UBP结构域,说明UBA结构域对于与cyclin D1的相互作用至关重要。出乎意料的是,与全长USP13相比,UBP结构域的缺失明显降低了与cyclin D1的相互作用,表明UBP结构域可能在USP13与cyclin D1的相互作用中发挥了一定的积极作用。

图5 在GC细胞中,USP13直接与cyclin D1相互作用
6、USP13去除K48连接的Cyclin多泛素化链D1
为进一步确定USP13是否去泛素化cyclin D1,我们将USP13 siRNAs或阴性对照siRNA与Myc-cyclin D1和HA-Ub共转染HEK293T细胞,并进行Co-IP实验。如图6A所示,在HEK293T细胞中,用siRNA敲低USP13增加cyclin D1的泛素化水平。相反,过表达Flag-USP13降低了HEK293T细胞和GC细胞中cyclin D1的泛素化水平(图6B)。为进一步研究USP13的去泛素化酶活性是否对该效应至关重要,我们将WT-USP13或USP13-C345A突变体与Myc-cyclin D1和HA-Ub共转染HEK293T细胞和GC细胞。Co-IP实验结果显示,突变体USP13-C345A不能降低cyclin D1的泛素化水平(图6C),表明USP13的DUB活性对于cyclin D1的去泛素化是必不可少的。为确定USP13对cyclin D1的去泛素化类型,我们将Myc-cyclin D1与HA-Ub K48或K63突变体共转染HEK293T细胞,将除第48或63位赖氨酸外的所有赖氨酸残基替换为精氨酸,同时或不与Flag-USP13共转染HEK293T细胞。如图6D所示,在WT和K48-Ub突变体存在的情况下,USP13降低了cyclin D1的泛素化水平,而在K63-Ub突变体存在的情况下,USP13并没有降低cyclin D1的泛素化水平,说明USP13主要鉴于USP13与cyclin D1的N端结构域存在相互作用。
我们推测USP13可能去除了cyclin D1 N端结构域中与赖氨酸(K)残基相连的多聚泛素化链。细胞周期蛋白D1的N端(aa1 ~ 153)有12个赖氨酸残基。根据之前的报道,在这些赖氨酸残基中,有5个不同的赖氨酸(K33、K46、K50、K112、K114)被检测为潜在的泛素化位点。我们将这五个位点的每个赖氨酸残基突变为精氨酸(R)。我们转染了Myc标记的WT-cyclinD1或不同的突变体 HEK293T细胞及HA-Ub、Flag-USP13。图6E显示,突变体K46R和K50R取消了USP13介导的去泛素化,表明USP13主要在K46和K50处去除了cyclin D1的多聚泛素化链。去除cyclin D1上K48连接的多聚泛素化链。
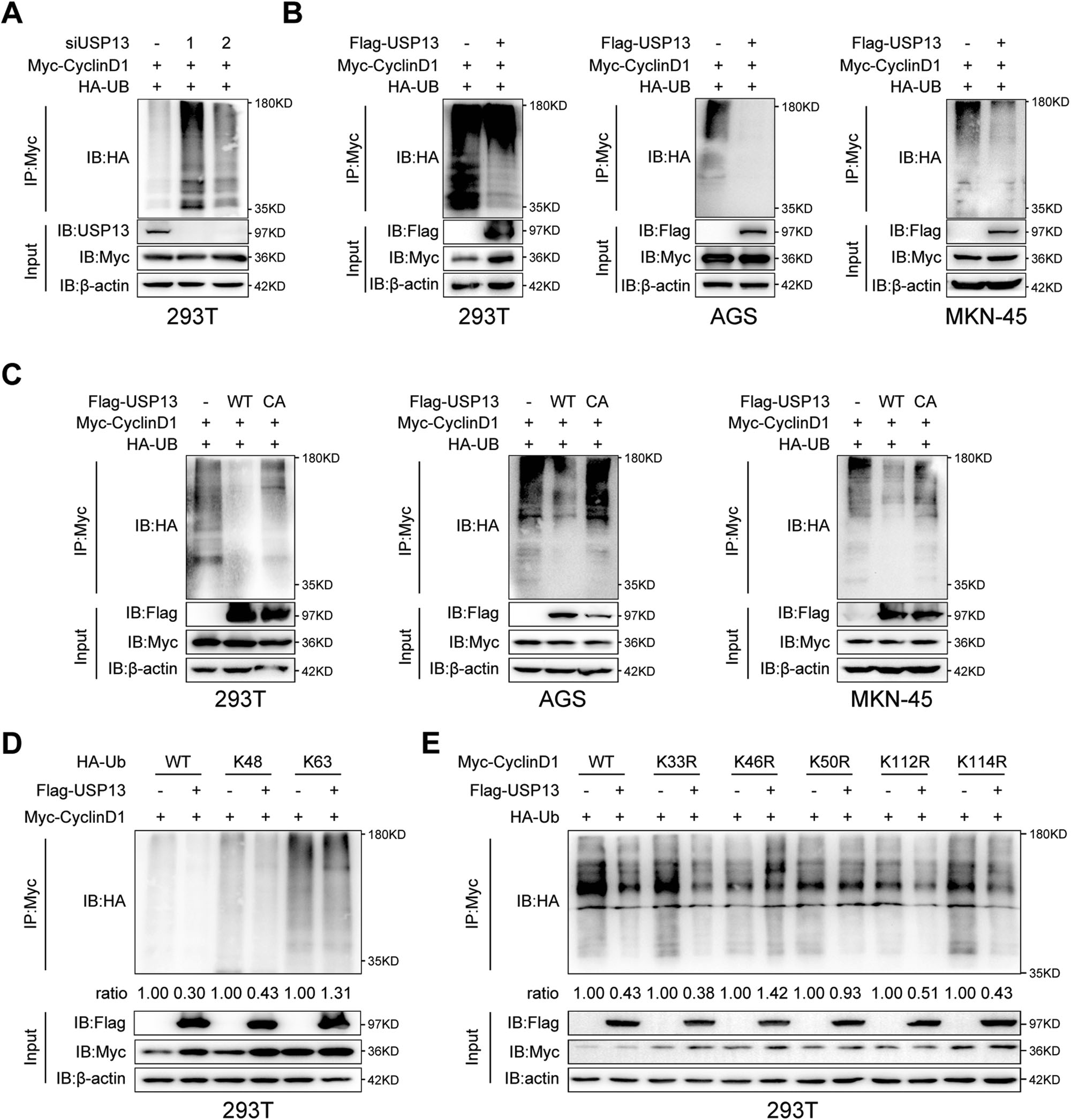
图6 USP13去泛素化细胞周期蛋白D1
7、USP13基因敲低可抑制GC细胞在体内的肿瘤发生
为研究USP13敲低是否抑制GC细胞的体内成瘤能力,我们将稳定敲低USP13的MKN-45GC细胞(shUSP13)或阴性对照(shNC)注射到裸鼠皮下。结果显示,与shNC组(图7A-C)相比,shUSP13组的肿瘤体积和肿瘤重量明显更小、更轻。HE染色证实所有肿瘤均为实体肿瘤(图7D)。Western blot结果显示,与对照组相比,shUSP13组肿瘤中USP13和cyclin D1蛋白表达降低(图7E),而cyclin D1 mRNA水平无明显变化(图7F)。免疫组化(IHC)分析显示,shUSP13组(图7G , H)细胞核相关抗原(Ki67)表达显著降低。
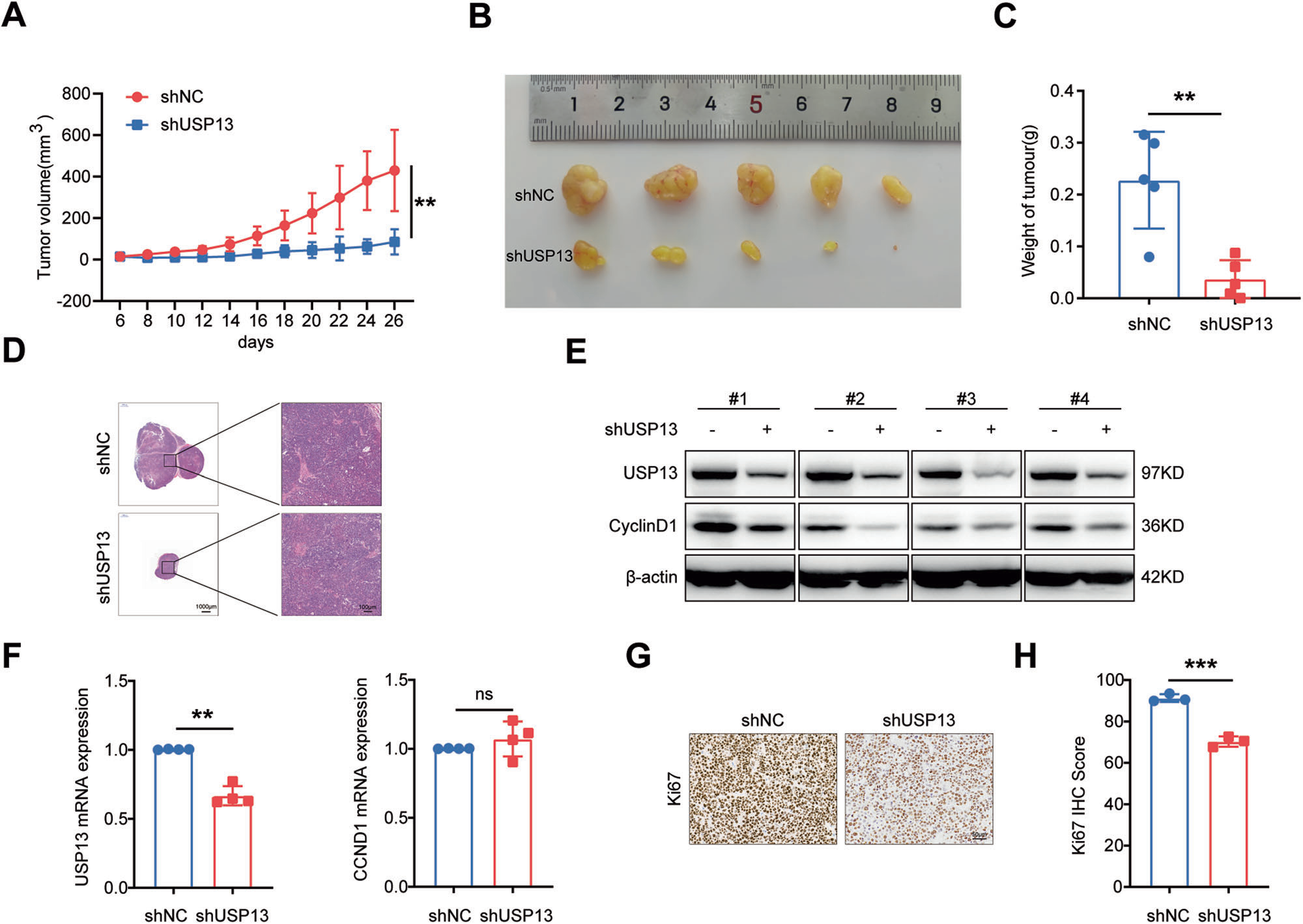
图7 USP13敲低抑制体内肿瘤生长
8、USP13通过cyclin D1调控GC细胞周期进程和细胞增殖
为进一步研究cyclin D1是否参与USP13介导的GC细胞生物学功能,我们进行了挽救实验。我们将USP13 siRNA和cyclin D1表达载体共转染GC细胞(图8A),以确定USP13 siRNA介导的生物学作用是否可以被cyclin D1所阻断。集落形成、CCK-8和EdU实验结果显示,cyclin D1可部分逆转USP13 siRNA介导的抑制集落形成能力(图8B、C)和细胞增殖能力(图8D-F)的作用。流式细胞术结果显示,cyclin D1可部分逆转USP13 siRNA介导的细胞周期G1期阻滞(图8G)。
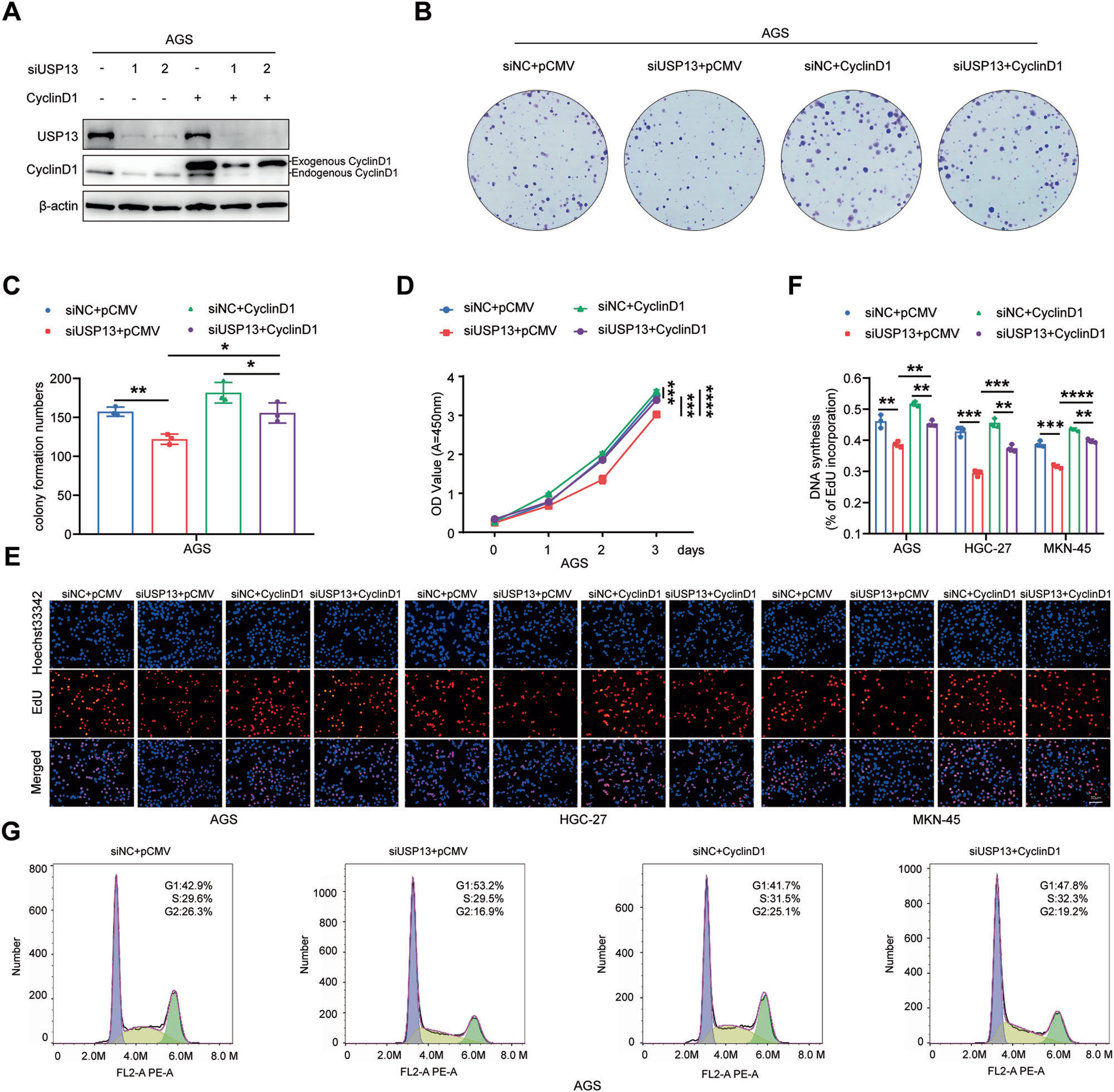
图8 Cyclin D1参与USP13介导的生物学功能。
实验方法
TCGA数据库挖掘,siRNAs及过表达质粒,RNA提取、反转录,qRT-PCR,Western Blot,免疫共沉淀(Co-IP),GST pull-down实验,免疫荧光,细胞周期分析,细胞增殖,克隆形成,慢病毒感染,BALB/c裸鼠,异种移植瘤实验
参考文献
Ma C, Wang D, Tian Z, Gao W, Zang Y, Qian L, Xu X, Jia J, Liu Z. USP13 deubiquitinates and stabilizes cyclin D1 to promote gastric cancer cell cycle progression and cell proliferation. Oncogene. 2023 Jul;42(29):2249-2262. doi: 10.1038/s41388-023-02739-x. Epub 2023 Jun 13. PMID: 37311811; PMCID: PMC10348911.






