TMEM11通过METTL1介导的ATF5 mRNA的m7G甲基化调节心肌细胞增殖和心脏修复
线粒体跨膜(TMEM)蛋白家族具有几种重要的生理功能。然而,其在心肌细胞增殖和心脏再生中的作用尚不清楚。在这里,我们检测到TMEM11在体外抑制心肌细胞增殖和心脏再生。TMEM11缺失可增强心肌细胞增殖,恢复心肌损伤后的心功能。相反,TMEM11过表达抑制小鼠心脏新生心肌细胞增殖和再生。TMEM11直接与METTL1相互作用,增强Atf5 mRNA的m7G甲基化,从而增加ATF5的表达。ATF5上TMEM11依赖性的增加促进了Inca1的转录,Inca1是细胞周期蛋白依赖性激酶的抑制剂,与细胞周期蛋白A1相互作用,抑制心肌细胞增殖。因此,我们的研究结果表明,TMEM11介导的m7G甲基化参与心肌细胞增殖的调节,靶向TMEM11-METTL1-ATF5-INCA1轴可能是促进心脏修复和再生的一种新的治疗策略。本文于2023年6月发表于Cell Death & Differentiation(IF=12.4)上。
技术路线

结果
1)抑制TMEM11可促进体外心肌细胞增殖
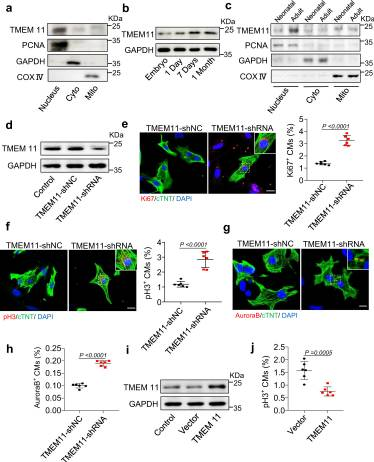
为了研究线粒体蛋白在调节心肌细胞增殖中的潜在作用,我们回顾了文献中报道的线粒体蛋白,并分析了它们在心脏中的位置和表达。有趣的是,我们观察到线粒体内膜蛋白TMEM11分布在心肌细胞的细胞核、细胞质和线粒体中(图1a)。TMEM11蛋白在小鼠出生后心脏中的表达模式显示,TMEM11蛋白水平在出生时相对较低,在成年期增加(图1b),表明TMEM11表达可能与成年小鼠心脏再生能力的丧失有关。此外,TMEM11的表达增加主要在细胞核中观察到,而在成年小鼠心脏的细胞质或线粒体中未检测到显著增加(图1c)。因此,我们推测TMEM11在心肌细胞增殖和心脏再生中具有潜在的调节作用。为了验证TMEM11在调节心肌细胞增殖中的作用,我们构建了含有TMEM11靶向shRNA (TMEM11-shRNA)的重组腺病毒载体,以沉默新生小鼠心肌细胞中TMEM11的表达(图1d)。TMEM11的沉默增加了心肌细胞中增殖标志物的表达,如ki67阳性细胞(图1e),有丝分裂标志物磷酸组蛋白H3 (pH3)阳性细胞(图1f),和细胞分裂标志物Aurora B阳性细胞(图1g, h)的增加。接下来,我们在心肌细胞中过表达TMEM11(图1i),外源性TMEM11表达显著降低了增殖标志物的表达(图1j)。这些数据表明,TMEM11的消融促进心肌细胞增殖,而其过表达抑制细胞周期进展。
2)体内TMEM11缺乏可重新激活心肌细胞增殖
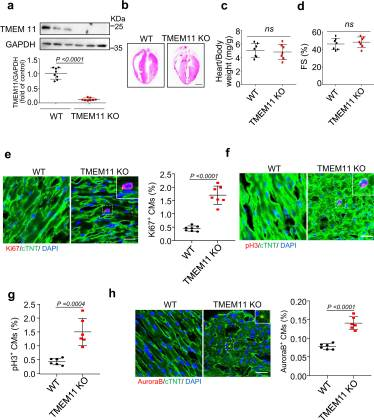
为了研究TMEM11敲除对体内心肌细胞增殖的影响,我们产生了TMEM11敲除(TMEM11 KO)小鼠,通过western blot分析证实了小鼠心脏中TMEM11的缺失(图2a)。在生理条件下,WT和TMEM11 KO小鼠的心脏组织形态、心体重量比和心功能没有显著差异(图2b-d)。与WT小鼠相比,敲除TMEM11增加了ki67阳性细胞的数量(图2e)。同样,在TMEM11缺失的成年小鼠心脏中,pH3阳性(图2f, g)和Aurora B阳性细胞(图2h)的数量明显高于WT小鼠。综上所述,这些结果表明TMEM11的缺失增强了体内心肌细胞的增殖。
3)敲除TMEM11可促进缺血损伤后心肌细胞增殖和心脏再生
为了进一步验证TMEM11沉默对成年心脏再生的影响,我们将TMEM11 KO和WT小鼠进行冠状动脉结扎诱导的心肌梗死。与WT心脏相比,TMEM11 KO显著减少了疤痕大小(图3a),心肌梗死后TMEM11 KO小鼠的左心室功能得到改善(图3b),表明TMEM11沉默介导了心肌细胞损伤后的修复潜力。同时,心肌损伤后TMEM11 KO心脏中Ki67阳性、pH3阳性和Aurora B阳性细胞数量较高(图3c-f),说明TMEM11的缺失通过诱导心肌细胞增殖改善心肌损伤后心肌修复和心脏功能。总的来说,这些数据证实,抑制TMEM11促进了小鼠缺血损伤后的心脏再生。

4)TMEM11过表达抑制新生心脏心肌细胞增殖和心脏再生
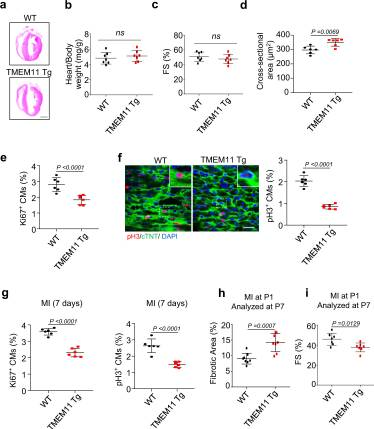
接下来,我们探讨了TMEM11过表达是否抑制了新生心脏的心肌细胞增殖和心脏再生。我们培育了心脏特异性TMEM11转基因(TMEM11 Tg)小鼠。在生理条件下,成年小鼠心脏形态、心体重比和心功能在Tg和WT小鼠之间均无差异(图4a-c)。然而,与WT小鼠相比,Tg小鼠心脏的心肌细胞大小增加(图4d)。此外,与WT小鼠相比,7日龄Tg小鼠心脏中Ki67阳性(图4e)或pH3阳性细胞(图4f)的数量显著减少,表明TMEM11过表达抑制小鼠心肌细胞增殖。为了进一步研究TMEM11过表达对新生心脏再生能力的影响,我们对1日龄TMEM11 Tg小鼠进行心肌梗死,并在第7天进行分析(P7)。与WT小鼠相比,TMEM11 Tg小鼠的Ki67阳性和pH3阳性细胞数量(图4g)减少,纤维化面积增加(图4h)。MI损伤后,与WT对照组相比,TMEM11 Tg小鼠的心功能受损 (图4i)。总之,这些发现表明TMEM11过表达通过抑制出生后心脏心肌细胞增殖来阻碍心脏再生。
5)TMEM11与METTL1相互作用并调节其RNA m7G甲基化活性
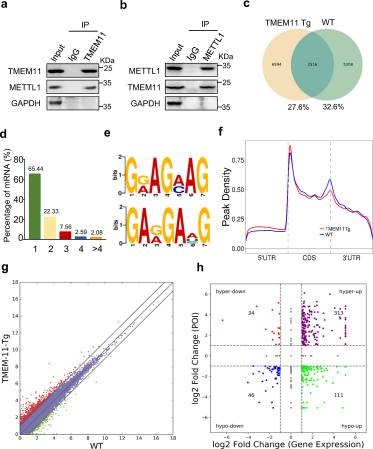
我们的首要任务是研究与TMEM11相互作用的蛋白质,以更好地了解TMEM11如何调节心肌细胞增殖。在富含抗TMEM11抗体的蛋白质中,我们鉴定出了METTL1,一种RNA甲基转移酶。考虑到m7G mRNA甲基化在心肌细胞增殖和心脏再生中的功能尚不清楚,我们进一步研究了METTL1。我们先进行免疫沉淀,然后进行western blotting,并在体内证实了TMEM11和METTL1的直接相互作用(图5a, b)。为了确定TMEM11是否调节心肌细胞中METTL1依赖的m7G-甲基化,我们进行了MeRIP-seq测序(图5c)。在所有检测到的m7G mRNA转录物中,超过一半(65.44%)含有一个m7G峰,4.67%含有四个或更多m7G峰(图5d)。序列基序分析显示,在METTL1的两个保守一致基序序列中,m7G峰高度富集(图5e)。在WT和TMEM11 Tg小鼠中,m7G峰主要分布在编码序列(CDSs)上,特别是在起始和停止密码子附近。然而,与WT小鼠相比,TMEM11 Tg小鼠的CDS和3 ' UTR之间区域的m7G峰密度相对较低(图5f)。接下来,我们在TMEM11 Tg和WT小鼠心脏中进行了RNA-seq分析,以探索m7G修饰与基因表达之间的关系(图5g),并将m7G peak数据与RNA-seq基因表达数据进行了对比,以将基因表达水平与m7G甲基化水平联系起来(图5h)。我们将上调的峰称为高甲基化的m7G峰。我们将下调的峰称为低甲基化的m7G峰。
6)TMEM11促进METTL1依赖的Atf5 mRNA的m7G修饰,并增强其表达
根据图5h所示的结果,我们进一步研究了TMEM11 Tg心脏心肌细胞增殖过程中METTL1的潜在下游靶点。我们对与增殖相关的差异甲基化基因进行了MeRIP-qPCR检测。我们的研究结果显示,与WT小鼠相比,TMEM11 Tg小鼠中Atf5 mRNA的m7G修饰增加最为显著(图6a)。此外,ATF5在TMEM11 Tg心脏中的表达显著增加(图6b)。Atf5 mRNA的整合基因组分析显示,在TMEM11 Tg心脏中,m7G峰值显著增加,同时Atf5 mRNA的表达也增加(图6c)。相比之下,在TMEM11 KO心脏中,Atf5 mRNA的m7G修饰减少(图6d),同时Atf5 mRNA和蛋白的表达减少(图6e)。这些结果促使我们选择ATF5作为TMEM11-METTL1轴调控心肌细胞增殖的潜在靶点。接下来,我们研究了ATF5是否通过调节新生心肌细胞的增殖作为TMEM11的下游靶点。TMEM11过表达可抑制心肌细胞增殖,转染siRNA-ATF5可挽救心肌细胞增殖(和图6f)。此外,在成年小鼠心脏中使用AAV9系统(sh-ATF5)敲低ATF5(补充图7c)可促进心肌细胞增殖 (图6g),表明ATF5参与心肌细胞增殖和心脏再生的调节。我们研究了TMEM11调控ATF5表达的机制。与WT小鼠心脏相比,TMEM11 KO心脏中METTL1与Atf5 mRNA的结合明显减少(补充图,未展示)。此外,METTL1过表达增加了Atf5 mRNA的m7G修饰和增加Atf5表达,并且这些作用通过伴随的TMEM11过表达而增强(补充图,未展示)。此外,METTL1敲低降低了体内和体外TMEM11过表达时Atf5 mRNA的m7G修饰及其表达(补充图,未展示)。综上所述,这些结果表明TMEM11通过METTL1介导Atf5 mRNA的m7G修饰,这种甲基化增强了mRNA的稳定性和翻译能力。

7)TMEM11在心肌细胞增殖过程中调控INCA1的表达
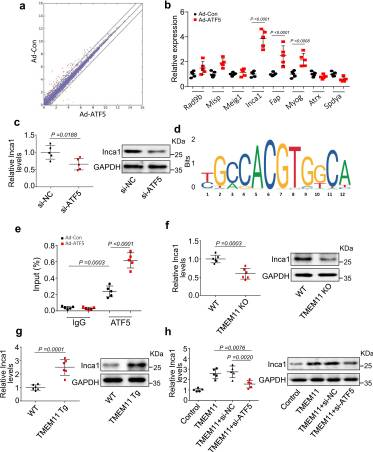
为了探索ATF5的下游靶点,我们对过表达ATF5的心肌细胞进行了RNA-seq分析(图7a)。我们在RNA-seq数据集中筛选与增殖调控相关的差异表达基因。我们用qPCR验证了它们的表达。其中,与对照细胞相比,过表达ATF5的心肌细胞中只有Inca1、Myog和Fap的表达水平显著升高(图7b)。与WT相比,只有Inca1在TMEM11 KO小鼠的心脏中表达降低(补充图,未展示)。因此,我们选择INCA1进行进一步的研究。接下来,我们证明了ATF5敲低降低了Inca1 mRNA和蛋白的表达(图7c),表明ATF5转录因子促进了Inca1的表达。我们还在Inca1基因的启动子区域观察到ATF5结合的共同基序(图7d),并使用ChIP-qPCR验证了ATF5与该序列的结合(图7e)。此外,ATF5过表达后观察到Inca1启动子区域显著富集(图7e)。与这些体外研究结果一致,与WT心脏相比,TMEM11 KO小鼠心脏中的Inca1 mRNA和蛋白表达降低(图7f),而TMEM11 Tg小鼠心脏中的Inca1表达水平显著升高(图7g)。在心肌细胞中,TMEM11增加了Inca1的表达水平,而这些作用通过敲除ATF5而减弱(图7h)。综上所述,这些结果表明INCA1作为TMEM11/ATF5通路的下游靶点,抑制出生后心肌细胞的增殖和再生。
结论
我们的研究揭示了TMEM11依赖性m7G修饰调节心肌细胞增殖的新机制。靶向TMEM11-METTL1-ATF5轴可能是促进心脏损伤后心脏再生的有效策略。
实验方法
MeRIP-qPCR,免疫荧光,MeRIP测序,TTC染色,HE染色,Masson染色,免疫沉淀,RIP,线粒体膜电位测定,质谱,WB,RT-qPCR,ChIP,mRNA-seq。
参考文献
Chen XZ, Li XM, Xu SJ, Hu S, Wang T, Li RF, Liu CY, Xue JQ, Zhou LY, Wang YH, Li PF, Wang K. TMEM11 regulates cardiomyocyte proliferation and cardiac repair via METTL1-mediated m7G methylation of ATF5 mRNA. Cell Death Differ. 2023 Jul;30(7):1786-1798. doi: 10.1038/s41418-023-01179-0.






