揭秘肝脏p53依赖的组织特异性抗辐射机制
胸腺和脾脏与肝脏不同,是对辐射敏感的组织,在体内全身辐射后会触发p53依赖性凋亡。但这种肝脏特异性抗性的分子机制尚不清楚。作者通过对经辐射处理的小鼠器官进行RNA-seq和ChIP-seq联合分析,发现了共有的和组织特异的p53转录反应。胸腺和脾脏共有的p53靶点富含凋亡靶点。肝脏不能上调这些基因并不是由于基因占有率降低。p53的C末端缺失可使辐射诱导的p53凋亡靶点在肝脏表达,同时增加细胞死亡。肝脏特异性p53靶标的转录激活还需要C末端的额外作用。据作者推测,抑制凋亡基因的表达与增强肝脏特异性靶点的活化共同赋予了组织特异性抗辐射能力。本文于2023年3月发表在《Cell Reports》IF:8.8期刊。
技术路线

主要实验结果
1、DNA损伤可诱导小鼠胸腺和脾脏p53依赖性细胞凋亡,但对肝脏无影响
以前的研究发现胸腺和脾脏是体内辐射敏感组织,而肝脏不是。为验证这些结论,对21天大的野生型C57/BL6小鼠进行2Gy的全身X射线照射。在处理6小时后,胸腺和脾脏出现大量的凋亡,而肝脏则没有(图1A)。使用p53基因缺失的小鼠证明胸腺和脾脏的这些效应确实是p53依赖性的(图1B)。免疫印迹法用于确定三种组织中p53的相对表达水平。在这些研究中,凝胶中的每个泳道代表一只动物。在X射线照射3小时后,p53在三种组织中的表达被诱导,并在6小时后开始减弱(图1C)。定量测量p53和actin条带的相对强度表明,尽管肝脏p53的表达水平可能较低,但无论是在治疗前(0 h)还是在辐射后(3 h),这三种组织中p53的表达水平没有统计学意义上的显著差异(图1D)。仔细研究p53蛋白水平对辐射的反应表明,胸腺和脾脏中的p53有统计学意义的增加(分别为p = 0.002和p = 0.001),但肝脏中的情况并非如此(p = 0.36)。然而,肝脏显示出强大的p53靶基因反应(见下文)。
2、X射线处理导致共同的和组织特异性的p53转录反应
为确定对全局基因表达的影响,野生型和p53缺失小鼠均未接受或接受2 Gy的X射线照射。从肝脏、胸腺和脾脏中收集RNA,并进行RNA-seq分析。基因表达显著改变的基因数量因组织而异,脾脏最多(3132个基因),其次是胸腺(481个基因)和肝脏(324个基因)。在这三种组织中,基因表达的上调高于抑制(图1E)。为确定这些基因表达变化对p53的依赖性,在相应的p53-null组织中测定辐射对野生型组织中显著改变的基因表达的影响(图1F)。火山图显示,在肝脏中明显改变的324个基因中,298个(92%)的表达依赖于p53。有趣的是,所有胸腺基因的表达都依赖于p53。但在脾脏中,在3132个已鉴定的基因中,298个基因在p53缺失小鼠中也发生了改变,其中2834个基因(90%)依赖于p53(图1F)。
对相应组织进行染色质免疫沉淀测序(ChIP-seq)分析,以确定p53的占据位点。基因表达水平脾脏显示了最多的辐射改变基因(3132个,而肝脏为324个,胸腺为481个)(图1E),而与此相反,肝脏具有最多的p53基因占据的重要位点(3872个,而胸腺为2405个,脾脏为2604个)(图1G)。将RNA-seq数据与ChIP-seq数据进行整合,以鉴定对辐射反应显著表达改变同时也有相关的ChIP-seq峰的基因。这样就鉴定出在放射后上调(图1H)或下调(图1I)的真正的p53靶点。尽管上调基因在不同组织间有相当大的重叠,但下调靶点具有高度的组织特异性。

图1 DNA损伤诱导胸腺和脾脏p53依赖性细胞凋亡,而不是肝脏,其具有共同的和组织特异性的p53转录反应
3、X射线诱导了p53的共享核心直接转录靶点
整合RNA-seq和ChIP-seq分析发现,20个基因在肝脏、胸腺和脾脏这三种组织中均显著上调,且在基因的10 kb范围内或基因本身至少有一个ChIP峰。这20个基因的上调在所有受检组织中都依赖于p53(图2A和2B)。选择了三个基因进行qRT-PCR验证(图2C)。Ccng1、Phlda3和Aen都上调了3-12倍,前两个基因在每个组织中都明显依赖于p53(图2C)。对这三个基因的ChIP-seq图谱的研究证实,在靠近转录起始位点的地方存在稳健的峰,且在Phlda3中,在基因上游存在额外的峰(图2D)。在这20个基因中,所有基因都至少有一个峰与p53 motif相关(图S3B),这些motif与之前发表的p53特异性DNA结合共识序列非常吻合(图2D),对所有20个共有基因的类似分析提供了一个与之前确定的非常相似的motif(图2E)。有趣的是,这些峰值在基因体内本身也同样存在,如在基因的上游,只有少数位点位于下游(图2F)。GSEA显示,GO_BP与先前与导致细胞凋亡的p53 DNA损伤应答相关的基因有关(图2G)。综上所述,20个共享基因的发现(其中许多基因先前已被鉴定为p53靶标)使人们对这些RNA-seq和ChIP-seq数据集及其用于进一步评估充满信心。
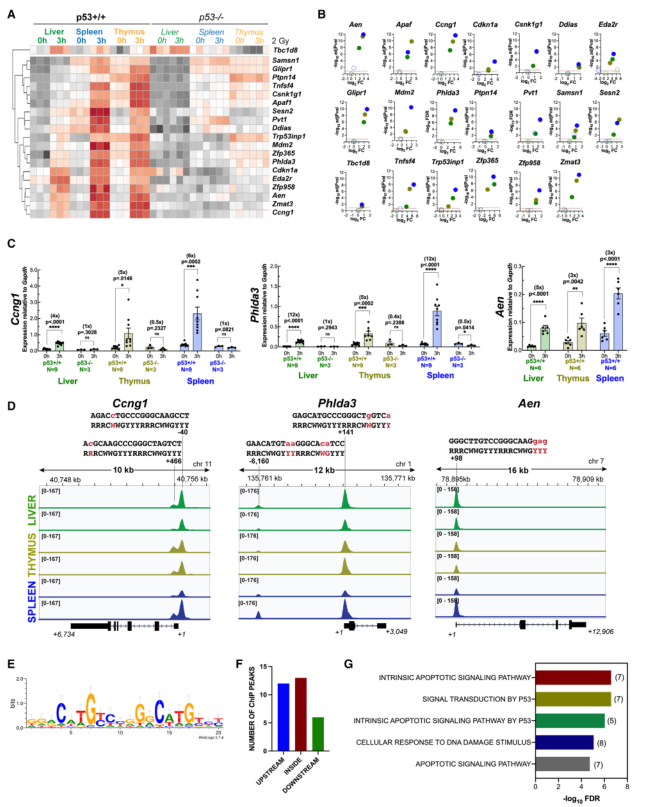
图2 X射线诱导了p53的共享核心直接转录靶点
4、肝脏p53不能上调凋亡基因
为阐明胸腺和脾脏与肝脏对辐射的不同生物反应的基础,接下来确定了敏感组织中特异性上调的基因。结果发现,80个基因在胸腺和脾脏中的表达在辐射后增加,而在肝脏中没有变化(图3A)。所有这80个基因都有与之相关的ChIP峰,并被认为是p53的真正靶标。GSEA显示与细胞凋亡相关的生物过程是富集率最高的(图3B)。与凋亡过程基因集重叠的21个基因被证实其基因表达依赖于p53,并且在肝脏中不表达(图3C)。qRT-PCR被用来证实这些基因的一个子集(Bbc3、Pmaip1和Bax)在胸腺和脾脏中确实是选择性靶点,但在肝脏中不是,并且它们的表达依赖于p53(图3D)。一个共同的靶点Cdkn1a在所有三个组织中作为p53依赖性基因表达的阳性对照。在10周龄小鼠中检测Bbc3 (Puma)时,在蛋白和mRNA水平发现了类似的组织特异性。值得注意的是,与胸腺和脾脏相比,肝脏的DNA损伤反应减弱,这可通过免疫印迹法检测p53在丝氨酸15处的磷酸化和γH2AX的水平来确定(图S2)。这就提出了一种可能性,即基因表达的组织特异性可能与对X射线的不同敏感性有关。尽管如此,肝脏确实显示出其他组织所没有的基因亚群的占据和表达(图1H)。肝脏特异性p53靶点的存在降低了上游信号传导受阻导致观察到的结果的可能性,但并不排除这种可能性。
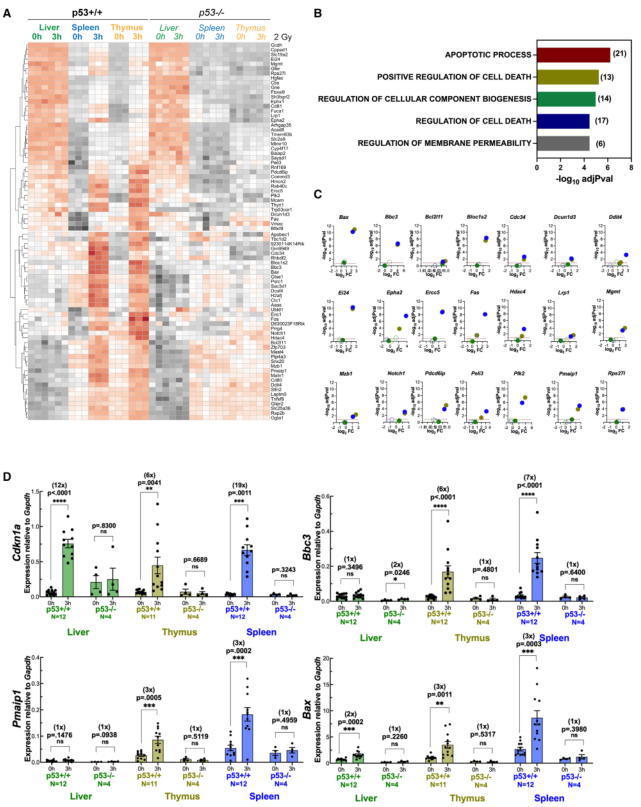
图3肝脏p53不能上调凋亡基因
5、无法上调肝脏中的p53凋亡靶点不是由于基因占用减少
肝脏p53不能上调凋亡靶点的分子基础可能是由于基因占据受损或DNA结合后的步骤。为解决这个问题,作者研究了三个关键凋亡靶标(Bbc3、Pmaip1和Bax)的ChIP-seq图谱。在辐照胸腺和脾脏中,三个基因都观察到强大的p53峰值。令人惊讶的是,在肝脏中,这三个基因的p53占据率也相似(图4A)。为了验证这一发现,野生型p53小鼠体内用另一种DNA损伤剂多柔比星处理,并对肝脏和脾脏组织进行分析。进行qRT-PCR检测两个共享靶标Cdkn1a和Mdm2的mRNA水平,并与两个凋亡靶标Bbc3和Pmaip1进行比较。与X-射线照射后的结果一致,多柔比星处理导致肝脏和脾脏中Cdkn1a和Mdm2的增加,而Bbc3和Pmaip1仅在脾脏中被诱导(图4B)。然后对相应的肝脏和脾脏组织样本进行染色质免疫沉淀。与X-射线的结果一样,多柔比星处理后,在肝脏和脾脏的Cdkn1a、Bbc3和Mdm2基因的反应元件上检测到p53的占据,Alb基因的一个区域被用作阴性对照(图4C)。
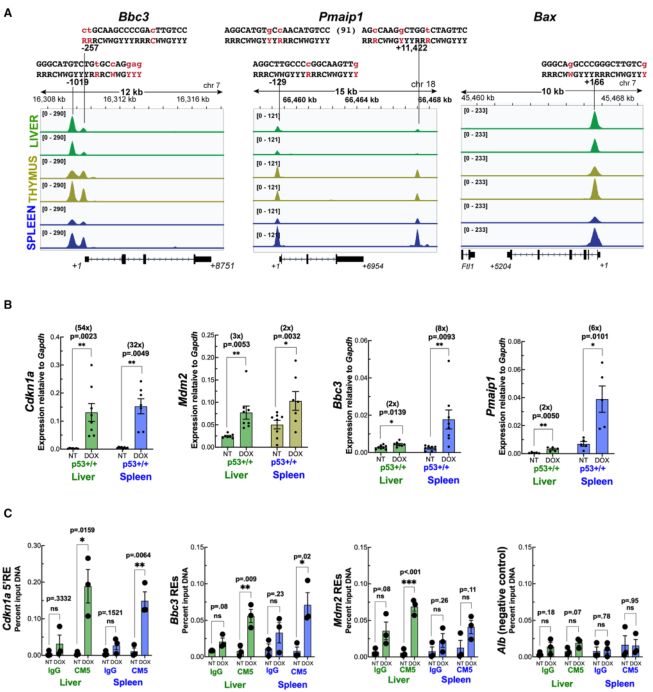
图4无法上调肝脏中的p53凋亡靶点不是由于基因占用减少
6、肝脏中p53靶基因表达的抑制有两种机制
迄今为止的研究结果表明,胸腺和脾脏靶标中的三个,即Bbc3、Pmaip1和Bax,被肝脏p53占据,但在该组织中对X射线或多柔比星处理没有调节(图3和图4)。然后研究了80个胸腺和脾脏靶点中有多少具有类似的特性,即它们也被p53占据但在肝脏中不被上调。在胸腺和脾脏中,所有这80个基因都显示出与相应的p53占位有显著差异的基因表达(图5A)。有趣的是,这些基因中的大多数在肝脏中也显示出显著的占位,调整后的p < 0.20(图5A)。值得注意的是,与胸腺和脾脏相比,这些基因在肝脏中的占据率在统计学上更高(图5B,左)。两个代表性基因(Notch1, Ei24)的ChIP-seq图谱显示,p53在所有三个组织中都有很强的占据率(图5B,中)。总之,80个基因中有74个被肝脏p53占据,其中所有与GO凋亡过程基因组重叠的基因都在这里被发现(下划线基因,图5B,右)。这些峰值主要出现在上游区域(图5B,左下)。将这些峰中的p53 motif进行比对,发现它们与之前确定的p53共识有合理的匹配(图5B,右下)。
相比之下,其余6个基因在肝脏中没有与之相关的稳健的p53 ChIP峰(图5C,左)。展示了ChIP-seq图谱的两个例子(Hgfac和Dcaf4)(图5C中)。图5C右展示了6个基因的列表。在胸腺和脾脏中发现的这些峰值,但在肝脏中没有发现,也大多出现在基因体内(图5C,左下)。这些峰中的p53 motif也与p53共识相似(图5C右下)。
值得注意的是,在74个显示肝脏p53占位的基因中,有7个基因有多个相关的ChIP峰,其中至少有一个峰在肝脏样本中丢失。图5B右侧紫色显示了这些基因。在ChIP峰与特定p53靶基因的功能注释出现之前,很难明确论证这一点的相关性。然而,肝脏p53对这些基因缺乏调控仍有可能是由于这些其他位点缺乏占位。
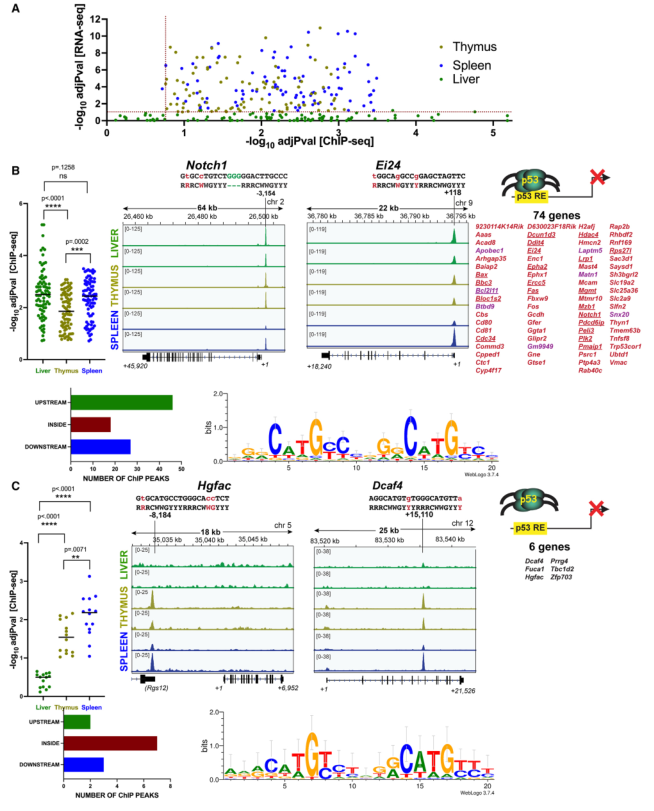
图5 肝脏p53靶基因表达缺陷有两种机制
7、p53的C端阻止了肝脏中p53凋亡靶点的上调
肝脏p53不能上调胸腺和脾脏的大部分靶标似乎不是由于基因占据受损。这表明下游转录事件受到了影响,这种影响很可能是由于蛋白质与蛋白质之间的相互作用。由于p53的CTD过去已被证实可介导p53与基因表达相关的辅助因子的结合,因此研究了受损肝脏p53反应对CTD的需求。之前文献已经产生了一个小鼠模型,其中内源性Trp53基因表达了一个缺少最后24个氨基酸的截短蛋白。同卵p53Δ24/Δ24小鼠在出生后两周内死亡,因此不适合在此进行研究。然而,杂合子p53Δ24/-小鼠寿命正常,无明显表型。因此,对p53Δ24/-小鼠进行X-射线处理并分析p53靶点的表达。与p53+/-小鼠相比,Δ24/-小鼠肝脏、胸腺和脾脏中某些p53靶点的表达进行了检测(图6)。CTD的缺失对胸腺或脾脏中共有靶点Cdkn1a和Mdm2或胸腺/脾脏特异靶点Bbc3、Pmaip1和Bax的基因表达没有实质性影响(图6A)。相反,缺失CTD后,肝脏中Cdkn1a、Bbc3、Pmaip1和Mdm2的诱导作用增强,但Bax的诱导作用不增强(图6A)。值得注意的是,辐射后p53+/-肝脏中mRNA几乎没有变化的Bbc3,现在在p53Δ24/-肝脏中被辐射诱导。进行免疫印迹以确定CTD的缺失是否改变了p53蛋白的表达(图6B)。多个印迹的定量证实不同组织的p53水平相当(图6C)。p53蛋白水平的诱导在不同组织和基因型中同样相似。与p53Δ24/-肝脏中Bbc3 mRNA的诱导一致,Puma蛋白也被强有力地诱导,并具有统计学意义(图6B和6C)。因此,CTD的缺失允许肝脏特异性上调凋亡靶标,特别是在辐射处理后的Bbc3。

图6 p53的C端阻止了肝脏中p53凋亡靶点的上调
8、p53的C端阻止X射线诱导的肝脏凋亡
为观察CTD缺失后观察到的基因表达变化是否会影响X射线治疗后的生物学结果,对p53+/-和p53Δ24/-小鼠的肝组织进行了TUNEL检测(图7A)。显微照片证实p53+/-肝脏在辐射前后几乎没有TUNEL阳性(图7A,左)。这与同源野生型p53小鼠的情况相似(图1)。相反,p5324/-肝脏显示TUNEL阳性细胞增加。对多个实验中的此类显微照片进行定量显示增加了7倍(图7A,右)。这与CTD缺失增强肝脏辐射敏感性的观点一致,同时伴随着关键凋亡靶标Bbc3及其相应蛋白Puma表达的增加。鉴于全长p53在这些组织中的基础凋亡率很高,因此与肝脏相比,去除CTD的影响轻微也就不足为奇了(图7A)。
9、p53的C端是肝脏特异性基因表达的关键决定因素
CTD缺失对辐射诱导的在肝脏中的一组候选基因的表达有明显的影响(图6)。然后进行RNA-seq分析,对CTD缺失的后果进行更全面的展示(图7B-7K)。当比较p53+/-肝脏和相应的p53Δ24/-组织时,274个基因在辐射后3小时有差异表达。GSEA显示,p53+/-肝脏中表达量增加的基因所富集的GO项与p53Δ24/-肝脏中表达量增加的基因所富集的GO项不同。值得注意的是,p53Δ24/-肝脏中调控增强的基因的GO富集包括 "程序性细胞死亡"(图7C)。这些差异也可能是由于基础基因表达的改变。为从进一步分析中排除这些基因,在0 h时对两种基因型的肝脏进行了比较(图S7A)。这样就剩下了241个基因,它们代表了那些基础表达无显著统计学差异,但在3 h时调控发生改变的基因(图7D)。其中,191个基因在p53+/-肝脏中增加,而50个基因在p53Δ24/-组织中增加(图7E)。因此,有两类基因:仅在p53+/-肝脏中被激活而在p53Δ/-中未被激活的基因(191个基因)和仅在p53Δ/-肝脏中被激活而在p53+/-中未被激活的基因(50个基因)(图7E)。对每组基因都进行了检查,以确认它们确实具有辐射反应性。
第一组中的191个基因在p53+/-肝脏中是靶基因,但在p53Δ/-组织中失去了反应性,其中只有46个基因具有辐射反应性(图7F)。这些基因似乎是肝脏特异性的,因为大多数基因在胸腺或脾脏中不会随辐射而改变(图7G)。在这种情况下,CTD似乎是肝脏特异性基因表达所必需的。与ChIP-seq研究结果(图1H)结合显示,这些基因被p53特异性地占据(图7H)。因此,有一部分靶点是肝脏特异性的(在胸腺或脾脏不受调控),它们的激活依赖于完整的CTD。肝脏特异性与基因在肝脏而非胸腺或脾脏的选择性占据有关。CTD在这种情况下发挥作用的根本原因可能是通过多种机制,仍有待阐明(图7L)。
在p53Δ24/-肝脏中显示调控增强的50个基因中,13个基因在p53Δ/-肝脏中被辐射诱导,而在p53+/-肝脏中没有被辐射诱导(图7I)。事实上,其中许多是胸腺和脾脏的靶标(图7J)。事实上,其中两个(Rhbdf2、Rxylt1)在胸腺和脾脏中是野生型p53的靶点,但在肝脏中不是(图7I和7J)。CTD的缺失使这些基因在肝脏中被激活。将这些结果与同基因+/+小鼠的ChIP-seq数据(图1G)相结合,可以发现所有这些基因都被肝脏p53占据(图7K)。这表明这些基因与肝脏中的p53相关,但只有在缺失CTD时才能被激活。一种可能的解释是抑制因子与肝脏中的CTD相关(图7M)。CTD的缺失将阻止抑制因子的结合,从而导致激活。值得注意的是,有33个基因在基本或辐射后CTD缺失时均表现出差异表达(图7D)。有趣的是,其中许多基因属于20个跨组织共享基因(图2)。其中三个基因(Aen, Eda2r, Zfp365)通过qRT-PCR得到证实。在这些情况下,X-射线照射后出现的激活增强不仅仅是由于基础表达的增加。
GSEA显示,这两组基因(CTD需要表达的基因和CTD抑制表达的基因)具有不同的GO术语(图7L和7M)。
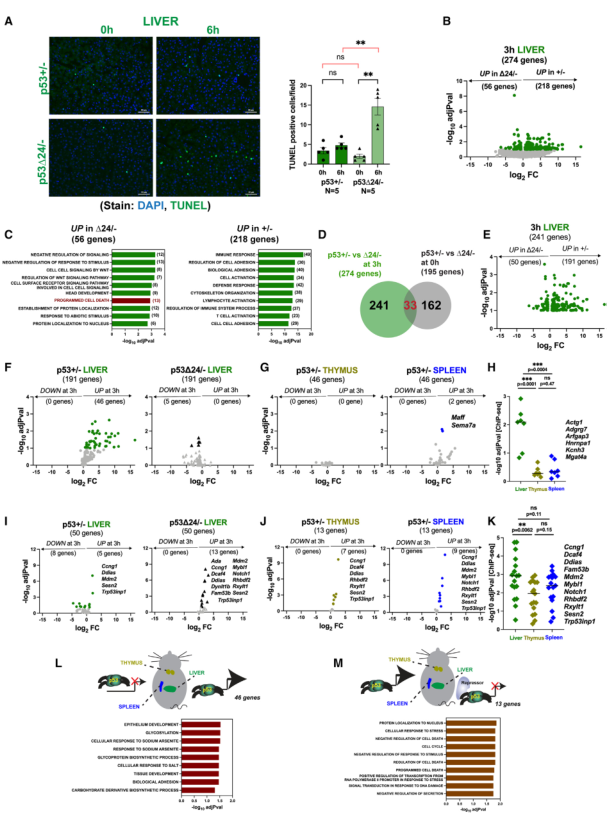
图7 p53的C端阻止X射线诱导的肝脏凋亡,并决定肝脏特异性基因的表达
总之,如下图所示,本研究利用RNA-seq和ChIP-seq发现p53辐射反应具有共享性和组织特异性;肝脏p53占据凋亡靶基因但不能调控其表达;p53 C末端抑制肝脏凋亡基因,赋予放射抗性;肝脏特异性基因对辐射反应需要p53 C末端。
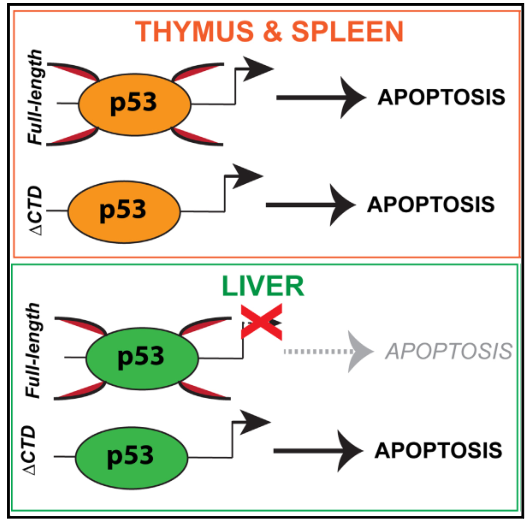
图8 图形摘要
实验方法
小鼠辐射建模和多柔比星处理,RNA提取,qRT-PCR,RNA-seq,ChIP-seq,TUNEL,免疫印迹
参考文献
Resnick-Silverman L, Zhou R, Campbell MJ, Leibling I, Parsons R, Manfredi JJ. In vivo RNA-seq and ChIP-seq analyses show an obligatory role for the C terminus of p53 in conferring tissue-specific radiation sensitivity. Cell Rep. 2023 Mar 28;42(3):112216. doi: 10.1016/j.celrep.2023.112216. Epub 2023 Mar 15. PMID: 36924496; PMCID: PMC10200257.






