靶向巨噬细胞免疫检查点Siglec-9——提高胶质母细胞瘤免疫治疗疗效

新辅助免疫检查点阻断疗法只能使一小部分多形性胶质母细胞瘤(GBM)患者受益。因此,靶向髓系细胞上的其他免疫调节剂是一种有吸引力的治疗选择。本研究中,作者发现具有功能可塑性的单核细胞源肿瘤相关巨噬细胞亚群,它们高度表达免疫抑制SIGLEC9基因,并优先在抗PD-1治疗无反应者中积累。在小鼠模型中,敲除Siglece(小鼠同源基因)可显著抑制肿瘤发展并延长存活时间。机制上,靶向Siglece可通过抗原呈递、分泌趋化因子和共刺激因子相互作用直接激活CD4+T细胞和 CD8+T细胞。此外,Siglece缺失与抗PD-1/PD-L1治疗协同提高抗肿瘤疗效。该研究于2023年7月17日发表在《Nature Cancer》,IF:22.7。
技术路线
主要研究结果
1. 新辅助免疫疗法重塑GBM微环境
将24名GBM患者分为三组:7名新诊断患者(ND)、5名复发患者(Rec)和12名接受帕博利珠单抗和安罗替尼新辅助联合疗法(Neo)的患者。Neo组又分为5例非应答者和7例应答者(图1a,b)。与非应答者相比,应答者的PFS和总生存期(OS)更长(图1b)。对肿瘤进行scRNA-seq分析,获得 149048个高质量细胞(图1c)。比较结果显示,Neo/Rec样本和ND样本中的T细胞、小胶质细胞和巨噬细胞存在显著差异。巨噬细胞占细胞总数的 37.5%,并且在不同疾病阶段的代表性逐渐降低,这表明巨噬细胞在GBM进展和治疗过程中发挥重要作用(图1d)。对24名患者中18名患者的34个组织切片进行ST分析,使用非负矩阵分解(cNMF)寻找共有的表达模块(图1e)。与瘤旁区相比,肿瘤核心区的缺氧、血管生成和炎症反应基因特征更为明显(图1f)。肿瘤核心区基因表达的增加与细胞外基质组织、血管生成、IL-4/IL-13 信号转导和炎症反应有关(图1g)。这些发现强调了不同GBM肿瘤区域的动态空间景观。

图1. ND、Rec和Neo中肿瘤微环境重编程的单细胞和空间转录组学研究
2. GBM中多种SIGLEC9+TAM亚群
对小胶质细胞、肿瘤相关巨噬细胞(TAMs)和单核细胞进行深入分析(图2a)。发现一个主要的小胶质细胞集群(C1,表达TMEM119和P2RY12)和一个小的高表达CXCL10的小胶质细胞集群(C8)(图2a,b)。TAM(CD68+、TGFBI+ 和 CSF1R+)再聚类显示五个亚群:增殖TAMs(C7,MKI67)、IL1+ TAMs(C6,IL1)、一个未定义的亚群(C5)和两个具有SIGLEC9 表达特征的亚群,分别命名为SIGLEC9+SEPP1+TAMs(C2,SIGLEC9+和SEPP1+)和SIGLEC9+MARCO+TAMs(C9,SIGLEC9+和MARCO+)(图2a,b)。还发现两个单核细胞集群:CD14+单核细胞(C3)和CD16+单核细胞(C4)(图2a)。与Rec样本相比,主要的小胶质细胞集群(C1)在ND样本中富集(图2c)。Rec组主要观察到SIGLEC9+ SEPP1+ TAMs(C2)和CD14+单核细胞(C3)(图2c)。在Neo组中,与应答者相比,SIGLEC9+MARCO+TAMs(C9)更多地出现在非应答者中,而SIGLEC9+SEPP1+TAMs(C2)则略有增加(图2c)。进行基因集变异分析(GSVA)(图2d),小胶质细胞在抗肿瘤相关途径略有富集,表明这些组织常驻髓系细胞可能不是抗肿瘤免疫反应的驱动力(图2d)。IL1+TAMs(C6)强烈富集的炎症反应途径强调了IL-1在激活巨噬细胞中的关键作用(图2d)。IL1+ TAM(C6)在Neo组中的优先分布表明,它们可能是由免疫检查点阻断疗法(ICB)诱发的(图2c)。值得注意的是,单核细胞衍生TAMs的两个异质亚群(SIGLEC9+SEPP1+TAMs,C2;SIGLEC9+MARCO+TAMs,C9)在活化和抗肿瘤途径中都有富集(图2d)。使用基于熵的统计算法ROGUE量化亚群的异质性,发现SIGLEC9+SEPP1+TAMs(C2)和SIGLEC9+MARCO+TAMs(C9)在不同疾病阶段(图2e)的ROGUE指数都很低,CXCL10+小胶质细胞集群(C8)也表现出高度异质性(低ROGUE指数)(图2e)。
3. SIGLEC9引导两个表达SEPP1或MARC的TAM亚群
将单细胞熵应用于TAMs,用统一的流形逼近与投影(UMAP)表示它们的细胞状态可能性。与初始状态相比,耗竭SIGLEC9+TAMs后,整体细胞熵大幅增加,而耗竭MARCO+TAMs则没有出现整体变化(图2f)。SEPP1+TAM的耗竭导致大部分区域的整体细胞熵更低(图2f)。因此,维持这两个TAM亚群的是 SIGLEC9而不是SEPP1或MARCO。值得注意的是,SIGLEC9+SEPP1+TAMs(C2)表达高水平的抗炎和血管生成相关基因,如IL10、VEGFB、SLC40A1、FOLR2 和CSF1R(图2g)。相反,与 SIGLEC9-SEPP1-TAMs相比,SIGLEC9+SEPP1+TAMs中的主要组织相容性复合体(MHC)-II基因(HLA-DQA1和HLA-DRB1)、促炎细胞因子IL18以及抗原递呈和吞噬相关基因C1QA/C1QB/C1QC也有所升高(图2g)。SIGLEC9+MARCO+TAMs的抗炎基因(如MRC1、MARCO和VSIG4)和炎症基因(如ALOX5、ENO1和FBP1)的表达均上调(图2h)。这些结果说明SIGLEC9+SEPP1+TAMs和SIGLEC9+MARCO+TAMs代表高度可塑性的免疫抑制巨噬细胞群。
4. SIGLEC9+TAMs源自单核细胞
RNA速率分析表明,CD14+单核细胞(C3)向SIGLEC9+SEPP1+TAMs(C2)和SIGLEC9+MARCO+TAMs(C9)定向流动(图2i)。这表明SIGLEC9+SEPP1+和SIGLEC9+MARCO+TAMs并不是离散的细胞群,而是连续的,并且来自单核细胞。值得注意的是,SIGLEC9+MARCO+TAMs在单核细胞趋化通路中表现出富集(图2d),进一步支持单核细胞迁移到肿瘤并逐步分化成SIGLEC9+TAMs的观点。测量各细胞群的空间共定位,发现SIGLEC9+SEPP1+TAMs或SIGLEC9+MARCO+TAMs与CD14+单核细胞共定位,进一步表明它们来自 CD14+单核细胞(图2j)。
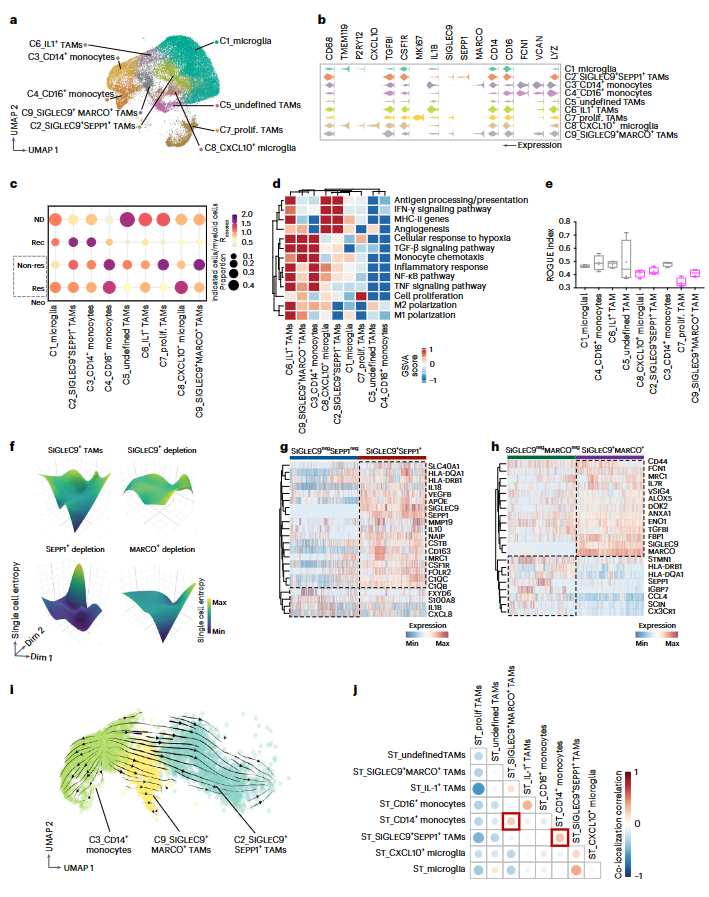
图2. 源自单核细胞的SIGLEC9+巨噬细胞具有抗肿瘤和免疫抑制的双重功能
5. SIGLEC9+TAMs在新辅助治疗后积聚
与其他疾病阶段相比,SIGLEC9在非应答者样本中表达明显较高(图3a)。此外,在应答者中SIGLEC9+SEPP1+和SIGLEC9+MARCO+TAMs中SIGLEC9表达明显减少,这表明其具有抑制功能(图3b)。差异基因表达(DGE)分析显示,与ICB治疗应答者相比,非应答者的SIGLEC9+SEPP1+和SIGLEC9+MARCO+TAMs表达更高的C1QA、C1QB、CD14和SPP1(图3c,d)。在应答者中,炎症因子如APOE、IL1B、STAT1,T细胞趋化因子CCL3、CCL4和与IFN-γ相关的ISG15均上调(图3c,d)。值得注意的是,SIGLEC9+TAMs 在应答者中显示出更好的T细胞趋化性,这表明它们可以增强ICB治疗的阳性反应(图3e)。SIGLEC9+TAMs显示出与新辅助抗PD-1治疗的GBM数据集中髓样细胞-C6亚群的相似性,均表达免疫抑制基因,如GPNMB、CSTB和MRC1(图3f-h)。在人类复发性GBM数据集中,SIGLEC9+SEPP1+TAM与表达吞噬/脂质和抗炎基因的TAM亚群一致,而SIGLEC9+MARCO+TAM与缺氧性TAM相似(图3i)。SIGLEC9+TAMs与其他数据集的相似性表明这些细胞类型的免疫抑制功能。
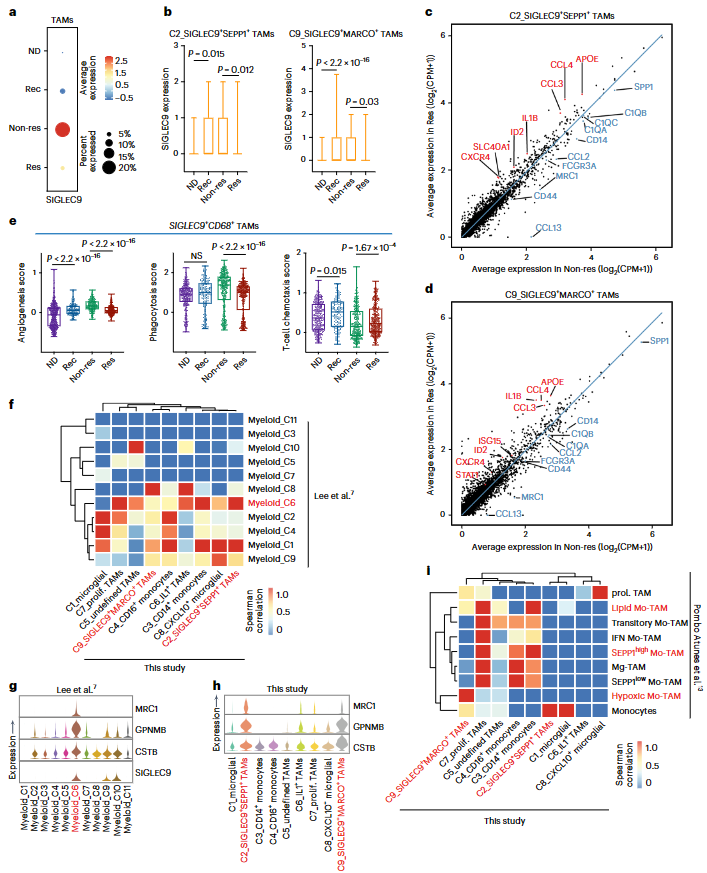
图3. 新辅助抗PD-1治疗后SIGLEC9+巨噬细胞持续存在
6. SIGLEC9+TAMs与不良临床结局相关
评估大型临床队列中的SIGLEC9基因表达,发现癌症基因组图谱(TCGA)GBM队列中,SIGLEC9 的表达与OS呈负相关(图 4a)。以scRNA-seq为参照,对TCGA数据进行CIBERSORTx反卷积分析,发现在同一队列中,SIGLEC9+TAM 的比例与OS呈负相关(图4b)。通过免疫组化(IHC)方法评估Siglec-9,该方法使用的组织芯片来自一个大型 GBM 队列,在该队列中,高水平的 Siglec-9 与OS呈负相关(图4c)。
7. Siglece基因缺失增强小鼠的抗肿瘤活性
Siglece是人类 SIGLEC9的小鼠功能同源物,使用野生型(WT)和 Siglece 基因敲除(Siglece-/-)小鼠进行反向翻译研究。首先在蛋白质水平上评估C57/BL6 小鼠的 Siglec-E(图4d)。在脾脏和淋巴结中,WT小鼠的巨噬细胞、中性粒细胞和单核细胞中高表达Siglec-E,树突状细胞(DC)中表达较少,T细胞、B细胞或自然杀伤(NK)细胞上几乎没有表达,而Siglece-/-小鼠在所有这些免疫细胞上都没有表达Siglec-E(图4e,f)。Siglec-E在肿瘤浸润白细胞中的表达与接种CT2A胶质瘤细胞的小鼠同系肿瘤中的脾和淋巴结中的表达相似(图4g)。Siglece的缺失明显阻碍了内脏肿瘤的生长(图4h),从而延长小鼠的存活时间(图4i)。鉴于Siglec-E在其他髓系细胞上也有表达(图 4d-g),使用CSF1R单克隆抗体阻断导致巨噬细胞的大量消减和 TAM在肿瘤中的浸润,发现巨噬细胞的耗竭完全消除Siglece基因缺陷小鼠的肿瘤生长抑制(图4j)。将骨髓衍生巨噬细胞(BMDMs)转移到肿瘤小鼠体内,评估肿瘤生长和小鼠存活率。发现移植的Siglece-/- BMDMs阻碍WT 肿瘤小鼠的肿瘤生长,并延长小鼠的存活时间,复制Siglece-/-小鼠肿瘤生长受阻和存活时间延长的现象(图4k、l)。相反,与WT BMDCs相比,被转移的Siglece-/-骨髓源性DCs(BMDCs)对肿瘤生长没有不同的影响(图4m,n)。这些结果表明,在小鼠GBM模型中,表达Siglece的巨噬细胞是介导肿瘤根除的主要细胞群。
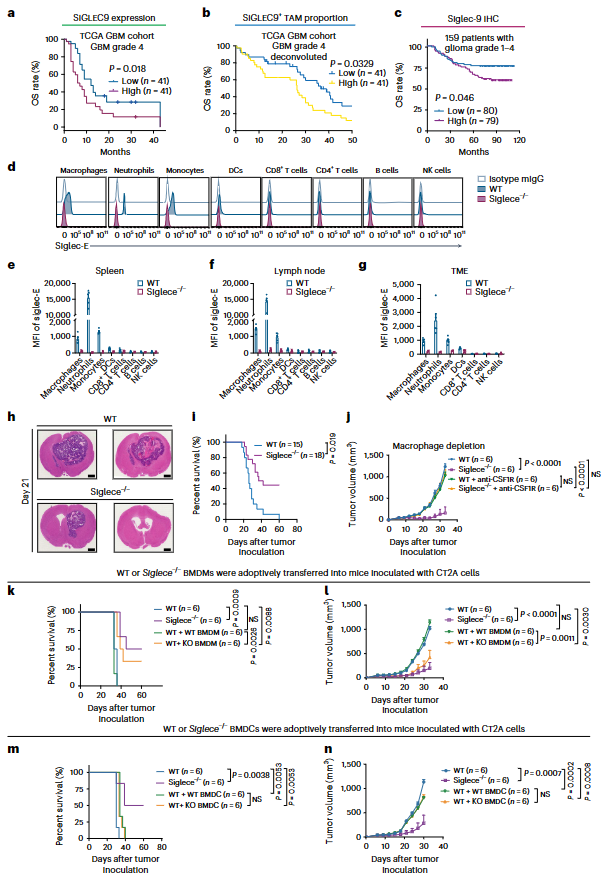
图4. SIGLEC9+巨噬细胞与不良临床结局有关,Siglece基因缺失阻碍小鼠GBM模型肿瘤的生长
8. Siglece基因缺失激活巨噬细胞和T细胞
利用scRNA-seq分析评估Siglece-/-小鼠的颅内肿瘤微环境(图5a)。观察到 Siglece-/-小鼠肿瘤中的免疫细胞,包括巨噬细胞、T细胞、NK细胞和DCs大量增加(图5b)。巨噬细胞增加参与抗肿瘤反应的基因的表达,包括趋化因子,如 Ccl3、Ccl4、Ccl5、Ccl7、Ccl8、Ccl9、Cxcl9和Cxcl10,它们能招募和激活细胞溶解性T细胞,以及IFN-γ刺激基因,如Isg15(图5c,d)。与WT肿瘤相比,体内Siglece-/-肿瘤中T细胞表达更高水平的Il2、Il17a和Ifng(图5d)。流式细胞荧光分选技术(FACS)分析显示,与 WT 相比,Siglece 基因缺失后,CD45+细胞、骨髓细胞(CD11b+、F4/80+、Ly6C+和DCs)和淋巴细胞(CD4+T、CD8+T 和NK细胞)的浸润明显增加(图5e),这与scRNA-seq分析结果一致。皮下肿瘤的实时PCR分析也验证了这些结果(图5f)。接下来,分析了瘤内巨噬细胞,发现Siglece-/-巨噬细胞中CD80和MHC-II等活化标记物的表达增加(图5g)。与WT BMDMs相比,将Siglece-/- BMDMs与CT2A细胞共培养显著增加趋化因子的表达,包括Ccl4、Ccl8和Cxcl9(图5h)。当与CT2A细胞共培养时,BMDMs中Siglece的缺失显著增加Il4和Il10的表达(图5i)。虽然Siglece缺失增加Pd-l1的表达,但与WT BMDMs共培养后,Pd-l1的表达仍与WT BMDMs 相似(图5i)。Siglece-/- BMDMs分别显著增加来OT-II或OT-I转基因小鼠的CD4+和CD8+T细胞的增殖比例(图5j,k)。来自Siglece基因缺失小鼠的肿瘤浸润淋巴细胞(TILs)也显示出CD107a、IFN-γ和Ki67等活化标志物的表达增加(图 5l)。此外,在WT小鼠皮下肿瘤生长过程中,发现巨噬细胞上Siglec-E的表达增加,而DC上的表达却没有增加(图5m)。这一结果进一步支持了负反馈环的存在,在负反馈环中,Siglece可防止免疫系统的过度反应,并作为巨噬细胞的免疫检查点。
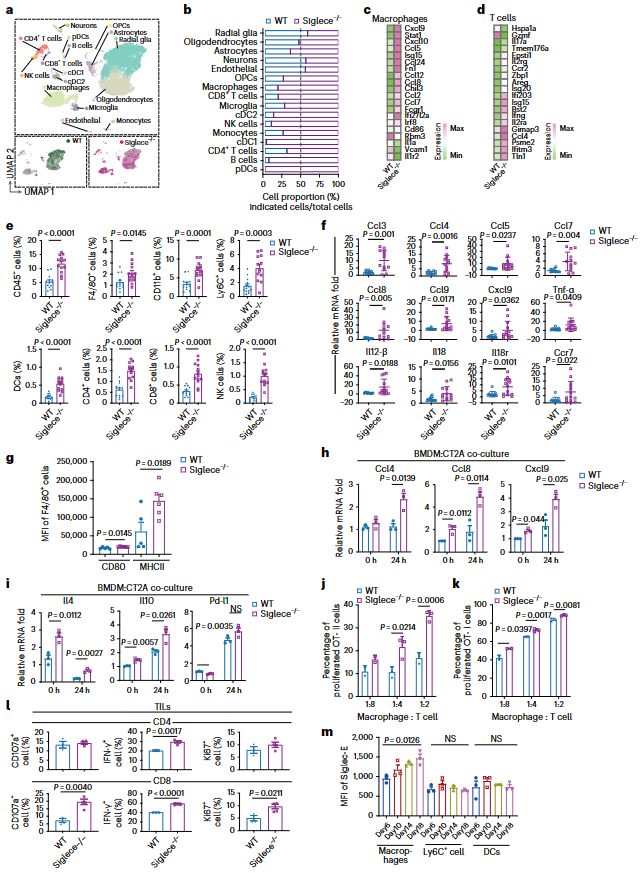
图5. Siglece基因缺失导致免疫细胞浸润、巨噬细胞和T细胞活化增强。
9. Siglece-/-与T细胞合作抑制肿瘤生长
使用抗体特异性地清除WT小鼠和Siglece-/-小鼠皮下肿瘤中的CD4+或CD8+T细胞。Siglece-/-小鼠中消耗CD4+T细胞明显降低肿瘤生长抑制作用,导致肿瘤生长率与WT小鼠相似(图6a)。在Siglece-/-或WT小鼠中消耗CD8+T细胞导致Siglece缺失型小鼠无法抑制肿瘤生长,而与WT小鼠相比加速肿瘤生长,这表明Siglec-E可能以CD8+T细胞细胞毒性依赖的方式介导肿瘤排斥反应(图6b)。这些结果表明,靶向Siglece减轻Siglece+TAMs的免疫抑制属性,而这种属性是由CD4+T细胞和CD8+T细胞介导的。
10. SIGLEC9+TAMs直接与GBM中的T细胞相互作用
将WT或Siglece-/-BMDMs共同培养并评估T细胞迁移(图6c)。与WT BMDMs相比,Siglece-/- BMDMs显著增强CD4+T细胞和CD8+T细胞的迁移(图6d)。这些结果表明,SIGLEC9+/Siglece+巨噬细胞直接招募T细胞。对ST 数据中CD68+SIGLEC9+细胞与T细胞特征的共定位分析表明,应答者样本中的 TH1和共刺激特征有所增加(图6e、f)。多重IHC显示,与非应答者样本相比,应答者样本中CD68+Siglec-9+细胞与CD8+PD-1+T细胞的空间距离更近(图6g,h)。scRNA-seq数据显示,SIGLEC9+TAMs通过各种基因对与T细胞广泛相互作用,如CCL4-CCR5、CCL3-CCR5、SPP1-CD44、SPP1-CC8、CD40-CD40LG和4-1BBL-4-1BB(图6j)。在小鼠GBM中也发现了这些相互作用,而且Siglece 缺失会增强这些相互作用,支持它们是Siglec-9/Siglec-E依赖性相互作用的观点(图6k)。

图6. 靶向Siglece+巨噬细胞与T细胞合作抑制肿瘤生长,且Siglece+/SIGLEC9+巨噬细胞与T细胞在空间上相关
11. Siglece基因缺失提高抗PD-1/PD-L1疗法的疗效
WT或Siglece -/-小鼠颅内接种CT2A胶质瘤细胞,用抗PD-1或抗PD-L1抗体治疗(图7a)。与不进行治疗、单独进行Siglece基因缺失和单独进行PD-1/PD-L1阻断治疗相比,Siglece基因缺失与抗PD-1或抗PD-L1抗体相结合可显著延长生存期(图7b,c)。用由Siglec-E细胞外结构域与小鼠IgG2a Fc结构域融合而成的重组蛋白(Siglec-E-Fc)治疗颅内肿瘤小鼠,与IgG治疗相比,小鼠存活时间延长(图7d,e)。Siglec-E-Fc可与肿瘤细胞膜上的唾液酸化蛋白或游离的唾液酸化蛋白结合,从而与巨噬细胞上的内源性Siglec-E竞争,阻断Siglec-E信号传导(图7f)。

图7. Siglece缺失增强ICB疗法的疗效,Siglece是治疗GBM的潜在治疗靶点
结论
综上所述,本研究发现Siglec-9是一种新颖的巨噬细胞免疫检查点分子,可以作为靶点提高抗PD-1/PD-L1治疗GBM的疗效,为GBM的治疗提供了新的思路。
实验方法
小鼠GBM模型构建,ICB处理,治疗性Siglec-E-Fc竞争实验,流式细胞术,胞内细胞因子染色,细胞培养,Transwell,RT-qPCR,人体组织芯片免疫染色和分析,多重免疫荧光,scRNA-seq文库构建,差异基因表达(DGE)分析,基因本体(GO)分析,单细胞熵值分析,单细胞轨迹构建,细胞互作评估,拷贝数变异(CNV)检测,细胞亚群的组织富集,空间转录组文库制备,bulk RNA-seq
参考文献
Mei Y, Wang X, Zhang J, Liu D, He J, Huang C, Liao J, Wang Y, Feng Y, Li H, Liu X, Chen L, Yi W, Chen X, Bai HM, Wang X, Li Y, Wang L, Liang Z, Ren X, Qiu L, Hui Y, Zhang Q, Leng Q, Chen J, Jia G. Siglec-9 acts as an immune-checkpoint molecule on macrophages in glioblastoma, restricting T-cell priming and immunotherapy response. Nat Cancer. 2023 Jul 17. doi: 10.1038/s43018-023-00598-9. Epub ahead of print. PMID: 37460871.






