Kremen2通过阻止SOCS3介导的EGFR降解来驱动非小细胞肺癌的进展

肺癌是一种常见的恶性肿瘤,是全球癌症相关死亡率的主要原因。非小细胞肺癌(NSCLC)约占肺癌的85%。NSCLC患者临床预后较差,总体5年生存率为15%。靶向治疗的出现使NSCLC的治疗取得了显著进展,然而患者不可避免地会出现耐药。因此,需要基于生物标志物的新靶点。Kremen2是一种由473个氨基酸组成的单跨膜结构域蛋白,是经典Wnt信号通路的重要调节因子。有研究报道,根据癌症基因组图谱(TCGA)分析,在来自18种不同癌症类型的70%以上组织样本中,肿瘤组织中的Kremen2表达水平显著高于配对的正常组织,尤其是在Kremen2表达水平比高10倍以上的鳞状肺癌中。然而,其在NSCLC中的生物学功能和临床意义尚不明确。表皮生长因子受体(EGFR)是一种受体酪氨酸激酶,是目前公认的治疗NSCLC的有效靶点。EGFR的异常活化被认为是恶性转化和肿瘤转移的主要原因。多种机制可诱导EGFR的致癌激活,如基因突变、转录过表达和EGFR降解缺陷。多项研究表明,EGFR的稳定性是调节肺癌进展的重要决定因素,EGFR降解失调加速了肿瘤的发生和进展。SOCS蛋白家族是众所周知的细胞因子受体信号转导的负调控因子。SOCS3是SOCS蛋白家族的成员,通过抑制JAK/STAT信号通路发挥肿瘤抑制作用。敲除SOCS3会破坏E3连接酶复合物的形成,并驱动整合素β1介导的小细胞肺癌转移。在之前的研究中,SOCS3主要是基于其甲基化沉默导致功能丧失而在NSCLC中进行评估。该研究发表在《Journal of Experimental & Clinical Cancer Research》,IF:11.3。
技术路线

主要研究结果
1. Kremen2在非小细胞肺癌中表达上调,并与不良预后相关
为了寻找新的与NSCLC相关的致癌基因,作者在TCGA数据库中检索了504例有病理信息的肺腺癌样本,并筛选出57对配对的非癌和癌样本。进一步分析这些配对患者样本的RNA-seq结果,并使用一般线性模型(P<0.05)筛选差异表达基因(DEGs)(图1A)。分析显示,Kremen2的表达存在显著差异,这在肺癌中尚未被研究过。此外,比较每对TCGA样本的原始Kremen2 RNA-seq数据后,肿瘤组织中的Kremen2表达水平较高(图1B)。采用GEPIA软件分析Kremen2在NSCLC中的表达。结果显示,与癌旁正常肺组织相比,在NSCLC组织中,尤其是肺鳞状细胞癌组织中,Kremen2表达显著上调(图1C)。
为了评估Kremen2在NSCLC临床标本中的表达,作者检测了新鲜冷冻的NSCLC标本及其配对的正常组织中Kremen2 mRNA的水平。结果显示,与正常组织相比,NSCLC组织中Kremen2 mRNA水平显著升高(图1D)。蛋白质印迹法检测到大多数NSCLC标本中Kremen2蛋白水平升高(图1E)。免疫组织化学染色进一步显示,肿瘤组织中Kremen2高表达(图1F)。此外,作者检测了一些NSCLC细胞系中的Kremen2蛋白水平,发现在NSCLC细胞中Kremen2蛋白表达普遍较高(图1G)。
为了阐明Kremen2过表达与NSCLC患者生存的相关性,作者使用Kaplan-Meier plotter数据库分析NSCLC病例。结果如图1H和I所示,表明高Kremen2表达水平的NSCLC患者与较差的总生存期(OS)相关,如较低的OS和首次进展生存期(P<0.05)。卡方检验显示,Kremen2表达上调与原发肿瘤(T)分期(P=0.041)和病理分级(P=0.045)相关。综上所述,这些数据表明,Kremen2在NSCLC中过表达,并且Kremen2过表达可能与患者的不良预后相关。
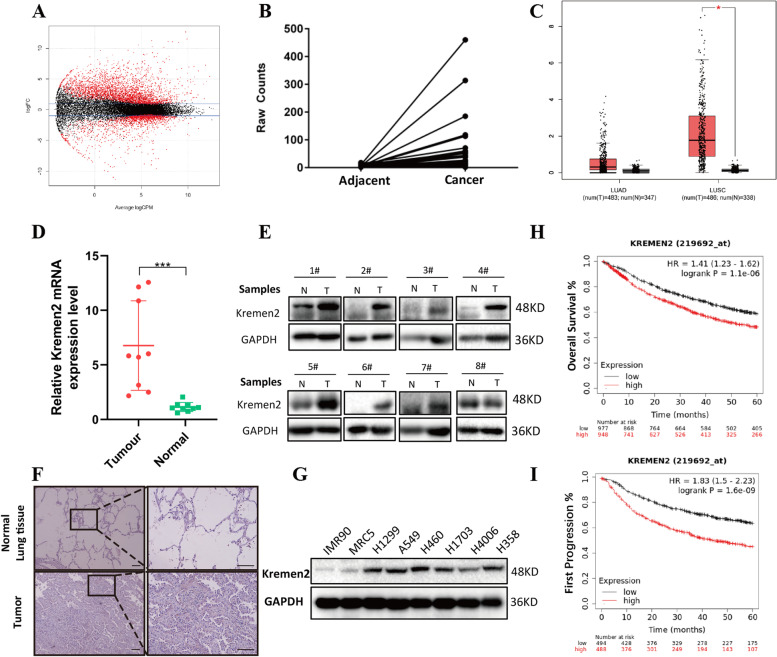
图1 Kremen2在非小细胞肺癌中表达上调,并与不良预后相关
2. 沉默NSCLC细胞中Kremen2表达可抑制细胞增殖
为了研究Kremen2在NSCLC中的生物学功能,作者利用CRISPR/Cas9方法产生敲除Kremen2的A549细胞(A549-krm2ko),其中插入胸腺嘧啶残基导致移码突变。通过克隆形成实验和EdU掺入实验检测Kremen2对A549和A549-krm2ko细胞增殖的影响。A549-Krm2KO细胞的克隆形成能力低于野生型细胞(图2A),EdU阳性细胞显著减少,表明细胞增殖能力下降,而在A549-Krm2KO细胞中过表达外源性Flag-Kremen2(Flag-Krm2)时,edu阳性细胞比例增加(图2B),证实了Kremen2对细胞增殖的影响。此外,作者利用慢病毒介导的shRNA沉默内源性Kremen2表达,建立了稳定沉默Kremen2的NSCLC细胞株。同样,A549和H1703细胞(shKrm2)中的Kremen2敲低抑制了集落形成和细胞增殖能力(图2D-F)。通过皮下注射稳定敲低Kremen2的A549细胞建立裸鼠移植瘤模型,验证这些体外发现是否与体内肿瘤生长相关。在A549异种移植模型中获得了一致的结果,敲低Kremen2的表达显著抑制了肿瘤的大小和重量(图2G-I)。IHC染色显示,由于A549细胞的Kremen2敲低,A549种植小鼠组织中的ki67阳性细胞百分比较低(图2J)。综上所述,这些数据表明,Kremen2在NSCLC细胞生长中发挥重要作用。

图2 沉默NSCLC细胞中内源性Kremen2表达可抑制细胞增殖
3. Kremen2高表达促进NSCLC细胞转移
临床资料显示,Kremen2的表达与LUAD患者病理分级呈正相关,提示Kremen2可能参与了肿瘤的转移。为了解决这一问题,作者检测了体内外Kremen2对肿瘤细胞转移能力的影响。Transwell实验结果显示,在A549细胞中,敲除Kremen2可减弱细胞的侵袭能力,而在A549-krm2ko细胞中过表达Flag-Krm2可增强细胞的侵袭能力(图3A)。同样,通过shRNA下调Kremen2表达后,H1703和A549细胞的侵袭数量减少(图3B,C)。此外,来自伤口愈合实验的数据表明,敲低Kremen2降低了细胞迁移(图3D-G)。通过实时荧光定量PCR检测沉默Kremen2后NSCLC细胞中上皮-间充质转化(EMT)标志物的变化,探讨其对NSCLC细胞EMT的抑制作用。Kremen2敲低和低pro-EMT Snail1和Twist1水平之间存在明显的正相关。为了进一步了解Kremen2在体内是否促进肿瘤转移,作者对A549-Krm2KO细胞和A549-Krm2KO + OE-Krm2细胞(A549-Krm2KO细胞过表达Kremen2)进行了尾静脉转移实验。结果显示,删除Kremen2减少了肺转移结节的数量,而过表达Kremen2显著增加了肺转移结节的数量(图3H-J)。为了更好地观察肺内转移结节的形成,作者在A549细胞中构建了共表达GFP的shCtrl和shKrm2细胞,观察细胞的荧光强度(图3K和L)。将两种表达GFP的细胞注射到裸鼠尾静脉。HE染色和荧光信号结果显示,在A549细胞中下调Kremen2与对照组相比,肺转移结节数量减少(图3M-O)。综上所述,这些发现表明,Kremen2是NSCLC转移的促进因子。
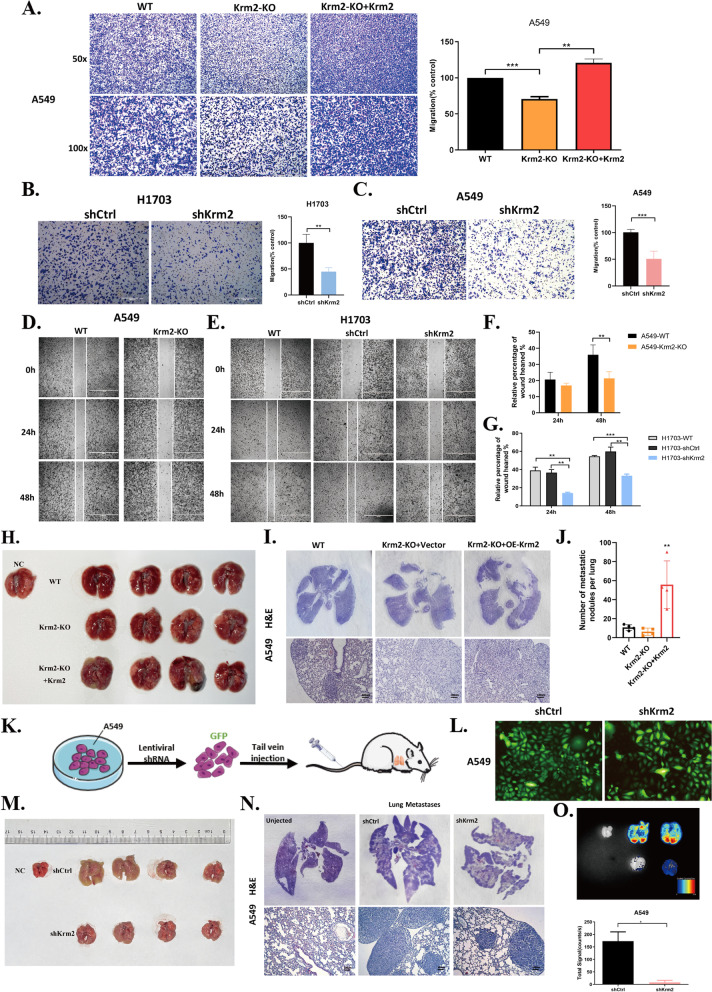
图3 体内外实验显示,Kremen2促进NSCLC细胞转移
4. Kremen2参与多种癌症相关信号通路
为了阐明Kremen2促进肺癌发生的机制,采用RNA-seq比较H1703细胞中对照组和Kremen2敲低(shKrm2)组的转录组变化。根据表达的倍数变化(≥1或≤-1),shKrm2组中共鉴定出273个上调基因和281个下调基因。对上调和下调基因进行层次聚类分析(图4A)。GO分析表明,DEGs与细胞增殖、发育、运动和迁移密切相关(图4B)。KEGG富集分析表明,这些DEGs富集在与癌症相关的信号通路,如MAPK、Wnt和PI3K-AKT信号通路(图4C)。由于之前的Kremen2研究多集中在Wnt信号通路,作者首先检测到了Wnt信号通路中关键蛋白表达的变化。蛋白质印迹结果显示,敲低Kremen2并没有显著影响β-catenin蛋白水平,但增加了H1703细胞中LRP6的总蛋白和磷酸化水平(图4D),可能是由于LRP6的内吞降解减少。此外,在H1703细胞中敲低Kremen2后,PI3K(Y607)和AKT(Ser473)的磷酸化水平显著下调(图4E),这与在胃癌中对Kremen2的研究结果一致。
由于STAT3信号通路的激活已经在相当比例的NSCLC病例中被报道,作者也测试了Kremen2是否调节STAT3信号通路。蛋白质印迹结果显示磷酸化JAK2(Y1007和Y1008)和STAT3(Y705)水平下调,而总JAK2和STAT3水平无变化。与此同时,STAT3通路中负责调节细胞增殖的下游因子c-Myc和Cyclin D1蛋白水平也显著降低(图4F和G)。相反,过表达Kremen2增强了p-JAK2、p-STAT3、c-Myc和Cyclin D1蛋白水平(图4H),表明Kremen2影响了JAK2-STAT3信号通路。

图4 抑制Kremen2参与多种癌症相关信号通路
5. Kremen2通过稳定EGFR促进NSCLC细胞增殖
考虑到EGFR是JAK2-STAT3和PI3K-AKT信号通路的上游共同激活因子,在NSCLC的进展中发挥重要作用,作者将从shKrm2 H1703细胞中筛选的DEGs输入FunRich软件进行功能分析。结果显示大多数基因聚集在EGFR相关通路上。然后,作者检测了Kremen2是否影响EGFR蛋白水平。蛋白质印迹结果表明,siRNA介导沉默Kremen2可下调A549和H1703细胞中的EGFR蛋白水平(图5A)。在Kremen2稳定敲低的细胞中,EGFR蛋白水平也降低,而过表达Kremen2增加了EGFR蛋白水平(图5B)。作者在A549-Krm2KO细胞中获得了类似的结果。将Flag-tagged Kremen2重新引入A549-Krm2KO细胞中可恢复EGFR蛋白水平(图5C)。如图5D所示,蛋白酶体抑制剂MG132逆转了Kremen2敲除细胞中EGFR蛋白水平的下降,表明Kremen2可能通过蛋白酶体降解来调节EGFR蛋白水平。作者进一步研究了敲低Kremen2是否影响EGF刺激后EGFR的磷酸化。结果显示,沉默Kremen2降低了A549和H1703细胞中EGF诱导的EGFR、STAT3和AKT的磷酸化(图5E)。为了评估Kremen2是否通过调节EGFR促进细胞增殖,作者在过表达Kremen2的A549细胞中去除内源性EGFR,观察到抑制内源性EGFR的表达减弱了Kremen2诱导的细胞增殖(图5F)。相反,在Kremen2敲低的A549细胞中过表达EGFR表明外源性EGFR表达促进了Kremen2敲低细胞的增殖(图5H)。综上所述,这些数据表明,在NSCLC中,Kremen2的高表达水平可能通过维持EGFR的稳定性促进肿瘤进展。
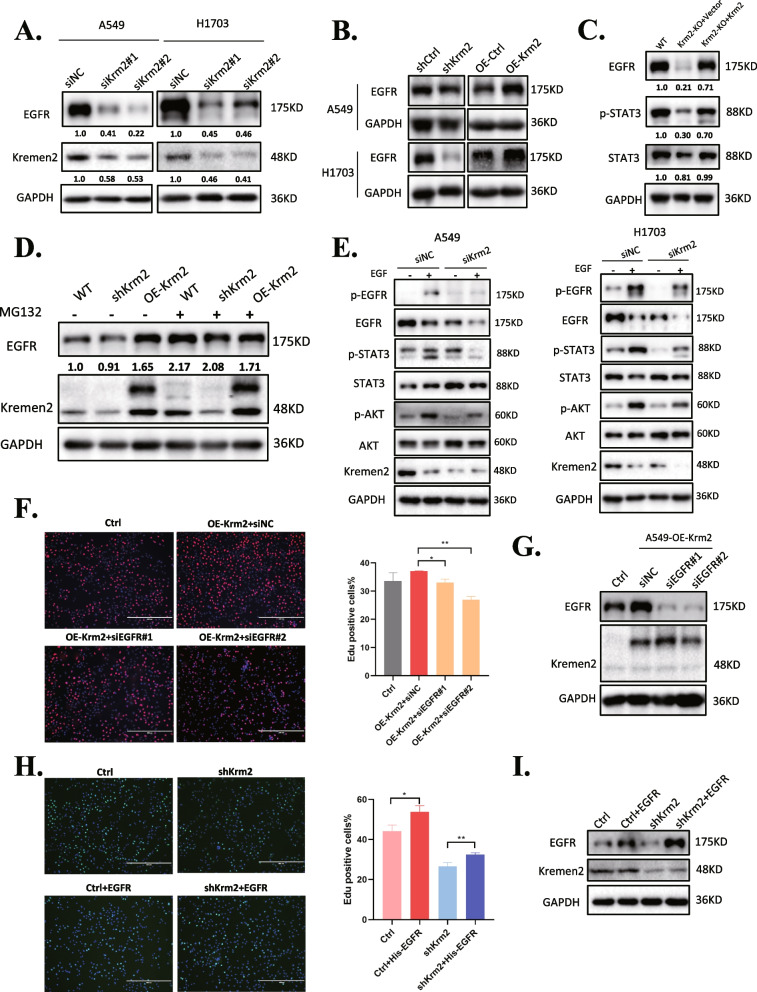
图5 Kremen2通过促进EGFR的稳定促进NSCLC细胞增殖
6. Kremen2和SOCS3的相互作用可抑制EGFR的泛素化和降解
为了了解Kremen2是如何调控EGFR的,作者使用co-IP来下调参与EGFR信号通路的Kremen2相互作用蛋白。令人惊讶的是,Kremen2不与EGFR、AKT或STAT3蛋白相互作用,但与STAT3信号通路的负调控因子SOCS3强相关(图6A)。此外,在A549细胞(图6B)中观察到内源性Kremen2和SOCS3共定位。在变性条件下纯化外源性SOCS3,然后对Kremen2进行免疫印迹分析,证实了Kremen2和SOCS3之间的相互作用(图6C)。接下来,作者分别在A549和A549-oe-krm2细胞中过表达SOCS3,以探索SOCS3在Kremen2和EGFR之间关系中的作用。如图6D所示,过表达外源性SOCS3降低了A549细胞中EGFR蛋白水平和STAT3的磷酸化水平,而稳定过表达Kremen2部分逆转了这一现象(图6D)。
此外,SOCS3过表达细胞中EGFR水平的下降被蛋白酶体抑制剂MG132逆转,表明SOCS3通过蛋白酶体降解调节EGFR水平(图6E)。为了进一步研究SOCS3是如何调控EGFR的,作者用cicloheximide处理细胞并检测EGFR的半衰期。结果表明,过表达SOCS3可缩短EGFR蛋白的半衰期(图6F)。接下来,作者对内源性蛋白进行了相互共IP。正如预期的那样,内源性SOCS3与EGFR相互作用(图6G),而内源性EGFR与SOCS3结合(图6H)。这些结果表明SOCS3可以与EGFR结合并促进细胞中EGFR的降解。
据报道,SOCS3可促进TBK1和整合素β1的泛素化和降解;因此,作者接下来研究了SOCS3对EGFR泛素化的影响。结果,与对照组相比,在A549细胞中过表达SOCS3增加了EGFR的多泛素化(图6I)。为了进一步研究Kremen2是否影响SOCS3介导的EGFR泛素化,作者进行了体外泛素化实验。在HEK293T细胞中,Flag-SOCS3和His-EGFR共表达,在变性条件下纯化His-EGFR,随后对EGFR进行免疫印迹分析,证明在SOCS3过表达细胞中外源性EGFR泛素化增加,而Kremen2过表达导致SOCS3对EGFR的多泛素化减少(图6J)。
综上所述,这些数据表明,Kremen2与SOCS3相互作用,并通过阻止SOCS3介导的EGFR泛素化和降解来稳定EGFR蛋白;从而增强EGFR信号通路的活化,促进NSCLC细胞的增殖和转移。

图6 Kremen2与SOCS3的相互作用抑制EGFR的泛素化和降解
结论
该研究证明了Kremen2在NSCLC肿瘤发生中的新作用。机制上,Kremen2可能通过与SOCS3相互作用,阻断泛素依赖的EGFR降解,从而维持EGFR介导的肿瘤信号通路,促进NSCLC细胞的增殖和转移。因此,Kremen2可能成为NSCLC新的治疗靶点。
机制图

实验方法
免疫组织化学(IHC),菌落形成和EdU测定,流式细胞术,Transwell和伤口愈合测定,定量实时聚合酶链反应(qRT-PCR),蛋白质印迹,免疫沉淀,免疫荧光,动物实验
参考文献
Sun Y, Gao Y, Dong M, Li J, Li X, He N, et al. Kremen2 drives the progression of non-small cell lung cancer by preventing SOCS3-mediated degradation of EGFR. J Exp Clin Cancer Res. 2023 Jun 3;42(1):140.






