不容错过的一区文章的架构模式--阿尔茨海默病的神经病理
Amyloid-b(Ab)在阿尔兹海默症(AD)中发挥着重要的作用,但一些促进Ab生成和Ab寡聚物(Abo)神经毒性的因素尚不清楚。作者发现,在AD患者和淀粉样前体蛋白(APP)/早衰蛋白-l(PS1)小鼠中,Ras同源GTP酶激活蛋白ArhGAP11A基因的水平显著升高。降低神经元ArhGAP11A基因水平,不仅通过RhoA/ROCK/Erk信号通路降低APP、PS1、b-分泌酶(BACE1)的表达,抑制Ab生成,而且通过降低凋亡相关p53靶基因的表达,减轻Abo的神经毒性。在APP/PS1小鼠中,特异性降低神经元中的ArhGAP11A基因水平显著减少Ab产生和斑块沉积,改善神经元损伤、神经炎症和认知缺陷。此外,Abos通过激活E2F1增强ArhGAP11A基因在神经元中的表达,进而形成一个有害的循环。作者的研究结果表明ArhGAP11A基因可能参与AD的发病机制,降低ArhGAP11A基因的表达可能是一种很有前途的AD治疗策略。本研究于2023年6月发表于期刊《Cell Reports》,IF:8.8。
技术路线

主要研究结果
1、ArhGAP11A水平在AD患者和APP/PS1小鼠中显著升高
为探讨AD发展过程中可能存在的危险因素,作者通过AD患者和健康老年人海马的数据集(GEO数据库)分析ArhGAP11A表达的变化。与健康年长患者相比,AD患者海马体中ArhGAP11A mRNA水平显著上升(图1A)。为进一步证实AD患者中ArhGAP11A表达的变化,作者测量了轻度认知障碍(MCI)患者、AD患者和健康老年人血浆中的ArhGAP11A蛋白水平,健康组作为对照。MCI患者血浆中ArhGAP11A水平显著高于对照组,并随着AD的发展而显著升高(图1B)。与之一致的是,5月龄APP/PS1小鼠小鼠脑内ArhGAP11A基因水平也显著升高,早于小鼠的认知缺陷,随后ArhGAP11A基因水平随着年龄的增长而显著升高,而野生型(wild-type, WT)小鼠ArhGAP11A基因水平在测试周期内无明显变化(图1C-D)。免疫组织化学(IHC)结果进一步显示,APP/PS1小鼠皮层神经元和小胶质细胞中ArhGAP11A基因水平持续高于5月龄WT小鼠,并随着年龄持续升高(图1E-F),而小鼠星形胶质细胞中ArhGAP11A基因水平过低,无法通过IHC检测。
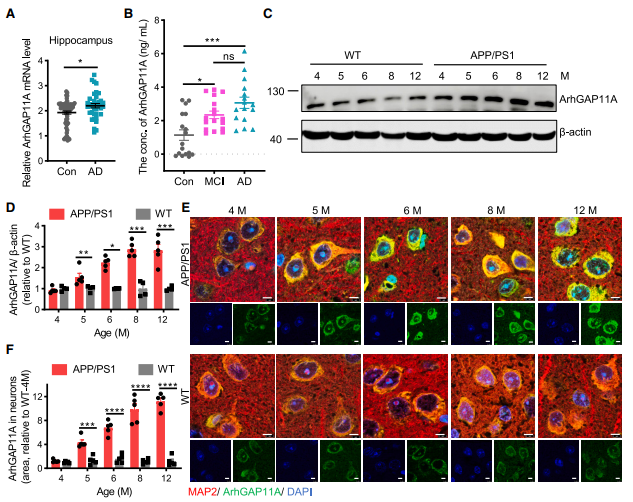
图1 ArhGAP11A水平在AD患者和APP/PS1小鼠中显著升高
2、ArhGAP11A基因影响APP、PS1、BACE1表达及Ab生成
为探究ArhGAP11A基因对APP加工和Ab产生的影响,培养原代皮层神经元,用携带ArhGAP11A基因short hairpin RNA(shRNA;sh-ArhGAP11A基因)或ArhGAP11A基因(LV-ArhGAP11A)的慢病毒感染原代皮层神经元(图2A)。在神经元中下调ArhGAP11A基因的表达,APP、PS1和BACE1的水平分别显著降低至48.2%、49.4%和32.7%(图2A-B),在感染sh-ArhGAP11A基因的原代皮层神经元中免疫细胞化学(ICC)实验进一步验证了这一点(图2C-2G)。与此一致,ArhGAP11A基因敲低使原代皮层神经元中Ab42和Ab40的水平分别下降至49.9%和46.3%(图2H)。
为确定ArhGAP11A基因下调引起的Ab减少是由于APP、PS1和BACE1的合成减少还是降解增加,在原代皮层神经元中加入CHX抑制蛋白合成,然后分析APP、PS1和BACE1蛋白水平。ArhGAP11A基因敲低不影响APP、PS1和BACE1的降解,但显著降低原代皮层神经元中APP、PS1和BACE1的mRNA水平(图2I)。这些结果表明ArhGAP11A基因在转录水平上介导了APP、PS1和BACE1的表达,但不影响蛋白的降解。

图2 ArhGAP11A下调通过降低神经元中APP、PS1和BACE1的表达来减少Ab的产生
3、ArhGAP11A通过RhoA/ROCK/Erk信号通路介导APP、PS1和BACE1转录
为揭示ArhGAP11A基因介导APP、PS1和BACE1转录的潜在机制,作者首先检测了ArhGAP11A基因对Rho-GTP成员RhoA-GTP、Rac1-GTP和Cdc42-GTP水平的影响。pull-down实验结果表明,在N2a细胞和原代皮层神经元中,敲低ArhGAP11A基因显著诱导RhoA-GTP水平增加1.5-2倍,而不是Rac1-GTP或Cdc42-GTP水平增加1.5-2倍(图3A-B),表明ArhGAP11A基因是RhoA的特异性GAP。
然后,作者检测了ArhGAP11A基因是否改变了APP、PS1和BACE1的转录因子SP1和c-Fos的水平。SP1是PS1和BACE1的重要转录因子,c-Fos磷酸化(p-c-Fos)与c-Jun和/或其他伴侣一起是APP的重要转录因子。ArhGAP11A基因敲低降低了p-c-Fos和SP1的水平,但没有降低c-Jun磷酸化(p-c-jun)的水平(图3C-D),而ArhGAP11A基因过表达显著增加了p-c-Fos和SP1的水平,表明ArhGAP11A基因通过调控转录因子p-c-Fos和SP1改变了APP、PS1和BACE1的表达。此外,RhoA的下游信号蛋白Rho激酶(ROCK)可以抑制ERK1/2磷酸化(p-Erk1/2)的激活,而p-Erk1/2正性调节p-c-Fos和SP1的水平。本研究观察到,感染sh-ArhGAP11A基因的原代皮层神经元中ROCK1和ROCK2水平显著升高,而感染sh-ArhGAP11A基因的原代皮层神经元中p-Erk1/2水平显著降低(图3C-D),提示ArhGAP11A基因可能通过ROCK/Erk信号通路调控转录因子p-c-Fos和SP1。在原代皮层神经元中,通过ICC实验进一步证实了ArhGAP11A基因敲低引起的p-c-Fos和SP1的减少(图3E-3G)。

图3 ArhGAP11A通过RhoA/ROCK/Erk信号通路介导APP、PS1和BACE1转录
4、下调ArhGAP11A基因通过抑制p53介导的细胞凋亡途径减轻Abo的神经毒性
Abos是最具神经毒性的聚集体,通过引起功能性神经元死亡、认知损伤和痴呆,在AD的发生和发展中起关键作用。为探究ArhGAP11A基因对Abos神经毒性的影响,作者在感染sh-ArhGAP11A基因或sh-negative control(NC)的原代皮层神经元中加入Abos。结果显示,2 mM的Abos使细胞存活率降低了50.3%,而ArhGAP11A基因敲低显著降低Abos的神经毒性,使细胞存活率升高至78.3 % 图4A)。相反,用LV-ArhGAP11A基因过表达ArhGAP11A基因,Abos的神经毒性显著增加,从41.4%增加到65.1%。此外,钙黄绿素-乙酰氧基甲基酯-碘化丙啶(AM-PI)染色检测细胞凋亡结果进一步证实,ArhGAP11A基因敲低有效逆转了Abos的神经毒性,而ArhGAP11A基因过表达显著增强Abos的神经毒性(图4B-C)。
有文献报道p53参与Abos下游信号通路,引发神经元凋亡。此外,ArhGAP11A基因可与p53相互作用,增强p53的转录功能,诱导细胞凋亡。结果显示,ArhGAP11A基因在神经元中与p53结合,且在感染sh-ArhGAP11A基因的原代皮层神经元中,ArhGAP11A基因与p53的结合显著降低(图4D)。作者随后分析p53在神经元中的分布,发现Abos诱导ArhGAP11A基因和p53水平的显著增加,而ArhGAP11A基因敲低显著降低ArhGAP11A基因和p53的水平,特别是在细胞核部分,而在细胞质部分p53的水平没有显著变化(图4E)。这些结果表明,敲低ArhGAP11A基因通过减少ArhGAP11A基因与p53的结合,降低细胞核中p53的水平,从而抵抗Abo的神经毒性。
P53作为转录因子,启动细胞核内凋亡相关蛋白的表达。作者进一步检测了p53下游信号通路中凋亡相关蛋白的水平。qPCR结果显示,Abo处理增加Bax、Puma和Noxa的mRNA水平,而ArhGAP11A基因敲低显著逆转了这些变化(图4F),表明ArhGAP11A基因敲低通过减少p53向细胞核的转移,阻止凋亡相关蛋白的异常表达,从而减少Abos的神经毒性和神经元凋亡。

图4 ARHGAP11A基因下调通过阻断p53转录活性降低Abos的神经毒性
5、Aβos通过激活E2F1增强ArhGAP11A基因的表达
为确定在AD和APP/PS1小鼠患者中ArhGAP11A基因的表达与Abos的相关性,作者用Abos处理原代皮层神经元,发现Abos显著提高ArhGAP11A基因的蛋白水平(图S7A-B)。为确定Abo诱导的ArhGAP11A基因增加是由于降解受损还是合成增强,对原代皮层神经元进行CHX实验以抑制蛋白质合成,并通过western blotting分析在不同时间点检测ArhGAP11A基因蛋白水平。结果显示,Abo处理不干扰ArhGAP11A基因降解(图S7C-D),但显著提高ArhGAP11A基因的mRNA水平(图S7E),表明Abos在转录水平上提高ArhGAP11A基因的生成。有报道显示,E2F1作为转录因子调控ArhGAP11A基因的表达,这种调控作用被Rb蛋白所阻断,并由Rb磷酸化介导。为研究Abo介导的ArhGAP11A基因表达增加是否由E2F1诱导,用Abos处理原代皮层神经元,检测Rb(p-Rb)、Rb和E2F1的磷酸化水平。Abo处理显著增加E2F1和p-Rb的水平,而不是Rb (图S7A和S7B),证明Abos通过激活转录因子E2F1增强ArhGAP11A基因的表达。
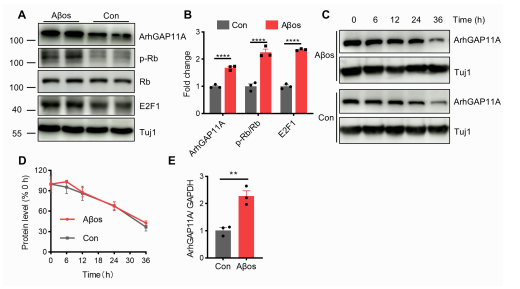
图S7 Abos通过激活E2F1增强ArhGAP11A基因的表达
6、神经元ArhGAP11A下调可减轻APP/PS1小鼠的认知缺陷
作者通过Morris水迷宫(MWM)实验检测ArhGAP11A基因敲低对APP/PS1小鼠空间学习记忆能力的影响。在训练阶段,注射shArhGAP11A基因的APP/PS1小鼠表现出空间学习能力显著改善,比shNC处理的APP/PS1小鼠潜伏期更短,而它们的运动功能在不同小鼠组之间没有显著差异(图5A)。随后,进行移除平台的探测实验以评估记忆回忆。与之一致的是,注射shArhGAP11A基因的APP/PS1小鼠的保持记忆显著提高,在目标象限停留的时间和穿越平台位置的次数比注射shNC的APP/PS1小鼠更多(图5B-D)。
随后,作者进行了Y迷宫和新奇物体识别(NOR)测试来进一步评估小鼠海马依赖的空间工作记忆和长短期识别记忆。结果表明,注射shArhGAP11A基因的APP/PS1小鼠在Y迷宫的新异臂中花费了更多的时间,进入新异臂的次数更多(图5E-F),在NOR测试中表现出了新异物体的探索次数和辨别指数的显著增加(图5G-H)。这些结果表明,神经元ArhGAP11A基因敲低显著减轻APP/PS1小鼠的认知和记忆损伤。
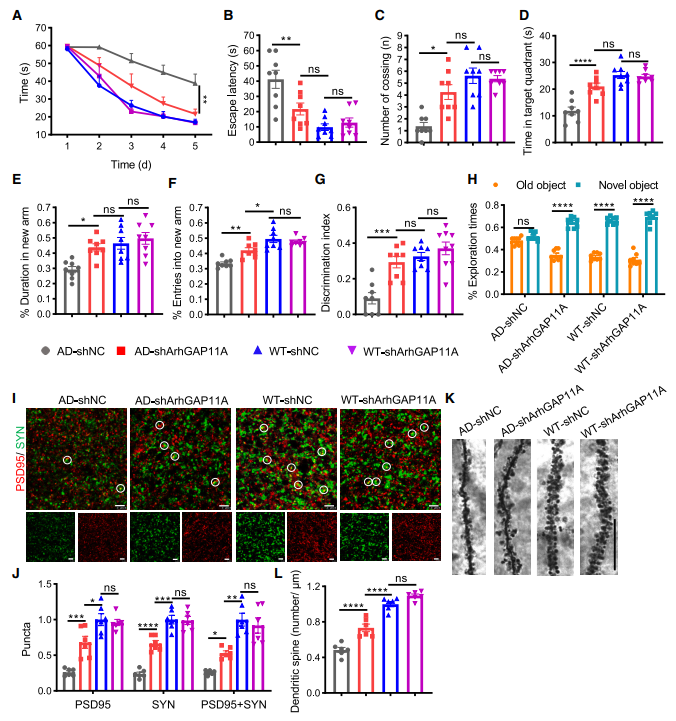
图5 神经元ArhGAP11A下调可减轻APP/PS1小鼠的记忆缺陷和神经病理
7、神经元ArhGAP11A下调可改善突触丧失和神经元损伤
为评估神经元ArhGAP11A基因对突触数量的影响,作者检测不同组小鼠脑内突触后致密物-95(PSD95)和突触素(SYN)的水平。结果显示,与shNC处理的APP/PS1小鼠相比,ArhGAP11A基因敲低小鼠的PSD95和SYN水平以及完整突触(PSD95与SYN共定位)的数量显著增强(图5I和图5J)。此外,作者进行高尔基染色以验证ArhGAP11A基因敲低对突触的改善作用。结果显示,shArhGAP11A基因处理的APP/PS1小鼠的平均树突棘密度显著增加,而shNC处理的小鼠的平均树突棘密度无显著变化(图5K-L)。
作者接下来进行Nissl染色评估神经元损伤和凋亡的变化,发现神经元ArhGAP11A基因下调显著增加了注射shArhGAP11A基因的APP/PS1小鼠海马和皮层神经元中尼氏小体的数量,表明ArhGAP11A基因敲低显著改善神经元损伤(图6A-C)。研究进一步通过TUNEL染色发现,APP/PS1小鼠的海马和皮层中存在大量的TUNEL +细胞,而shArhGAP11A基因处理显著降低TUNEL +细胞的数量(图6D-F)。这些结果表明,敲低ArhGAP11A基因显著减少APP/PS1小鼠的突触丢失和神经元损伤。此外,作者还通过IHC实验测定了小鼠神经元中p53的水平和分布,发现APP/PS1小鼠的神经元中p53的水平明显升高,尤其是在细胞核中,促进了p53的转录活性,引起了p53依赖的神经元凋亡,而shArhGAP11A基因处理显著降低了p53的水平,特别是在细胞核中,这可能解释为什么ArhGAP11A基因敲低明显减轻的神经元损伤(图6G-H)。
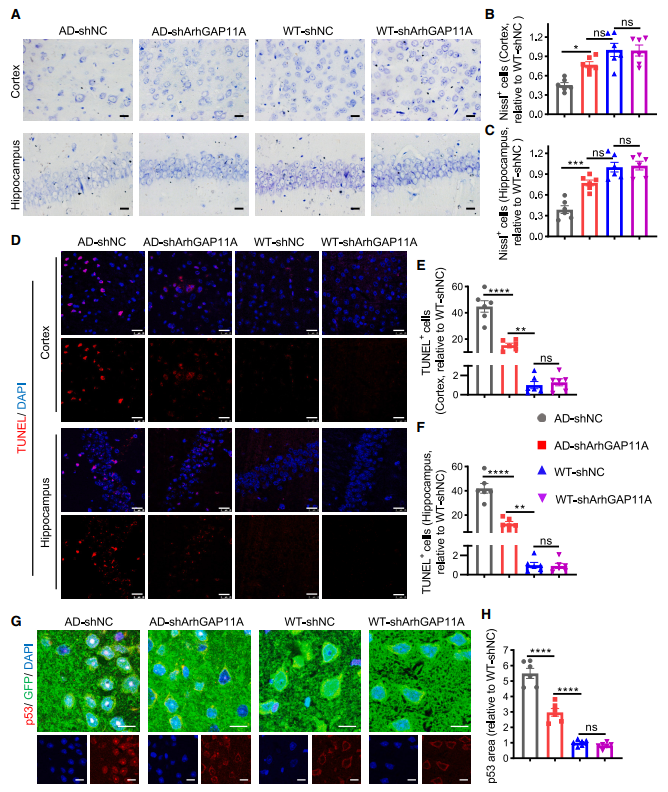
图6 神经元ArhGAP11A下调可改善APP/PS1小鼠的神经元损伤和凋亡
8、神经元ArhGAP11A下调可降低Ab负荷
接下来,作者进行IHC实验来评估ArhGAP11A基因对APP/PS1小鼠海马神经元中p-c-Fos、SP1、APP、PS1和BACE1水平的影响。结果显示,与注射sh NC的小鼠相比,在APP/PS1小鼠和WT小鼠中,ArhGAP11A基因敲低显著降低了p-c-Fos、SP1、APP、PS1和BACE1的水平(图7A-F)。此外,APP/PS1小鼠的可溶性和不可溶性海马组分中Ab42和Ab40的水平显著降低了(图7G和7H)。与此一致的是,在注射shArhGAP11A基因(图7I-7K)的APP/PS1小鼠小鼠的海马和皮层中,斑块数量明显减少。总之,这些数据表明神经元ArhGAP11A基因敲低有效地抑制了小鼠APP、PS1和BACE1的表达和Ab的生成。
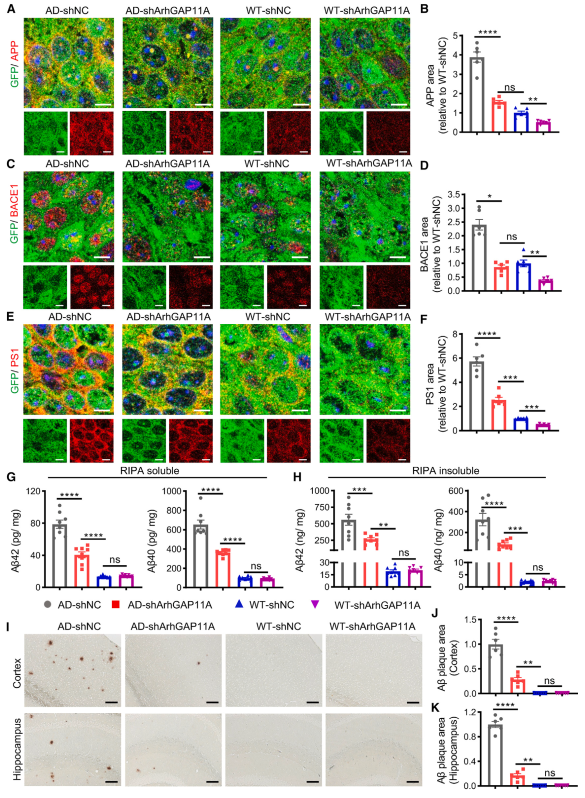
图7 ArhGAP11A下调可降低小鼠大脑中APP、BACE1、PS1和Aβ的水平
9、神经元ArhGAP11A下调可减轻神经胶质瘤和神经炎症
作者进一步评估了神经元ArhGAP11A基因敲低对APP/PS1小鼠中神经胶质增生和神经炎症的影响。IHC结果显示,与注射shNC的小鼠相比,sh ArhGAP11A基因处理显著降低APP/PS1小鼠海马和皮层中的小胶质细胞增生和星形胶质细胞增生(图S11A-S11F),并通过Western blotting分析进一步证实了这些发现(图S11G和S11H)。此外,qPCR实验还检测了活化的小胶质细胞和星形胶质细胞中细胞因子的表达。与胶质细胞增生的结果一致,shArhGAP11A基因显著降低APP/PS1小鼠脑中肿瘤坏死因子a(TNF-a)、白细胞介素-6(IL-6)和IL-1b的水平,而shNC则无此作用(图S11I-K)。这些结果表明神经元ArhGAP11A基因敲低有效地减弱APP/PS1小鼠脑中的神经炎症。
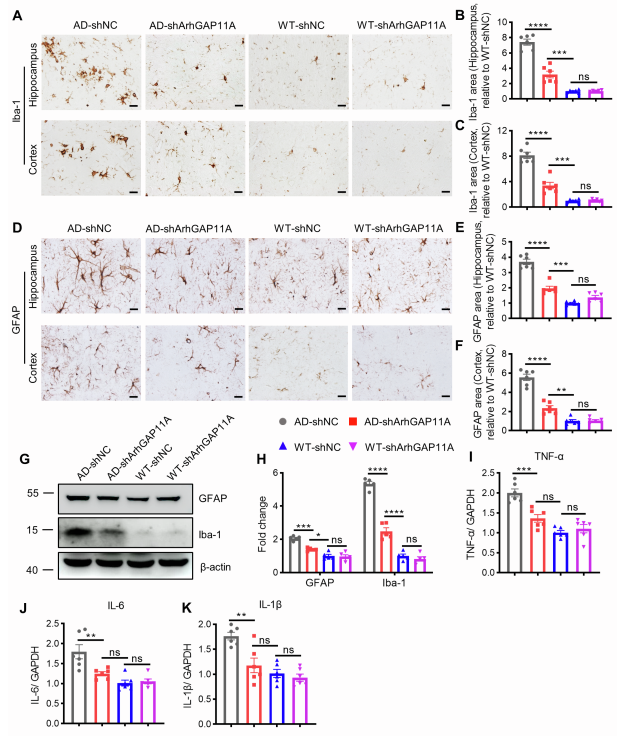
图S11 神经元ArhGAP11A下调可减轻神经胶质瘤和神经炎症
结论
综上所述,ArhGAP11A基因通过增加Ab生成和增强Abo神经毒性参与AD的神经病理发展。同时,Abos进一步增加神经元ArhGAP11A基因的表达,导致AD的病理恶化。因此,ArhGAP11A基因可能是缓解AD病理特征和治疗AD的潜在靶点。
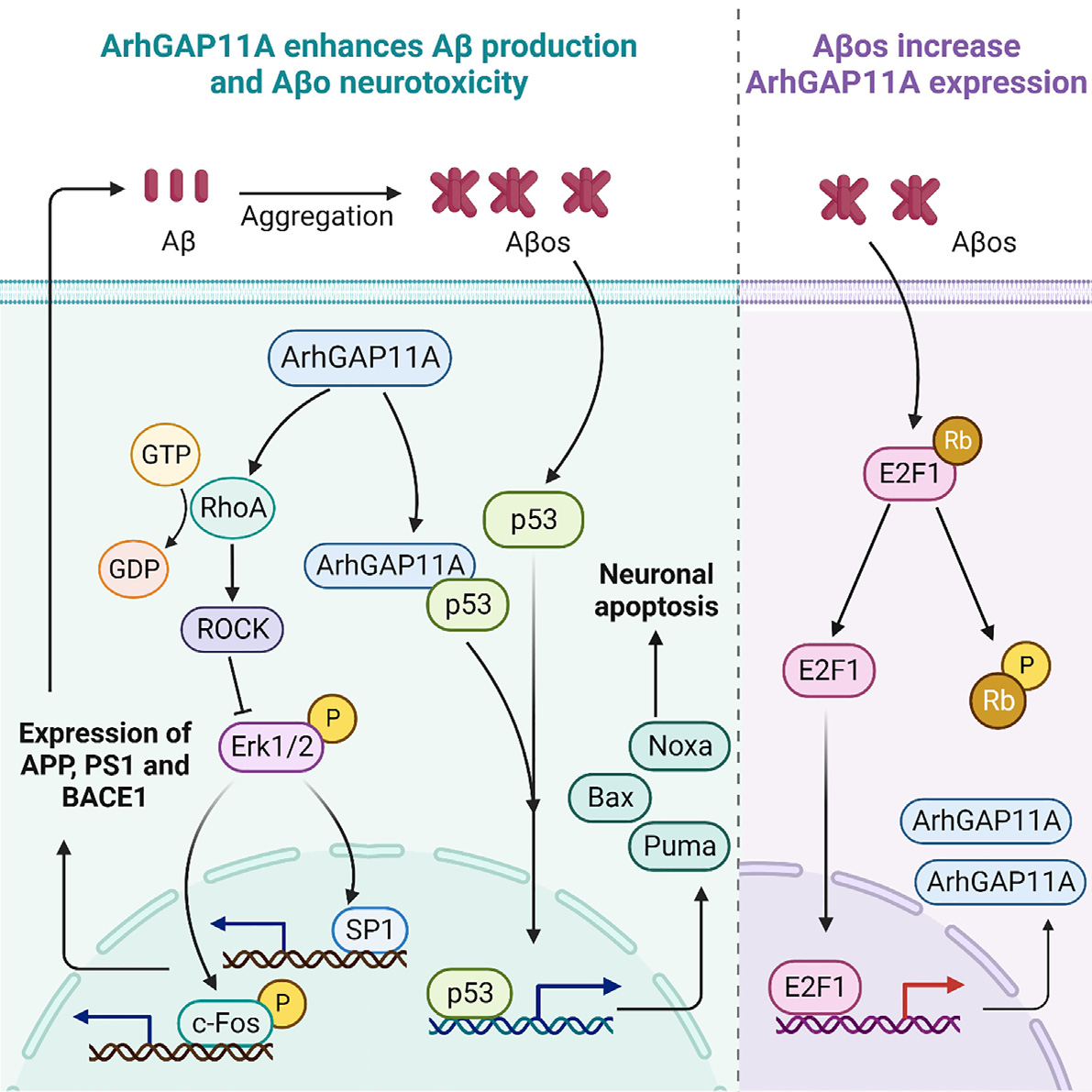
机制示意图
实验方法
APP/PS1小鼠(6月龄),N2a细胞培养,293T细胞培养,GEO数据库分析,MTT检测,Pull-down实验,CoIP,蛋白提取,Western blotting,行为测试,免疫组织化学(IHC),免疫细胞化学(ICC),Golgi染色,qRT-PCR
参考文献
Huang YR, Xie XX, Yang J, Sun XY, Niu XY, Yang CG, Li LJ, Zhang L, Wang D, Liu CY, Hou SJ, Jiang CY, Xu YM, Liu RT. ArhGAP11A mediates amyloid-β generation and neuropathology in an Alzheimer's disease-like mouse model. Cell Rep. 2023 Jun 9;42(6):112624. doi: 10.1016/j.celrep.2023.112624. Epub ahead of print. PMID: 37302068.






