基于人类PBMC scRNA-seq的衰老时钟揭示了 核糖体与炎症平衡作为单细胞衰老和超长寿命的标志
量化老年率对于评估与年龄相关的衰老和死亡率很重要。最近生成了一个七位超级百岁老人(SCs)的血液单细胞RNA测序数据集。在这里,作者生成一个参考28个样本的年龄队列,以计算单细胞水平的老化时钟,并确定SCs的生物年龄。作者的时钟模型将SCs的血液生物学年龄定在80.43岁到102.67岁之间。与模型预期的衰老轨迹相比,SCs表现为原始CD8+T细胞增加,细胞毒性CD8+T细胞减少,记忆CD4+T细胞和巨核细胞减少。作为单细胞水平上最显著的分子标志,SCs含有更多的高核糖体水平的细胞和细胞类型,根据贝叶斯网络推断,这与SCs的低炎症状态和缓慢衰老有关。通过抑制单核细胞中的核糖体活性或翻译过程,验证了单细胞衰老时钟揭示的翻译与炎症平衡的关系。
该研究于2023年6月发表在《Science advances》,IF:14.957。
技术路线
结果
1、scRNA-seq揭示了衰老队列中的细胞类型组成
为了构建基于单细胞转录组的衰老速率预测模型,作者从28岁到77岁的17个个体(其中6个男性和11个女性,年龄分布相似)收集了PBMCs(外周血单核细胞),作者将其称为上海东方医院自然衰老队列(简称SE队列),并使用10X Genomics scRNAseq对其进行测序。对于每个个体,平均测序和分析了8545个细胞,每个细胞平均有110,364个reads(图1A)。作者将这些数据与已发表的PBMC scRNAseq数据集一起进行进一步分析。这些数据集包括两个中国队列,中国年轻队列(CYCT)和武汉队列(WHCT),以及两个日本队列,日本老年队列(JOCT)和超百岁人士队列(SCs)。每个队列包含五个个体。由于质量不佳(线粒体基因表达超过10%或检测到的基因数小于200),作者移除了25,111个细胞,总共保留了131,972个单细胞的SE数据集,以及23,796个细胞的CYCT数据集,45,923个细胞的WHCT数据集,19,252个细胞的JOCT数据集和38,417个细胞的SC数据集。然后,作者消除了SE数据集和其他独立队列之间的批次效应,并根据经典细胞系标记物和簇特异性标记基因的表达,识别了红细胞(RBCs)、巨核细胞(Mega)和六个主要的免疫细胞系谱,包括CD4+ T细胞(TC)、CD8+ T细胞、自然杀伤细胞(NK)、单核细胞(MC)和树突状细胞(DC),并通过UMAP进行可视化(图1B)。
2、免疫细胞亚型重新聚类进行细分
为了分离免疫细胞的亚型,作者分别对NK和TC系谱的细胞、BC系谱的细胞以及MC和DC系谱的细胞进行了重新聚类。利用每个簇中最显著上调的基因,作者总共确定了29个细胞亚型(图1B)。这些细胞亚型随后被用于下游分析。

图 1. 衰老过程中人血外周血单核细胞 (PBMC) 的单细胞 RNA 测序 (scRNA-seq) 图谱
3、基于细胞类型比例的时钟模型显示,SCs比实际年龄年轻得多
随着年龄的增长,各种细胞类型的比例发生变化(图2A)。因此,作者测试使用scRNA-seq数据中细胞类型比例来构建一个"时钟"来预测年龄。作者首先训练了一个偏最小二乘回归(PLSR)线性模型,并使用留一法交叉验证(LOOCV)来评估模型的准确性。作者计算了变量在投影中的重要性(VIP)来对每个变量对PLSR模型的整体贡献进行排序,VIP得分>1的变量被认为是高解释变量。这些变量包括NK-GZMH、CD8-CTL、CD8-Naive、CD4-Tm、CD4-Naive、Naive-B、NK-FCER1G、CD14-MC和Memory-B-CRIP1(图2B)。为了扩展训练数据的年龄范围,作者使用TOSICA,进一步映射了由广东医科大学产生的包含非常老(72至100岁)样本(GM)的公开PBMC数据集的细胞类型,并训练了一个PLSR模型。作者发现它们在细胞类型组成或scRNA-seq时钟预测的cAgeDiff中并没有显著差异。因此,作者将这两组样本都包含在扩展的训练样本中。基于这个扩展数据集(SE + GM),作者发现仅基于前7个细胞类型的三个成分的PLSR模型产生了一个预测年龄与实际年龄之间相关系数(PCC)为0.88,平均绝对误差(MAD)为8.36的模型(图2C)。作者还使用细胞类型比例来训练一个弹性网络(EN)回归线性模型,并使用权重来对每个变量对EN模型的整体贡献进行排序。基于前7个细胞类型的EN模型具有与PLSR模型类似的准确预测能力,在SE + GM队列中预测年龄与实际年龄之间的PCC和MAD分别为0.89和7.86,而PLSR模型的准确性在训练和独立队列之间更为相似,表明稍微具有更好的泛化能力。PLSR模型和EN模型之间前7个细胞类型有5个共同的,暗示了它们在通过血液细胞类型组成进行年龄预测中的重要性。
为了进一步验证作者的模型,作者将其应用于三个独立健康队列的血液scRNA-seq数据上。其中包括五个CYCT个体(年龄范围为29至58岁)、五个WHCT个体(年龄范围为37至71岁)和五个JOCT个体(年龄范围为50至80岁,年龄按十年为单位精确,因此根据定义,预期的误差超过5年)。在这三个队列中,作者的七种细胞类型的PLSR模型在按年龄排序三个队列中的MAD分别为10.06、10.91和10.16,PCC分别为0.43、0.69和0.28。当绘制预测年龄与实际年龄之间的差异(AgeDiff)时,注意到在PLSR和EN模型中老年人中存在轻微的系统性低估(negative AgeDiff),而在年轻人中存在高估(positive AgeDiff)。因此,作者使用Loess模型进行了系统性偏差的校正,得到了校正后的AgeDiff(cAgeDiff)。在这种校正后,独立对照队列中与实际年龄的MADs为7.95、8.19和8.62,PCC为0.64、0.85和0.57。值得注意的是,年龄校正不会改变模型与实际年龄的MAD,但会增强PCC。由于作者的单细胞衰老时钟与年龄呈线性关系,作者希望它具有线性可扩展性,可以外推到训练数据中未包含的年龄谱的任何一端。根据作者的时钟模型预测,比最小的训练样本小28岁以上,TOSICA映射的脐带血样本(Cord)的年龄为-10.10至-5.42岁(图2D)。而在年龄范围的另一端,比最年长的训练样本年大20岁的SCs被预测为80.43至102.67岁,平均比他们的实际年龄年轻18.64岁。经过年龄校正的细胞类型EN模型将所有SCs预测为低于110岁,平均年龄为95.23岁,将脐带血(Cord)预测为7.12至12.68岁。
为了进一步测试时钟性能,将年龄时钟应用于其他独立的疾病数据集,包括COVID-19数据集和系统性红斑狼疮(SLE)数据集。基于细胞类型组成的PLSR模型显示,处于疾病状态的个体的平均生物学年龄高于年龄匹配的对照组,并且随着疾病严重程度的增加而增加(图2,E至G)。也许由于样本规模较小,只有严重症状的COVID-19患者明显年龄较大(图2E;t检验,P = 0.040),而SLE症状得到控制和病情加重的患者年龄较明显大于对照组(图2G;t检验,P = 8.77 × 10−4和4.20 × 10−3)。由EN模型预测的cAgeDiff显示出疾病与对照组之间一致显著的增加。这些结果表明,基于细胞类型组成的PLSR和EN时钟模型都能够识别这些疾病患者免疫相关生物年龄的增加。
与模型预测的SCs的“缓慢老化”一致(图2D),在PLSR和EN模型中使用的七个细胞类型中,两个CD8+T细胞亚群之间存在高度显著的负相关,即CD8+ CTL和CD8+ 初始 T细胞,在SE + GM和SC队列中,它们分别随年龄显著增加和减少,但SCs在很大程度上与70至100岁的SE + GMs个体重叠(图2H)。这表明,在血液细胞群体水平上,CD8+ 初始T细胞向CD8+ CTL的极化是衰老的标志。

图 2. 基于单细胞 RNA 测序 (scRNA-seq) 的单细胞成分衰老时钟和超级百岁老人 (SCs) 的年龄延迟。
4、SCs中与年龄相关的细胞成分变化被推迟
作者利用模型预测与SCs实际状态之间的细胞和分子偏差,来解析其极端长寿相关的特征(图3A)。作者通过PLSR时钟模型反向计算了110岁时的细胞类型组成。另外,基于PLSR和EN时钟模型中的前7个细胞类型(图2E),作者使用线性回归模型(LR)定义了与年龄显著正相关或负相关的细胞类型(具有RCC与年龄斜率,P < 0.05)。然后,根据PLSR模型或LR模型计算了110岁时的预期细胞比例,如果它们与SCs中的实际比例相比显著偏高或偏低(z分数,P < 0.05),则将这些细胞类型视为“SC延迟衰老细胞类型”或“SC延迟年龄下降细胞类型”(图3A)。作者发现,与PLSR模型相比,SCs在CD8+ 初始T细胞、初始B细胞、记忆B细胞和NK-GZMK方面显示出明显的延迟性年龄相关性下降(z分数,P < 0.05),在CD4+ Tm方面显示出较小的延迟衰老相关增加(z分数,P < 0.1),在CD8+ 初始T细胞方面显示出延迟衰老相关减少,并在CD4+ Tm和初始B细胞方面显示出延迟衰老相关增加,与LR模型相比。当绘制年龄下调的CD8-初始细胞和年龄上调的CD4 Tm细胞的比例随年龄变化时,在28到100岁的28个样本中,SCs与线性趋势线呈现明显的延迟偏差。
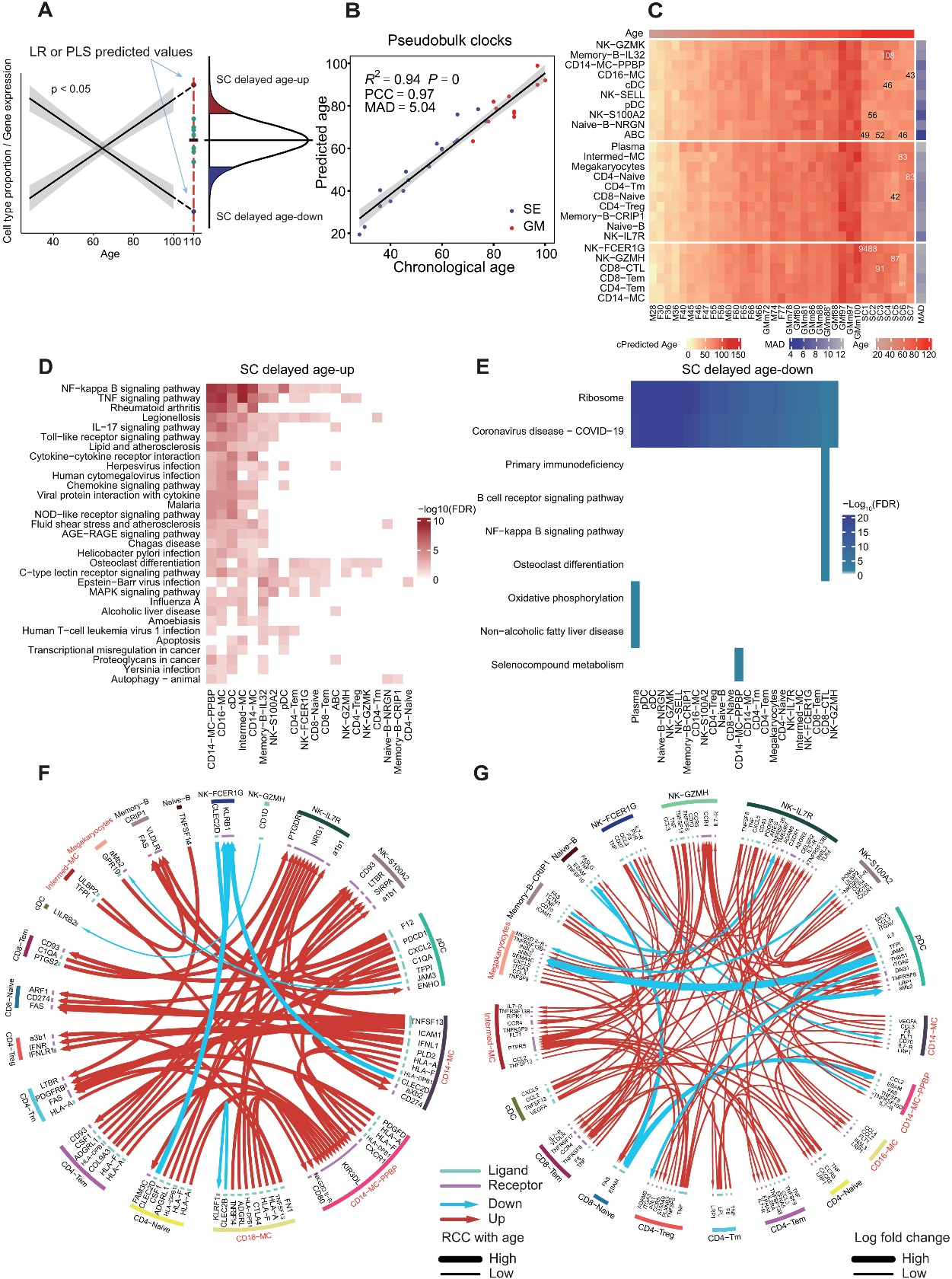
图 3. 超级百岁老人 (SCs) 中与衰老相关的细胞类型比例和基因表达变化延迟。
5、SCs中与年龄相关的单细胞基因表达变化延迟
作者使用每个个体所有细胞的基因表达之和来训练PLSR模型,作为伪批量转录组时钟模型,该模型对28个训练样本的预测与实际年龄的MAD为5.04,PCC为0.97(图3B),并将SCs的平均年龄预测为82.49岁。作者还使用每个细胞类型每个个体所有细胞基因表达的总和,分别训练了各细胞类型的伪批量转录组时钟模型,MAD在4.80年(ABC细胞)到9.60年(浆细胞)之间(图3C)。与基于细胞类型比例的时钟模型相比,这些时钟模型更加显著地将SCs的中位转录组年龄预测为51.62岁到63.19岁(年龄校正前),年龄校正后为65.01岁到75.83岁(图3C)。接着,基于这些PLSR时钟模型,或者根据贡献度VIP > 1的基因(表S1)定义为与年龄相关的基因,使用LR模型在每个细胞类型中预测它们在110岁时的表达水平,然后类似于上面描述的细胞类型分析,定义了“SC延迟年龄增加基因”(与年龄上调,并且在SCs中延迟)和“SC延迟年龄下调基因”(与年龄下调,并且在SCs中延迟)(图3A)。使用LR模型,该模型不显示对年龄的系统性偏差,作者发现2749个年龄增加基因和495个年龄下调基因,并且1023个年龄增加基因和149个年龄下调基因在SCs中有显著的延迟表达。转录因子(TF)靶标富集分析显示,年龄增加和年龄下调基因都富集了FOXR2、ZNF318、PSMB5、PER1、ZZZ3和NERF的靶。其中,FOXR2、ZNF318、PSMB5和ZZZ3的靶标在SC延迟年龄下调基因中富集,核因子κB(NFκB)的靶标在SC延迟年龄增加基因中富集。KEGG通路富集分析显示,年龄增加基因富集了NFκB/TNF/TLR/NOD/FoxO信号通路、病毒感染、凋亡、T细胞受体信号通路、细胞因子和PD-1通路,其中,NFκB/TNF/TLR/NOD/FoxO信号通路、病毒感染、凋亡、细胞因子和丝裂原活化蛋白激酶(MAPK)通路在SCs中有显著的延迟(图3D),而年龄下调基因主要富集于核糖体基因,这些基因在SCs的大多数细胞类型中显著延迟表达(图3E)。
与PLSR模型预期值相比,SCs中有111个显著延迟表达的年龄上调基因,与MAPK信号通路、雷帕霉素(mTOR)信号通路、NFκB信号通路和病毒感染有关。另外,有1261个年龄下调基因在SCs中显著延迟表达。再次,大部分细胞类型中富集了与核糖体和翻译相关的基因。而在其他队列中,SEs中鉴定出的年龄下调核糖体基因也随着年龄的增加而减少。
6、SCs中炎症细胞与细胞间的相互作用受到抑制
通过使用细胞间通讯数据库,作者计算了每对细胞类型之间的配体-受体对数量,利用CellphoneDB进行分析。作者发现,在不同的细胞类型中,许多与衰老相关的受体-配体对在衰老过程中上调(PCC,P < 0.05)。这些受体-配体对主要与炎症、细胞因子和抗原呈递相关(图3F)。类似于延迟上调和下调的细胞类型和基因,作者定义了在SCs中延迟上调和下调的配体-受体对。与大多数细胞类型相比,与年龄相关的下调的aMb2整合素信号配体-受体对在SCs中普遍延迟,而与炎症相关的上调的TNF信号配体-受体对也被延迟,特别是在pDC中(图3G)。
7、核糖体/翻译在单细胞水平上对抗炎症
根据上述结果,作者想知道核糖体水平的年龄相关下降和炎症水平的年龄相关增加是否是单个细胞老化的两个相关事件。为了定量评估每个细胞的炎症状态,作者根据炎症相关基因列表计算了每个细胞的炎症分数。核糖体基因的中位表达水平被用来指示每个细胞中核糖体的水平。在SE和SC队列中,对于所有细胞类型的所有单个细胞,核糖体水平与炎症分数之间存在显著的负相关(图4A)。此外,在不同的细胞类型之间,平均核糖体水平和平均炎症分数之间也存在显著的负相关(图4B)。根据核糖体水平与炎症分数的分布,细胞类型可以分为高炎症和低核糖体(HI-LR)细胞类型,包括Intermed-MC、CD14-MC、CD16-MC、CD14-MC-PPBP和巨核细胞,以及低炎症和高核糖体(LI-HR)细胞类型,即其他细胞类型(图4B)。在除一种细胞类型外,所有核糖体基因的表达水平都随着年龄的增长而在SE中降低,在HI-LR细胞类型中,SCs的水平与年轻的SEs相似(图4C)。一致地,基于每个细胞类型内的核糖体和炎症基因表达的主成分分析(PCA)显示,对于大多数细胞类型(例如CD4-Treg和CD14-MC),单个细胞分别落入高和低核糖体表达的两个主要细胞状态。与核糖体表达水平一致,大多数细胞类型中处于高核糖体状态的细胞比例随年龄减少(图4D)。值得注意的是,在HI-LR细胞类型中,SCs始终比SE拥有更多处于高核糖体状态的细胞(图4D)。这表明,在血液中,高炎症低核糖体表达,或者更准确地说,在高核糖体状态下的细胞更多,是超长寿在单个细胞水平上的共同特征。
作者还在COVID-19和SLE队列中验证了核糖体表达和炎症分数的变化。与核糖体表达和炎症之间的平衡一致,在COVID-19和SLE的疾病进展中,所有细胞类型和HI-LR细胞中炎症分数持续增加,核糖体表达水平持续下降,而在SLE中的变化比COVID-19更显著。
此外,作者发现大多数细胞类型内处于高核糖体状态与低核糖体状态的细胞之间的细胞间通信显著不同(图4E)。在低核糖体状态下,前100个配体-受体对主要是在CD8-CTL和其他细胞类型之间,包括MHCII、S100A8/A9TLR4、CCL5-CCR5和TNF相关的配对,而在高核糖体状态下这些配对显著降低(t检验,P < 0.01;图4E)。在高核糖体状态与低核糖体状态中,最常见的下调配体-受体对是核糖体蛋白S19(RPS19)与其膜受体C5AR1,据报道,该相互作用能抑制免疫反应。
最后,为了了解SE + GM数据中核糖体水平、炎症水平、年龄和衰老速率之间的因果关系,作者分别基于HI-LR和LI-HR细胞类型中的所有单个细胞,在衰老速率参考SE + GM数据中推断了一个贝叶斯网络(BN)。这里,衰老速率通过年龄校正的AgeDiff来衡量,AgeDiff是基于细胞组成PLSR模型预测年龄与实际年龄之间的差异,并经过年龄校正。BN模型推断出AgeDiff取决于HI-LR细胞类型中的核糖体水平和炎症水平,而核糖体水平反过来又取决于年龄。模型还推断出核糖体水平的降低会导致HI-LR细胞中炎症水平的增加。然而,在LI-HR细胞类型中,年龄降低会降低炎症分数,并且炎症分数不会影响衰老速率(图4F)。这表明核糖体丰度,通常是翻译和生长速率的代表,可能抑制HI-LR细胞的炎性细胞因子分泌;换句话说,高水平的炎性细胞因子表达可能是HI-LR细胞类型生长停滞或基础低核糖体活性不足的结果,而干细胞可能受益于高细胞核糖体/翻译/生长速率以对抗衰老引起的慢性炎症。相比之下,基础水平的炎性细胞因子可能是LI-HR细胞正常生长的结果(图4F)。对于每种细胞类型推断的BN模型中可以一致地观察到类似的关系,根据这些BN中的相互作用,HI-LR细胞类型会自动聚集在一起,并通过无监督层次聚类与其他细胞类型分离开来(图4G)。
最后,为了确认HI-LR细胞中核糖体活性(翻译)对炎症的抑制作用,作者在人类血液原代单核细胞和THP-1单核细胞系(代表HI-LR细胞类型,并且在作者先前的研究中发现其分泌衰老相关的细胞因子)中,使用翻译抑制剂环己基甲酰胺(CHX)进行时间限制的翻译抑制。CHX能与60S核糖体亚单位结合,抑制翻译延伸。如BN模型所预期的那样,在原代单核细胞中,抑制翻译引起了常见炎性细胞因子白细胞介素-6(IL-6)和IL-8的显著上调,并且这种上调呈时间依赖性(图4H)。类似的结果也在THP-1细胞中观察到。血液单细胞衰老和 SC 延迟衰老标志的核糖体和炎症平衡的示意图(图4I)。
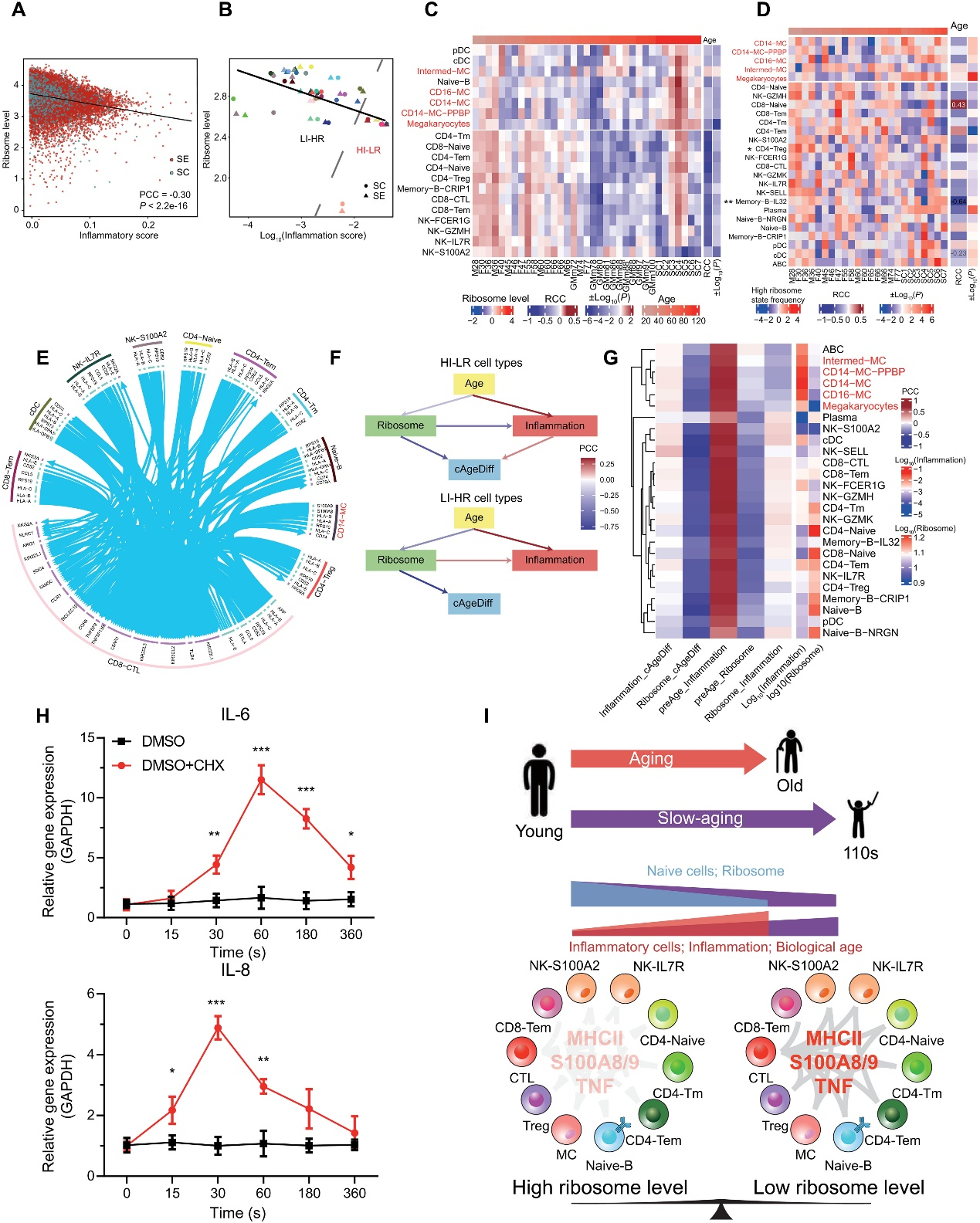
图 4. 衰老过程中核糖体与单细胞和细胞类型炎症之间的关系
实验方法
scRNA-seq、校正批次效应、细胞亚型注释、构建时钟模型、饱和度分析、TOSICA、GO terms、TF 富集分析、炎症评分、细胞间通讯分析、AgeDiff校正、BN推断、翻译抑制测定。
参考文献
Hongming Zhu et al. ,Human PBMC scRNA-seq–based aging clocks reveal ribosome to inflammation balance as a single-cell aging hallmark and super longevity.Sci. Adv.9,eabq7599(2023).DOI:10.1126/sciadv.abq7599






