KEAP1-NRF2通路调控TFEB/TFE3依赖性溶酶体生物发生
实验方法:斑马鱼CRISPR/Cas9基因编辑,RNA提取和RNA-seq分析,幼虫切片免疫荧光染色,ß-半乳糖苷酶(ß-gal)染色,KEAP1敲除HepG2细胞系的产生,免疫印迹,siRNA敲低基因,流式细胞术,代谢物提取和代谢组学分析
氧化还原和代谢稳态的维持对胚胎发育是不可或缺的。核因子红细胞2相关因子2 (NRF2)是一种应激诱导的转录因子,在氧化还原平衡和细胞代谢的调节中起核心作用。在稳态条件下,NRF2被Kelch样ECH相关蛋白1 (KEAP1)抑制。我们证明了Keap1缺陷诱导Nrf2激活和发育后致死。生存能力丧失之前是严重的肝脏异常,其特征是溶酶体的积累。机制上,我们证明Keap1的缺失会促进转录因子EB (TFEB)/转录因子结合到IGHM增强子3 (TFE3)依赖的溶酶体生物发生的异常激活。重要的是,我们发现依赖Nrf2的溶酶体生物发生调控是细胞自主的和进化保守的。这些研究确定了KEAP1-NRF2通路在调节溶酶体生物发生中的作用,并表明在胚胎发育过程中需要维持溶酶体的稳态。本文于2023年5月发表于Proceedings of the National Academy of Sciences of the United States of America (IF=12.779)。
本研究的意义:
KEAP1-NRF2通路在氧化还原平衡和细胞代谢调控中起核心作用。尽管NRF2在包括癌症在内的各种疾病状态中被广泛研究,但关于NRF2在胚胎发育中的作用的知识却很缺乏。我们证明NRF2激活诱导致死性,在肝异常和溶酶体积累之前。此外,我们发现NRF2激活溶酶体生物发生的主要调节因子TFEB/TFE3。这些研究强调了在胚胎发育过程中维持溶酶体稳态的关键作用,更广泛地说,表明异常的溶酶体生物发生可能是NRF2驱动的病理的一个标志。
技术路线:

结果:
(1) Keap1缺失激活Nrf2并驱动胚胎后致死
为了研究Keap1在胚胎发育过程中的作用,采用了CRISPR/Cas9基因编辑方法(图S1A-C)。由于硬骨鱼谱系中的基因组重复,斑马鱼有两个Keap1类似物(keap1a和keap1b),它们在Nrf2的调控方面以冗余的方式起作用。具有keap1a (crkeap1a)、keap1b (crkeap1b)或keap1a/b (crkeap1a/b)嵌合敲除(KO)的Crispants最初在Nrf2报告者斑马鱼系[Tg(gstp1:EGFP)]中产生,其中EGFP的表达是由含有ARE的gstp1启动子驱动的。在keap1a或keap1b缺失后,Nrf2报告基因活性没有显著变化(图1A)。相反,crkeap1a/b幼虫表现出Nrf2激活增加(图1A)。Nrf2激活在组织中不是均匀的,但在神经肥大、嗅腔、耳石、远端肠道和肝脏中都有观察到。Nrf2激活表型遗传给了杂交的crkeap1a/b系的后代(图S1D)。与Nrf2报告基因活性的缺乏一致,RNA-Seq分析在单个KOs中发现了有限数量的差异表达基因(DEGs)(图1B)。相比之下,在crkeap1a/b幼虫中观察到转录景观的广泛变化(图1B)。对DEGs中已知基序的超几何优化(HOMER)分析显示含有ARE的基因富集(图1C)。此外,NRF2靶基因在DEGs中被过度代表(图1B,D)。GSEA证实了与NRF2激活相关的特征的富集(图1E)。代谢组学分析发现,crkeap1a/b幼虫中还原型谷胱甘肽的丰度显著增加(图1F和图S1E)。与Keap1缺失相关的分子特征导致胚胎后发育期间存活率显著下降(图1G),这与在Keap1缺失小鼠中观察到的胚胎后致命性一致。这些数据表明,斑马鱼中keap1a和keap1b的复合缺失为研究KEAP1-NRF2通路在发育过程中的作用提供了一个强有力的模型。
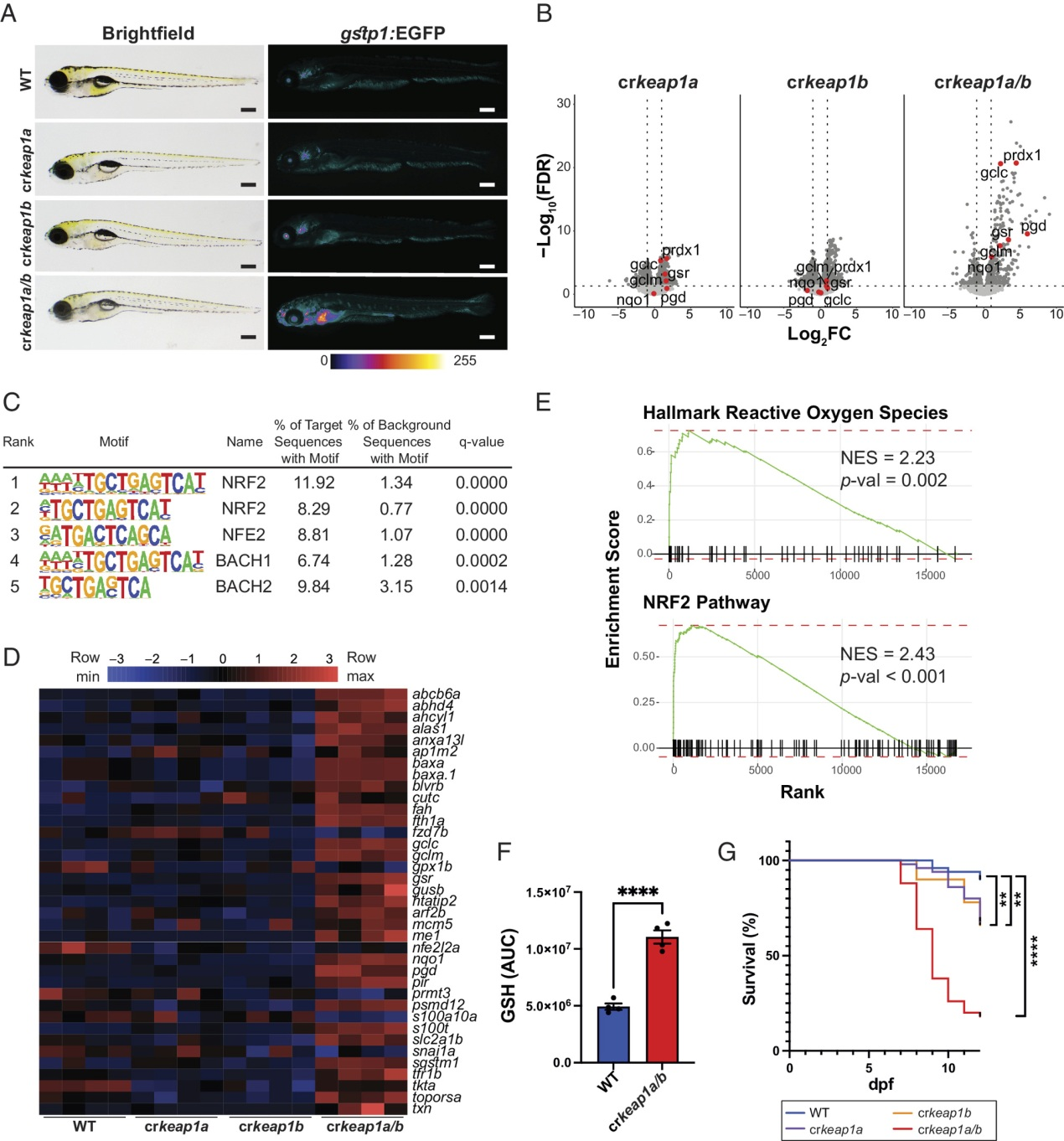
图1:Keap1缺失激活Nrf2并驱动胚胎后死亡
(2) 缺乏Keap1的幼虫在胚胎后肝脏发育中表现出缺陷
对crkeap1a/b斑马鱼的进一步分析显示,Nrf2报告基因活性在肝脏中最高(图2A)。除了Nrf2激活增加外,crkeap1a/b幼虫的肝脏形态也发生了改变。具体来说,与多叶野生型(WT)肝脏相比,crkeap1a/b肝脏表现为单个液滴状叶(图2A)。接下来,利用肝细胞报告细胞系(Tg(lf:NLS-mcherry))特异性检测肝细胞中的Nrf2活性。虽然crkeap1a/b幼虫的肝脏体积和肝细胞数量没有变化,但肝细胞中Nrf2活性显著增加(图2B,C和图S2A,B)。流式细胞术分析证实,从crkeap1a/b幼虫分离的肝细胞中Nrf2报告细胞活性升高(图2D)。组织学评估显示,肝细胞核的窦状窦变宽,大小增加(图2E和图S2C)。Nrf2和血管报告基因联合背景下crkeap1a/b幼虫的多光子分析[Tg(gstp1:EGFP;kdrl:mCherry)]证实血管舒张(图S2D)。重要的是,在血管系统中未观察到Nrf2活性(图S2D)。总的来说,这些研究表明肝细胞对Keap1的缺失很敏感。
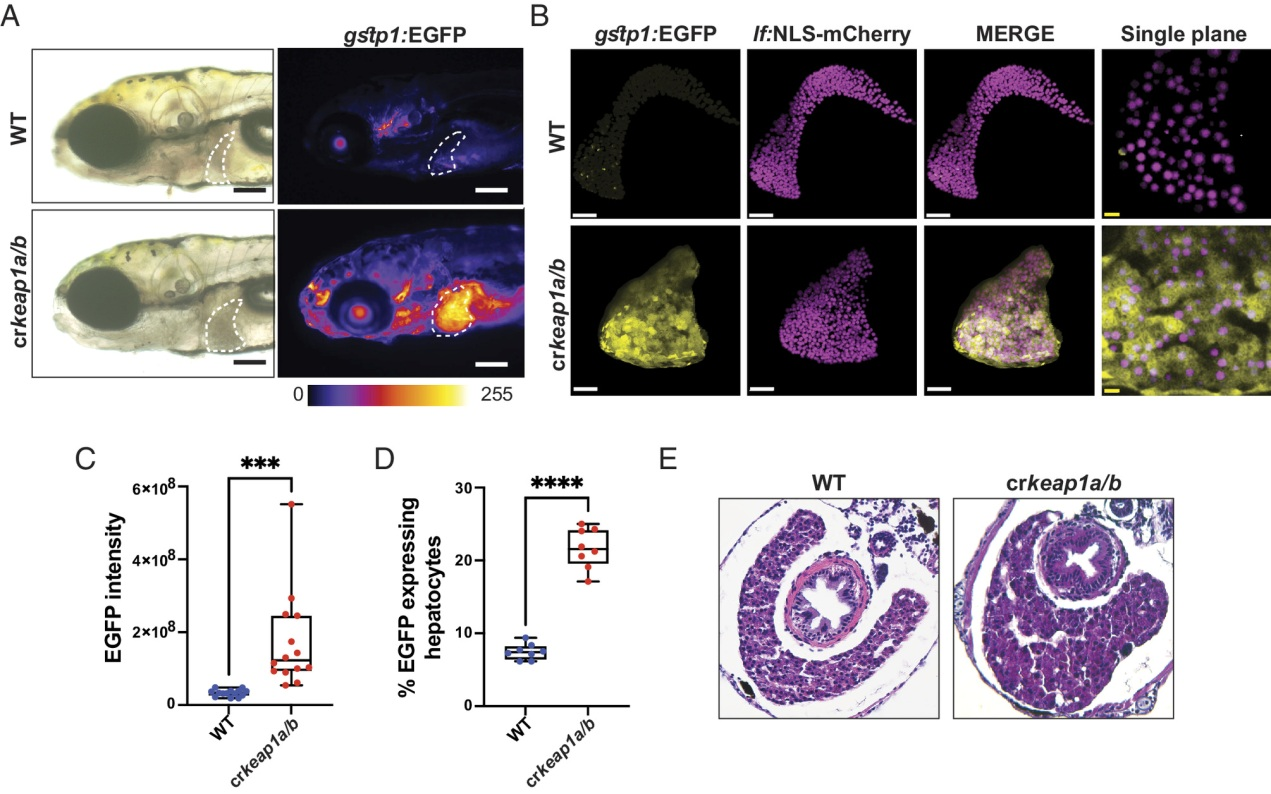
图2:缺乏Keap1的幼虫在胚胎后肝脏发育中表现出缺陷
(3) 丢失Keap1诱导溶酶体生物发生
GSEA在crkeap1a/b幼虫中观察到的最富集的途径之一是KEGG溶酶体特征(图3A)。事实上,在Keap1缺失的情况下,许多溶酶体基因的表达,包括ß-半乳糖苷酶(ß-gal)和多种组织蛋白酶的表达显著增加(图3B)。在解剖的幼虫肝组织中,溶酶体特征也高度富集(图3C)。显示单个膜结合囊泡增加,表明溶酶体丰度增加(图S3A)。为了直接观察肝脏中的溶酶体,一种肝细胞特异性溶酶体报告基因[Tg(lf:Lamp1-mGreenLantern; lf:mKate2-CAAX)]。在这条线中,由于Keap1的缺失,观察到溶酶体丰度急剧增加(图3D,E)。为了观察整个幼虫的溶酶体活性,进行了ß-gal染色。与WT幼虫在富含溶酶体的肠细胞中呈现ß-gal染色相反,crkeap1a/b幼虫在肝脏中呈现强烈的ß-gal染色(图3F,G)。虽然ß-gal染色被用作溶酶体活性的测量,但它也被用作细胞衰老的替代标记。因此,采用正交试验来排除衰老在Keap1缺陷表型中的作用。衰老的一个特征是p53依赖的细胞周期停滞。在crkeap1a/b肝细胞中,ß-gal和增殖细胞核抗原共染色未发现细胞周期阻滞的证据(图S3B)。此外,p53的丢失并不影响ß-gal染色(图S3C,D)。对RNA-Seq数据集的进一步分析显示,在crkeap1a/b幼虫肝脏和整个幼虫中观察到的DEGs中缺乏与衰老相关的分泌表型因子(图S3E,F)。这些数据表明,由于Keap1的丢失,溶酶体的生物发生增加。
溶酶体基因的表达和溶酶体生物发生的调控由MiT/TFE转录因子家族成员控制,其中包括TFEB和TFE3。滤泡素(FLCN)的缺失通过促进TFEB/TFE3的激活来刺激溶酶体的生物生成。采用CRISPR/Cas9基因编辑方法比较丢失Keap1或Flcn后观察到的发育表型。flcn (crflcn)在肝细胞特异性溶酶体报告者背景上的镶嵌KO复制了在crkeap1a/b幼虫中观察到的溶酶体丰度和活性的增加(图3H-K和图S3G-I)。有趣的是,Flcn或Keap1的缺失与相似发育阶段的死亡率相关,这表明溶酶体生物发生的失调可能导致胚胎后死亡(图S3J)。
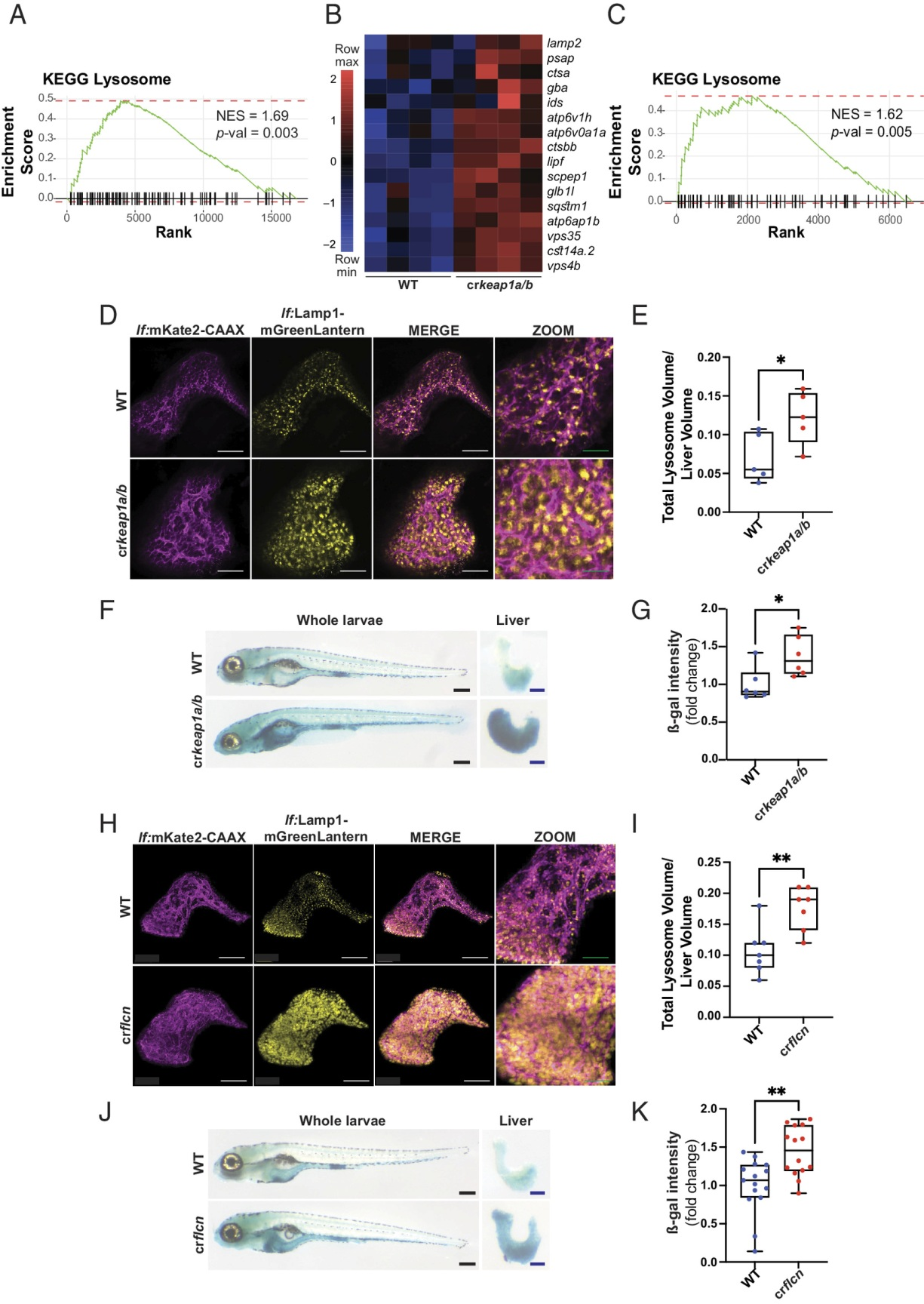
图3:丢失Keap1诱导溶酶体生物发生
(4) Bach1介导的Nrf2抑制调节溶酶体生物发生
除了NRF2调控的基因富集外,HOMER de novo基序分析发现BTB结构域和CNC同源物1 (BACH1)是crkeap1a/b幼虫中最富集的基序之一(图1C)。BACH1是一种转录抑制因子,通过与MAF识别元件(MARE)结合来调节血红素代谢。由于MARE和ARE基序的相似性,已知NRF2靶基因的一个子集受BACH1的共同调控。为了探索BACH1在KEAP1调节的溶酶体生物发生中的作用,我们在Tg(gstp1:EGFP; lf:NLS-mcherry)背景(图S4A)。在WT背景下,Bach1的缺失对Nrf2报告基因活性没有影响(图4A)。RNA-Seq分析证实Bach1缺失并不足以诱导NRF2转录程序(图4B)。然而,在Keap1缺乏的情况下,Bach1的缺失加剧了Nrf2报告基因的活性(图4A),这反映在Nrf2靶基因表达的增强上(图4B,C)。此外,GSEA显示,在Bach1 DKO中,多个特征的标准化富集得分更高,包括KEGG溶酶体特征;crkeap1a/b复合突变体相对于crkeap1a/b突变体幼虫(图1E,3A,4C和图S4B)。ß-gal染色证实Bach1 DKO溶酶体生物发生显著增加;crkeap1a/b幼虫(图4D,E)。重要的是,Bach1的缺失加速了Keap1依赖性的胚胎后致死(图4F)。这些结果表明,在胚胎发育过程中,BACH1有助于抑制NRF2的活性。
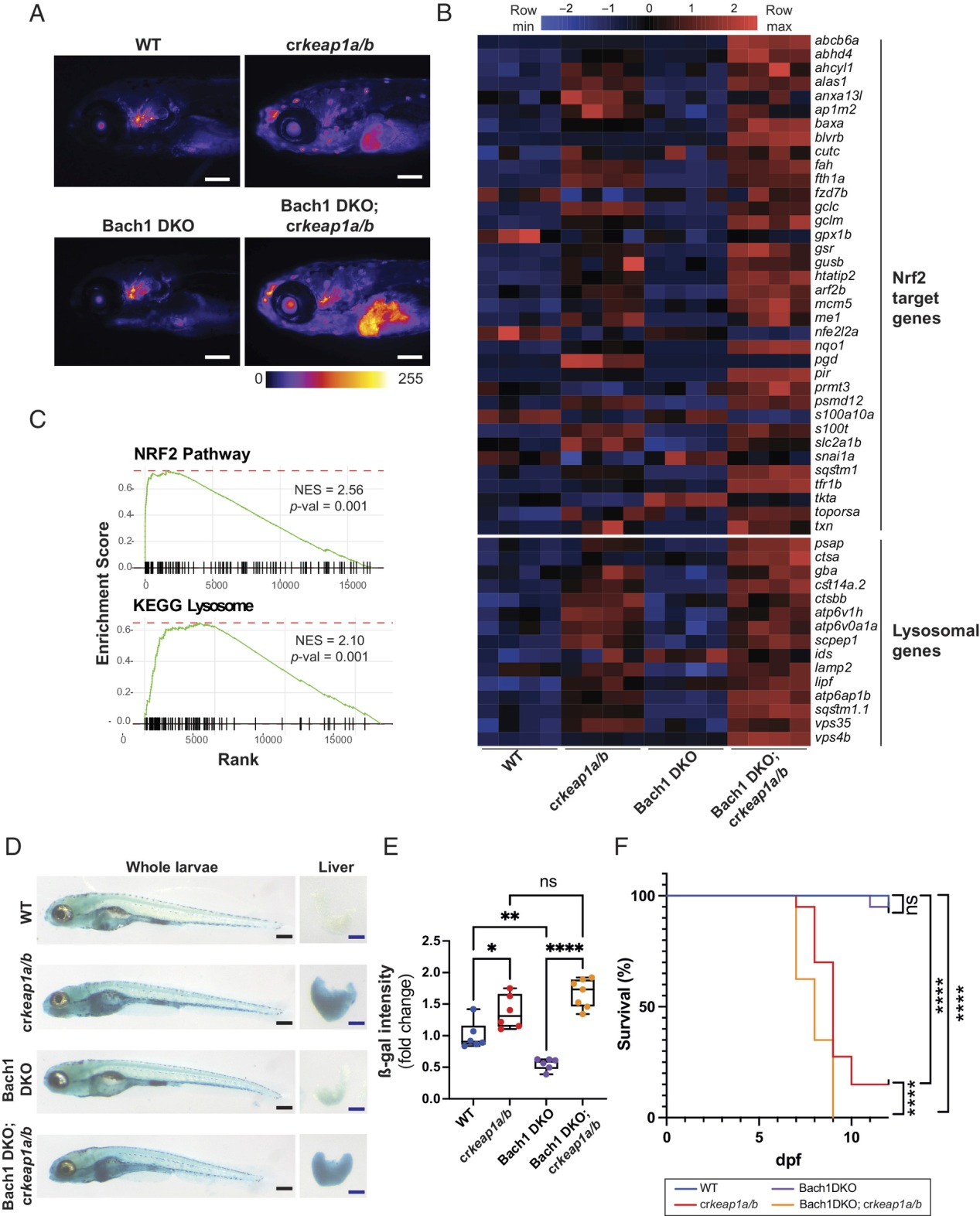
图4:Bach1介导的Nrf2抑制调节溶酶体的生物发生
(5) 依赖Keap1的溶酶体生物发生调控需要Nrf2
为了确定在KEAP1缺乏的情况下溶酶体生物发生是否需要NRF2,我们利用了先前报道的NRF2突变系(nfe2l2fh318)。在NRF2突变背景下,Keap1缺失未能诱导NRF2转录程序(图S5A)。此外,Nrf2活性的丧失抑制了crkeap1a/b幼虫中溶酶体基因表达的增加(图5A)。此外,在Nrf2突变背景下,crkeap1a/b幼虫中观察到的ß-gal染色增加和胚胎后致死(图5B-D)。这些结果表明,依赖Keap1的溶酶体生物发生和胚胎后致死依赖于NRF2。
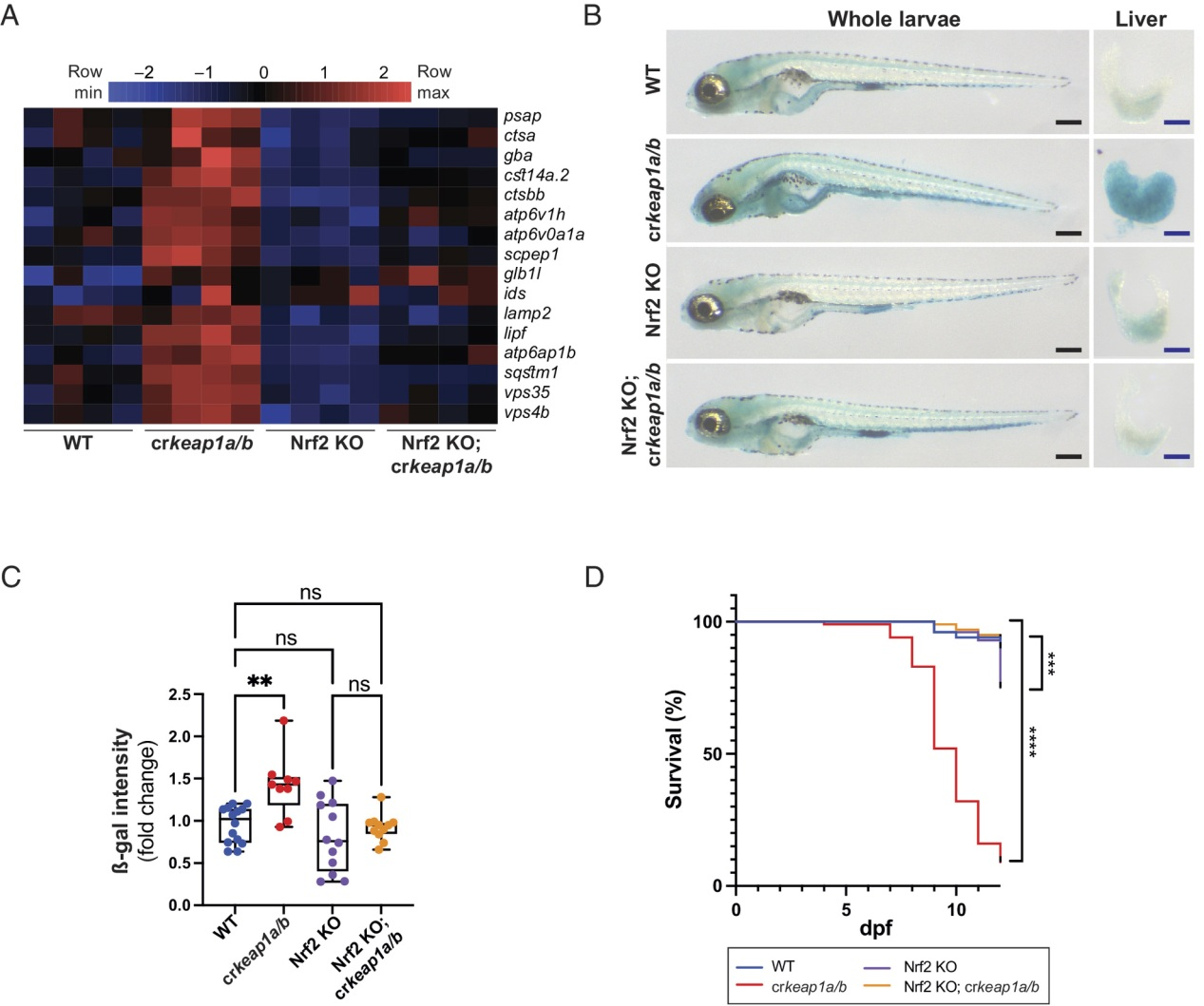
图5:依赖Keap1的溶酶体生物发生调节需要Nrf2
(6) 依赖Keap1的溶酶体生物发生调控是细胞自主的和进化保守的
为了确定KEAP1对溶酶体生物发生的调节是否以细胞自主和进化保守的方式发生,我们还利用哺乳动物细胞研究了KEAP1缺失的影响。考虑到KEAP1缺失主要影响体内肝脏(图2),我们采用肝细胞系(HepG2)。使用CRISPR/Cas9基因编辑方法生成KEAP1 KO HepG2细胞。与体内数据一致,KEAP1的缺失导致NRF2表达和GSH含量显著增加(图6A和图S6A)。此外,KEAP1的缺失与ß-gal染色显著增加相关(图6B,C)。KEAP1 KO HepG2细胞也表现出组织蛋白酶活性升高和溶酶体丰度增加,分别使用Magic Red组织蛋白酶活性测定和嗜酸性染料溶酶体检测(图6D和图S6B)。为了检验TFEB/TFE3在KEAP1 KO细胞中的作用,在没有或存在siRNA介导的TFEB和TFE3敲低的情况下进行了RNA-Seq分析(图S6C)。NRF2靶基因和溶酶体基因在KEAP1 KO HepG2细胞中上调(图6E和图S6C)。此外,GSEA还揭示了NRF2通路特征和KEGG溶酶体特征的富集(图6F)。重要的是,TFEB/TFE3敲低抑制了KEAP1 KO HepG2细胞中溶酶体基因的表达,而对NRF2靶基因的表达没有任何影响(图6E,F和图S6D)。与溶酶体基因表达增加一致,KEAP1 KO细胞中观察到TFEB/TFE3的核定位升高(图6G)。对来自the Cancer Genome Atlas数据库的基因表达数据的分析显示,NRF2靶基因PRDX1和TXN的表达与TFEB/TFE3靶基因ATP6V0B和GLA的表达之间存在很强的相关性(图6H,I和图S6E)。总的来说,这些数据表明KEAP1缺失以细胞自主和进化保守的方式诱导TFEB/TFE3依赖性溶酶体程序。
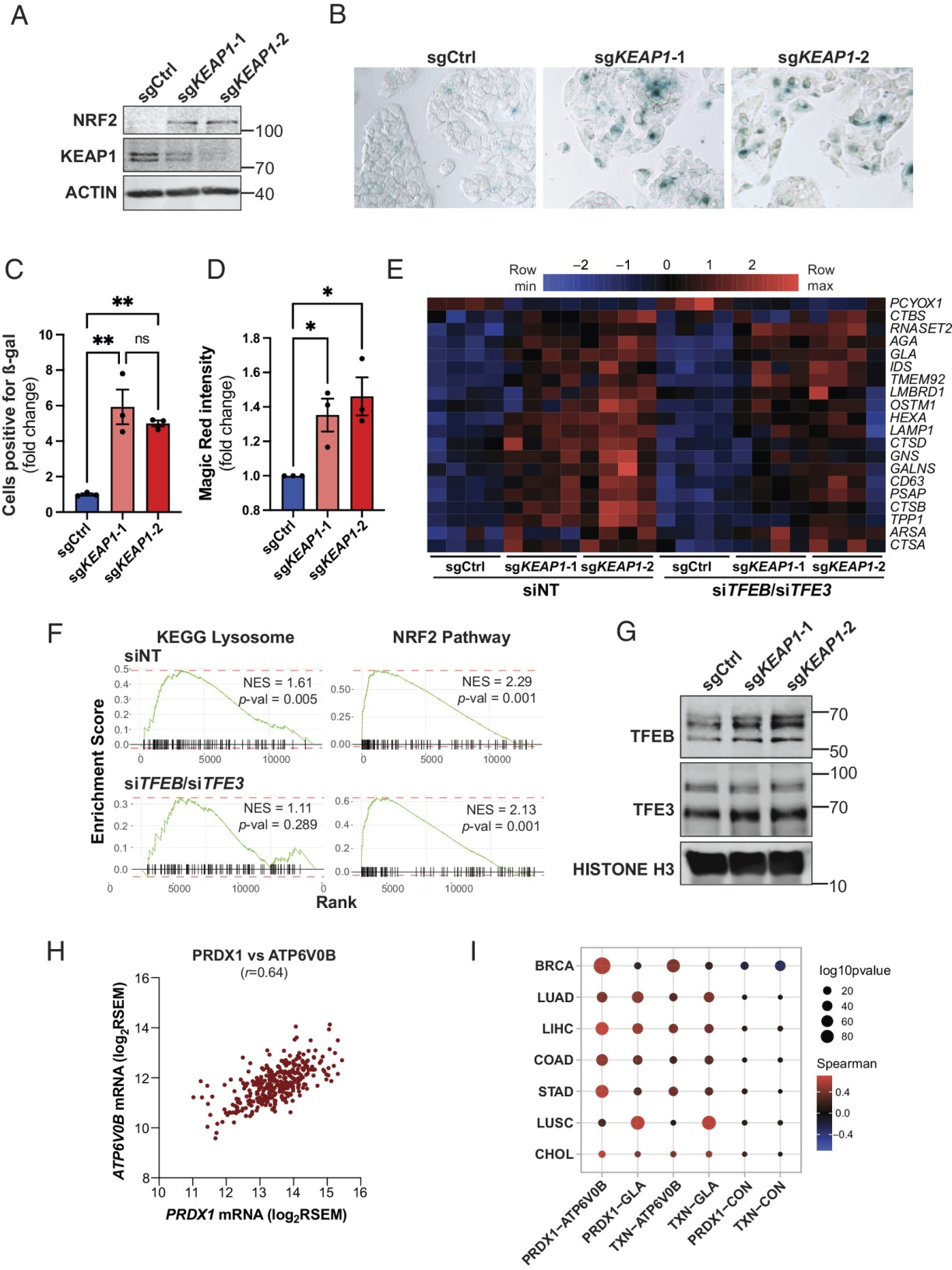
图6:依赖Keap1的溶酶体生物发生调控是细胞自主的,并且在进化上是保守的
结论:本研究揭示KEAP1缺失促进溶酶体生物发生。机制上,我们提供了NRF2激活保守的TFEB/TFE3依赖程序的证据。鉴于KEAP1和NRF2在癌症中经常发生突变,探索TFEB/TFE3在NRF2驱动的癌症中的作用将是有趣的。
参考文献:Ong, A. J. S., Bladen, C. E., Tigani, T. A., Karamalakis, A. P., Evason, K. J., Brown, K. K., & Cox, A. G. (2023). The KEAP1-NRF2 pathway regulates TFEB/TFE3-dependent lysosomal biogenesis. Proceedings of the National Academy of Sciences of the United States of America, 120(22), e2217425120. https://doi.org/10.1073/pnas.2217425120.






