靶向黑色素瘤相关抗原硫酸软骨素蛋白多糖4的IgE抗体的抗癌促炎作用
免疫组织化学,免疫荧光,流式细胞术,转录组学分析,动物实验

肿瘤相关抗原硫酸软骨素蛋白多糖4(CSPG4)是一种高度糖基化的跨膜蛋白聚糖。尽管在一些正常组织中中报道了CSPG4表达,CSPG4在几种实体瘤中过表达,包括恶性黑色素瘤、乳腺癌亚群、间皮瘤和神经母细胞瘤。因此CSPG4被认为是癌症靶向免疫疗法的有希望的靶标。几种CSPG4靶向疗法已在临床前和临床研究中进行了评估,显示初步疗效和良好的安全性。尽管检查点抑制剂抗体免疫疗法的批准取得了实质性进展,但晚期疾病的 5 年生存率仍然很低(< 55%)。许多患者的肿瘤对现有的免疫和靶向治疗没有反应,或者获得性耐药性迅速发展。因此,针对黑色素瘤相关抗原(如CSPG4)的免疫疗法可以有效地引导免疫细胞对抗癌症并解决重大未满足的需求。靶向黑色素瘤相关抗原的 IgE 类抗体尚未得到评估。该研究发表于《Nature Communications》,IF:17.694。
技术路线:

主要研究结果:
1. CSPG4在恶性黑色素瘤组织中的过表达,以及CSPG4 IgE的工程和表征
公开数据集的转录组学分析证实,在几种肿瘤细胞系(每种癌症类型n = 4-8)和人类癌症组织(每种癌症类型n = 127-102)中,与其他肿瘤类型相比,黑色素瘤中CSPG1075基因表达水平显著更高(图1a,b),以及皮肤黑色素瘤(n = 461)与正常皮肤(n = 558)组织相比(图1c)。此外,在原发性和转移性疾病(皮肤、内脏和淋巴结转移)中测量CSPG4基因表达(图1d,左,n = 36-208),以及黑色素瘤的所有阶段(图1d,右)。使用小鼠抗人CSPG4抗体(通过碱性磷酸酶(AP,粉红色)检测)在人黑色素瘤中的免疫组织化学(IHC)评估(n = 428,图1e),和几个正常组织(n = 389)表明在4%的恶性黑色素瘤中可检测到CSPG63蛋白表达(n = 428,图1l)。
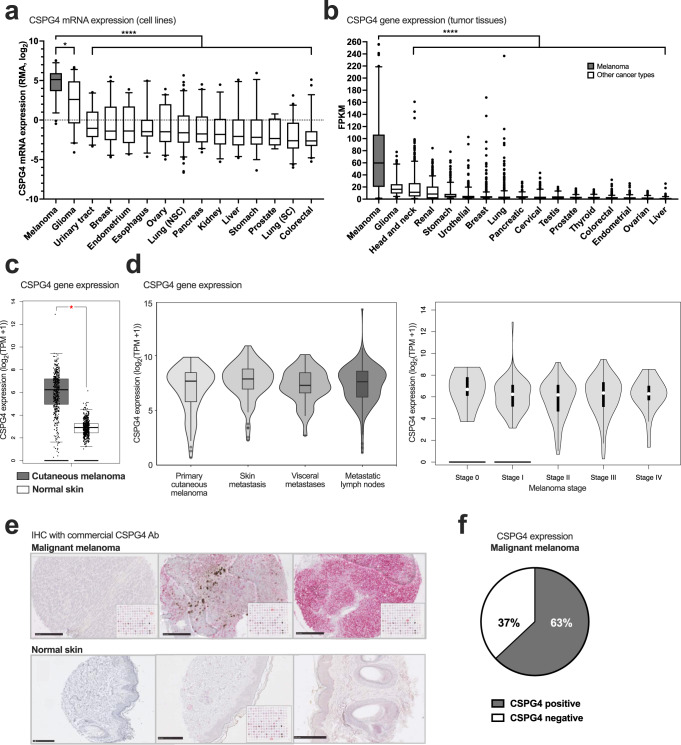
图1 CSPG4在恶性黑色素瘤和正常组织中的表达
先前已经报道了同类首创的MOv18 IgE的抗肿瘤功能,并指出IgE参与肿瘤微环境(TME)中表达Fcε受体的免疫效应细胞(如单核细胞和巨噬细胞)的参与和重编程。作者从CSPG4特异性克隆中生成了具有人IgE恒定结构域和小鼠可变区域的单克隆抗体(图2a)。亲和纯化的CSPG4 IgE显示出与MOv18(FRαIgE)相当的生物物理特性。SDS聚丙烯酰胺凝胶电泳(SDS-PAGE),在还原和非还原条件下,以及体积排阻高效液相色谱(SEC-HPLC)证实了亚基组成和分子量与等效IgE一致的单分散产物,纯度通常高于95%(图2b)。
流式细胞术和IHC分析(图2c-f)证明了CSPG4 IgE与已知表达人CSPG4的人黑色素瘤细胞系的剂量依赖性结合(A2058,A375,WM1366)。正如预期的那样,作者没有检测到与IGROV1卵巢或SKBR3乳腺癌细胞的结合(图2c)。与FRα IgE相比,CSPG4 IgE与表达FcεRI的大鼠嗜碱性白血病细胞(RBL-SX38)结合(图2c,右)。根据使用商业小鼠抗体克隆的IHC评估,CSPG4 IgE显示所有恶性黑色素瘤的阳性染色率为~70-75%(n = 468),当分为皮肤病变,淋巴结和远处转移时(n = 302)。良性痣(n = 18)显示CSPG4 IgE检测到低/中等CSPG4表达(图2d,e,左),CSPG4表达在黑色素瘤的所有阶段都保持不变(图2e,右)。与正常人体组织的结合(n = 297)为阴性或低,除了大脑、消化、内分泌、眼睛和女性生殖组织,其中在一定比例的组织中观察到低或中等CSPG4表达(图2l)。
因此,在恶性黑色素瘤中检测到CSGP4表达,并且在正常组织中表现出低且有限的分布。嵌合CSPG4 IgE和小鼠抗人CSPG4克隆通过IHC显示出与人体组织的相当结合,并识别出表达CSPG4的黑色素瘤细胞。

图2 CSPG4 IgE 的生成、生物物理表征和癌症特异性
2. CSPG4 IgE可发挥体外抗肿瘤功能
接下来,作者评估了CSPG4 IgE的潜在抗肿瘤功能。作者分析了CSPG4在人黑色素瘤细胞系(A375,A2058,WM1366,WM115,WM1361,G361和SKMEL28)中与未知表达CSPG4的细胞(IGROV1卵巢和SKBR3乳腺癌细胞以及原代非恶性黑色素细胞)中的相对表达(图3a)。
此前有报道称,CSPG4及其下游信号通路在黑色素瘤细胞中的高表达可能有助于肿瘤进展1,35.由于Fab介导和Fc介导的针对肿瘤细胞的抗肿瘤IgE抗体的效应功能可能会限制癌细胞的生长,作者研究了CSPG4 IgE是否会在体外损害癌细胞功能。首先,作者研究了在没有交联或效应细胞的情况下,作者的抗体对癌细胞功能的Fab介导的直接影响。与非特异性同种型对照相比,CSPG375 IgE部分抑制了A4细胞粘附,迁移和侵袭(图3b)。此外,CSPG4 IgE通过其Fc结构域与RBL-SX38细胞结合并通过多克隆抗IgE交联可以触发细胞脱颗粒(通过β-己糖胺酶释放测量),类似于阳性对照交联半抗原特异性(NIP)IgE。在存在高CSPG4表达的A4和A375黑色素瘤细胞的情况下,CSPG2058 IgE比非特异性同种型对照NIP IgE引发的脱颗粒明显更大(图3c)。
CSPG4 IgE 通过健康志愿者和黑色素瘤患者来源的外周血单核细胞 (PBMC) 触发了高于同种型对照 IgE 的 A2058 和 A375 黑色素瘤细胞的显著抗体依赖性细胞毒性 (ADCC)(图3d,分别为左和右)和人单核细胞U937细胞(图3e)。通过流式细胞术证实CSPG4与原代人单核细胞上未占用的Fcɛ受体I(FcɛRI)结合(图3l,左)。CSPG4 IgE 介导的 A375 和 A2058 黑色素瘤细胞的 ADCC 由来自两个健康参与者的单核细胞触发(图3l,右)和黑色素瘤患者(图3g)。总之,这些发现表明ADCC功能依赖于靶细胞的抗原表达。
与非特异性IgE相比,CSGP4 IgE对黑色素瘤细胞具有直接影响,并利用人类健康志愿者和黑色素瘤患者来源的效应细胞触发体外效应器功能,肿瘤细胞细胞毒性和脱颗粒。
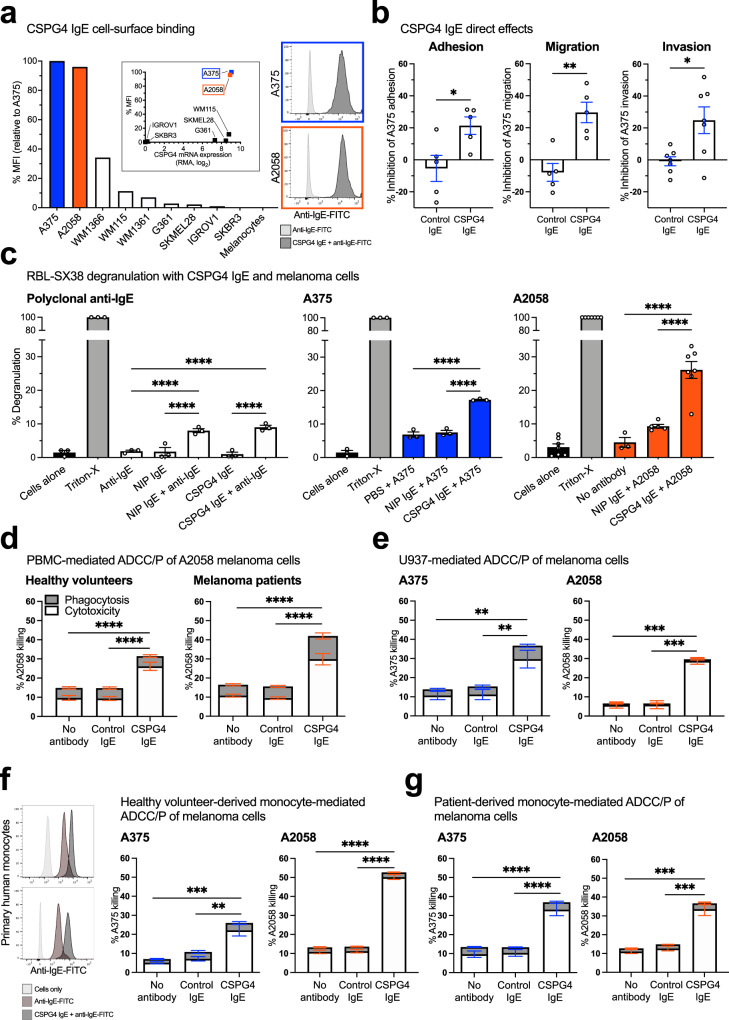
图3 CSPG4 IgE体外的抗肿瘤和Fc介导的效应功能
3. CSPG4 IgE 介导的人单核细胞上清液中免疫介质的上调和单核细胞中促炎细胞表面标志物的表达显著增加
先前的研究表明,IgE刺激免疫效应细胞(如卵巢癌患者单核细胞)可能会增强促炎信号。在这里,作者旨在评估CSPG4 IgE和黑色素瘤的这些功能。在健康的志愿者和黑色素瘤患者中,作者调查了血液;IgE 滴度(分别为 n = 38 和 n = 13)和 PBMC 内单核细胞的总体比例(分别为 n = 25 和 n = 44)和表达高亲和力 IgE Fc 受体 FcɛRI 的单核细胞的比例(分别为 n = 25 和 n = 46)。作者发现这些参数中的任何一个都没有显著差异(图4a,左三张图)。同样,在评估健康志愿者和黑色素瘤患者血清中的趋化因子和细胞因子谱时,TNF,IL-10,IL-1β,IL-4,GM-CSF,IL-13,M-CSF,VEGF,PDGFA和TGFβ2中没有显著差异,而黑色素瘤队列中的TGFβ1水平显著更高(图4a,右图)。
FcɛRI结合的CSPG4 IgE与多克隆抗IgE交联以模拟人单核细胞U937细胞表面的免疫复合物形成,导致TNF上调(图4b),与先前的发现一致。随后,在用CSPG4 IgE刺激的人单核细胞的上清液中(图4c),与单独给予IgE的细胞相比,当CSPG1 IgE交联时,作者检测到分泌的TNF,IL-6β,IL-2和CCL-1 / MCP-4显著增加,而IL-4和IL-23滴度没有观察到显著差异。单核细胞表面标志物的流式细胞术分析(图4d)表明,与单独给予IgE的细胞相比,IgE交联导致共刺激和活化分子CD80,CD86,PD-L1,CD40和HLA-DR的表达显著增加,并且清除受体CD163和CCR2的表达降低。与非特异性IgE对照共培养物相比,在与表达CSPG4的A4癌细胞共培养物中,以抗原特异性方式与原代单核细胞结合的CSPG2058 IgE的交联也引发了TNF,CCL-2 / MCP-1,IL-10和IL-6的分泌显著增加,但IL-4和IL-23的分泌没有增加(图4e)。
人单核细胞表面CSPG4 IgE的交联显著增加了促炎细胞因子和共刺激细胞表面标志物的产生和表达。
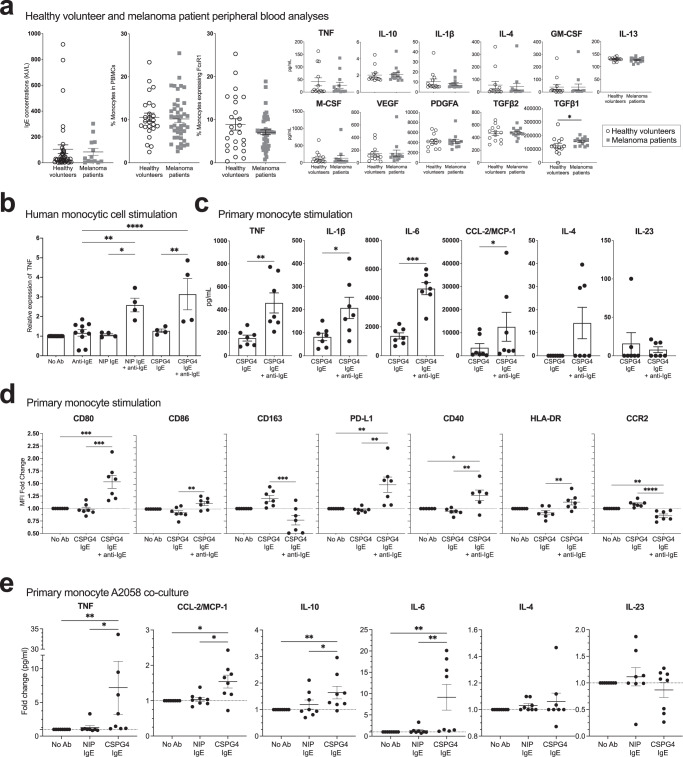
图4 人单核细胞表面CSPG4 IgE的交联促进促炎细胞因子的分泌并增强共刺激细胞表面标志物的表达
4. CSPG4 IgE 限制体内黑色素瘤肿瘤生长
作者研究了CSGP4 IgE是否可以限制免疫缺陷(NOD / scid / IL-2R γ-/−)小鼠体内人类黑色素瘤的生长。由于人IgE不与表达FcεR的小鼠免疫细胞发生反应,因此将小鼠移植健康志愿外周血免疫细胞,并用A375黑色素瘤细胞皮下攻击(图5a)。30天后切除的肿瘤保留CSPG4表达(图5b)。与IgE同种型对照和相应的CSPG4 IgG治疗相比,每隔4天或7天给予CSPG14 IgE显著限制了小鼠皮下人黑色素瘤异种移植物的生长(图5c)。
与先前抗FRα IgE的体内评估一致11,13,切除肿瘤的免疫组织化学分析显示,与给予同种型对照IgE或CSPG45 IgG的小鼠肿瘤相比,用CSPG68 IgE治疗的小鼠肿瘤中人CD4白细胞浸润,CD4巨噬细胞浸润显著更高(图5d)。

图5 CSPG4 IgE治疗可以限制肿瘤生长,并在移植有健康志愿免疫细胞的皮下A375体内模型中诱导人免疫细胞浸润
为了深入了解与IgE抗体治疗效果相关的免疫途径,对这些体内实验结束时检索到的黑色素瘤样品进行了基因表达分析。与对照组相比,在CSPG4 IgE处理动物的表达CSPG4的异种移植物中观察到单核细胞和巨噬细胞基因特征的表达增强(图6a)。根据倍数变化对Reactome内基因集的富集进行排名(图6b)。转录组学分析揭示了IgE治疗组中富集的几种免疫信号通路,包括FcɛRI,TNF受体,干扰素,白细胞介素-1和-12,抗原呈递相关通路和MHC I / II类呈递(图6c)。这些发现与单核细胞和巨噬细胞的潜在活性以及促炎信号一致,包括TNF产生升高,这也与CSPG4 IgE刺激人单核细胞离体观察到(图4c,e),并在用CSPG4 IgE静脉内治疗的小鼠的黑色素瘤异种移植物中浸润人免疫细胞(图5d)。

图6单核细胞和巨噬细胞特征,以及 Fcɛ 受体和促炎免疫途径的激活,在体内进行 CSPG4 IgE 治疗
为了进一步评估CSPG4 IgE在限制黑色素瘤传播方面的作用,通过尾静脉用A375黑色素瘤细胞攻击移植了健康志愿者外周血免疫细胞的小鼠,导致肺部病变的形成。与对照组IgE相比,28天后切除的肺显示每肺黑色素瘤病变数量显著降低,并且CSPG4 IgE的肺部肿瘤占用百分比呈降低趋势(图7a)。为了评估CSPG4 IgE是否可以限制患者免疫细胞背景下黑色素瘤的生长,移植黑色素瘤患者来源免疫细胞的小鼠接受了皮下A375人黑色素瘤的挑战。与无抗体或非特异性同种型IgE对照组相比,静脉注射CSPG29 IgE治疗的小鼠黑色素瘤异种移植重量(肿瘤激发后4天)显著降低(图7b,左)。同样,与PBS和同种型对照IgE组相比,用CSPG4 IgE治疗的小鼠的肿瘤生长受到显著限制(图7b,右)。在PBS和同种型对照IgE处理的动物之间测量肿瘤重量或肿瘤体积没有统计学上的显著差异(图7b)。此外,为了研究CSPG4 IgE限制患者来源黑色素瘤生长的潜力,小鼠移植了来自两个III期和IV期皮肤黑色素瘤转移个体的患者来源的皮肤黑色素瘤肿瘤异种移植物(PDX),并移植了来自同一患者的自体外周血淋巴细胞(PBL)。与对照组相比,每周静脉注射CSPG4 IgE治疗与显著延长的生存期相关(图7c)。
因此,在移植有健康志愿者或黑色素瘤患者免疫细胞的免疫缺陷小鼠和用自体患者免疫细胞重组的PDX小鼠中,不同的体内黑色素瘤模型与对照组相比,CSPG4 IgE与显著的肿瘤生长限制或生存率提高有关。CSPG4 IgE在体内的疗效与肿瘤中CD68巨噬细胞的显著浸润以及转录组水平上Fcɛ受体和几种促炎免疫途径的显著激活有关。
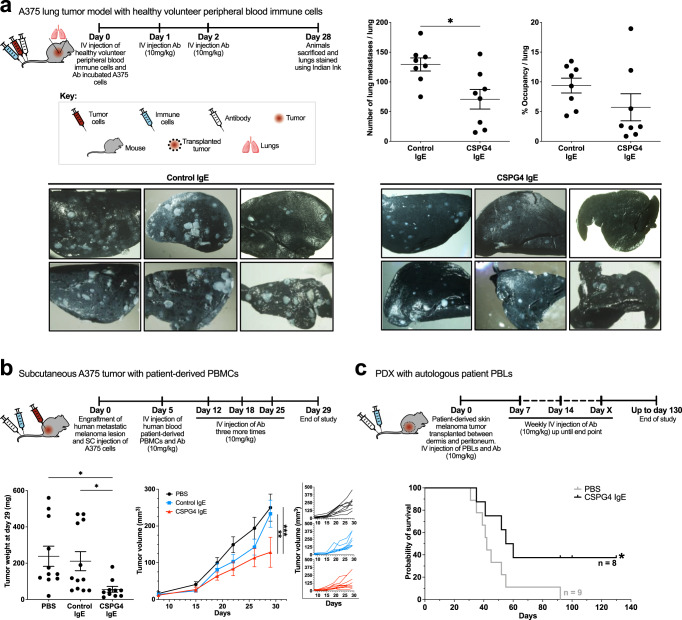
图7 CSPG4 IgE在A375和PDX肿瘤模型中的疗效
5. 对CSPG4 IgE的潜在I型超敏反应的体外和离体评估
为了初步了解与IgE相关的I型超敏反应风险,作者询问了CSPG4 IgE是否可以增强患者来源的循环嗜碱性粒细胞的脱颗粒作用。首先,在RBL-SX4脱颗粒模型中测试了CSPG38 IgE在存在健康和患者血清的情况下触发脱颗粒的潜力。虽然NIP IgE(阳性对照)通过其特异性多聚体抗原(NIP-BSA)的交联引发了显著的脱颗粒,但与来自健康志愿者(n = 4)和黑色素瘤患者(n = 16)的血清一起与CSPG15 IgE孵育时,背景以上没有引发脱颗粒(图8a)。此外,使用嗜碱性粒细胞活化试验(BAT)在黑色素瘤患者的全普通血液中研究了IgE离体对原代人嗜碱性粒细胞的潜在活化(图8b-d)。该测定用于测试对药物和过敏原过敏的可能性。用已知的嗜碱性粒细胞活化刺激孵育患者血液;非IgE介导的fMLP,IgE介导的抗FcεRI和抗IgE,以及NIP IgE与NIP-BSA一起触发SSC的激活低CCR3高嗜碱性粒细胞(通过增加CD63细胞表面表达来测量)(图8c)。CSGP4 IgE和非CSPG4对照IgE在黑色素瘤患者的全血样本中离体孵育时都不会触发嗜碱性粒细胞活化(n = 15)(图8d)。
CSPG4 IgE在存在患者血清的情况下未诱导RBL-SX38细胞脱颗粒,并且未激活黑色素瘤患者全血中的嗜碱性粒细胞。这些发现为患者血清和血液中缺乏CSPG4 IgE离体嗜碱性粒细胞活化的早期信号提供了初步指示。
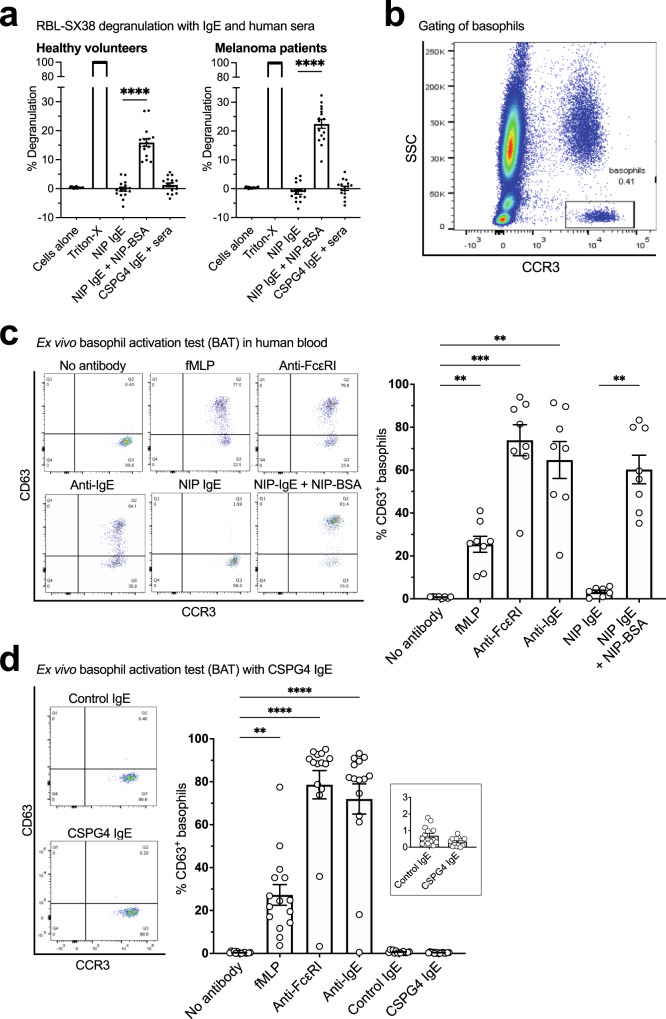
图8 CSPG4 IgE 在患者或健康参与者存在人血清的情况下不介导 RBL-SX38 细胞脱颗粒,也不会触发癌症患者离体血液中的嗜碱性粒细胞活化
结论:
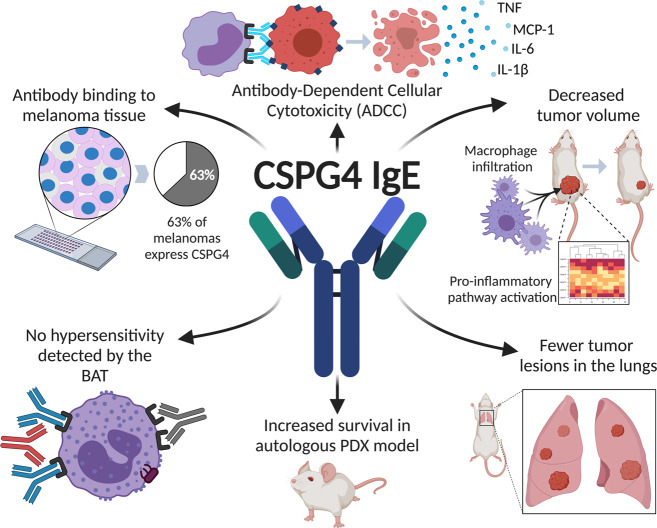
总之,该研究表明,CSPG4 IgE介导的抗肿瘤活性来自健康志愿者和黑色素瘤患者的免疫细胞对表达CSPG4的人黑色素瘤细胞。CSPG4 IgE治疗限制了不同体内模型中的肿瘤生长或生存率的提高,无论肿瘤部位如何,并且植入健康志愿者或患者的免疫细胞。作者还证明CSPG4 IgE增加了巨噬细胞肿瘤浸润,并与几种促炎免疫途径的激活有关。这些细胞和促炎信号传导先前已在临床前被描述为对IgE疗法的稳健抗肿瘤活性很重要。最后,离体BAT提供了对CSPG4 IgE不存在I型超敏反应的初步证据,尽管其在临床环境中的应用尚未确定。这些有希望的发现可能对治疗不同的实体瘤具有深远的益处,特别是那些缺乏批准的癌症靶向抗体疗法的实体瘤。
示意图:
参考文献:
Chauhan J, Grandits M, Palhares LCGF, et al. Anti-cancer pro-inflammatory effects of an IgE antibody targeting the melanoma-associated antigen chondroitin sulfate proteoglycan 4. Nat Commun. 2023 Apr 25;14(1):2192.






