lncRNA LINC01554调控的G3BP2促进食管鳞状细胞癌转移
转移是食管鳞状细胞癌(ESCC)患者死亡的主要原因。尽管越来越多的研究表明G3BP2参与了几种人类癌症,但G3BP2如何与长链非编码RNA相互作用并调控mRNA转录在介导ESCC转移中仍不清楚。在本研究中,我们发现G3BP2在ESCC中表达上调。进一步分析发现,G3BP2表达上调与ESCC患者的淋巴结转移、肿瘤浸润深度及不良预后显著相关。体外和体内功能测试均表明,G3BP2显著增强ESCC细胞的迁移和侵袭能力。在机制上,LINC01554通过泛素化保护G3BP2免于降解来维持G3BP2在ESCC中的高表达,并确定了LINC01554和G3BP2之间的相互作用域。此外,RNA-seq显示HDGF受G3BP2调控。G3BP2与HDGF mRNA转录本结合以稳定其表达。异位表达HDGF可有效消除G3BP2消耗介导的肿瘤细胞迁移抑制作用。有趣的是,引入可抑制G3BP2的化合物C108可显著抑制体外和体内ESCC细胞的转移。总之,本研究描述了一个新发现的促进食管鳞癌转移的调控轴LINC01554/G3BP2/HDGF,并将为食管鳞癌提供新的治疗策略。本文于2021年11月发表于“Oncogene”(IF=9.867)。
技术路线
结果
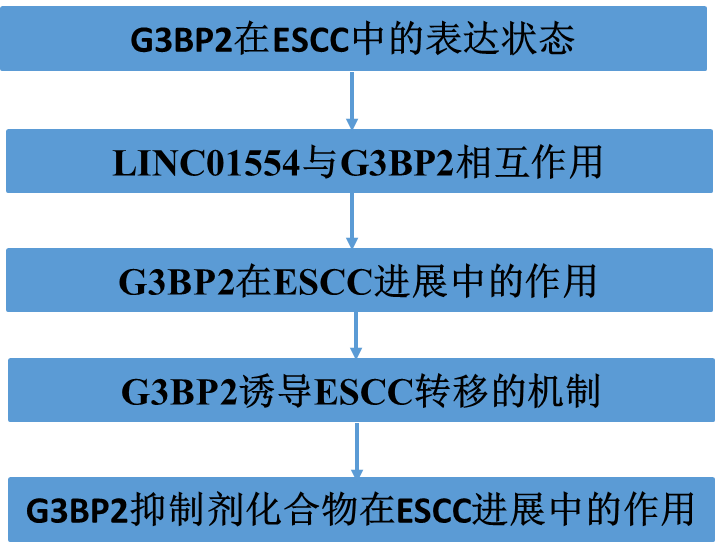
1)在ESCC患者中,G3BP2的上调与不良预后相关
为了研究G3BP2在ESCC中的表达状态,我们首先对Oncomine和TCGA数据库进行大数据挖掘。这两个数据库表明G3BP2高表达ESCC(图1A),这进一步在SYSUCC队列证实mRNA水平(图1 B)。Western blot也检测到G3BP2在ESCC细胞中的表达升高(图1C)。为了探讨G3BP2在ESCC中表达上调的临床意义,我们通过免疫组化染色研究了包含183个原发性ESCC和93对非肿瘤组织的组织芯片(图1D)。结果显示G3BP2在ESCC组织中高表达(图1E)。此外,G3BP2高表达与淋巴结转移(图1F)和肿瘤浸润深度(图1G)显著相关。KaplanMeier分析显示,G3BP2高表达导致ESCC患者总生存期较差(图1H)。所有这些数据都说明了G3BP2高表达水平与ESCC进展之间的相关性。
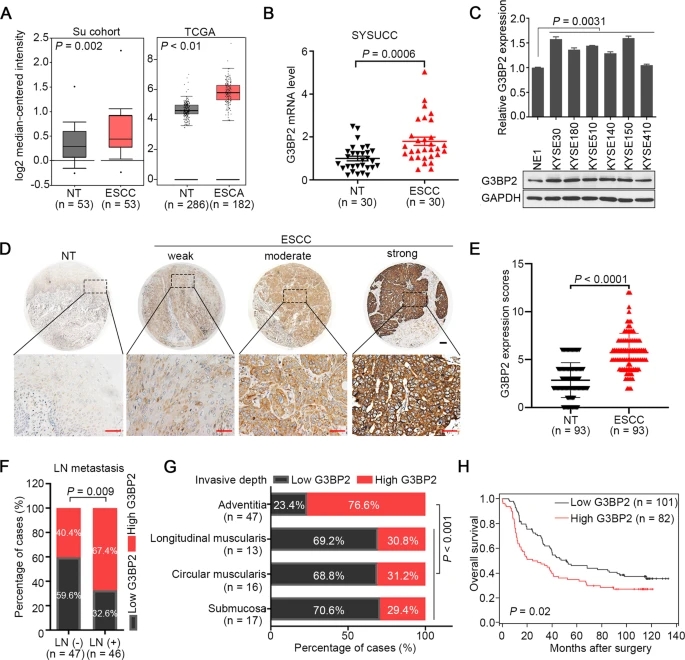
2)LINC01554保护G3BP2免受泛素蛋白酶体降解
根据G3BP2的结构特征,我们探究其是否与非编码RNA相互作用。catRAPID和RPI-seq平台均强烈提示G3BP2和LINC01554之间存在相互作用的可能性(图2A, B)。RNA FISH-IF检测结果显示,G3BP2和LINC01554共定位于细胞质中(图2C)。RIP检测结果显示,G3BP2能特异地沉淀LINC01554(图2D)。RNA下拉实验进一步表明,LINC01554探针(而非其反义探针)显著拉下G3BP2蛋白(图2E)。接下来,我们研究了LINC01554是否调控了G3BP2的表达。在LINC01554转染的KYSE30和KYSE150细胞中检测到G3BP2的RNA和蛋白,我们发现在LINC01554转染后,G3BP2在蛋白水平上增加,而在RNA水平上没有增加(图2F)。另外,在LINC01554转染的细胞中,G3BP2蛋白的半衰期明显延长(图2G,左图)。为了检验G3BP2的降解是否通过泛素介导的蛋白酶体系统发生,我们进行了体外泛素化实验,发现LINC01554降低了G3BP2泛素化水平(图2G,右图)。因此,这些数据表明LINC01554与G3BP2相互作用,并保护其免受泛素-蛋白酶体系统介导的蛋白降解。
为了证实G3BP2的RRM域与LINC01554的相互作用,我们建立了RRM域缺失的G3BP2突变体。RIP(图2H)和RNA pull-down检测(图2I)的结果表明,G3BP2的RRM结构域确实与LINC01554结合。RRM结构域消除后,G3BP2蛋白表达减少,这是由于泛素化促进了蛋白降解(图2J-L)。接下来,我们利用catRAPID平台预测LINC01554中与G3BP2相互作用所必需的特异性结合序列。从图2M中可以看出,1-600 bp的核苷酸序列交互得分较低,而600-800 bp的核苷酸序列交互得分最高。1400-1931 bp序列也呈现较高的交互得分。根据上述结果,并考虑LINC01554的二级结构长度,LINC01554与G3BP2的实际结合序列可能在400-900 bp之间。此后,我们构建并生物素化了LINC01554的三个截短片段(片段1:1 - 500 bp,片段2:400 - 900 bp,片段3:1400 - 1931 bp),用于KYSE30细胞裂解液的RNA拉下实验,发现LINC01554的片段2确实拉下了G3BP2(图2N)。为了进一步研究LINC01554中片段2与G3BP2相互作用的不可或缺的功能,我们构建了一个缺失片段2的LINC01554突变体。RIP和RNA pull-down检测的结果显示,片段2在介导LINC01554与G3BP2相互作用中发挥了不可或缺的作用(图2O, P)。此外,在LINC01554中去除片段2后,G3BP2蛋白表达降低(图2Q, R)。综上所述,LINC01554主要通过400-900 bp的核苷酸结构域与G3BP2的RRM结构域结合。
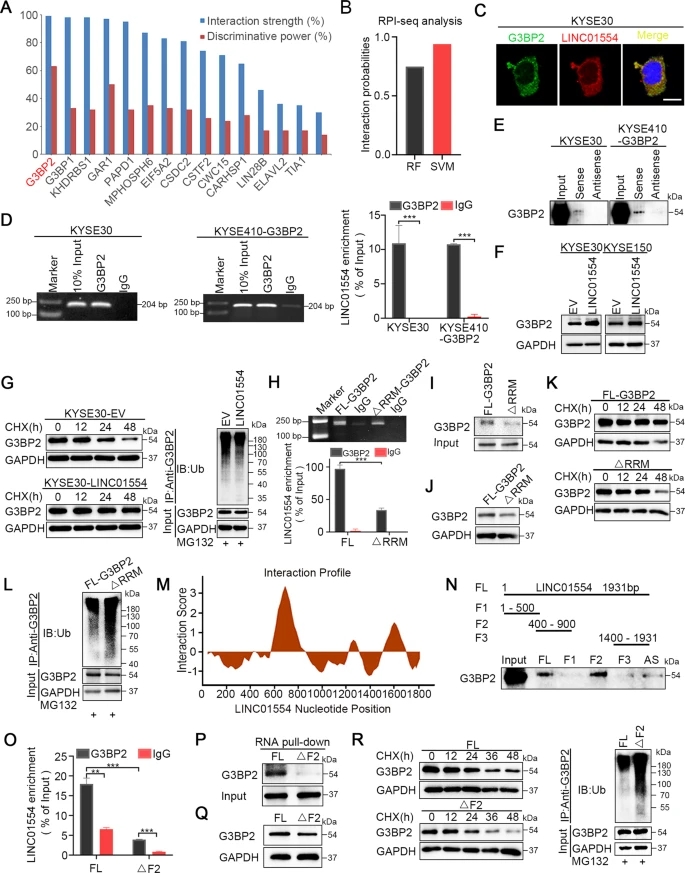
3)G3BP2在体外和体内促进ESCC细胞转移
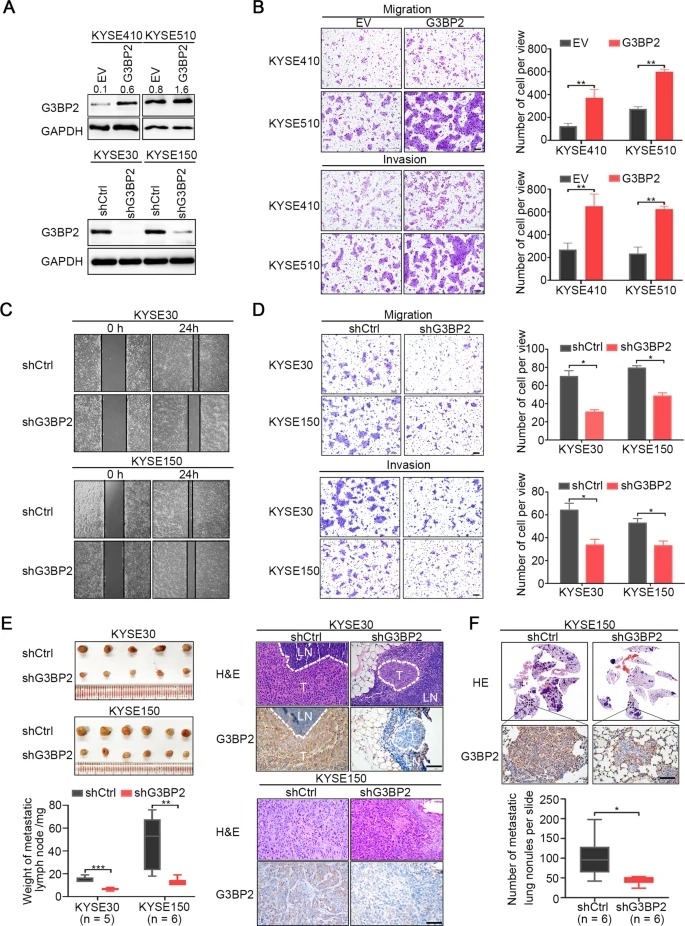
鉴于G3BP2在ESCC中表达升高的临床意义和机制,我们接下来探讨G3BP2在ESCC进展中的作用。我们分别在内源性G3BP2低表达细胞(KYSE410和KYSE510细胞)和内源性G3BP2高表达细胞(KYSE30和KYSE150细胞)中建立了异位表达或敲除G3BP2的稳定细胞系。Western blot检测过表达和敲除效率(图3A)。G3BP2在KYSE410和KYSE510细胞中的异位表达显著增加了ESCC细胞的迁移和侵袭(图3B),而在KYSE30和KYSE150细胞中敲除G3BP2则显著降低了细胞的转移能力(图3C, D)。我们进一步在体内使用淋巴结和肺转移性裸鼠模型评估了G3BP2的功能。在淋巴结转移模型小鼠中,敲除组的淋巴结更小、更轻,且G3BP2表达更低(图3E)。在肺转移模型小鼠中,我们还发现,敲除组分离的肺组织中,与对照组相比,转移结节更少,G3BP2的表达更低(图3F)。综上所述,提示G3BP2在促进食管鳞癌转移中具有重要作用,与其临床意义一致。
4)G3BP2稳定HDGF mRNA转录
为了确定G3BP2调控的mRNA转录物参与诱导ESCC转移,我们对G3BP2敲除的KYSE30和KYSE150细胞进行了RNA-seq测序。根据P< 0.05和log2 (fold change) > 1的筛选标准,在KYSE30细胞和KYSE150细胞中分别鉴定出387和263个差异下调基因,其中在两个细胞系中共有25个基因(图4A)。我们发现在前10个差异下调基因中,无论KYSE30和KYSE150细胞中,HDGF都出现了较大的fold change,P值都非常显著(图4B)。为了验证RNA-seq结果,我们检测了稳定的G3BP2敲除细胞株中HDGF的RNA和蛋白水平,发现与对照细胞相比,HDGF的RNA和蛋白水平显著降低(图4C)。免疫组化染色分析还显示,转移性淋巴结和来自G3BP2敲除KYSE150细胞的肺组织中HDGF低表达(图4D)。接下来,我们试图弄清楚G3BP2如何调节HDGF的表达。G3BP2属于RNA结合蛋白类,已有报道通过其RNA结合结构域稳定SART3 mRNA转录。基于此,我们推断G3BP2通过类似的机制调控HDGF的表达。我们进行了一个RIP试验来验证我们的推测,并发现G3BP2确实与HDGF mRNA转录本结合(图4E)。mRNA半衰期实验显示,沉默G3BP2导致HDGF mRNA稳定性显著降低(图4F)。最后,我们阐明了G3BP2和HDGF表达在ESCC中的相关性。我们在34个ESCC样本的SYSUCC队列中检测G3BP2和HDGF的RNA表达水平,发现G3BP2和HDGF的表达呈正相关(图4G)。这些发现表明G3BP2通过稳定HDGF的mRNA转录来调节HDGF的表达。
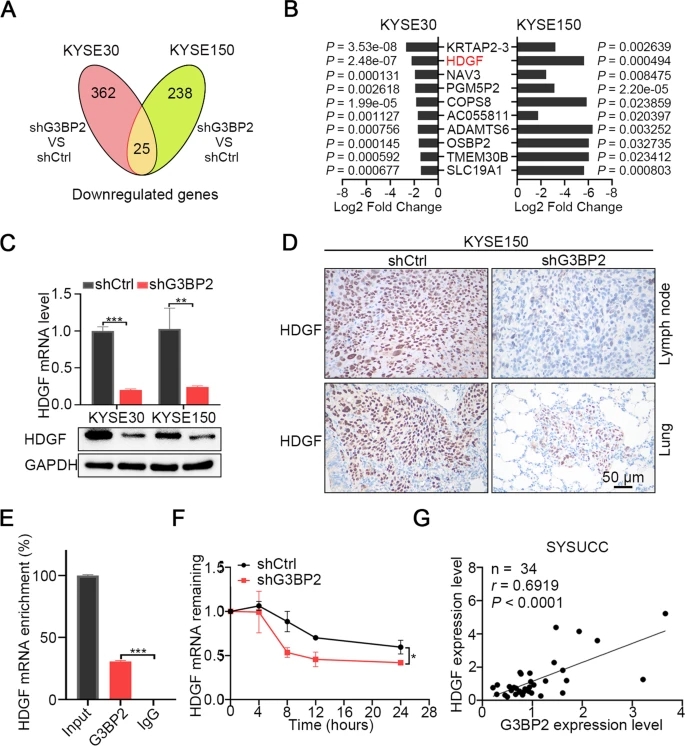
5)LINC01554/G3BP2/HDGF信号轴促进ESCC细胞转移
鉴于LINC01554控制着G3BP2的蛋白稳定性,HDGF mRNA转录本受G3BP2调控,我们进一步研究LINC01554/G3BP2/HDGF调控信号轴是否在驱动ESCC转移中发挥关键作用。首先,通过迁移和侵袭transwell实验验证了G3BP2和LINC01554相互作用对食管鳞癌转移的影响。结果显示,在KYSE30细胞中,无论是消除G3BP2中的RRM结构域,还是消除LINC01554中的片段2,都显著减弱了细胞的迁移和侵袭能力(图5A, B)。为了证实G3BP2介导LINC01554 -促进ESCC细胞转移,我们在LINC01554转染的KYSE30细胞中沉默了G3BP2。我们发现G3BP2蛋白表达明显降低(图5C),细胞转移消失(图5D)。此外,诱导表达LINC01554逆转了G3BP2的表达(图5E),并在G3BP2沉默后功能上挽救了细胞迁移和侵袭的减少(图5F)。考虑到HDGF受G3BP2调控,我们在KYSE30细胞中检测了HDGF的表达。结果显示,异位表达LINC01554后,HDGF的表达水平升高,但删除LINC01554与G3BP2相互作用的区域后,HDGF的表达水平降低(图5G)。为了阐明HDGF在G3BP2介导的食管鳞癌转移中的关键作用,我们在G3BP2敲除细胞中表达了HDGF,并发现HDGF的蛋白表达被挽救(图5H)。Transwell迁移实验显示,过表达HDGF促进ESCC细胞迁移,并有效挽救了沉默G3BP2引起的细胞迁移减少(图5I)。最后,我们用RNA FISH检测了LINC01554的表达,用IHC染色检测了G3BP2和HDGF的表达,发现LINC01554、G3BP2和HDGF的表达具有相同的模式。在ESCC中,LINC01554高表达时,G3BP2和HDGF表达增加,而在相应的非肿瘤组织中,LINC01554低表达,G3BP2和HDGF表达降低(图5J)。综上所述,LINC01554/G3BP2/HDGF信号转导轴在促进食管鳞癌转移中发挥了重要作用。
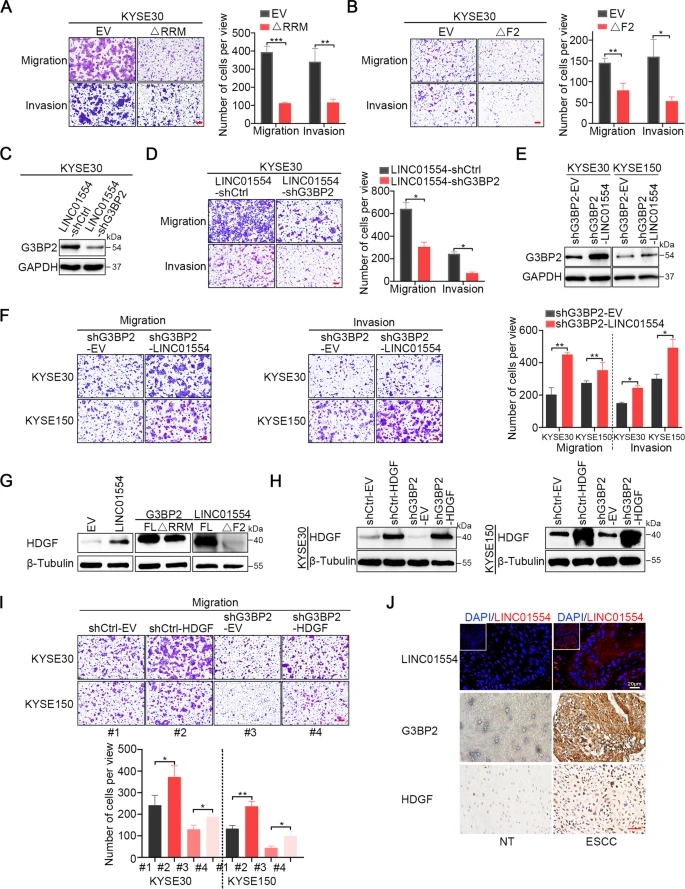
6)一种G3BP2抑制剂化合物C108能有效地消除体外和体内ESCC细胞的转移
化合物C108是Nisha Gupta等人在2017年开发的一种抑制包括G3BP2在内的几种蛋白质的小分子。据报道,它可以阻断RRM域,进而破坏SART3 mRNA的稳定性,从而导致乳腺癌的肿瘤抑制。为了测试化合物C108是否可以消除G3BP2和LINC01554之间的相互作用,并可能用于阻断G3BP2诱导的ESCC转移,我们首先用化合物C108处理G3BP2过表达的KYSE410细胞,LINC01554转染的KYSE30细胞和相应的对照细胞,然后观察G3BP2的表达和肿瘤细胞的转移能力。Western blot结果显示,化合物C108处理后细胞中G3BP2的表达显著降低(图6A)。由于G3BP2的表达减少,肿瘤细胞的迁移和侵袭均受到抑制(图6B)。为了进一步证实化合物C108对G3BP2表达及肿瘤细胞转移的抑制作用,我们将化合物C108引入内源性G3BP2高表达的KYSE30和KYSE150细胞。化合物C108处理后的细胞中G3BP2表达降低,肿瘤细胞迁移和侵袭能力降低(图6C, D)。此外,在转染LINC01554的KYSE30细胞、KYSE30细胞和KYSE150细胞的淋巴结转移小鼠模型中,我们发现与对照组相比,化合物C108处理组的转移淋巴结体积更小、重量更轻(图6E-G)。经G3BP2和HDGF染色的转移淋巴结切片显示,与对照组相比,化合物C108处理组的G3BP2或HDGF的表达均显著降低(图6H)。综上所述,化合物C108可能是一种有希望用于转移性ESCC的治疗方法。
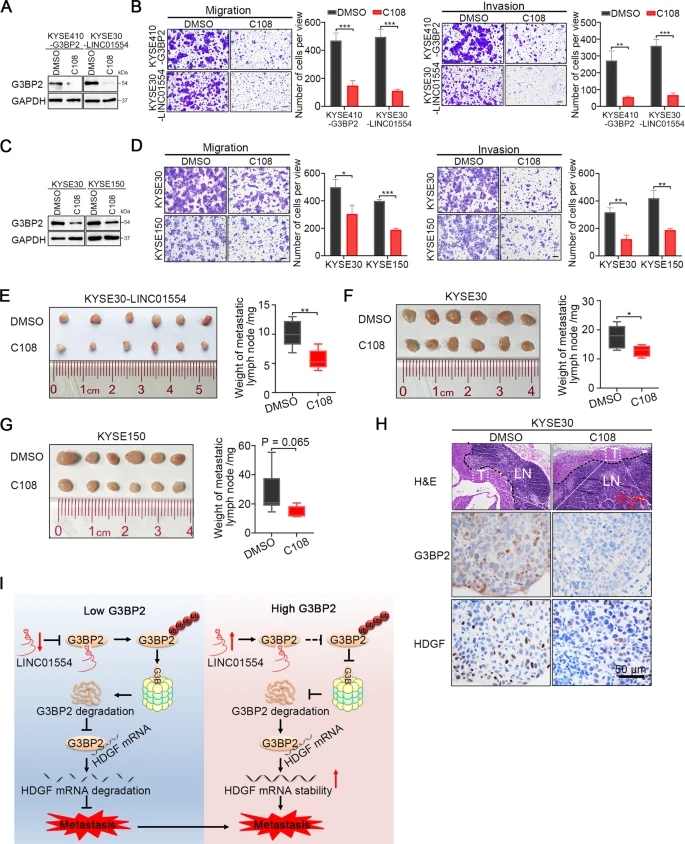
结论:我们的研究结果确定了一个新的调控信号轴LINC01554/G3BP2/HDGF,促进食管鳞癌转移,这可能为开发潜在的食管鳞癌生物标志物和治疗靶点提供合理的策略。
参考文献:
Zheng Y, Wu J, Deng R, Lin C, Huang Y, Yang X, Wang C, Yang M, He Y, Lu J, Su X, Yan Q, Zhu Y, Guan X, Li Y, Yun J. G3BP2 regulated by the lncRNA LINC01554 facilitates esophageal squamous cell carcinoma metastasis through stabilizing HDGF transcript. Oncogene. 2021 Nov 15. doi: 10.1038/s41388-021-02073-0. Epub ahead of print. PMID: 34782720.






