褪黑素和维替泊芬通过调节线粒体动力学协同抑制头颈部鳞状细胞癌的生长和干细胞特性
头颈部鳞状细胞癌(HNSCC)是一种发生于口腔、咽和喉部的恶性肿瘤,其5年生存率大约只有50%,研究与肿瘤发生和转移相关的潜在机制是发展HNSCC治疗的关键。肿瘤干细胞(CSCs)具有无限的自我更新能力和肿瘤启动能力,参与了HNSCC的肿瘤进展、治疗耐药性和复发,而靶向CSC相关通路的药物是癌症治疗的显著疗法。目前,有研究发现褪黑素(Mel)和维替泊芬(VP)具有抗肿瘤作用,可调节线粒体自噬,减弱EMT和相关干细胞特性。该研究发表在《JOURNAL OF PINEAL RESEARCH》,IF:13.007。
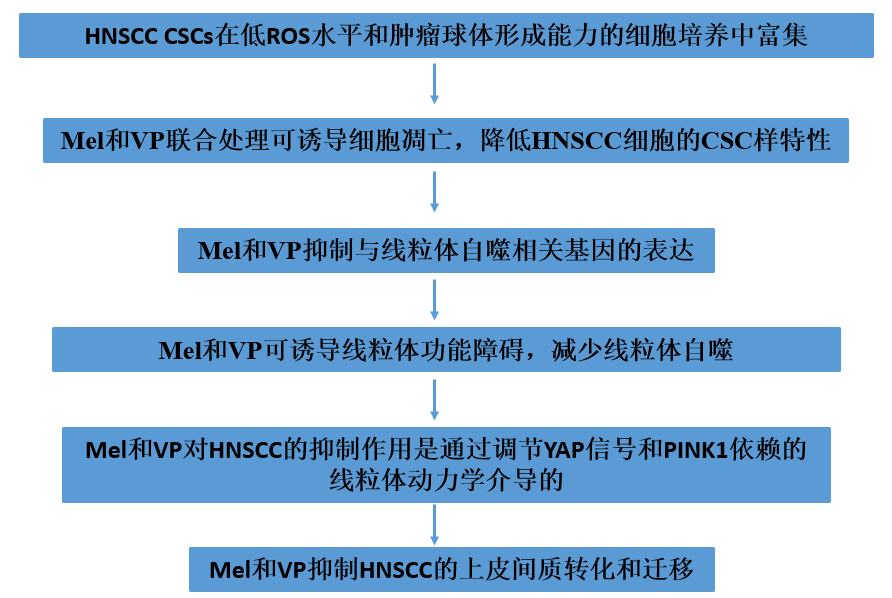
技术路线:
主要研究结果:
1. HNSCC CSCs在低ROS水平和肿瘤球体形成能力的细胞培养中富集
在许多类型的癌细胞中,ROS水平可用于丰富CSC群体,因为CSC居住在相对较低的ROS条件下,以维持静止和自我更新。此外,在3D培养中生长的癌细胞由于不均匀地暴露于氧气和营养物质,可表现出增加的致瘤表型。因此,采用低生理活性氧水平和球体形成特性的细胞培养来研究HNSCC中的CSC亚群(图1)。在正常细胞中,CD44+CD24-和CD133+细胞亚群分别为10.1%和1.14%(图1A)。用CellROX对低活性氧和高活性氧种群分类,细胞内ROS水平被广泛地用于丰富CSC(图1B)。细胞分选后, CD44+CD24和CD133+细胞(ROS-low细胞)明显高于CD44+CD24和CD133+细胞(ROS-high细胞)和正常细胞(图1C-E)。ROS-low细胞表现出由CPDL和顺铂耐药性(cisplatin)决定的CSC特性(图1F,G)。同样, CD44+CD24细胞和CD133+细胞数量分别增加了42.9%和3.41%(图1H-J)。3D培养的SCC-25细胞对顺铂的耐药性增强(图1K)。这些结果表明,在3D培养以及低水平ROS的条件下,HNSCC培养物含有丰富的干细胞群,并表现出CSC样特性。
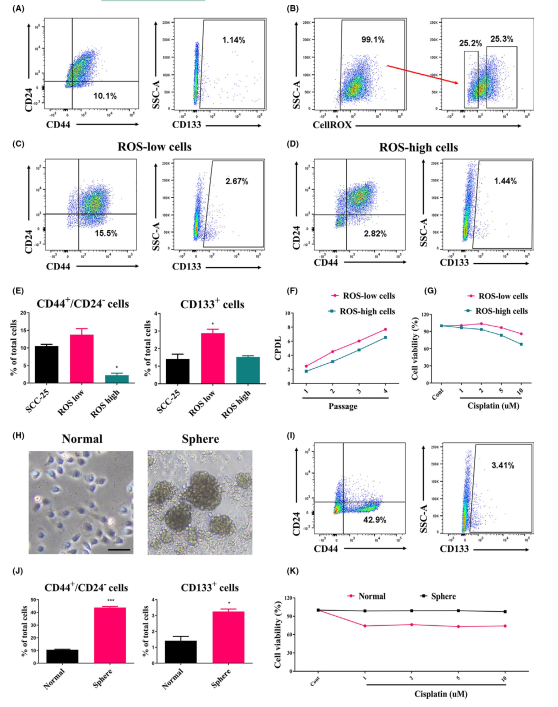
图1 在ROS-low和球形细胞培养中CSCs的特性
2. Mel和VP联合处理可诱导细胞凋亡,降低HNSCC细胞的CSC样特性
为了证明Mel和VP对HNSCC生长的影响,分析了Mel或VP处理后SCC-25细胞的细胞活力(图2A)。单用Mel或VP以剂量依赖的方式抑制细胞活力(图2A)。无论细胞ROS水平如何,Mel (1 mM)和VP (2.5 μm)联合处理对HNSCC细胞活性有协同作用(图2B)。尽管联合治疗组中观察到pAkt/Akt的表达呈下降趋势,但治疗并未改变pAkt/Akt的表达。在联合治疗组中,Cleaved Cas-3/Cas-3表达上调,表明Mel和VP促进HNSCC细胞凋亡(图2C,D)。治疗后进一步观察SCC-25细胞的CSCs特征。Mel和VP单独处理降低了细胞的成球能力,增加了细胞的线粒体ROS水平(图2E-J)。此外,联合处理大大降低了细胞的成球能力和CSC数量,而增加线粒体ROS的产生(图2E-J)。这些结果表明,Mel和VP抑制了HNSCC细胞的活力,并降低了HNSCC的特性和种群数量。
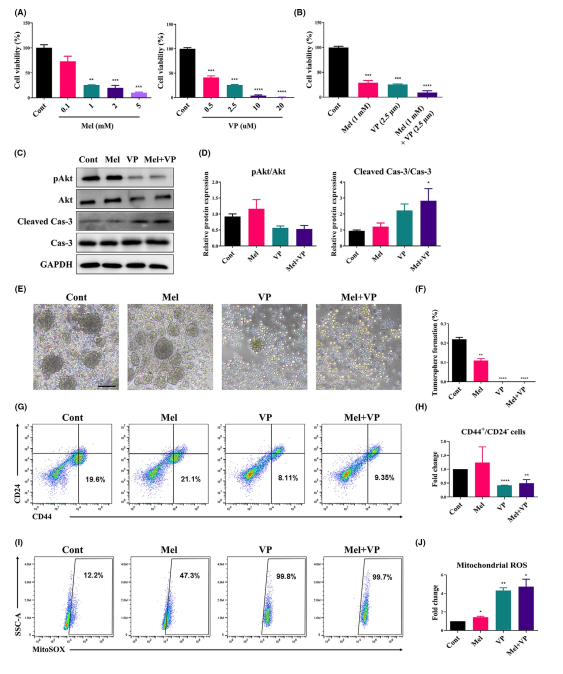
图2 Mel和VP对CSC性能的影响
3. Mel和VP抑制与线粒体自噬相关基因的表达
由于线粒体自噬与癌细胞的增殖和死亡有关,进一步研究了Mel和VP对SCC-25细胞中参与线粒体自噬的基因表达的影响(图3)。VP单独降低了PINK1的表达,与Mel联合显著降低了PINK1和parkin的表达(图3A,B)。用Mel和VP处理ROS低和ROS高的SCC-25细胞,研究其对细胞自噬的调节作用。两种ROS分类的细胞与正常的SCC-25细胞表现出相似的模式(图3C-F)。联合治疗降低了PINK1和parkin的表达,而与细胞内ROS水平无关。然而,线粒体网络相关蛋白FIS1(线粒体分裂)的片段化并未因治疗而改变(图3A-F)。综上所述,这些结果表明Mel和VP通过线粒体自噬而不改变线粒体分裂来抑制HNSCC的生存能力。
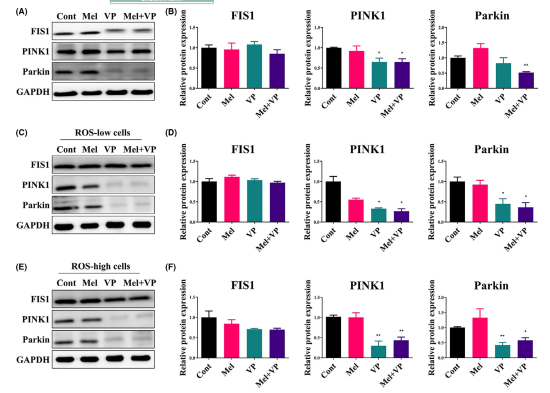
图3 Mel和VP治疗后对线粒体自噬的调节
4. Mel和VP可诱导线粒体功能障碍,减少线粒体自噬
使用TMRE(线粒体膜电位)染色标记活性线粒体,以显示Mel和VP在线粒体损伤中的作用。Mel或VP单独降低线粒体膜电位,它们的结合协同使线粒体失活(图4A,B)。此外,用parkin和TOM20对细胞进行染色,观察ROS-low和ROS-high细胞的线粒体形态和线粒体自噬的表达(图4C,D)。联合治疗降低了ROS-low和ROS-high细胞中parkin和TOM20的表达。染色结果显示,对照组的parkin/TOM20表达主要集中在细胞质中。该治疗改变了相互连接的线粒体网络,并将parkin/TOM20移至靠近细胞核的位置(图4C)。这些数据表明,Mel和VP触发线粒体损伤,导致线粒体自噬减少。
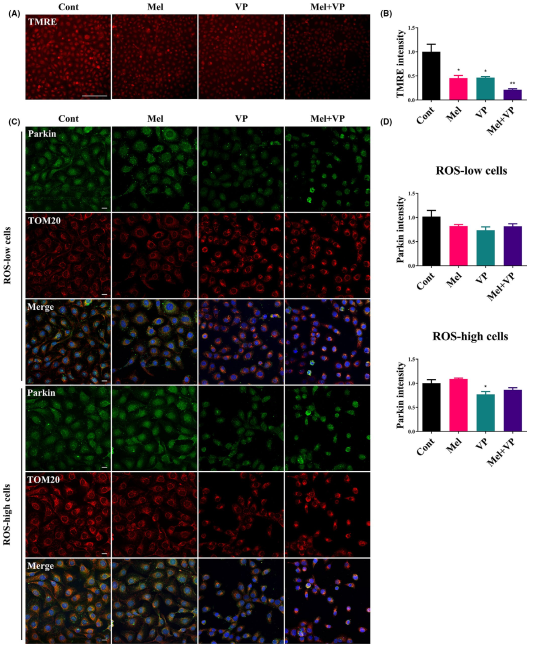
图4 Mel和VP治疗后线粒体功能和线粒体自噬的研究
5. Mel和VP对HNSCC的抑制作用是通过调节YAP信号和PINK1依赖的线粒体动力学介导的
为了研究Mel和VP与YAP信号转导的相关性,分析了Mel和VP处理后SCC-25细胞中YAP靶基因CCN1的表达(图5A-C)。Mel和VP单独降低了CCN1的RNA表达(图5A)。Mel和VP共同作用后,CCN1在mRNA和蛋白水平上的表达均显著降低(图5A-C),说明Mel和VP可能直接下调YAP信号转导,导致YAP靶基因CCN1的表达下降。MPP+ iodide(碘化物)进一步证实了线粒体功能障碍对HNSCC的影响。MPP+ iodide抑制线粒体复合物I,并消耗内源性PINK1,导致线粒体损伤。MPP+ iodide以剂量依赖性的方式显著降低细胞活力(图5D)。进一步评估MPP+ iodide处理的SCC-25细胞中CD44+CD24细胞的百分比(图5E,F)。MPP+ iodide未改变CD44+CD24细胞群。这些结果表明,抑制PINK1可导致HNSCC细胞死亡,而不影响干细胞数量。
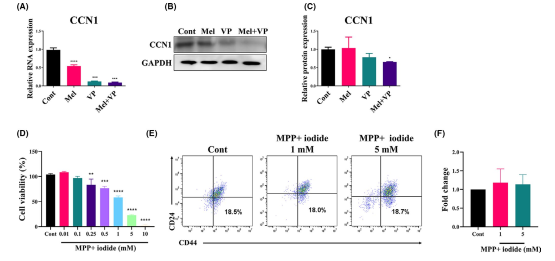
图5 Mel和VP对YAP信号转导的调控及PINK1依赖线粒体动力学的抑制作用
6. Mel和VP抑制HNSCC的上皮间质转化和迁移
EMT在促进肿瘤的侵袭转移方面起着重要作用。为了进一步验证Mel和VP对EMT介导的肿瘤进展的影响,分析了SCC-25细胞中上皮和间充质标志物的表达(图6A,B)。TGF-β1诱导SCC-25细胞发生EMT:包括Vim和N-cad在内的间质标志物在TGF-β1作用下表达升高,而E-cad在TGF-β1作用下表达略有降低(图6A,B)。联合治疗组间充质标志物的表达显著降低,而上皮标志物的表达在各治疗组中略有恢复(图6A,B)。伤口愈合实验结果表明,Mel或VP均显著减少了伤口愈合面积。此外,联合治疗后细胞很少增殖并迁移到划伤区域(约4%)(图6C,D)。在Transwell迁移实验中,Mel和VP减少了向上腔室下表面迁移的细胞数量(图6E,F)。此外,与癌症侵袭转移相关的MMP-2和MMP-9在Mel和VP处理的细胞中表达下调(图6G,H)。这些发现提示Mel和VP可能是HNSCC中EMT、迁移和转移的关键调控因子。
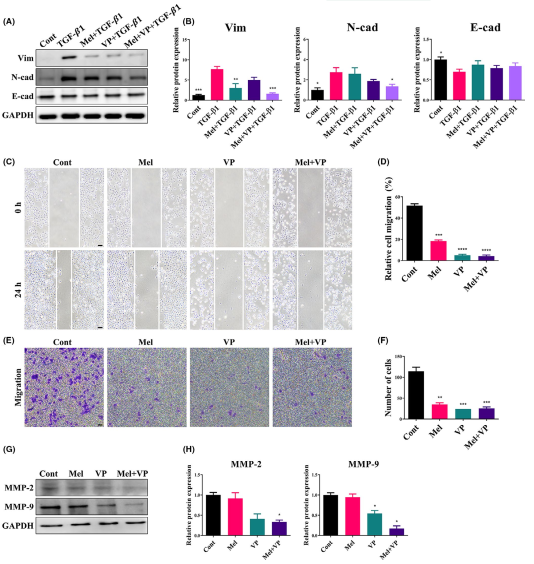
图6 Mel和VP治疗后EMT和转移的调节作用
主要研究结论:
综上所述,研究结果表明ROS-low HNSCC细胞和HNSCC的3D球形培养物表现出增强的CSC特性。此外,Mel和VP通过调节HNSCC中的PINK1/parkin/TOM20轴,导致线粒体损伤和线粒体吞噬功能降低。Mel和VP联合治疗通过调节EMT减少癌细胞转移。因此,Mel和VP联合治疗可能是HNSCC患者的潜在治疗策略。