PARP抑制剂通过抑制SLC7A11促进铁死亡,并与铁死亡诱导剂协同作用于BRCA野生型卵巢癌
卵巢癌在女性生殖系统恶性肿瘤中死亡率居首位,PARP1是癌症治疗的重要靶点。其中药物抑制PARP是治疗晚期卵巢癌的一种有前途的治疗策略。PARP抑制癌细胞的作用机制尚不完全清楚,同时是否能通过直接与DNA损伤相关的机制来抑制肿瘤仍不清楚。近日,有作者证明了抑制PARP通过抑制SLC7A11促进铁死亡(ferroptosis),ferroptosis与PARP抑制相结合,并提示PARP抑制剂与FINs联合治疗BRCA型卵巢癌。该研究发表在《Redox biology》,IF为11.799。

技术路线:

主要结果:
1. 抑制PARP促进卵巢癌细胞的铁死亡
PARP抑制通常被认为是通过抑制DNA修复和促进细胞凋亡来诱导癌细胞死亡,但目前尚不清楚抑制PARP对卵巢癌细胞的毒性机制是否为ferropsis。因此作者首先证明PARP抑制与铁死亡的相关性。使用PARP的抑制剂olaparib(奥拉帕尼)诱导了卵巢细胞系的脂质过氧化,同时使用铁死亡抑制剂ferrostatin-1能消除这个影响(图1A),另外奥拉帕尼显著诱导了PTGS2(一种ferropsis的遗传标志)的表达。
为了了解ferroptosis在奥拉帕尼介导的抗癌作用中的潜在作用,作者研究了ferroptosis抑制剂ferrostatin-1和凋亡抑制剂Z-VAD-fmk对奥拉帕尼处理的细胞克隆生存的影响。结果发现奥拉帕尼治疗抑制了克隆基因的存活,而奥拉帕尼和ferrostatin-1联合治疗部分恢复了A2780和HEY细胞的存活(图1C和D)。在不同浓度奥拉帕尼的作用下,ferrostatin-1处理提高了A2780和HEY细胞的细胞活力(图1E),这表明,ferrostatin-1对PARP抑制剂奥拉帕尼的疗效起部分作用。BODIPY 581/591C11染色显示,在基础条件下,PARP1缺失(sgPARP1)促进了脂质过氧化,并显著增强了erastin(ferroptosis激活剂)诱导的细胞的脂质过氧化(图1F)。在HEY和A2780细胞中,PARP1的缺失显著增强了erastin诱导的 ferroptosis(图1G,H),表明PARP1可能在ferroptosis通路中起到关键的中介作用。总的来说,这些数据强烈表明,PARP抑制促进了ferroptosis,而ferroptosis是PARP抑制剂奥拉帕尼在卵巢癌细胞中发挥作用的关键。
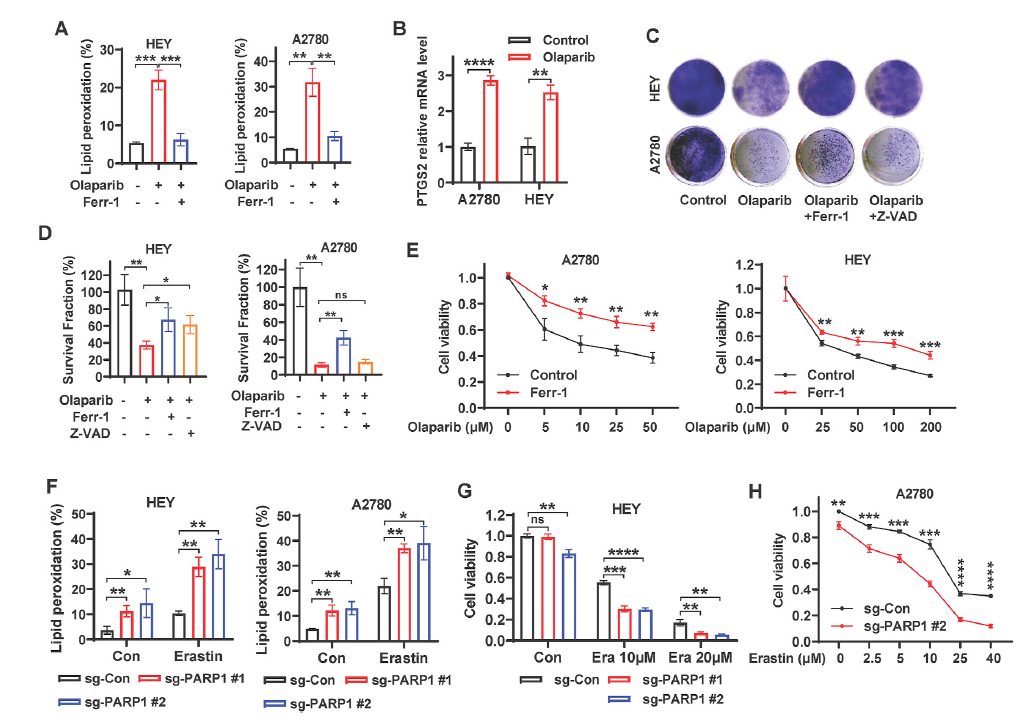
图1. 抑制PARP促进卵巢癌细胞的铁死亡
2. 抑制PARP以p53依赖的方式抑制SLC7A11的表达
为了探讨抑制PARP促进ferroptosis的机制,通过基因集富集分析(GSEA)评估TCGA卵巢癌数据库中PARP1调控基因富集的ferroptosis相关生物学过程。结果发现,在PARP1调控的基因中,氨基酸跨质膜运输和溶质载体(SLC)介导的跨膜运输等基因标记显著富集(图2A)。这两个基因集的整合鉴定出38个基因,这些基因促进谷胱甘肽(GSH)生物合成,抑制脂质过氧化和ferroptosis (图2B),并发现PARP1和SLC7A11在卵巢癌组织中的表达均明显高于正常卵巢组织(图2C)。进一步Pearson相关系数分析发现PARP1与SLC7A11在卵巢癌及正常组织中的表达水平呈正相关(图2D)。另外,PARP1还与一些其他的ferroptosis保护剂相关,如卵巢癌中的AIFM2(也称为FSP1)、CBS和HSPB1(图2E)。在PARP抑制下,与铁蛋白相关基因表达没有显著变化(图2F)。与mRNA表达一致的是,在HEY和A2780细胞中,奥拉帕尼显著降低了SLC7A11蛋白水平(图2G)。同时,奥拉帕尼显著上调了p53的表达,而没有显著影响其他SLC7A11调控因子的水平,如BAP1和ATF3(图2H)。NRF2是促进SLC7A11转录的转录因子,由于奥拉帕尼处理引起的胁迫而上调(图2H)。进一步富集途径分析显示PARP1与p53降解显著正相关(图2I)。
接下来,作者确定了PARP1基因消融对SLC7A11和p53表达的影响。PARP1敲除明显降低HEY细胞中SLC7A11蛋白水平,诱导p53表达(图2J)。在对PARP1进行遗传消融的HEY细胞中并未发现GPX4上调(图2J),这表明奥拉帕尼处理后HEY细胞中GPX4的诱导可能是对氧化应激的适应性反应,因为该细胞系中GPX4的基础水平较低(图2G)。另外,作者观察到奥拉帕尼在SKOV3细胞中降低PARP1蛋白水平而不影响SLC7A11蛋白水平(图2K)。同样,PARP1的缺失也无法抑制SKOV3细胞中SLC7A11的表达(图2L)。为了进一步确定PARP抑制是否以p53依赖的方式抑制SLC7A11的表达,通过CRISPR/Cas9在野生型p53表达的HEY细胞中敲除p53。我们发现,与p53缺陷的SKOV3细胞一致,奥拉帕尼在对照组细胞中下调SLC7A11的mRNA和蛋白表达,而在p53 敲除细胞中没有下调(图2M, N)。综上所述,结果表明,PARP抑制主要通过上调卵巢癌细胞中的p53来抑制SLC7A11的转录。
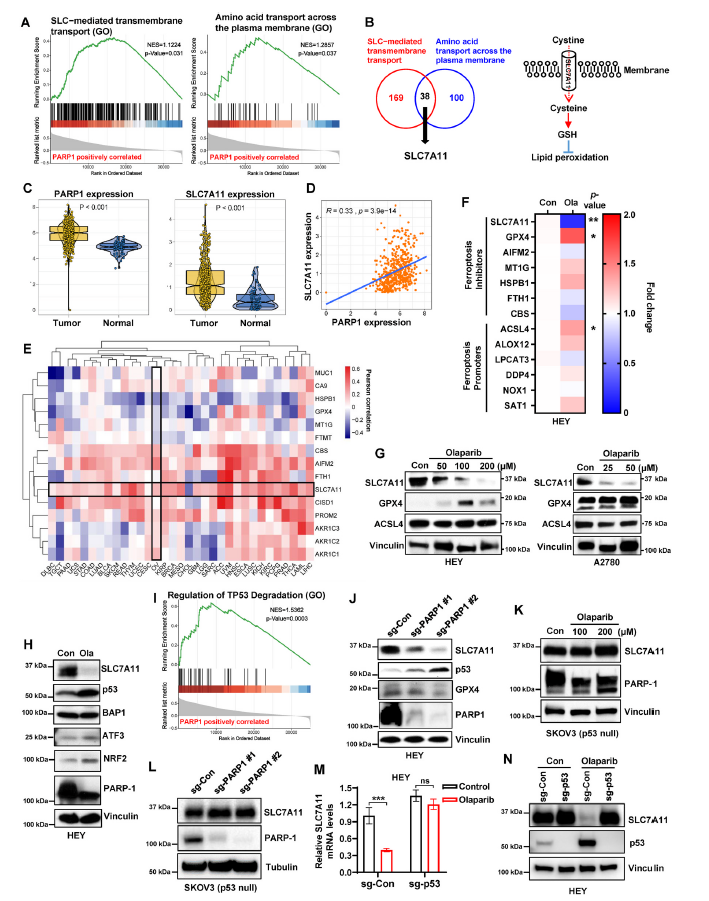
图2 抑制PARP以p53依赖的方式抑制SLC7A11的表达
3. PARP抑制剂奥拉帕尼通过抑制SLC7A11介导的谷胱甘肽合成部分促进ferroptosis
接下来,从功能上将SLC7A11与奥拉帕尼介导的ferroptosis和卵巢癌的疗效联系起来。首先研究了奥拉帕尼抑制的SLC7A11表达是否与卵巢癌细胞中胱氨酸摄取和谷胱甘肽合成的减少相关。结果发现,奥拉帕尼治疗抑制了胱氨酸的摄取,并显著降低了谷胱甘肽水平(图3A),另外,奥拉帕尼降低了对照细胞中谷胱甘肽水平并促进了脂质过氧化,而SLC7A11的过表达明显恢复了谷胱甘肽水平并减轻了奥拉帕尼诱导的脂质过氧化(图3B-D)。在奥拉帕尼处理的A2780细胞中,SLC7A11过表达显著恢复了细胞活力,达到与ferrostatin-1处理相似的水平(图3E)。另外,与SLC7A11过表达类似,NAC处理(n -乙酰半胱氨酸)增加了基础和奥拉帕尼处理条件下A2780细胞的GSH水平,并在奥拉帕尼处理下部分恢复了A2780细胞的克隆存活(图3F和G)。提示SLC7A11促进GSH生物合成是奥拉帕尼诱导ferroptosis的重要机制。
接下来,确定p53缺失是否在奥拉帕尼诱导的ferroptosis中具有与SLC7A11过表达类似的作用。用shRNA敲除HEY细胞中的SLC7A11(图3H),在奥拉帕尼处理的HEY细胞中,SLC7A11敲低(sh-SLC7A11)进一步降低了奥拉帕尼消耗的GSH水平,并显著降低了细胞活力(图3I和J),表明SLC7A11敲低使细胞对奥拉帕尼更加敏感。与NAC处理相比,L -丁硫氨酸亚砜亚胺(BSO)处理HEY细胞进一步增强了奥拉帕尼对GSH生物合成的抑制,并显著地使细胞对奥拉帕尼敏感(图3K和L),这与SLC7A11基因敲低一致。总之,这些结果表明,PARP抑制剂奥拉帕尼至少部分通过抑制SLC7A11介导的谷胱甘肽合成来促进ferroptosis,而且奥拉帕尼的功效可以通过基因改变SLC7A11的表达或药理上调节卵巢癌细胞中谷胱甘肽的水平来调节。
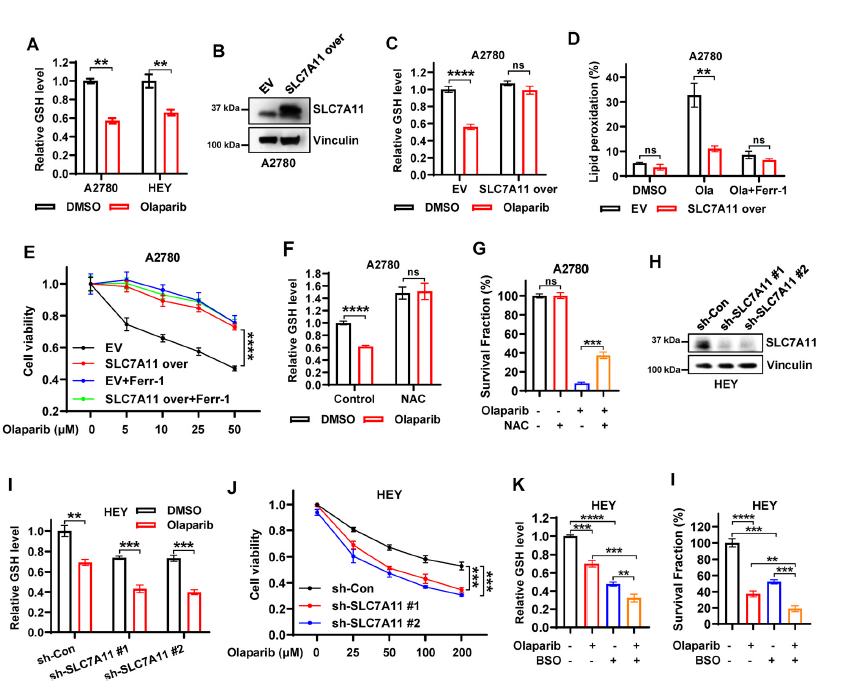
图3 奥拉帕尼通过抑制SLC7A11介导的谷胱甘肽合成部分促进ferroptosis
4. 奥拉帕尼的DNA损伤反应与ferroptosis介导的疗效无关
奥拉帕尼介导的细胞致死机制主要来源于抑制PARP的催化活性,阻止DNA单链断裂修复,促进DNA双链断裂。但是上述数据提示奥拉帕尼可诱导卵巢癌细胞发生ferroptosis,而ferroptosis是奥拉帕尼介导的抗癌作用的一部分。因此作者研究奥拉帕尼治疗后,ferroptosis和DNA损伤反应之间是否存在串扰。免疫荧光分析显示,在A2780细胞中,奥拉帕尼处理后磷酸化的(γ) H2AX位点(DNA损伤的标记)显著增加,而ferrostatin-1处理虽然挽救了奥拉帕尼处理后的细胞存活(图1D和E),但没有影响奥拉帕尼处理或未处理细胞中观察到的γH2AX聚焦的数量(图4A和B)。同样地,western blotting显示奥拉帕尼可诱导H2AX和其他DNA修复途径的调控因子磷酸化,包括ATM和Chk2,并增加cleaved caspase-3(凋亡标记)的表达,然而,无论奥拉帕尼处理与否,ferrostatin-1处理对A2780细胞中的这些标记物均无明显影响(图4C),表明奥拉帕尼处理后,铁抑制对DNA损伤反应及其下游效应-细胞凋亡没有显著影响。同时奥拉帕尼增加了γH2AX聚焦位点的数量,并诱导了对照细胞中H2AX的磷酸化,而SLC7A11敲低并没有进一步改变这两个位点(图4D-F)。总之,这些结果表明,DNA损伤或修复既不参与ferroptosis扰动介导的奥拉帕尼耐药,也不参与ferroptosis增强介导的奥拉帕尼敏化。
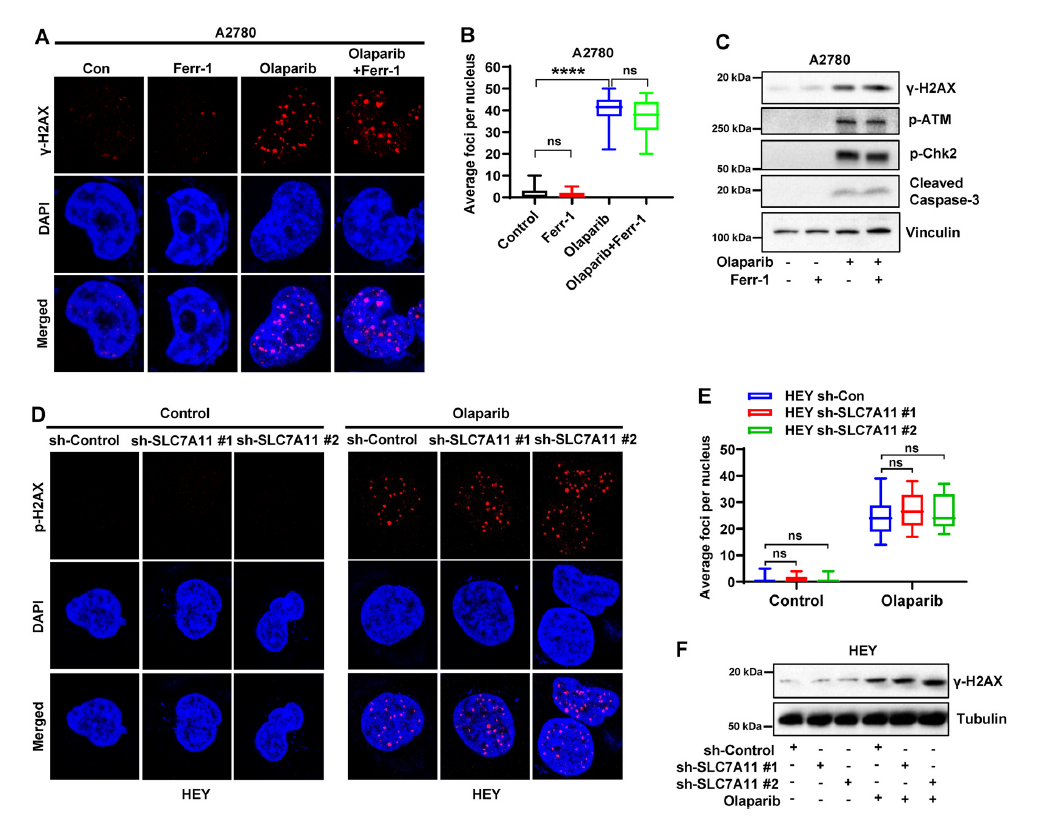
图4 奥拉帕尼的DNA损伤反应与ferroptosis介导的疗效无关
由于野生型BRCA可以修复奥拉帕尼诱导的DNA损伤并导致奥拉帕尼帕林耐药,因此奥拉帕尼未能为精通BRCA的卵巢癌提供实质性的临床益处。由于SLC7A11的敲除增强了奥拉帕尼帕利的疗效(图3J),我们首先检查了靶向SLC7A11的erastin是否会在BRCA野生型卵巢癌细胞中产生类似的效果。BODIPY 581/591C11染色显示,在BRCA野生型HEY和A2780细胞中,erastin不仅显著触发脂质过氧化,而且协同增强了奥拉帕尼诱导的脂质过氧化(图5A)。HEY和A2780细胞对奥拉帕尼相对耐药,而erastin处理降低了细胞活力,使HEY和A2780细胞对奥拉帕尼显著敏感(图5B)。在指示浓度下,在HEY和A2780细胞中,FINs和奥拉帕尼的联合指标均小于1(图5C),提示erastin与奥拉帕尼协同作用。我们在临床常用的SLC7A11抑制剂磺胺吡啶治疗中也得到了类似的观察结果,即磺胺吡啶促进奥拉帕尼诱导的脂质过氧化,并协同作用使HEY细胞对奥拉帕尼致敏(图5D-F)。紧接着作者证明RSL3(失活GPX4)处理增强了奥拉帕尼诱导的HEY细胞脂质过氧化,并以协同的方式显著使HEY细胞对奥拉帕尼敏感(图5G-I)。总之,在没有p53缺陷的BRCA野生型卵巢癌细胞对奥拉帕尼具有协同敏感性,这表明奥拉帕尼的应用可能扩展到BRCA野生型卵巢癌与FINs联合使用。
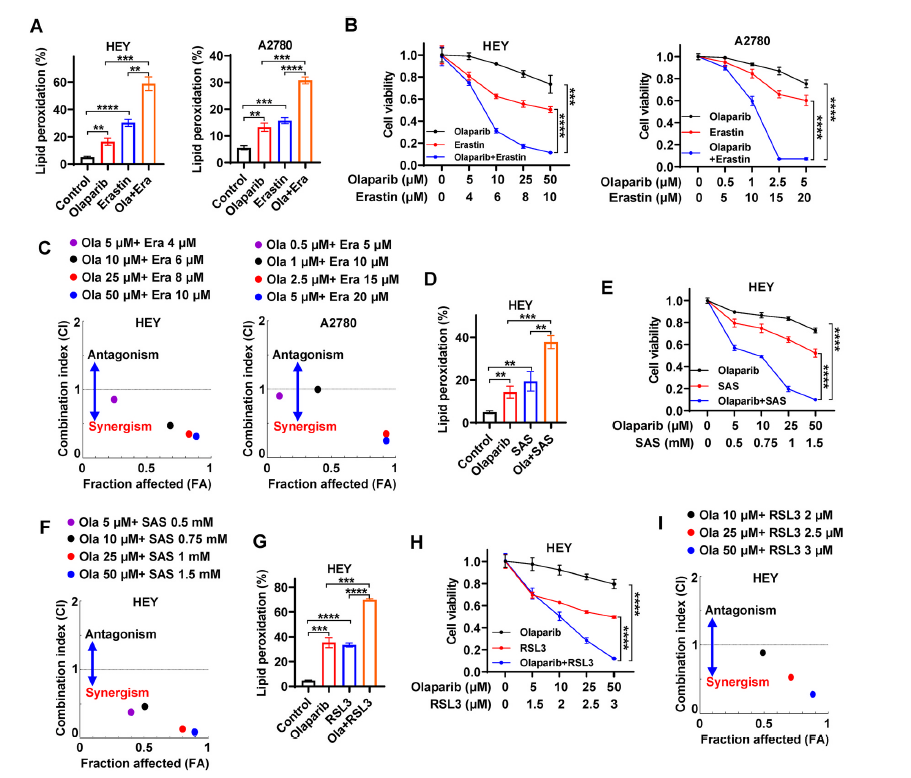
图5 FINs协同使精通BRCA的卵巢癌细胞对奥拉帕尼敏感
6. 体内ferroptosis与奥拉帕尼介导的肿瘤抑制相关
为了证实ferroptosis与奥拉帕尼体内疗效的潜在相关性,我们将A2780细胞接种到裸鼠中,并给小鼠注射奥拉帕尼、liproxstatin-1 (一种稳定的ferroptosis拮抗剂),或两者同时使用(图6A)。与体外实验结果一致,奥拉帕尼显著降低了肿瘤的生长。单独使用liproxstatin-1治疗并不影响肿瘤生长,但奥拉帕尼的疗效部分消失(图6B-D),提示奥拉帕尼诱导肿瘤发生ferroptosis,抑制ferroptosis导致体内奥拉帕尼耐药。
为了验证在体内使用FINs增强ferroptosis是否能使BRCA卵巢癌对奥拉帕尼敏感,我们将HEY细胞接种到裸鼠中,并同时给小鼠使用奥拉帕尼、磺胺吡啶或两种药物(图6E)。虽然单独使用磺胺吡啶并没有显著降低肿瘤生长或延长小鼠存活率,但它确实显著提高了这些HEY源性肿瘤对奥拉帕尼的敏感性,导致了有效的肿瘤抑制和生存益处(图6F, G)。值得注意的是,与其他治疗相比,奥拉帕尼联合磺胺吡啶的小鼠体重并没有明显下降(图6H),提示奥拉帕尼联合磺胺吡啶的毒性在体内是耐受的。总的来说,奥拉帕尼和磺胺吡啶联合治疗BRCA野生型卵巢癌是一种有前景的治疗策略。
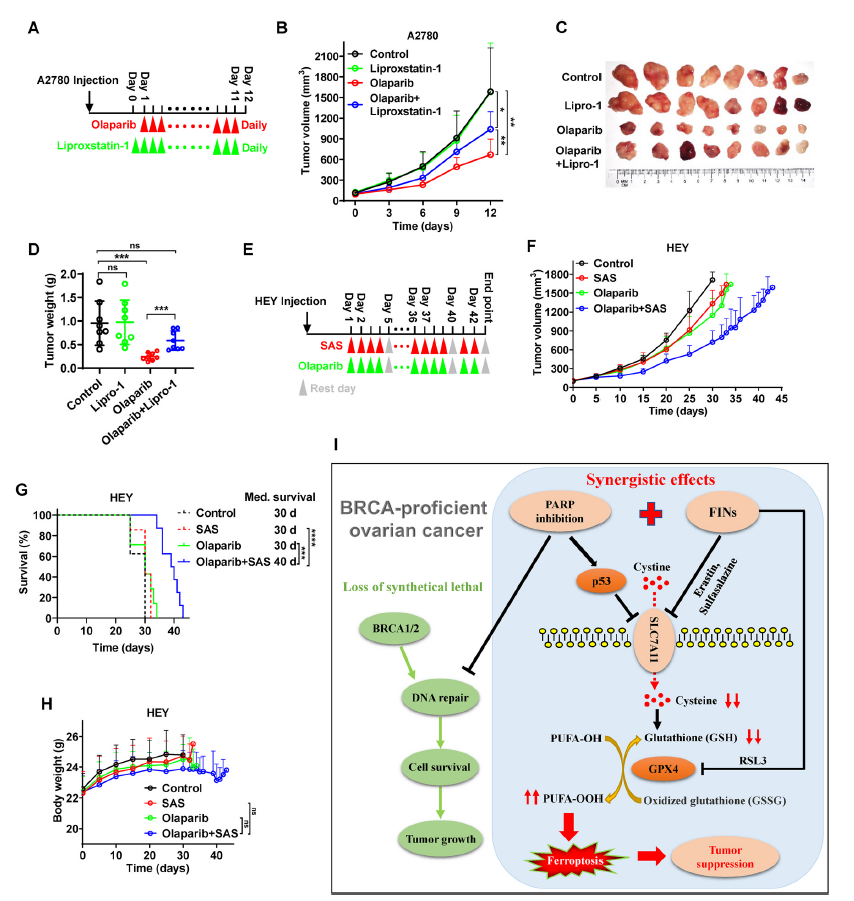
图6 体内ferroptosis与奥拉帕尼介导的肿瘤抑制相关
总结:
该研究揭示了PARP抑制显著促进了卵巢癌中的ferroptosis,表明ferroptosis与抑制PARP介导的抗肿瘤作用有关,并证实了FINs协同使BRCA功能良好的卵巢癌细胞对PARP抑制剂奥拉帕尼敏感。为PARP抑制剂在BRCA型卵巢癌中的应用提供了一种有前景的治疗策略。
参考文献:
Hong T, Lei G, Chen X, Li H, Zhang X, Wu N, Zhao Y, Zhang Y, Wang J. PARP inhibition promotes ferroptosis via repressing SLC7A11 and synergizes with ferroptosis inducers in BRCA-proficient ovarian cancer. Redox Biol. 2021, 42:101928. doi: 10.1016/j.redox.2021.101928.






