肿瘤抑制因子ZDHHC1
由于缺乏高效的预防和治疗措施,癌症正威胁着我们每个人的健康,在全球范围内留下了沉重的健康负担。尽管癌症历来被认为是一种以细胞不断增殖和侵袭/转移为特征的细胞生物学疾病,但最近提出的证据表明,它也应被视为一种代谢性疾病。近期,重庆医科大学向廷秀教授课题组发现ZDHHC1是一种潜在的肿瘤抑制因子,由于启动子甲基化而经常被沉默,能够负调节肿瘤细胞的代谢,同时通过刺激氧化应激和内质网应激诱导细胞焦亡和凋亡加速细胞死亡,可用于开发新的癌症预防和疗法。相关研究以“DNA methylation downregulated ZDHHC1 suppresses tumor growth by altering cellular metabolism and inducing oxidative/ER stress-mediated apoptosis and pyroptosis”为题发表在Theranostics杂志上,杂志影响因子8.579。
技术路线:
结果:
1.ZDHHC1在肿瘤中的表达特征
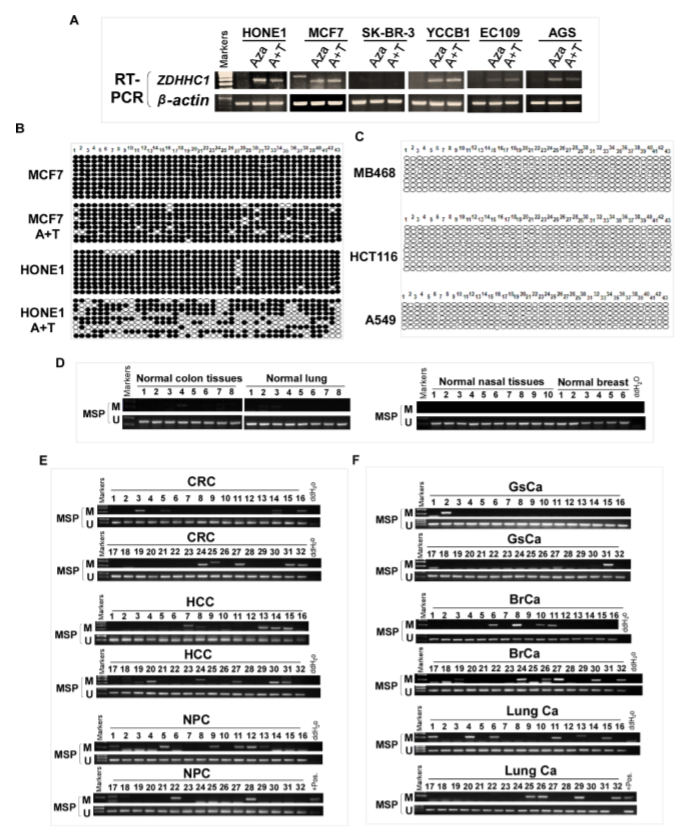
作者发现ZDHHC1在正常的成人和胎儿组织中广泛表达(A),但在一些癌细胞系中沉默或表达下调(B),并通过甲基化特异性PCR(MSP)发现ZDHHC1启动子发生了甲基化(C)。

进一步研究发现在ZDHHC1缺失的细胞中,去甲基化处理后检测到ZDHHC1重新表达(A);亚硫酸氢盐基因组测序(BGS)实验表明ZDHHC1阴性细胞系的启动子区域携带大量的甲基化CpG位点,若细胞被去甲基化剂处理致使这些位点被去甲基化(B),且发现表达ZDHHC1的MB468, HCT116和A549细胞中ZDHHC1没有甲基化(C)。通过MSP和BGS检测结肠癌、肝细胞癌、鼻咽癌、胃癌、乳腺癌和肺癌的肿瘤和邻近正常组织中ZDHHC1启动子甲基化发现,与邻近的正常组织相比,肿瘤样本的启动子有明显的甲基化趋势(D-E)。这些结果表明,ZDHHC1在肿瘤中的表达经常通过启动子的甲基化被沉默。
2.ZDHHC1在肿瘤中的作用
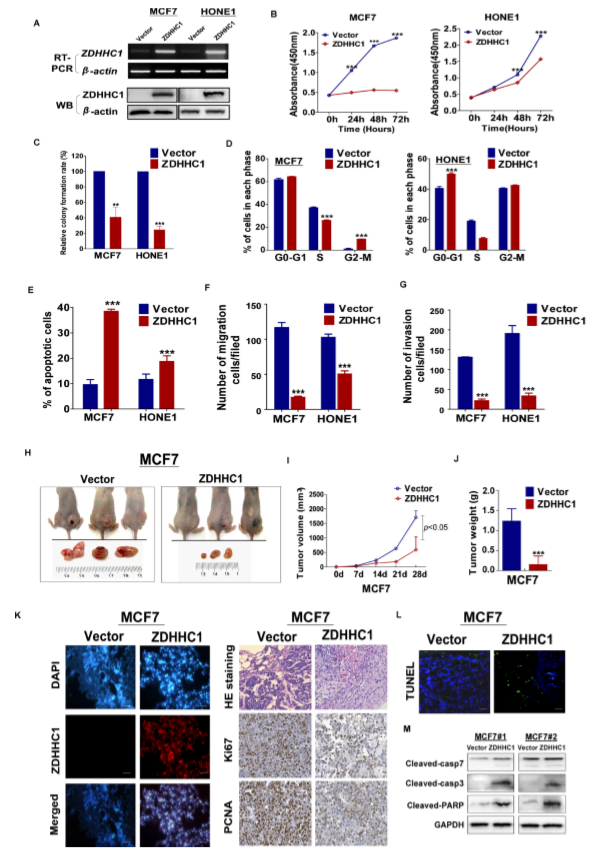
作者通过RT-PCR和WB实验证实了稳定转染在ZDHHC1阴性癌细胞系(HONE1和MCF7细胞系)中异位表达ZDHHC1的有效(A),并通过CCK-8和克隆形成实验发现ZDHHC1可以抑制细胞增殖(B,C)。细胞周期分析显示ZDHHC1表达导致HONE1细胞阻滞于G0/G1期,而MCF7细胞聚集在G2/M期(D),这可能是由于细胞类型特异性的差异,进一步通过Annexin V-FITC染色和透射电镜实验发现ZDHHC1表达诱导MCF7和HONE1细胞凋亡,且transwell和伤口愈合试验发现ZDHHC1抑制细胞迁移和侵袭(F,G)。体外验证了ZDHHC1的抑癌作用,作者接下来在裸鼠异种移植瘤模型中验证ZDHHC1的抑癌作用,发现转染ZDHHC1表达细胞的肿瘤重量和体积显著下降(H-J),免疫组化表明Ki67和PCNA的表达明显下降,而TUNEL染色显示ZDHHC1组异种移植切片的凋亡水平升高(K,L),WB实验揭示了在ZDHHC1表达的异种移植瘤中,caspase- 3,7和PARP表达均上调(M)。总之,ZDHHC1在体内外发挥抑制癌细胞增殖、诱导癌细胞凋亡和抑制癌细胞迁移和侵袭的能力,这通常是肿瘤细胞中肿瘤抑制基因的关键特征。
3.ZDHHC1对EMT和干细胞特性的影响
作者发现ZDHHC1表达的细胞更容易紧密粘在一起,类似于间充质-上皮转变(A),且通过免疫荧光和WB检测到ZDHHC1表达上调了上皮标志物E-cadherin和Occludin的表达,下调了间质标志物Vimentin和N-cadherin的表达(B,C),进一步检测了6个肿瘤干细胞特性关键生物标志物的表达,发现NANOG、SOX2、OCT4、CD44、ABCG2和BMI1在ZDHHC1过表达细胞中表达下降(D),球体形成实验中ZDHHC1降低了癌细胞的球体形成率(E,F)。以上说明ZDHHC1作为一种肿瘤抑制因子,在人类癌症中抑制EMT和细胞干细胞特性。

4.ZDHHC1在肿瘤中的调控机制
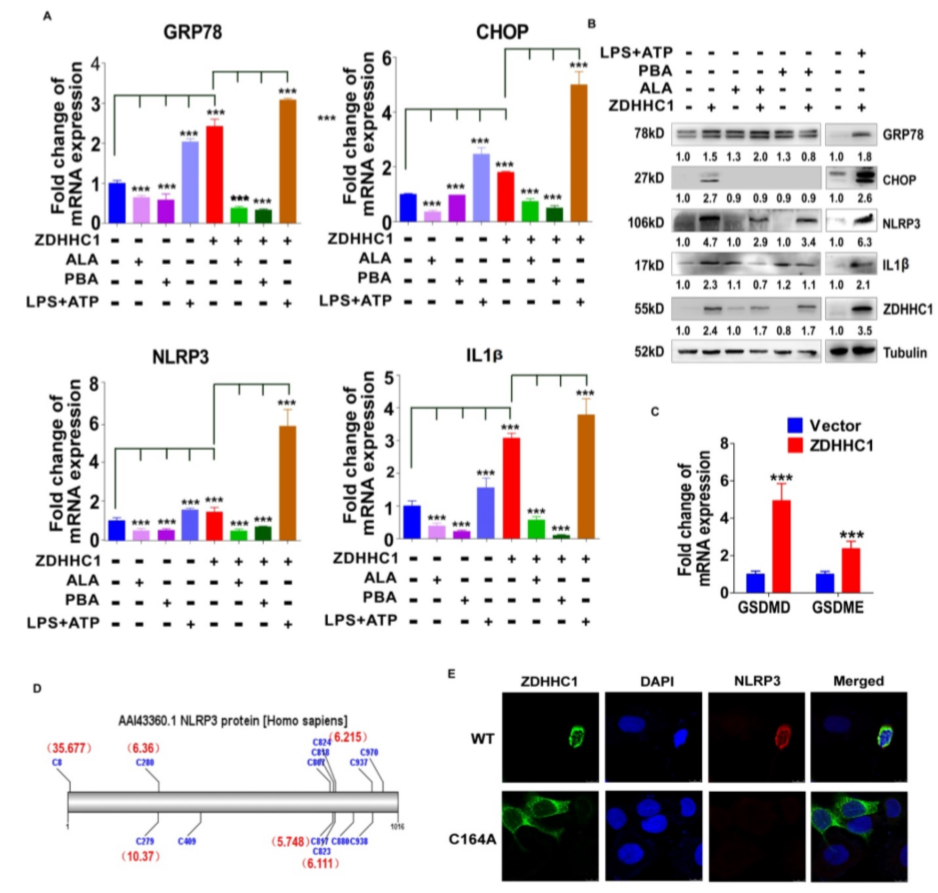
作者通过RT-qPCR测定转染siRNA-CYGB的细胞中CYGB沉默效率(A), 转染siRNA-CYGB导致ZDHHC1表达下调、GLUT1和HXK2表达上调,而ZDHHC1表达降低了GLUT1和HXK2表达水平,且在ZDHHC1-HONE1细胞中沉默 CYGB可部分逆转GLUT1和HXK2的表达(B-D)。挽救实验证实了沉默CYGB可以部分逆转ZDHHC1过表达抑制癌细胞系增殖和诱导凋亡的能力(E-G)。特异性试剂盒测定活性氧(ROS)、超氧化物(O2-)含量、NADP+/NADPH比值和总抗氧化能力(TAC)显示ZDHHC1表达细胞中ROS、O2-含量以及NADP+/NADPH比值增加,而TAC水平无显著变化(H-K),且发现ZDHHC1上调了几个被认为是内质网应激和未折叠蛋白反应(UPR)途径关键靶基因,且核苷酸结合寡聚化结构域样受体家族、NLRP3、caspase-1、IL-1β和IL-18的mRNA和蛋白水平升高(L-M)。此外,透射电镜显示表达ZDHHC1的细胞表现出焦亡形态:膜完整性降低、细胞肿胀和裂解(N),免疫染色发现ZDHHC1过表达细胞的异种移植裸鼠肿瘤组织中MLKL的表达明显更高(O)。综上所述,ZDHHC1至少部分通过CYGB介导的葡萄糖代谢途径抑制癌细胞的葡萄糖代谢,并通过介导氧化应激和内质网应激反应诱导细胞焦亡。

5.ZDHHC1对氧化应激和内质网应激的影响
作者用氧化应激抑制剂ALA和内质网应激抑制剂4-PBA处理有或无ZDHHC1表达的HONE1细胞,发现内质网应激和焦亡标志物GRP78、CHOP、NLRP3和IL-1β表达明显下降,且LPS+ATP诱导细胞焦亡后ZDHHC1组的相关指标上调(A,B),GSDMD和GSDME的水平显著增加(C)。在HONE1细胞中异位表达野生型或突变的ZDHHC1(C164A),发现NLRP3可被ZDHHC1上调,但不能被ZDHHC1 C164A上调(D,E)。以上数据说明ZDHHC1诱导的细胞毒性至少部分通过介导氧化应激和内质网应激信号通路参与细胞焦亡和细胞凋亡。
结论:
总之,癌细胞系和多种肿瘤组织中通过DNA甲基化下调ZDHHC1的表达,且CYGB对于ZDHHC1在癌细胞中作为肿瘤抑制因子的功能至关重要,证实了ZDHHC1介导氧化应激和内质网应激刺激焦亡,从而增加癌细胞凋亡。
参考文献:
Xin Le, Junhao Mu, Weiyan Peng,et al. DNA methylation downregulated ZDHHC1 suppresses tumor growth by altering cellular metabolism and inducing oxidative/ER stress-mediated apoptosis and pyroptosis. Theranostics. 2020, 10(21): 9495-9511.






