外泌体circPACRGL促进结直肠癌
结直肠癌(CRC)是全球癌症相关死亡的主要原因。外泌体是细胞间通信的重要调节因子,外泌体中丰富的circRNA。circRNA是调控肿瘤增殖和进展的非编码RNA的一部分。然而,癌源性外泌体circRNA在CRC中的作用及调控机制尚不清楚。上海同济大学医学院的商安全等人在Molecular Cancer(IF=15.302)这一杂志发表文章介绍circPACRGL在调节结肠癌中的作用。
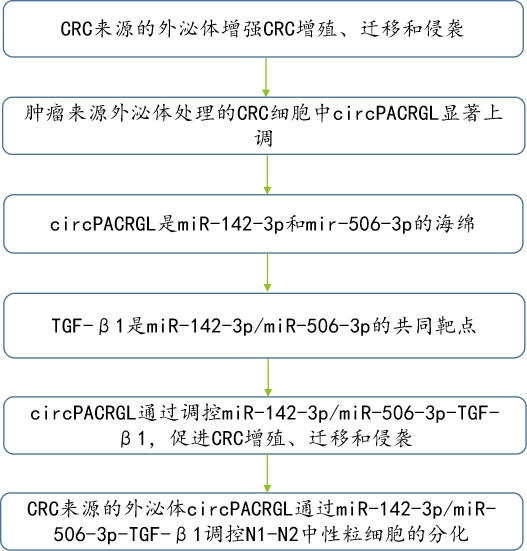
技术路线图:
研究结果:
1.CRC来源的外泌体增强CRC增殖、迁移和侵袭
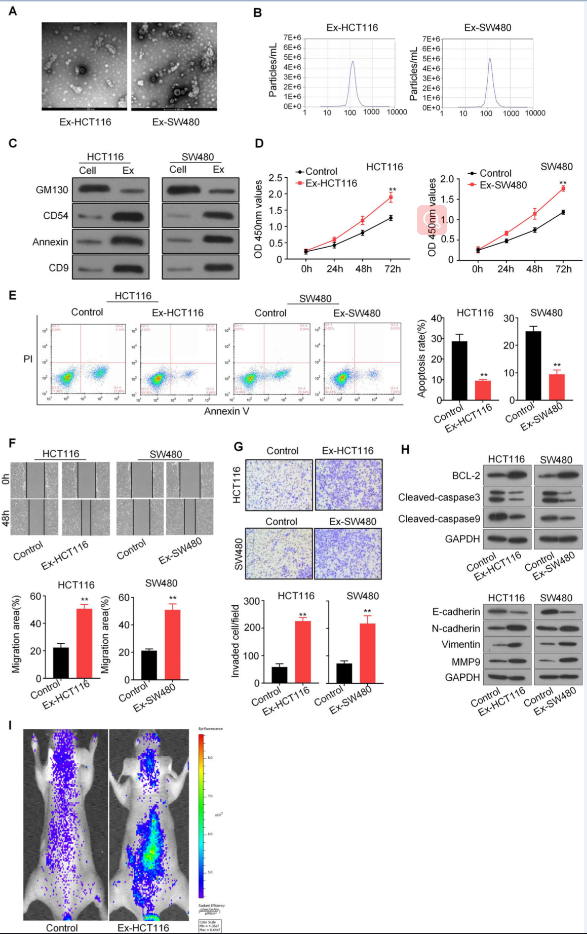
为了探讨外泌体在CRC中的作用机制,从HCT116和SW480细胞上清中分离出外泌体。通过透射电子显微镜和纳米粒子跟踪分析(NTA)方法发现圆形粒子是80-100nm的双层膜,符合外泌体大小(图1 a和b)。WB检测外泌体特征标记物(CD9, CD54,Annexin,GM130)的表达,验证提取到的是外泌体。CCK8检测显示外泌体显著增强了CRC细胞的增殖(图1d)。流式细胞术分析显示CRC细胞的凋亡细胞百分比明显降低(图1e)。此外,伤口愈合和transwell表明,液从CRC细胞的外泌体能显著促进CRC的迁移和侵袭(图1 f和g)。此外,WB结果表明CRC来源的外泌体增加BCL-2, N-cadherin, Vimentin,和MMP9的表达,减少reduced E-cadherin,Cleaved-caspase3, Cleaved-caspase9 蛋白的表达(图1 h)。裸鼠尾静脉注射外泌体处理的-HCT1 116 -荧光素酶标记的细胞,体内成像系统监测发现外泌体处理显著增加了HCT116细胞的转移。结果表明CRC来源的外泌体促进CRC增殖、迁移和侵袭。
2.肿瘤来源外泌体处理的CRC细胞中circPACRGL显著上调
报道显示circRNAs在肿瘤来源的外泌体中富集。我们分析了三对外泌体刺激的HCT116和SW480的表达谱,和未处理细胞的RNA测序来识别与CRC相关的circRNA(图2a)。SW480和HCT116的差异表达由Venn图显示。circPAGRAL(circ-0069313)是两组中表达上调最多的基因(图2b),并通过RT-qPCR验证(图2c)。外泌体刺激的CRC细胞中circPAGRAL水平持续且显著升高(图2c)。这与CRC细胞中使用CRC患者血清来源外泌体处理的结果不一致(图2d)。我们进一步从CRC患者的肿瘤组织中分离出外泌体。qRT-PCR结果显示,circPAGRAL在经肿瘤来源外泌体处理的CRC细胞中表达显著上调(图2e)。这些结果表明在肿瘤来源外泌体刺激的CRC细胞中circPACRGL显著升高,circPACRGL可能来源于肿瘤来源的外泌体。
RT-qPCR检测验证了在HCT116和SW480细胞中circPACRGL沉默导致其表达明显降低(图2f)。与肿瘤来源的外泌体共培养后,两种CRC细胞中circPACRGL mRNA表达显著升高(图2g)。这些结果表明circPACRGL主要来源于肿瘤来源的外泌体,而不是来源于肿瘤细胞内的表型变化。

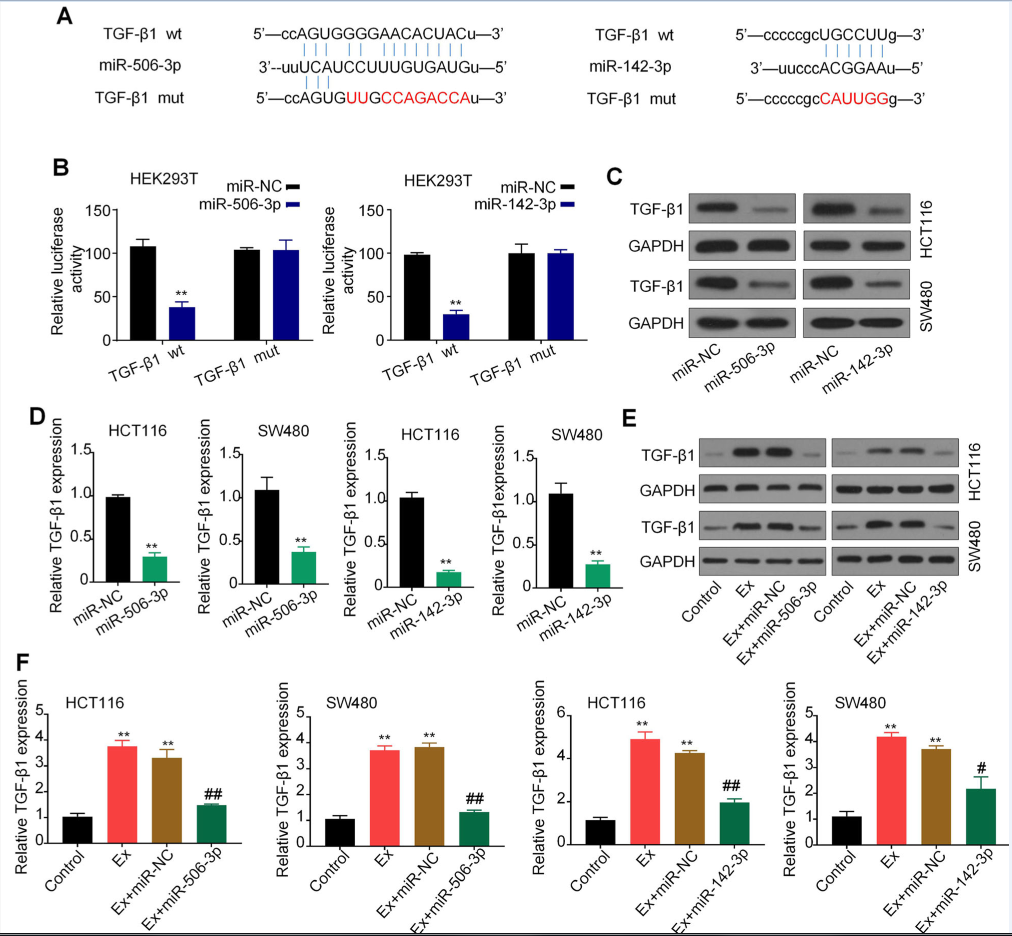
3.circPACRGL作为miR-142-3p和mir-506-3p的海绵
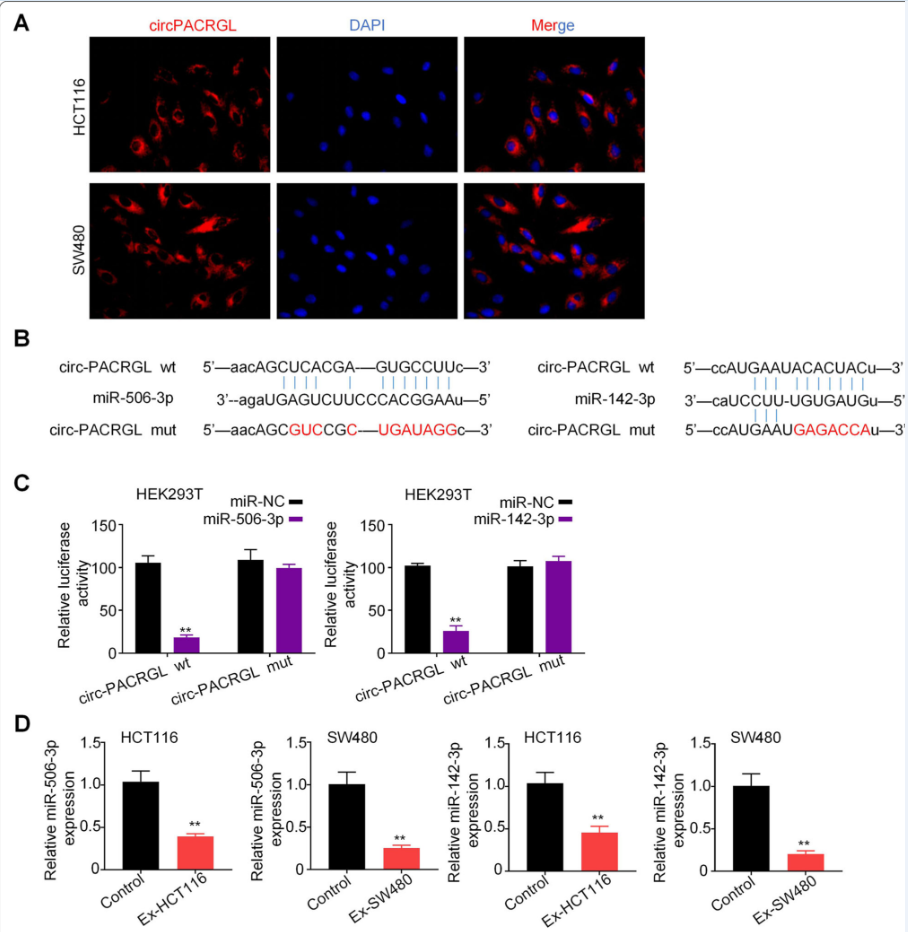
在细胞质中,许多证据表明circRNA的调控机制是作为miRNA海绵。FISH荧光原位杂交结果显示,circPACRGL转录信号主要分布在HCT116和SW480细胞的细胞质中(图3a)。在线生物信息学数据库StarBase 2.0分析circPACRGL靶miRNA,发现circPACRGL同时具有miR-142-3p和miR-506-3p的结合位点(图3b)。双荧光素酶报告基因实验进一步证实miR-142-3p和miR-506-3p是circPACRGL的靶点。与miR-NC相比,circPACRG -wt和细胞共转染miR-142-3p/miR-506-3p mimics,荧光素酶活性明显下降。同时,细胞miR-142-3p和miR-506-3p mimics和circPACRGL-mut显示荧光素酶活性变化小(图3 c)。此外,我们发现CRC来源的外泌体刺激的HCT116和SW480细胞miR-142-3p/miR-506-3p表达显著减少(图3 d)。这些结果表明circPACRGL可以作为miR-142-3p和miR-506-3p的海绵。
4.TGF-β1是miR-142-3p/miR-506-3p的共同靶点
MiRNAs可与调控mRNA和蛋白表达的基因3′UTR结合。在线生物信息学工具StarBase 2.0预测miR-142-3p和miR-506-3p的靶基因,发现了TGF-β1。有报道TGF-β1参与肿瘤的发生发展,并与N1/N2中性粒细胞的分化相关。荧光素酶报告基因检测,证实TGF-β1是miR-142-3p和miR-506-3p共同的靶基因(图4a和b)。HEK293T细胞在共转染miR-142-3p/miR-506-3p mimics和TGF-β1-wt后荧光素酶活性明显降低。然而,miR-142-3p/miR-506-3p-mut挽救了这种抑制(图4b)。WB和qPCR进一步表明,miR-142-3p/miR-506-3p mimics 转染显著降低TGF-β1的蛋白质和mRNA水平(图4 c和d)。
在外泌体处理的CRC细胞中,TGF-β1蛋白质和mRNA水平显著增加;而在与miR-142-3p/miR-506-3p抑制剂共培养之后,这种上调作用显著的抑制(图4 e和f)。研究表明, TGF-β1是miR-142-3p/miR-506-3p的一种常见靶标。
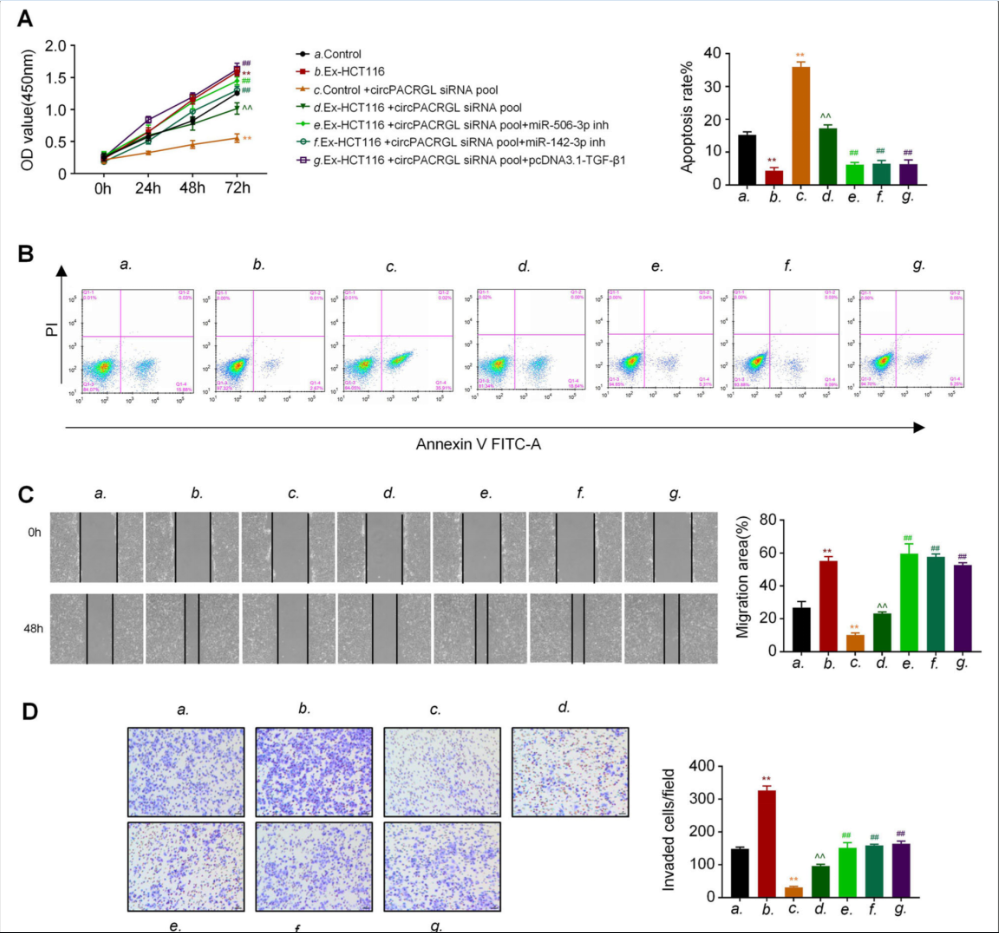
5.circPACRGL通过调控miR-142-3p/miR-506-3p-TGF-β1,促进CRC增殖、迁移和侵袭
CCK8结果显示,与对照组相比,经CRC来源的外泌体处理之后CRC细胞的增殖能力明显提高(图5a)。下调circPACRGL可显著降低CRC细胞的增殖,而在miR-142-3p/miR-506-3p 抑制剂处理或TGF-β1过表达后,这种抑制作用减弱(图5a)。外泌体刺激的CRC细胞的凋亡细胞比例降低。下调circPACRGL可促进CRC细胞凋亡,但这种增强作用被外泌体刺激所抑制。miR-142-3p/miR-506-3p 抑制剂处理或TGF-β1过表达后,CRC细胞的凋亡率显著降低(图5b)。伤口愈合和transwell表明,CRC来源外泌体提高CRC细胞迁移和入侵的能力;circPACRGL敲除后,作用相反(图5 c和d)。结果证实circPACRGL通过调控miR-142-3p/miR-506-3p-TGF-β1促进CRC增殖、迁移和侵袭。
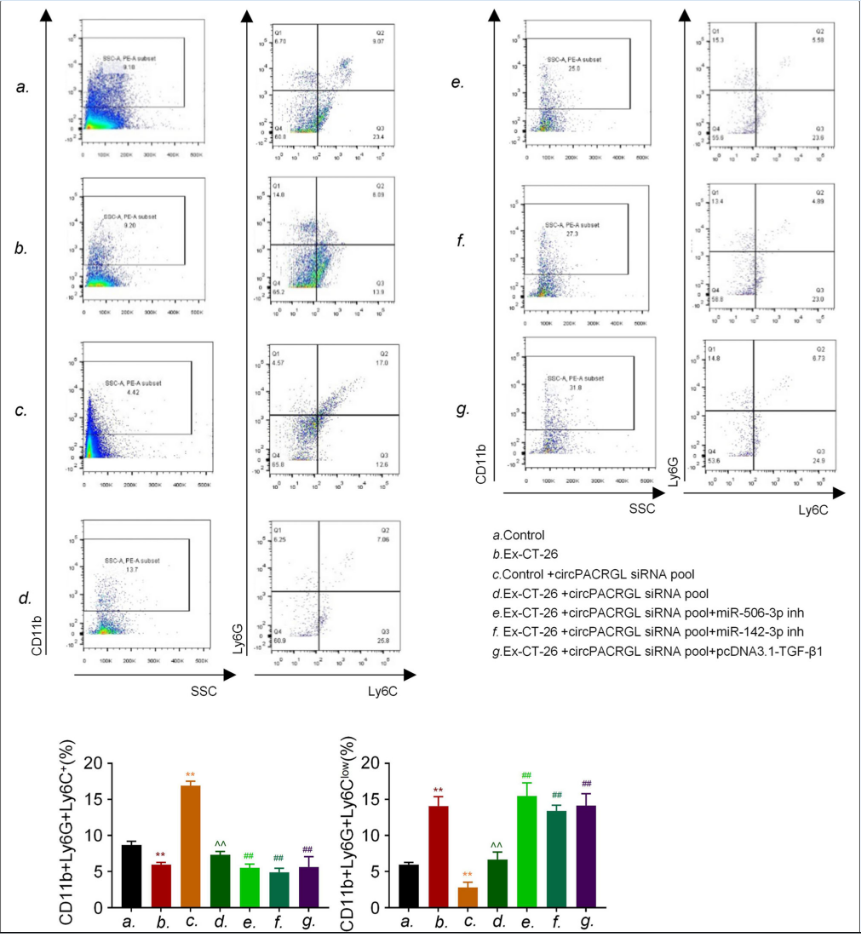
6.CRC来源的外泌体circPACRGL通过miR-142-3p/miR-506-3p-TGF-β1调控N1-N2中性粒细胞的分化
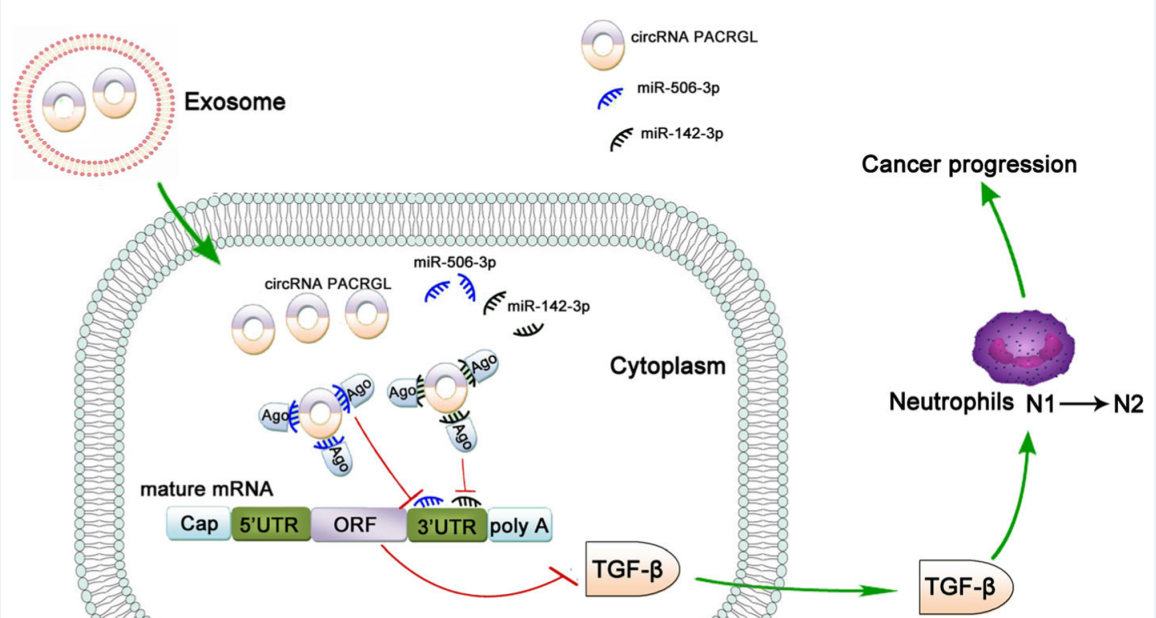
研究报道显示高水平的TGF-β1与肿瘤的发生,N1中性粒细胞向N2中性粒细胞表型转换有关,而N2中性粒细胞可促进肿瘤增殖和转移。我们探讨了CRC来源的外泌体 circPACRGL是否也可以通过这个轴调控中性粒细胞的N1-N2分化。流式细胞仪结果显示,CRC来源的外泌体可以增加N2中性粒细胞的百分比,这与N2标记CD11b+/Ly6G+/Ly6Clow的上调一致(图6). 在circPACRGL敲低的细胞组中显著降低,而这种抑制作用加入CRC来源的外泌体后消失。然而,miR-142-3p/miR-506-3p抑制剂处理或TGF-β1高表达可显著加速N1-N2的分化在CRC来源的外泌体处理的circPACRGL敲低细胞中。总的来说,我们发现CRC来源的外泌体circPACRGL通过miR-142-3p/miR-506-3p-TGF-β1轴调控N1-N2中性粒细胞的分化。
总结:
文章中发现了肿瘤来源外泌体中circPACRGL。
研究发现了circPACRGL通过miR-142-3p/miR-506-3p-TGF- 271增强CRC细胞的增殖、迁移和侵袭,以及N1-N2中性粒细胞的分化。
研究发现了circPACRGL在CRC细胞存活和转移中起着致癌作用。
文章为研究circRNA在CRC中的作用提供了理论依据。






