开采lncRNAs巨大宝藏的神兵利器--CRISPR-Cas9 Screen
近期,癌症研究顶级期刊Cancer Cell发表了来自瑞士伯尼尔大学的Rory Johnson教授的综述:通过CRISPR-Cas技术筛选具有治疗潜力的的长链非编码RNA。该文总结了新发表使用CRISPR的技术筛选与肿瘤细胞增殖和抗药性相关lncRNAs的研究论文;并着重介绍了这一高通量、高特异性筛选方法的策略、材料和方法。小编在这和大家一起分享。

LncRNAs(long non-coding RNAs,长链非编码RNA)是一类长度在200 nt以上,不编码蛋白质的一类RNA。它们参与众多的生物学过程,也是目前癌症研究中的热门内容。其数量远超过蛋白编码基因,达到50000甚至更多。高通量测序方法为我们发掘新的lncRNAs提供了极大的支持。通过基因测序检测突变或全转录组检测表达量变化,已经发现了许多癌症相关的lncRNA。如NETA1在多数实体瘤中表达量均上调并有促癌症作用(Chakravarty, Sboner et al. 2014)。此外,基于RNAi的shRNA文库筛选也是常使用的方法。然而单纯表达量差异的筛选无法与功能联系起来。因此,利用CRISPR-Cas9的功能性高通量筛选技术研究lncRNAs成了我们的一大利器。早在2014年,张峰课题组就报道了针对所有蛋白编码基因的CRISPR-Cas9筛选文库(Shalem, Sanjana et al. 2014);这一方法目前在研究中也广泛使用。之后研究人员在此基础上推出了针对不同基因群的亚库、携带不同活性的融合蛋白的激活或抑制文库等。近年来,许多高水平文章报道了通过该方法发现参与各中生物学过程的新基因。而针对lncRNAs的高通量文库在2018年才有报道(Liu, Cao et al. 2018)。接下来让我们来学习整个实验的设计思路。
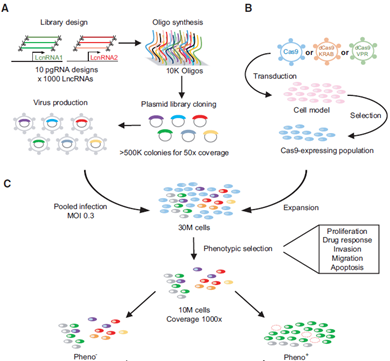
图1 CRISPR-Cas Screen文库构建、感染和筛选模式图
如图1所示,我们首先需要设计或购买符合我们研究目标的sgRNA文库。例如Addgene 89640、 86538–86550、1000000106等,都十分方便研究者直接使用。这些文库针对每一个lncRNA均设计6条sgRNA来提高结果的准确性。然后包装病毒后感染细胞建立稳定表达相应Cas9蛋白和gRNA的细胞系。需要注意的是,使用含gRNA的病毒感染细胞时,MOI值应较低(应低于1,该文章推荐值为0.3),这样才能保证单个细胞中只有单个lncRNA被编辑。通过抗生素等筛选方法去除未感染细胞后,便可以进行筛选实验了。
我们根据研究目的制定特定筛选策略。根据不同lncRNAs编辑后产生的不同表型筛选出目标组别和对照组别。如根据侵袭能力不同分选出高侵袭能力的细胞和低侵袭能力的细胞;药物处理后根据耐药性分选不同表型的细胞;根据带GFP荧光标签的目标蛋白的含量筛选目标蛋白上调或下调的细胞类群。严格的筛选标准和合理的对照设置能使我们的筛选结果更加准确有效。接下来便是检测各自细胞亚群中有哪些lncRNAs被编辑。
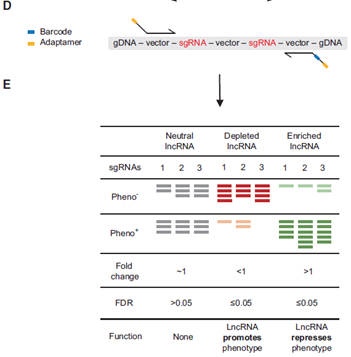
图2 CRISPR-Cas Screen筛选后测序检测和分析模式图
提取相应细胞基因组并使用特异性引物PCR出整合的sgRNA序列后构建二代测序文库测序,再通过生物信息学分析样品中gRNA丰度,丰度变化的gRNA所对应的lncRNA便是调控筛选条件过程的潜在分子靶标。如此得到的靶标均是在癌症发生过程中有调节功能的lncRNA,在经过分析和筛选后部分指标并验证其功能后,便是你深入探究分子机制、大展身手的最佳时机。下面举例展示部分文章的筛选和验证结果(Zhu, Li et al. 2016),如图3所示。文章在Huh7OC细胞中筛选了700个lncRNAs,发现其中51个能上调或下调该细胞的生长。验证实验中敲除AC004463.6(图3 f中粉色标注)后,癌细胞的生长受到显著抑制;敲除LINC01087(图3 g中红色标注)后,癌细胞的生长显著增加。当然,这种方法中也会存在着敲除作用是否高效,功能性筛选结果的机制研究困难等问题。
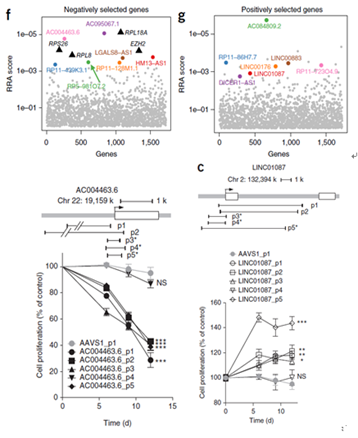
图3 部分筛选指标验证结果
上海英拜生物多年来一直聚焦于lncRNA、miRNA、cirRNA研究的前沿,在测序筛选、机制功能研究方面均有着丰富的经验和众多成功案例。更多资讯可查询公司相关产品。






