MMP3过表达在富含CAF的实体瘤模型中增强CAR-T细胞浸润及抗肿瘤活性
嵌合抗原受体(CAR)T 细胞疗法在血液系统恶性肿瘤中已取得显著成功,但在实体瘤治疗中仍面临诸多挑战。其中主要障碍之一是细胞外基质(ECM),它作为物理屏障阻碍 T 细胞向肿瘤组织浸润。MMP3 过表达不会损害 CAR-T 细胞的增殖、激活或细胞毒性。然而,它能显著增强 CAR-T 细胞穿透 ECM 的侵袭能力,并在体外提升肿瘤细胞杀伤效果。在富含 CAF 的异种移植模型中,经 MMP3 工程改造的 CAR-T 细胞表现出更优的肿瘤浸润、扩增能力和抗肿瘤活性。值得注意的是,在严格的富含 CAF 的肿瘤微环境中,MMP3 过表达恢复了 B7H3 CAR-T 细胞的功能,而传统 CAR-T 细胞的活性则受到限制。重要的是,在免疫功能正常的小鼠模型中,MMP3 过表达也赋予了 CAR-T 细胞强大的抗肿瘤活性,凸显了其在更接近生理和临床场景中的治疗价值。这些研究结果表明,MMP3 工程改造是一种简单且有效的策略,可克服基质屏障,增强 CAR-T 细胞疗法在实体瘤中的疗效。这篇文章于2026年1月26日发表于《Journal for ImmunoTherapy of Cancer》期刊上,IF:10.6。
研究技术路线:
主要实验结果:
1、MMP3过表达不影响CAR-T细胞的体外功能
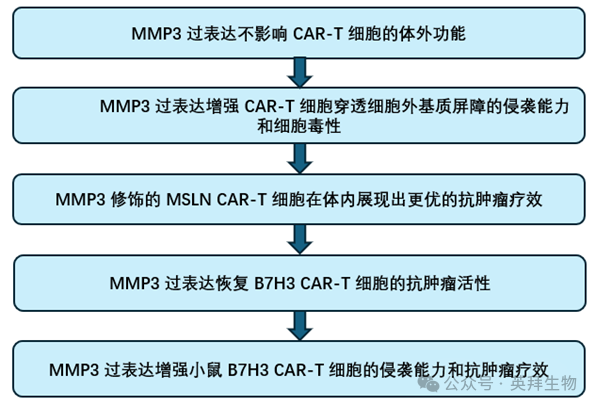
为评估MMP3过表达对CAR-T细胞功能的影响,作者构建了靶向间皮素(MSLN)的第二代CAR,包括共表达MMP3和不共表达MMP3两种类型(图1A)。尽管MMP3-MSLN CAR-T细胞的转导效率略低于传统MSLN CAR-T细胞(45.6% vs 61.4%),但差异无统计学意义(p>0.05)(图1B)。酶联免疫吸附试验(ELISA)证实,MMP3-MSLN CAR-T细胞可大量分泌MMP3,而未转导对照组(MOCK)和MSLN CAR-T细胞的分泌水平极低(图1C)。
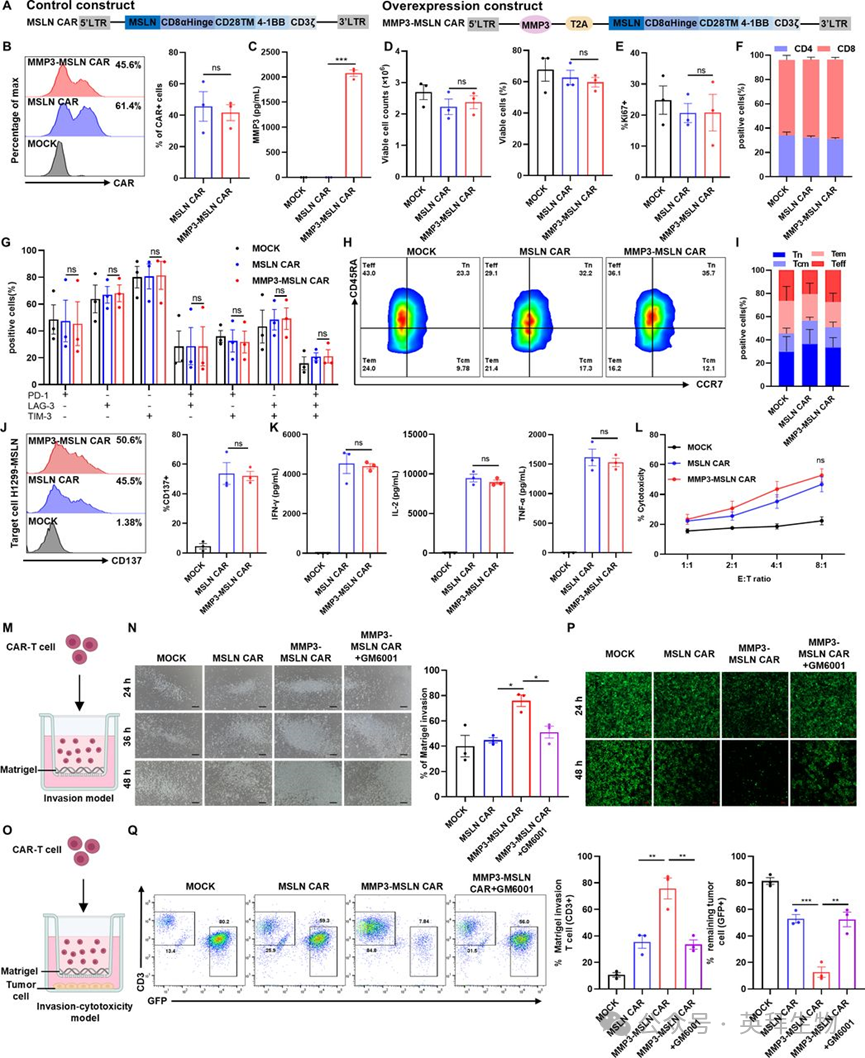
图1. 过表达MMP3的MSLN CAR-T细胞的构建、转导效率、增殖能力、表型特征、体外抗肿瘤活性及侵袭能力
重要的是,MMP3过表达未改变CAR-T细胞的增殖能力(图1D-1E)、CD4/CD8细胞比例、耗竭标志物表达或记忆表型分布(图1F-1I)。在与MSLN阳性肿瘤细胞(H1299-MSLN)共培养刺激后,MMP3-MSLN CAR-T细胞与传统CAR-T细胞在激活标志物(CD137)上调(图1J)、细胞因子分泌(干扰素-γ、白细胞介素-2、肿瘤坏死因子-α)(图1K)以及不同效应细胞与靶细胞(E:T)比例下的抗原特异性细胞毒性方面均表现相当(图1L)。
使用靶向B7H3的CAR-T细胞进行实验也得到了类似结果。两种CAR-T细胞的CAR表达水平相当(43.0% vs 40.1%),在增殖能力、表型特征、激活状态、细胞因子分泌和溶细胞功能方面均保持一致,同时MMP3分泌量充足。
这些数据共同表明,MMP3过表达不会损害CAR-T细胞在体外的基本生物学功能。
2、MMP3过表达增强CAR-T细胞穿透细胞外基质屏障的侵袭能力和细胞毒性
作者随后通过基质胶(Matrigel)侵袭实验,探究MMP3是否能增强CAR-T细胞穿透细胞外基质(ECM)成分的能力(图1M)。结果显示,与MOCK组和传统MSLN CAR-T细胞相比,MMP3-MSLN CAR-T细胞的侵袭能力显著增强(图1N)。广谱MMP抑制剂GM6001可阻断这种增强的侵袭作用,证实该效应依赖于MMP的酶活性(图1N)。MMP3-B7H3 CAR-T细胞也呈现出类似的研究结果。
为明确侵袭能力的提升是否会增强肿瘤细胞毒性,作者设置了CAR-T细胞穿透基质胶靶向下方小室中H1299-MSLN肿瘤细胞的实验体系(图1O)。结果显示,MMP3-MSLN CAR-T细胞能显著降低肿瘤细胞活力,这一结论可通过绿色荧光蛋白(GFP)荧光强度降低和流式细胞术定量分析得到证实(图1P、1Q)。GM6001同样可阻断这种增强的细胞毒性,进一步支持该效应依赖于MMP的作用(图1P、1Q)。在基质胶侵袭实验中,MMP3-B7H3 CAR-T细胞也表现出更优的肿瘤清除能力。
因此,尽管MMP3过表达本身并未直接增强CAR-T细胞的细胞毒性,但它通过促进CAR-T细胞穿透物理屏障,从而更高效地清除肿瘤细胞。
3、MMP3修饰的MSLN CAR-T细胞在体内展现出更优的抗肿瘤疗效
鉴于传统基质胶肿瘤模型存在局限性,作者通过共注射H1299-MSLN肿瘤细胞、基质胶和癌相关成纤维细胞(CAF),建立了更具生理相关性的异种移植模型(图2A)。CAF的加入丰富了肿瘤微环境(TME)的基质成分,促进了ECM沉积,并形成了更强的免疫细胞浸润屏障。这种富含CAF的模型能够更准确地评估CAR-T细胞在临床相关TME条件下的表现。
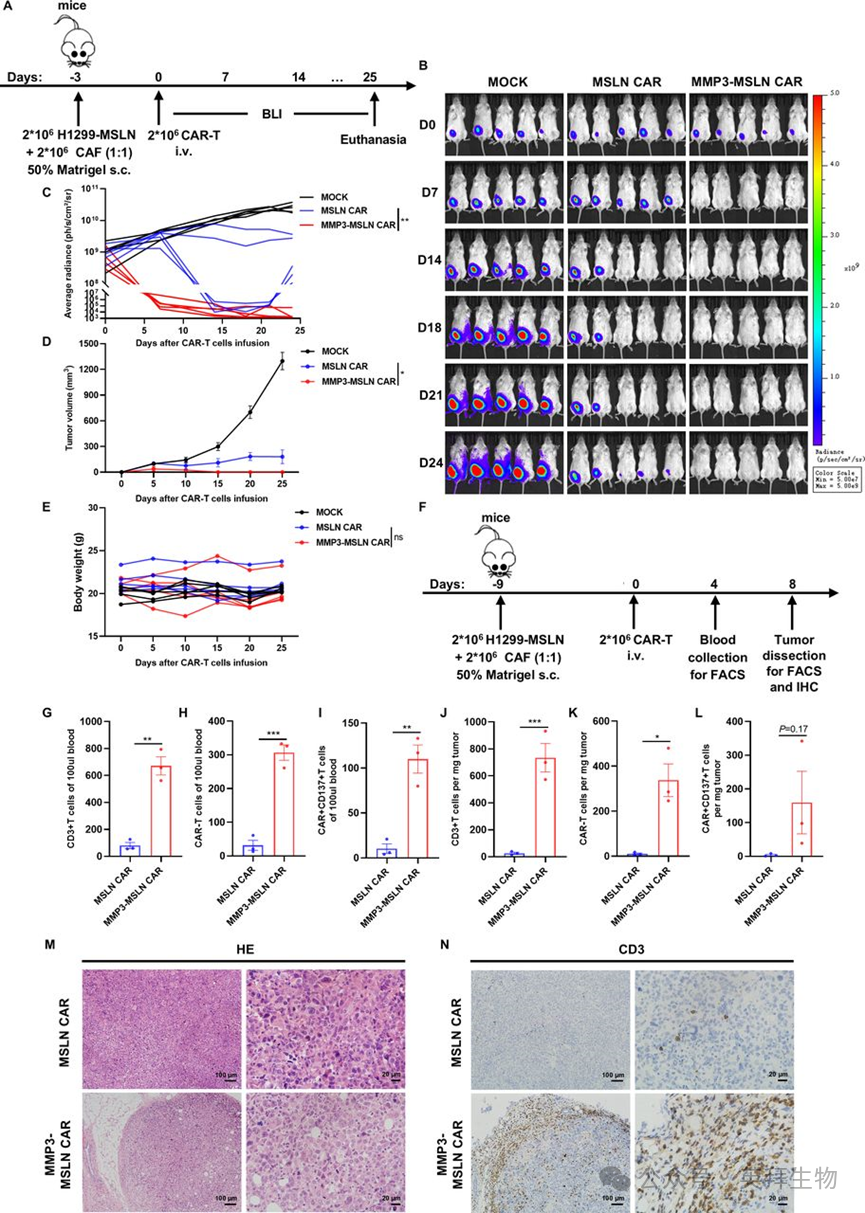
图2. 过表达MMP3的MSLN CAR-T细胞在富含CAF的异种移植模型中的体内抗肿瘤疗效及浸润情况
在富含CAF的H1299-MSLN异种移植模型中,与MOCK T细胞相比,传统MSLN CAR-T细胞能诱导显著的肿瘤消退,证实了其在体内的抗原特异性抗肿瘤活性(图2B-2D)。值得注意的是,MMP3-MSLN CAR-T细胞比传统MSLN CAR-T细胞实现了更快速且持久的肿瘤消退(图2B-2D),且未伴随体重下降(图2E)。
为进一步检测CAR-T细胞的浸润情况,作者在肿瘤接种后第8天对额外一批小鼠进行了CAR-T细胞输注(图2F)。外周血的流式细胞术分析显示,MMP3-MSLN CAR-T细胞治疗组的循环CD3+T细胞和CAR+T细胞水平显著升高,且激活状态(CD137+)的T细胞比例更高(图2G-2I)。一致地,肿瘤组织分析表明,与对照组相比,MMP3-MSLN组中总CAR-T细胞和激活状态CAR-T细胞的浸润显著增加(图2J-2L)。免疫组织化学(IHC)染色进一步证实,接受MMP3-MSLN CAR-T细胞治疗的小鼠肿瘤内T细胞浸润增强(图2M、2N)。
这些结果证实,在基质丰富的肿瘤模型中,MMP3过表达可促进MSLN CAR-T细胞的扩增、浸润和抗肿瘤疗效。
4、MMP3过表达恢复B7H3 CAR-T细胞的抗肿瘤活性
为进一步评估MMP3过表达的普适性,作者采用相同的富含CAF的小鼠模型方法,使用表达B7H3的A549细胞进行实验(图3A)。值得注意的是,用于建立B7H3和MSLN异种移植模型的肿瘤细胞、CAF和基质胶比例完全相同,确保了不同模型间基质屏障条件的可比性。
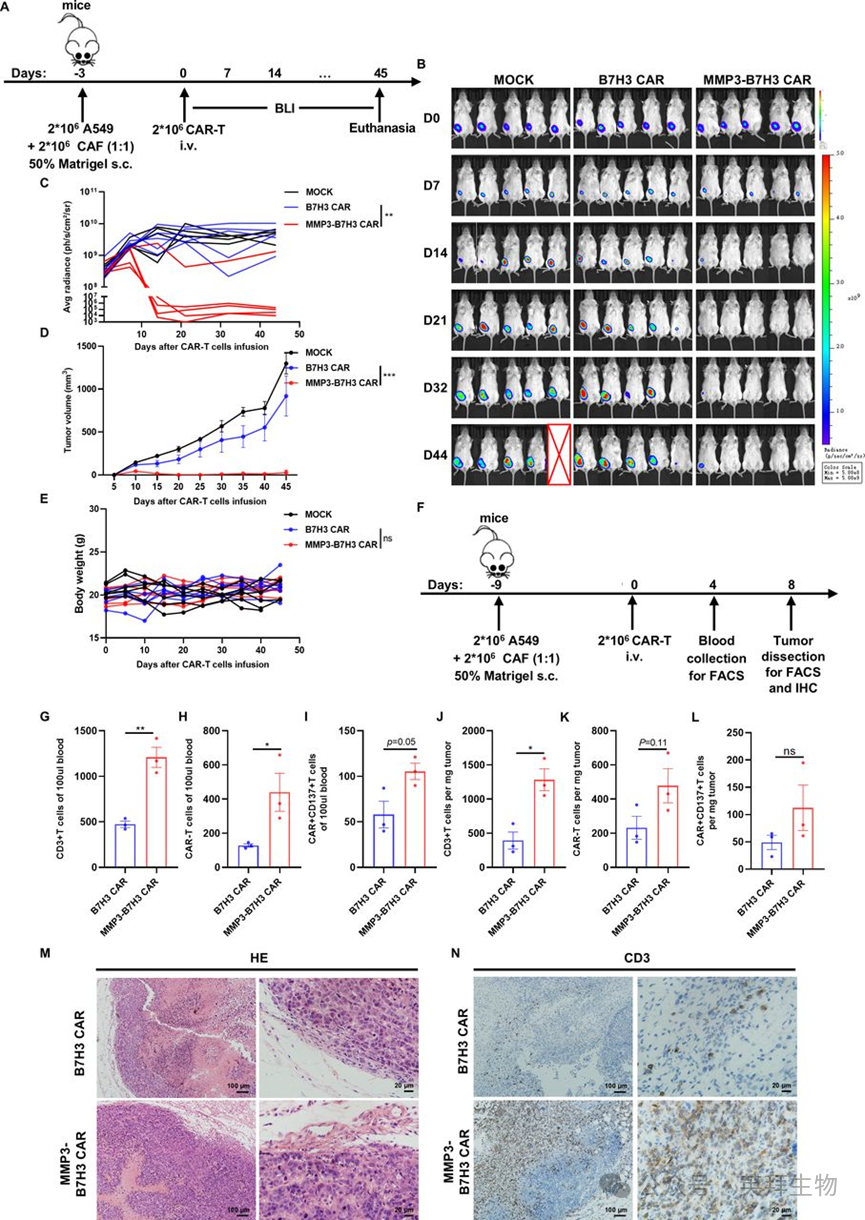
图3. 过表达 MMP3的B7H3 CAR-T细胞在富含CAF的异种移植模型中的体内抗肿瘤疗效及浸润情况
尽管条件一致,但传统B7H3 CAR-T细胞的抗肿瘤活性有限,其肿瘤生长曲线与MOCK T细胞治疗组高度相似(图3B-3D)。这表明在致密的、富含CAF的TME环境中,B7H3 CAR-T细胞本身具有较弱的抗肿瘤活性。因此,与MSLN模型相比,B7H3模型是一个更严格的治疗增强效果评估体系。
重要的是,与传统B7H3 CAR-T细胞和MOCK T细胞相比,MMP3-B7H3 CAR-T细胞表现出显著增强的肿瘤控制能力(图3B-3D),且未引发全身性毒性(图3E)。外周血和肿瘤组织的流式细胞术分析显示,与对照组相比,MMP3-B7H3组中CAR-T细胞的积累和激活呈上升趋势(图3F-3L)。免疫组织化学染色进一步证实,MMP3过表达显著增加了肿瘤内T细胞的浸润(图3M、3N)。这些发现表明,即使在富含CAF的TME中基础抗肿瘤活性不足的情况下,MMP3过表达仍能克服基质屏障并恢复B7H3 CAR-T细胞的疗效。
5、MMP3过表达增强小鼠B7H3 CAR-T细胞的侵袭能力和抗肿瘤疗效
为明确MMP3过表达是否能改善小鼠CAR-T细胞的浸润和肿瘤控制效果,作者构建了小鼠B7H3 CAR-T细胞(B7H3 mCAR)和过表达小鼠MMP3的B7H3 CAR-T细胞(MMP3-B7H3 mCAR)。两种CAR-T细胞的CAR表达水平相当(图4A)。ELISA检测结果显示,MMP3-B7H3 mCAR-T细胞分泌的小鼠MMP3水平显著高于MOCK组和B7H3 mCAR-T细胞,而后两者的分泌量极低(图4B)。在LLC-hB7H3细胞刺激下,两种CAR-T细胞在多个E:T比例下均表现出相似的细胞因子(干扰素-γ)分泌水平(图4C)和抗原特异性细胞毒性(图4D)。
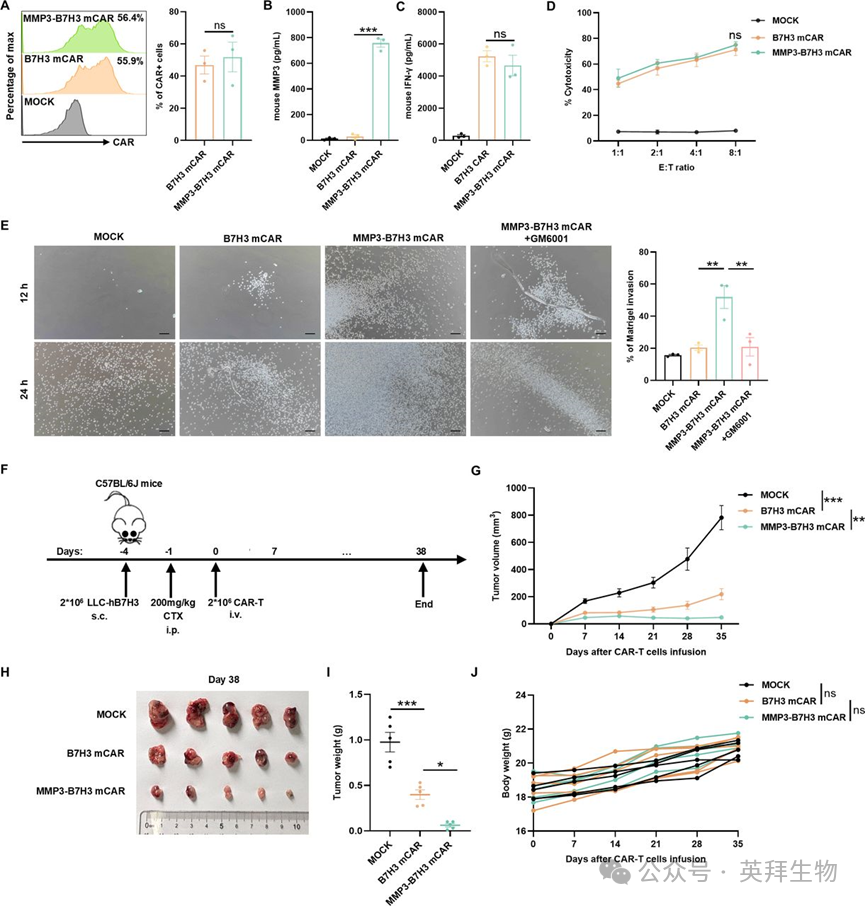
图4. 过表达MMP3增强小鼠B7H3 CAR-T细胞的侵袭能力和抗肿瘤疗效
在基质胶侵袭实验中,与对照组B7H3 mCAR-T细胞相比,MMP3-B7H3 mCAR-T细胞的侵袭活性显著增强,且这种增强作用可被MMP抑制剂GM6001阻断(图4E)。
为评估过表达MMP3的小鼠CAR-T细胞的体内抗肿瘤活性,作者给C57BL/6J小鼠皮下接种LLC-hB7H3细胞,并在CAR-T细胞输注前腹腔注射环磷酰胺(CTX)进行淋巴清除(图4F)。与对照组B7H3 mCAR-T细胞相比,MMP3-B7H3 mCAR-T细胞显著抑制了肿瘤生长(图4G-4I)。各组间体重无显著差异,表明该治疗具有良好的耐受性(图4J)。这些发现表明,在免疫功能正常的模型中,MMP3过表达可促进ECM降解,并增强CAR-T细胞的浸润和抗肿瘤活性。
综上所述,作者的研究结果强调了基质成分在限制CAR-T细胞对实体瘤疗效中的关键作用。本研究建立的富含CAF的模型更准确地再现了临床TME的物理屏障和免疫抑制屏障。重要的是,在不同的CAR靶点中,MMP3过表达均能显著增强CAR-T细胞的扩增、浸润和肿瘤清除能力。在免疫功能正常和免疫缺陷小鼠模型中均观察到了一致的结果,这凸显了该策略在克服基质抵抗和改善实体瘤治疗效果方面的广泛适用性。
结论
总之,作者的研究结果证实,MMP3过表达是一种简单且有效的策略,可增强CAR-T细胞在实体瘤中的浸润和抗肿瘤活性。通过简化基因修饰过程并维持T细胞功能,MMP3工程为开发针对实体恶性肿瘤的下一代CAR-T细胞疗法提供了一个很有前景的方向。
参考文献
Xu J, Hu Q, Zhu Y, Liu Q, Wang F, Yu Y, Wang W, Ding X. The TRIM3/TLR3 axis overrides IFN-β feedback inhibition to suppress NSCLC progression. Cell Death Dis. 2026 Jan 16;17(1):44. doi: 10.1038/s41419-025-08265-w. PMID: 41545343; PMCID: PMC12811290.






