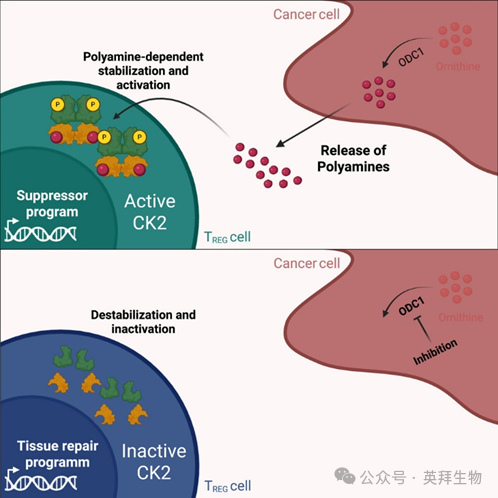
多胺通过调节性T细胞功能特化调控适应性抗肿瘤免疫
在癌症中,代谢改变和失控的肿瘤生长会改变营养物质的可利用性,进而影响抗肿瘤免疫反应。调节性T(Treg)细胞是具有免疫抑制特性的T细胞亚群,它们也能影响组织稳态和修复。然而,这些功能在分子机制上如何被控制,以及它们是否受肿瘤代谢的影响,尚不清楚。本研究揭示,肿瘤微环境中多胺的过量释放,会以蛋白激酶CK2(CK2)依赖的方式,引导Treg细胞向免疫抑制方向发生功能极化。剥夺多胺供应,或者在Treg细胞中通过基因或药物手段抑制CK2活性,能诱导Treg细胞产生组织修复特性。这些具有修复特性的Treg细胞协调了高效的抗肿瘤2型免疫反应,并协同组织修复机制,从而支持肿瘤的清除。这些发现表明,靶向调控Treg细胞的功能可作为癌症治疗的潜在途径。本文于2025年7月发表于《Immunity》,IF:26.3。
图形摘要
主要研究结果:
1.肿瘤产生的多胺调控适应性抗肿瘤免疫应答
为评估肿瘤来源的代谢物,研究人员给野生型(WT)小鼠皮下(s.c.)注射了B16.F10黑色素瘤(B16.F10)细胞或MC38结肠腺癌(MC38)细胞。当肿瘤生长至约200 mm³时进行切除,并用PBS冲洗以收集间质液进行定量质谱分析。分析显示肿瘤微环境(TME)中存在多种丰富的代谢物,其中腐胺、精胺和亚精胺的水平与健康皮肤相比显著升高(图1A)。与此一致的是,荷瘤小鼠血清多胺浓度的升高与人类患者的发现相呼应,表明肿瘤来源的多胺释放增强(图1B)。为进一步评估其与人类肿瘤的相关性,研究人员分析了癌症基因组图谱(TCGA)的数据,结果显示肿瘤组织中多胺合成代谢酶的表达升高。此外,促进多胺合成的酶(ODC1、SRM、SMS、AZIN1和AMD1)的高表达与较差的生存率相关,而分解代谢酶(SAT1、PAOX、SMOX和OAZ1–3)表达升高则预示着较好的预。鉴于研究人员关注多胺驱动的适应性免疫抑制,他们选择了低免疫原性且生长迅速的B16.F10黑色素瘤模型。
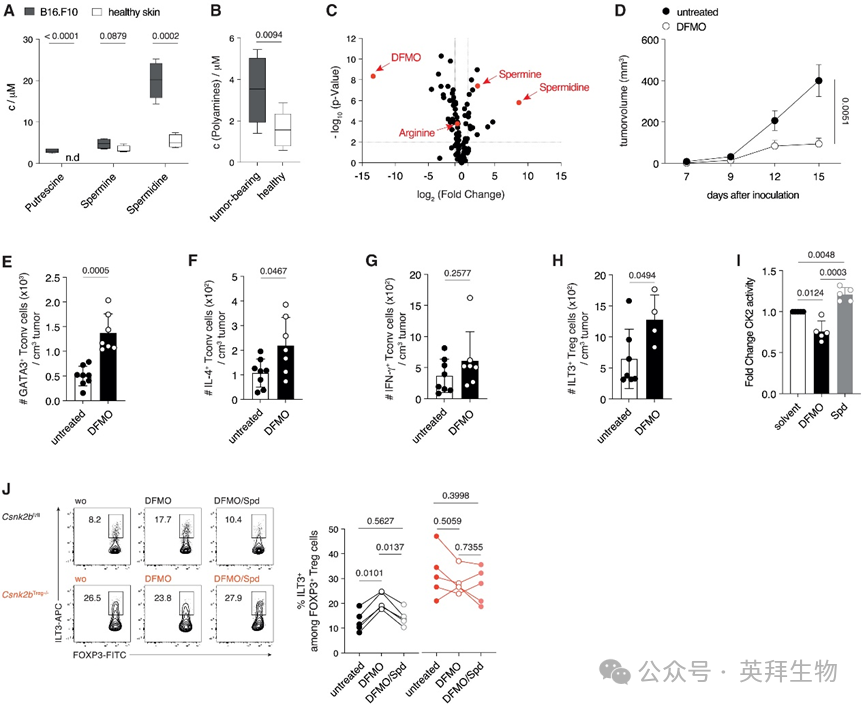
图1 肿瘤来源的多胺抑制抗肿瘤2型免疫
鉴于多胺作为癌症诊断生物标志物的作用,研究人员探究了肿瘤微环境(TME)中升高的间质多胺水平如何影响肿瘤进展。虽然多胺生物合成限速酶ODC1的完全种系缺失在体外会导致B16.F10细胞死亡,但研究人员转而使用二氟甲基鸟氨酸(DFMO)或小干扰RNA(siRNA)抑制ODC1,以研究肿瘤来源的多胺在免疫应答中的作用。在将B16.F10细胞皮下(s.c.)接种到C57BL/6J野生型(WT)小鼠体内之前,先用DFMO处理或用靶向Odc1的siRNA转染。使用DFMO抑制ODC1降低了细胞内亚精胺和精胺的水平,并导致精氨酸(ODC1底物L-鸟氨酸的前体)的积累(图1C)。这种代谢阻断导致体内肿瘤生长减少(图1D),表明可能对肿瘤细胞增殖、抗肿瘤免疫或两者都有直接影响。同样,使用siRNA沉默Odc1减少了多胺产生并限制了肿瘤进展。对肿瘤浸润CD4+ T细胞的分析显示,ODC1抑制后出现了偏向TH2的免疫应答,表现为GATA3+和白介素(IL)-4+细胞增加,而干扰素(IFN)-γ+细胞数量不变(图1E–1G),提示多胺抑制2型免疫。为评估TME中多胺剥夺如何影响调控2型免疫的Treg细胞,研究人员分析了经DFMO处理或ODC1沉默的肿瘤及其各自对照组中肿瘤浸润淋巴细胞(TIL)内表达免疫球蛋白样转录物(ILT)3的Treg细胞。抑制多胺合成后,TME中无法抑制2型免疫的ILT3+ Treg细胞亚群增加(图1H)。ILT3+ Treg细胞的发育及其促TH2功能依赖于CK2β,后者调控全酶组装和激酶活性。在体外,多胺结合到CK2β的苏氨酸72位点(位于催化口袋附近含谷氨酸的三肽E60/61/63旁),这种结合诱导构象变化,增强底物进入和CK2磷酸化活性。为证实他们的发现,研究人员使用SwissDock进行了分子对接,并用Chimera可视化预测的多胺与CK2β的结合,确定酸性凹槽为主要结合位点,证实了Leroy等人的发现。为评估多胺在调控Treg细胞CK2活性中的作用,研究人员用ODC1抑制剂DFMO或外源性亚精胺培养野生型Treg细胞。DFMO降低了CK2全酶活性,而亚精胺则增强了该活性(图1I),表明存在特定的调控机制。此外,DFMO处理增加了Treg细胞上ILT3的表达,这种效应可被亚精胺逆转。在CK2β缺陷的Treg细胞中则不存在这种调控(图1J),证实多胺介导的ILT3表达调控依赖于CK2β活性。
2. Treg细胞特异性CK2β缺失促进高效抗肿瘤免疫
为明确CK2β在多胺调控的Treg细胞活性中的功能相关性,研究人员使用了Csnk2bTreg−/−小鼠(Csnk2bfl/flFoxp3-IRES-Cre),该小鼠在FOXP3+ Treg细胞中特异性缺失CK2β。这些小鼠出生符合孟德尔比率,表型正常,胸腺Treg细胞的发育、稳态和多胺合成均未改变。CK2β缺失显著降低了Treg细胞中CK2全酶的活性。为评估这是否影响细胞适应性,研究人员使用等量的CD90.2+ Csnk2bTreg−/−和CD90.1+ 野生型(WT)骨髓构建了混合骨髓嵌合体。移植后8周,两组Treg细胞在外周淋巴结中的比例相当,表明尽管缺失CK2β,其竞争适应性仍得以保留。
在排除了CK2β缺失对Treg细胞适应性的影响后,研究人员给小鼠皮下接种B16.F10细胞,观察到与同窝对照小鼠(Csnk2bfl/fl)相比,Csnk2bTreg−/−小鼠的肿瘤生长显著减缓(图2A)。肿瘤生长减缓伴随着TME中CD45+免疫细胞浸润增强(图2B),表明抗肿瘤反应更强。为在单细胞水平评估抗肿瘤免疫反应,我们量化了TIL中细胞毒性CD8+ T细胞(CTL)的百分比和数量。该分析显示CTL的百分比和数量均增加(图2C和2D),表明肿瘤细胞杀伤能力增强。在Csnk2bTreg−/−小鼠的肿瘤浸润CTL中,研究人员发现多功能CTL增多,表现为KLRG1表达增加(图2E)、IFN-γ和肿瘤坏死因子α(TNF-α)共表达增加(图2F),以及PD-1+LAG-3+CD8+ T细胞百分比降低(图2G)。CK2β缺陷的Treg细胞上程序性细胞死亡蛋白1(PD-1)的表达也下调。对TME中αβ T细胞的单细胞RNA测序(scRNA-seq)显示,与对照组相比,Csnk2bTreg−/−小鼠的CTL中细胞毒性相关基因的表达更高(图2H)。与这些发现一致,研究人员观察到CD4+FOXP3−效应T细胞(Tconv细胞)的百分比和数量均增加(图2I和2J)。
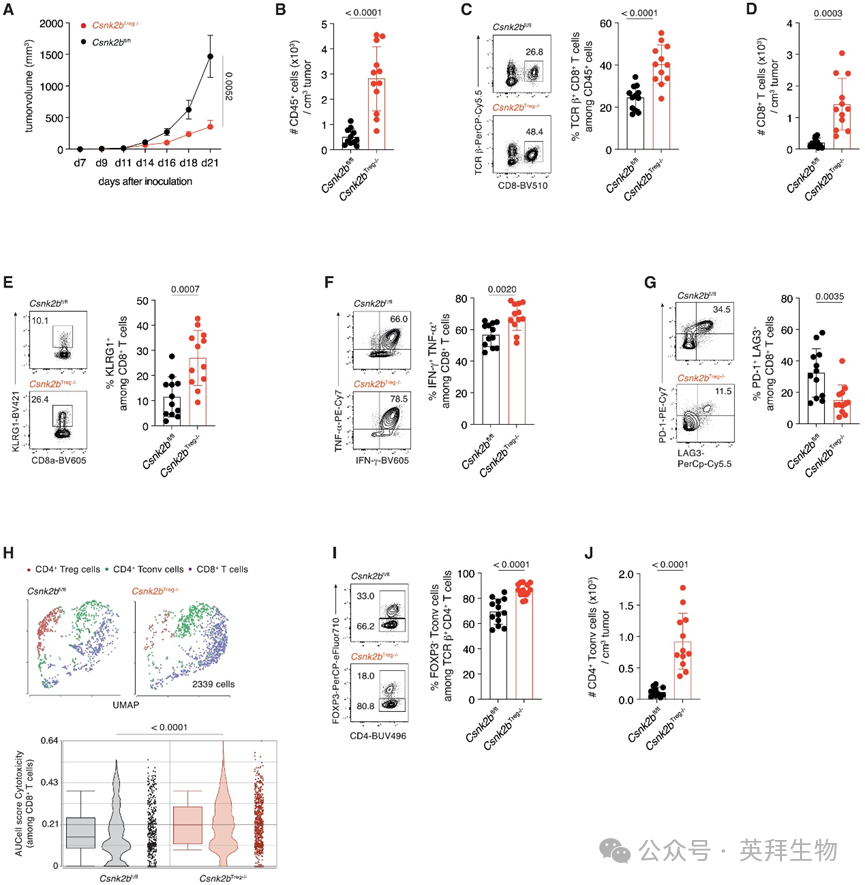
图2 Treg细胞特异性CK2β缺失促进高效抗肿瘤免疫
为分析这种强烈的抗肿瘤免疫反应是否源于CK2β缺陷的Treg细胞抑制功能受损,研究人员检测了与Treg细胞抑制功能相关分子的表达。该分析显示CTLA-4、颗粒酶B(GrzB)、CD39和CD73的表达未改变,而白介素-10(IL-10)和转化生长因子β(TGF-β)的表达略有增强,提示其抑制特性未发生改变。为在功能上检测CK2β缺陷的Treg细胞的抑制特性,研究人员从Csnk2bTreg−/−和Csnk2bfl/fl小鼠中分离出Treg细胞,并将其与从C57BL/6J野生型(WT)小鼠分离的初始CTL和CD11c+树突状细胞(DC)共培养。这些分析表明,在体外,CK2β缺陷和CK2β正常的Treg细胞抑制CTL增殖和IFN-γ产生的能力相当。同样,与CK2β正常的Treg细胞相比,CK2β缺陷的Treg细胞抑制TH1细胞产生IFN-γ的能力也相同。为在体内检测CK2β缺陷的Treg细胞的抑制能力,研究人员采用了T细胞驱动的结肠炎模型。他们观察到,野生型和CK2β缺陷的Treg细胞在抑制由初始CD62LhighCD44−CD4+ T细胞过继转移至Rag1缺陷宿主小鼠诱导的结肠炎方面具有同等的抑制能力,这体现在它们均能预防炎症依赖性体重减轻。
总之,这些发现清楚地表明,Treg细胞中多胺依赖的CK2激活会损害高效的适应性抗肿瘤免疫。
3.ILT3+ Treg细胞协调高效的2型抗肿瘤免疫应答
为评估Treg细胞中CK2β在多胺依赖性抑制抗肿瘤2型免疫应答中的作用,研究人员分析了Csnk2bTreg−/−和Csnk2bfl/fl小鼠肿瘤微环境(TME)中CD4+ T细胞区室的细胞组成。为此,研究人员给Csnk2bTreg−/−和Csnk2bfl/fl小鼠接种B16.F10细胞,并在接种后第21天手术切除肿瘤。随后分离Tconv细胞进行RNA测序(RNA-seq)全转录组分析。差异表达基因(DEG)分析显示,在肿瘤浸润的Tconv细胞中,与TH2表型相关的基因表达显著增强(图3A)。为在细胞水平上证实这些发现,研究人员通过多色流式细胞术分析了Csnk2bTreg−/−和Csnk2bfl/fl小鼠TME中TH2细胞的存在。该分析显示表达GATA3、IL-4、IL-5和IL-13的TH2细胞百分比显著增加,支持了肿瘤浸润Tconv细胞RNA-seq获得的结果(图3B)。
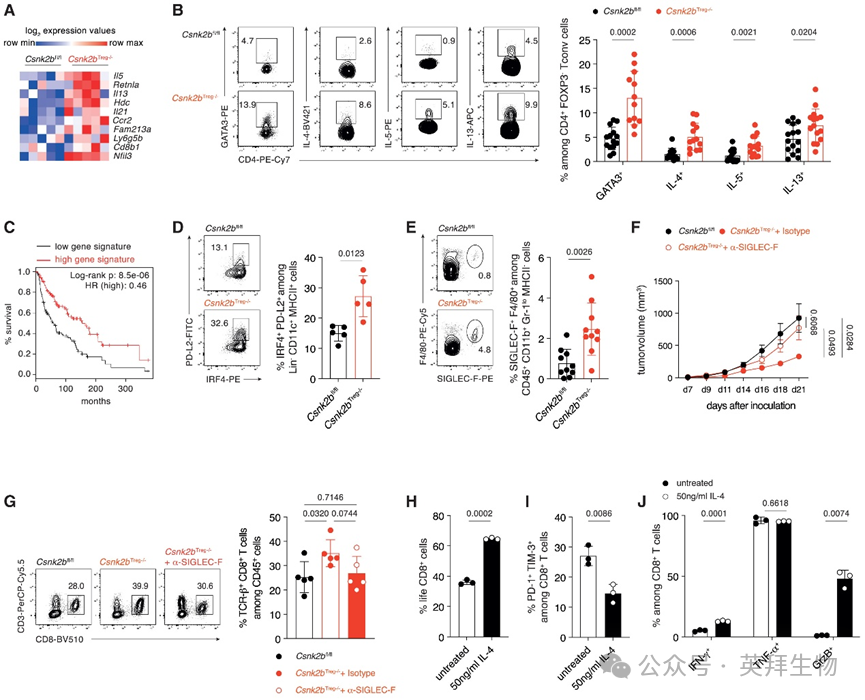
图3 Treg细胞中Csnk2b的缺失导致抗肿瘤2型免疫
为评估荷瘤Csnk2bTreg−/−小鼠肿瘤微环境(TME)中Tconv细胞全转录组差异对抗肿瘤免疫的相关性,研究人员对Csnk2bTreg−/−小鼠肿瘤浸润Tconv细胞中高表达的差异基因(DEG)进行了生物信息学分析。为评估临床意义,研究人员使用TCGA数据将这些基因与黑色素瘤患者预后进行关联分析。基于在TCGA皮肤黑色素瘤(SKCM)数据集中的表达,通过Gene Expression Profiling Interactive Analysis (GEPIA) 2生成一个基因特征集并进行生存分析。这些分析表明,在荷瘤Csnk2bTreg−/−小鼠TME的Tconv细胞中观察到的转录组变化与黑色素瘤患者生存率的提高显著相关(图3C)。这些发现提示,Treg细胞中CK2β的缺失及随之增强的TH2驱动的抗肿瘤免疫应答可能具有跨物种相关性。
为理解这种适应性2型免疫的成因,研究人员对TME中的抗原提呈细胞进行了基于流式细胞术的分析。分析显示TME中表达干扰素调节因子4(IRF4)和程序性细胞死亡1配体2(PD-L2)的树突状细胞(DC)亚群比例增加(图3D),该亚群支持TH2细胞分化。为理解TME中增强的2型免疫应答发展对髓系抗肿瘤免疫反应的影响,研究人员通过多色流式细胞术分析了粒细胞。研究人员观察到嗜酸性粒细胞在TME中的显著浸润(图3E),这可能是对TH2细胞来源的IL-5和IL-13的反应。
为理解观察到的增强的2型免疫和嗜酸性粒细胞募集的作用,研究人员通过注射α-唾液酸结合免疫球蛋白样凝集素(SIGLEC)-F抗体在体内清除嗜酸性粒细胞。流式细胞术分析和基于t分布随机邻域嵌入(tSNE)的可视化显示,α-SIGLEC-F处理后嗜酸性粒细胞几乎完全消失。此外,在Csnk2bTreg−/−小鼠中清除嗜酸性粒细胞导致抗肿瘤免疫受损(图3F)以及TME中CTL百分比降低(图3G),进一步削弱了有效的抗肿瘤免疫。
4.抗肿瘤2型免疫可防止CTL耗竭
当前的癌症免疫疗法,包括免疫检查点阻断,主要集中于增强1型免疫以根除癌细胞。虽然这些方法已取得临床成功,但如何防止CTL耗竭(即癌症反应性T细胞失去功能并无法控制肿瘤生长)仍知之甚少。为理解Treg细胞调控的2型免疫应答如何控制Csnk2bTreg−/−小鼠肿瘤中CTL的多功能性,研究人员根据Satpathy及其同事的方法建立了一个慢性体外耗竭模型。刺激后收集细胞,并通过分析PD-1、T细胞免疫球蛋白及粘蛋白结构域蛋白-3(TIM-3)、IFN-γ、TNF和GrzB的表达来测量耗竭程度。Csnk2bTreg−/−小鼠肿瘤浸润CD4+ Tconv细胞中IL-4的产量显著增加(图3B),促使研究人员在该体外系统中测试外源性IL-4的作用。加入IL-4联合慢性刺激导致CTL活力增强(图3H)、表达PD-1和TIM-3的双阳性细胞减少(图3I)、IFN-γ和GrzB表达增强,而TNF表达不受影响(图3J)。这些数据强烈表明,IL-4浓度的升高能够防止Csnk2bTreg−/−小鼠肿瘤中CTL的耗竭。
5.蛋白激酶CK2调控Treg细胞的组织修复程序
接下来,研究人员试图理解Treg细胞中CK2β的缺失、ILT3+ Treg细胞的发育以及2型抗肿瘤免疫应答的诱导之间的关系。因此,研究人员通过多色流式细胞术检测了Csnk2bTreg−/−和Csnk2bfl/fl小鼠肿瘤中的ILT3+ Treg细胞。分析显示,Csnk2bTreg−/−小鼠肿瘤浸润ILT3+ Treg细胞的百分比(图4A)和绝对数量(图4B)均显著增加。这些发现促使研究人员探究多胺导向的Treg细胞CK2活性的信号转导通路。为此,研究人员在CK2β缺陷和CK2β正常的Treg细胞中进行了激酶组学分析。分析表明这对CK2的多个下游通路有强烈影响,包括Lyn(图4C),Lyn是组织驻留Treg细胞(tisTreg细胞)发育和功能所必需的激酶。CK2被证明可调节过氧化物酶体增殖物激活受体γ(PPARγ)的核输出,PPARγ是一种与Treg细胞组织驻留相关的转录因子。为分析CK2β缺陷的Treg细胞中CK2活性降低与PPARγ及ILT3表达之间的相关性,研究人员检测了PPARγ缺陷的Treg细胞中ILT3的表达。该分析显示编码ILT3的基因Lilrb4a的mRNA表达显著降低。为确定ILT3+ Treg细胞与tisTreg细胞之间的关系,研究人员基于Feuerer等人的数据(图4D),对C57BL/6J小鼠的ILT3+和ILT3− Treg细胞进行了RNA测序(RNA-seq),并比较了它们与tisTreg细胞相关基因的表达。这些比较分析表明,ILT3+ Treg细胞与从皮肤分离的tisTreg细胞在整体转录水平上几乎完全一致。为确认ILT3是tisTreg细胞的表面标志物,研究人员通过多色流式细胞术分析了肿瘤浸润ILT3−和ILT3+ Treg细胞上ST2、KLRG1和GATA3的表达。分析显示ILT3+ Treg细胞中ST2、KLRG1和GATA3的阳性比例更高。此外,双调蛋白(AREG)和Vegfa在ILT3+ Treg细胞中的表达显著增强,提示组织修复特性,尤其是在这些细胞中。
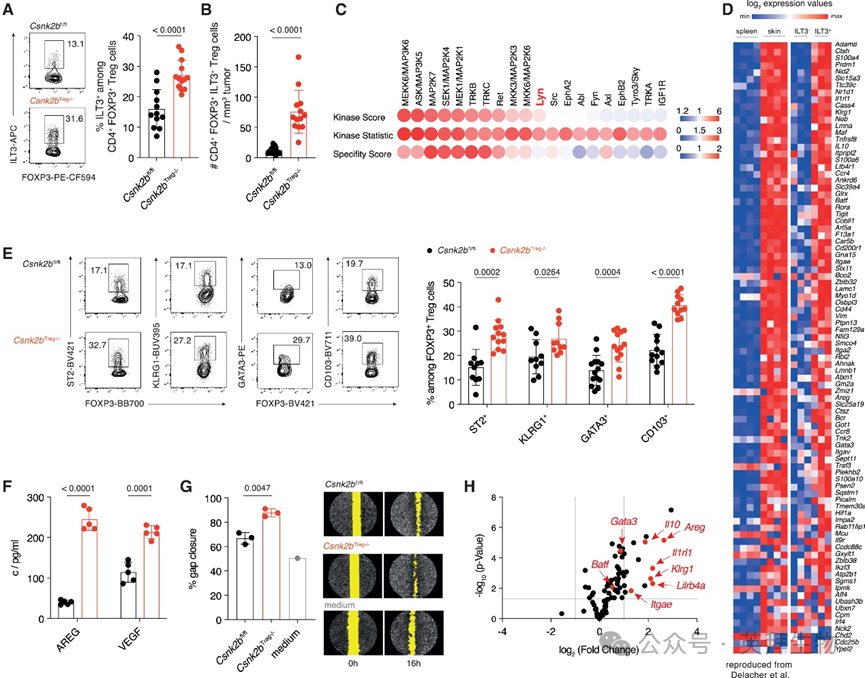
图4 CK2β缺陷的Treg细胞表现出组织修复Treg细胞的显著特征
为分析肿瘤浸润的CK2β缺陷Treg细胞中的tisTreg细胞特征,研究人员进行了流式细胞术分析,以评估从Csnk2bTreg−/−和Csnk2bfl/fl小鼠TME分离的Treg细胞上ST2、KLRG1、GATA3和CD103的表达。分析显示,除ILT3外,CK2β缺陷的Treg细胞上ST2、KLRG1、GATA3和CD103也呈高表达(图4E)。
为研究CK2β缺失对组织修复特性的影响,研究人员从Csnk2bTreg−/−和Csnk2bfl/fl小鼠分离Treg细胞,并刺激这些细胞72小时以允许伤口愈合因子分泌。基于ELISA的检测显示,CK2β缺陷的Treg细胞产生的tisTreg细胞效应分子AREG和血管内皮生长因子(VEGF)显著增强(图4F)。为分析组织修复功能,收集无细胞上清液,并在3T3小鼠成纤维细胞的伤口愈合实验中进行评估。来自CK2β缺陷Treg细胞的上清液比对照组更快地闭合细胞间隙,表明其组织修复特性增强(图4G)。为在全基因组水平理解CK2β在tisTreg细胞发育中的作用,研究人员分离了Csnk2bTreg−/−和Csnk2bfl/fl小鼠的Treg细胞,使用αCD3和αCD28联合刺激72小时,并进行了批量RNA测序(RNA-seq)。该分析显示与tisTreg细胞表型相关的基因表达显著增强,包括Il1rl1、Klrg1、Itgae、Gata3、Areg和Batf(图4H)。
总之,这些结果表明,Treg细胞中多胺驱动的蛋白激酶CK2活性稳定了其抑制特性并阻碍了组织修复功能。
6.多胺调控激酶CK2调节的Treg细胞组织修复特性
为全面了解多胺剥夺及伴随的CK2活性降低所诱导的变化,研究人员在存在和不存在DFMO的情况下对Treg细胞进行了批量RNA测序(RNA-seq)分析。使用磁珠从C57BL/6J小鼠脾细胞分离Treg细胞,随后在无多胺培养基中培养,添加或不添加DFMO以抑制内源性多胺合成。
分析显示与tisTreg细胞修复特性相关的基因表达增强。特别观察到,多胺剥夺后,Klrg1、Il1r1、Areg和Lilrb4a基因的表达相对较强(图5A)。此外,对这些细胞培养上清液的分析显示AREG产量显著,进一步强调了多胺剥夺对tisTreg细胞功能的诱导作用(图5B)。
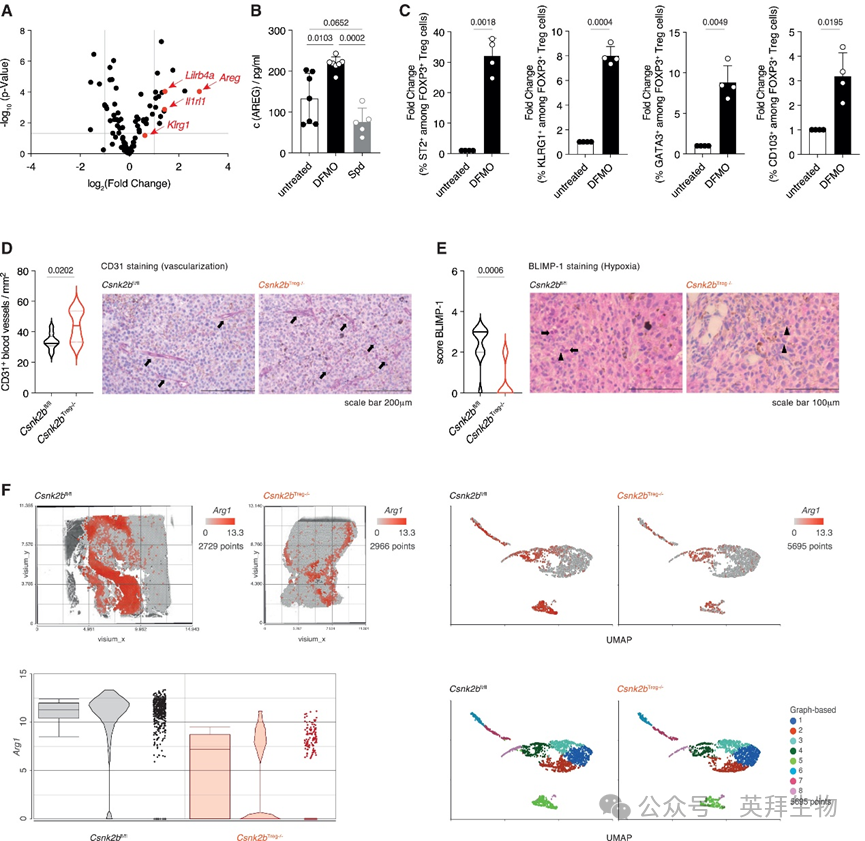
图5 多胺调节Treg细胞的组织修复能力
为证实多胺调控ILT3+ Treg细胞的发育,研究人员从Csnk2bTreg−/−和Csnk2bfl/fl小鼠的脾细胞中分离Treg细胞,并在存在或不存在DFMO的条件下刺激细胞后进行批量RNA测序(RNA-seq)。这些分析证实,多胺剥夺以及CK2β缺失均导致与tisTreg细胞表型相关基因的表达,并证明在501个多胺依赖性上调基因中,有283个基因的表达依赖于CK2β。
为在蛋白水平进一步证实这一结果,研究人员进行了流式细胞术分析,检测在添加或不添加DFMO的无多胺培养基中培养细胞后tisTreg细胞标志物ST2、KLRG1、GATA3和CD103的表达。该分析通过流式细胞术证实,在多胺剥夺条件下,这些tisTreg细胞标志物的表达增强(图5C)。仅在CK2β存在的情况下,单独的多胺剥夺就显著增加了所有检测的tisTreg细胞标志物的表达。该结果进一步证实,多胺剥夺以CK2β依赖的方式在ILT3+ Treg细胞的发育中起着核心作用。
为理解tisTreg细胞协调的组织修复程序在肿瘤微环境(TME)中的作用,研究人员通过免疫组织化学分析了TME的血管化情况。伴随Csnk2bTreg−/−小鼠TME中ILT3+ Treg细胞数量的增加,肿瘤显示出CD31+血管形成增强(图5D),这可能有助于减少缺氧、改善营养供应并促进代谢副产物的清除。为检测这些肿瘤中的缺氧情况,研究人员进一步染色了B淋巴细胞诱导成熟蛋白-1(BLIMP-1)转录因子,其表达受缺氧诱导因子1-α(HIF1α)调控并在缺氧条件下增加36。与Csnk2bfl/fl小鼠的肿瘤相比,Csnk2bTreg−/−小鼠肿瘤中BLIMP-1的表达显著降低(图5E),表明缺氧程度减轻。为从空间角度理解增强的血管化的影响,我们进行了肿瘤切片的空间转录组学分析。与在Csnk2bfl/fl小鼠中生长的肿瘤相比,在Csnk2bTreg−/−小鼠的肿瘤中,Arg1(已知在肿瘤相关巨噬细胞中受缺氧依赖性HIF活性调控37)的表达显著降低(图5F,上图)。通过聚类和分类,我们发现代表肿瘤相关巨噬细胞的簇5在Csnk2bfl/fl小鼠的肿瘤中高表达Arg1,但在Csnk2bTreg−/−小鼠的肿瘤中不表达,这支持CK2β缺陷的Treg细胞的组织修复特性有助于协调血管形成和减少缺氧(图5F,下图)。
总之,ILT3+ Treg细胞驱动的组织修复功能可能是Csnk2bTreg−/−小鼠中血管形成增强、缺氧减少和强烈抗肿瘤免疫反应的原因。
7.多胺代谢是基于Treg细胞的肿瘤治疗的潜在靶点
多胺转运蛋白抑制剂AMXT 1501和ODC1抑制剂DFMO的联合治疗目前正在临床试验中进行测试。为理解该治疗方法对治疗肿瘤TME中Treg细胞表型和功能的影响,研究人员给Csnk2bTreg−/−和Csnk2bfl/fl小鼠接种B16.F10细胞,并口服DFMO联合瘤周皮下注射AMXT 1501。研究人员测量了肿瘤生长情况,并通过多色流式细胞术分析了TME中Treg细胞的表型。联合治疗对Csnk2bTreg−/−小鼠的肿瘤生长没有影响,但显著减缓了Csnk2bfl/fl小鼠的肿瘤生长,使其生长速度与治疗和未治疗的Csnk2bTreg−/−小鼠中观察到的减缓生长相当(图6A)。此外,该治疗对TME中总的Treg细胞没有影响(图6B),但显著增强了ILT3+ Treg细胞的发育,表现为百分比(图6C)和绝对数量的增加,达到与Csnk2bTreg−/−小鼠相当的水平。同时,该治疗导致了增强的2型抗肿瘤免疫,表现为表达GATA3-(图6D)、IL-4-(图6E)和IL-13-(图6F)的肿瘤浸润Tconv细胞的百分比和绝对数量增加,而表达IFN-γ的Tconv细胞百分比未改变(图6G)。总之,这些结果表明,肿瘤来源的多胺控制ILT3+ Treg细胞的发育,并且多胺剥夺在体内以ILT3+ Treg细胞和CK2β依赖的方式诱导有效的2型抗肿瘤免疫。
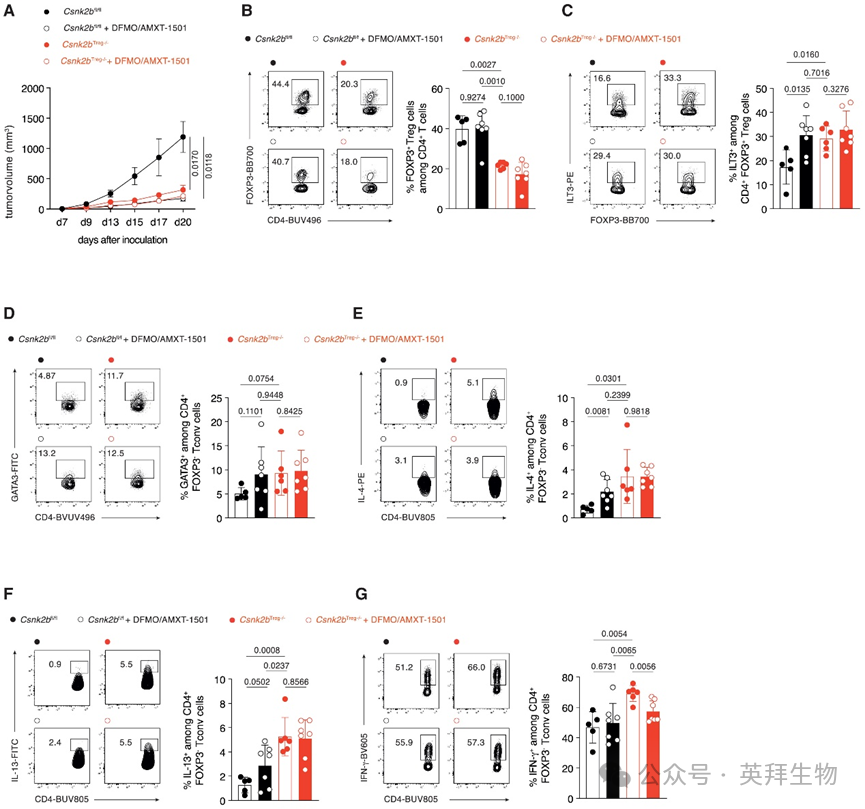
图6 肿瘤来源的多胺改变肿瘤内Treg细胞表型,阻碍有效的抗肿瘤反应
8. ILT3+ Treg细胞和2型抗肿瘤免疫反应对黑色素瘤患者有益
为理解Treg细胞中CK2表达降低或LILRB4(编码ILT3的基因)表达升高是否与黑色素瘤患者的生存获益相关,研究人员利用TCGA数据进行了生物信息学分析。与研究人员的临床前模型数据一致,肿瘤活检组织中CSNK2B表达降低联合Treg细胞转录组特征(低CSNK2B表达/高Treg细胞),以及LILRB4表达升高联合Treg细胞转录组特征(高LILRB4表达/高Treg细胞),均与黑色素瘤患者的生存期延长显著相关(图7A和7B)。同样,CSNK2B表达降低以及TH2细胞主转录因子GATA3或嗜酸性粒细胞强表达分子SIGLEC8的表达升高也与生存期延长相关。此外,肿瘤活检中ILT3的表达与GATA3和SIGLEC8的表达呈正相关。为理解Treg细胞中CK2β的作用以及ILT3+ Treg细胞在患者肿瘤中的作用,我们从RNA-seq分析中提取了这些细胞的特异性基因特征集(Areg, Batf, Ccr8, Cd44, Gata3, Gzmb, Il10, Il1rl1, Irf4, Itgae, Klrg1, and Lilrb4a),并将该转录组特征用于TCGA数据集的生存率分析。这些分析表明,该Treg细胞转录组特征表达增强导致生存率提高。因此,这些分析支持ILT3+ Treg细胞在协调人类中有效的TH2细胞驱动的2型抗肿瘤免疫方面发挥重要作用。
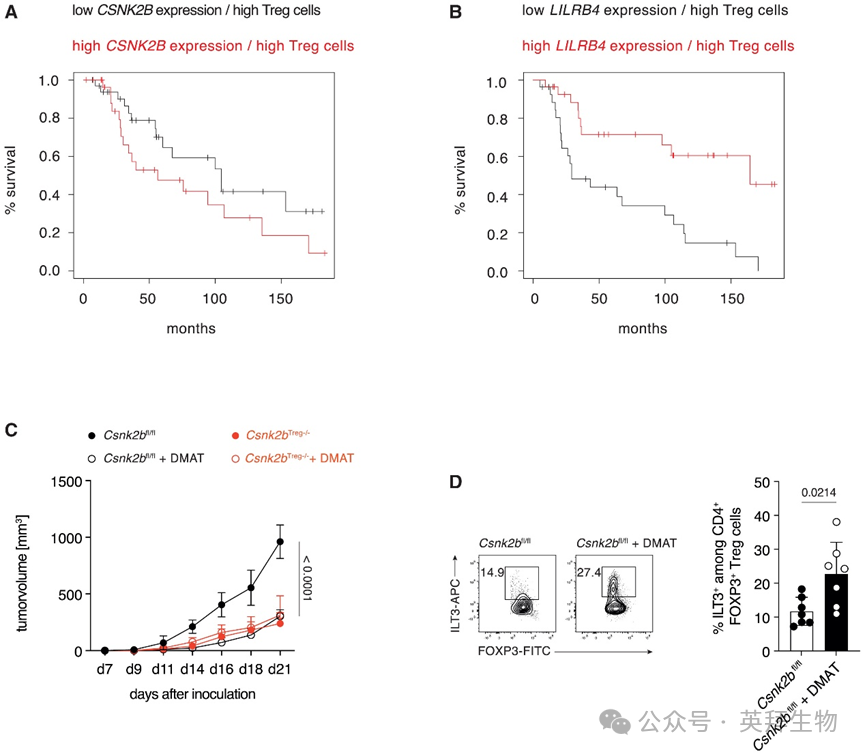
图7 Csnk2b的缺失或药理学CK2抑制重编程肿瘤浸润性Treg细胞,并与黑色素瘤生长抑制和患者生存期延长相关
最后,为测试所发现通路治疗黑色素瘤的治疗潜力,研究人员给Csnk2bTreg−/−和Csnk2bfl/fl小鼠皮下接种B16.F10细胞。在接种后第7天触及肿瘤时,研究人员以10 mg/kg体重的剂量皮下注射CK2抑制剂(2-二甲氨基-4,5,6,7-四溴-1H-苯并咪唑;DMAT),并监测随后的肿瘤生长。该治疗对TH2细胞本身的分化没有影响,对CTL也没有激活作用,但导致Csnk2bfl/fl小鼠的肿瘤生长受到强烈抑制,其抑制程度与治疗或未治疗的Csnk2bTreg−/−小鼠中观察到的相当(图7C)。多色流式细胞术显示,DMAT治疗后肿瘤生长显著减缓的同时,TME中ILT3+ Treg细胞的百分比增加(图7D)。对经DMAT处理和未处理的CK2β缺陷Treg细胞转录组的比较分析几乎没有发现差异表达基因(DEG),表明所用浓度的DMAT对CK2的抑制具有特异性(数据未显示)。
总之,这些结果证明了多胺导向的CK2活性对于ILT3+ Treg细胞的发育和功能至关重要,这些细胞协调有效的2型抗肿瘤免疫并维持免疫稳态。
结论
研究揭示了多胺调节Treg细胞中的CK2活性,对其表型和功能(平衡肿瘤免疫控制和免疫耐受)具有显著影响。CSNK2B低表达或LILRB4高表达患者生存期的改善支持了ILT3+ Treg细胞在人类黑色素瘤中的有益作用。因此,研究人员提出ILT3+/ILT3−FOXP3+ Treg细胞比率作为比总FOXP3+ Treg细胞数量更具信息量的预后标志物。这是否适用于所有肿瘤类型仍有待确定。重要的是,研究数据支持了靶向多胺合成或功能联合免疫检查点抑制剂(ICIs)的理论基础,因为ICIs依赖于有效的CTL反应。调节多胺驱动的免疫抑制微环境可以增强ICI疗法在黑色素瘤及其他癌症中的疗效。
参考文献
Bündgen et al., Polyamines regulate adaptive antitumor immunity by functional specialization of regulatory T cells, Immunity (2025), .immuni.2025.07.007






