去泛素化酶USP24通过稳定DHODH蛋白抑制三阴性乳腺癌的铁死亡
三阴性乳腺癌是一种侵袭性极强的乳腺癌亚型,其治疗选择有限且预后不良。尽管铁死亡这种依赖铁离子的程序性细胞死亡形式在肿瘤抑制中扮演着重要角色,但其在三阴性乳腺癌中的具体分子机制在很大程度上仍属未知。在本研究中,我们鉴定出去泛素化酶USP24是在人三阴性乳腺癌细胞发生铁死亡过程中,关键去泛素化酶中变化最为显著的一个。沉默USP24能够增强铁死亡介导的肿瘤抑制作用。从机制上讲,USP24与DHODH直接相互作用并对其进行去泛素化,这一过程对于维持辅酶Q的还原状态以及保护细胞免受脂质过氧化损伤至关重要。相应地,通过药理学方法抑制USP24,能够通过一条依赖于DHODH的通路,在体外和体内模型中与铁死亡诱导剂产生强烈的协同效应。这些发现凸显了USP24是一个潜在的治疗靶点,可用于增强三阴性癌细胞对铁死亡的敏感性。本文于2025年7月发表于“Cell Death and Disease”(IF=9.6)上。
技术路线:

结果:
1)在三阴性乳腺癌细胞铁死亡的过程中USP24会选择性地下调
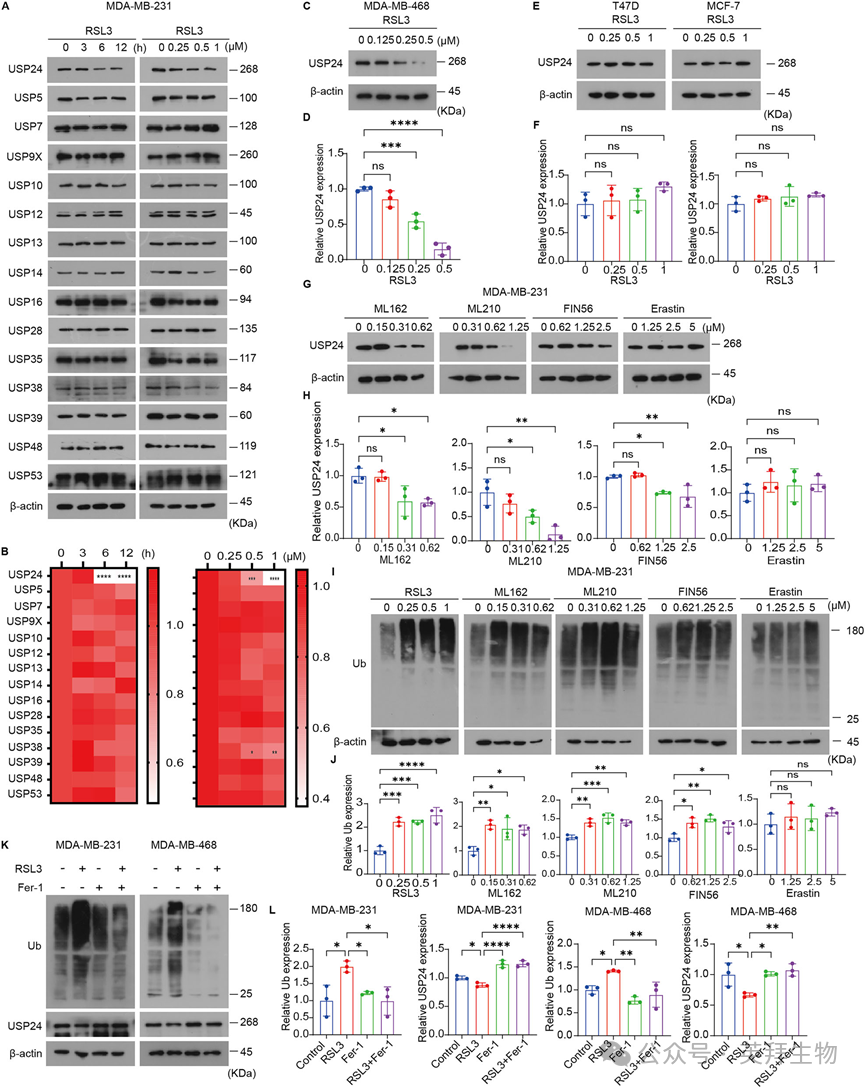
为探究铁死亡过程中去泛素化酶的变化,我们研究了RSL3对MDA-MB-231细胞中多种DUBs蛋白水平的影响。Western blot结果显示,RSL3以剂量和时间依赖性的方式显著下调了USP24的蛋白水平(图1A, B)。该效应并非仅限于MDA-MB-231细胞,因为在MDA-MB-468 细胞中也观察到类似结果,RSL3同样诱导了USP24蛋白水平的显著降低(图1C, D)。RSL3处理还会导致MDA-MB-468细胞中USP38水平下降,而在MDA-MB-231细胞中对USP38的表达没有影响,这表明USP38的调控具有细胞类型依赖性(图1A, B)。然而,RSL3对其他DUBs的影响则相对较小(图1A, B)。我们还研究了RSL3对非TNBC细胞(如T47D和MCF-7)中USP24蛋白表达的影响。结果显示,RSL3并没有改变这些乳腺癌细胞中USP24的表达,这表明铁死亡诱导的USP24下调是细胞型选择性的(图1E, F)。为了确定这种作用是否仅针对RSL3,我们评估了其他铁死亡诱导剂对USP24表达的影响。与RSL3类似,其他GPX4抑制剂,包括ML162、ML210和FIN56,下调USP24基因和蛋白水平(图1G、H)。相反,erastin对USP24蛋白水平没有影响,仅对其基因表达有很小的影响(图1G,H)。这些发现表明GPX4抑制,而不是SLC7A11阻断,与USP24下调特异性相关。鉴于DUB在泛素化中的关键调控作用,我们进一步评估了GPX4抑制剂对MDA-MB-231细胞泛素化动力学的影响。用RSL3、ML162、ML210或FIN56处理导致泛素化蛋白的显著积累,而erastin未能诱导这种效应(图1I,J)。为了证实铁死亡与这些观察结果之间的关系,我们测试了GPX4抑制剂与ferrostatin-1的组合。ferrostatin-1完全逆转了GPX4抑制剂诱导的泛素化积累和USP24下调(图1K、L)。综上所述,这些发现表明GPX4抑制剂诱导了TNBC细胞中USP24的下调并促进了泛素化的积累。
2)敲低USP24可促进TNBC细胞铁死亡
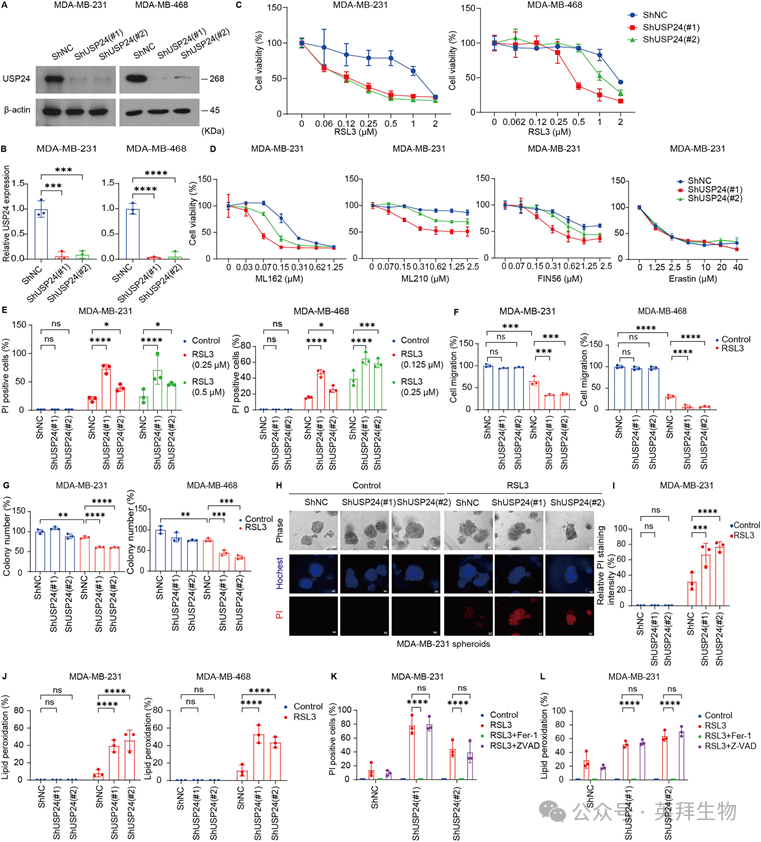
上述研究结果表明,USP24可能在铁死亡调控中发挥潜在作用。为验证这一假设,我们在MDA-MB-231和MDA-MB-468细胞中建立了USP24稳定敲低的细胞系。结果显示,敲低USP24显著增强了这两种细胞系对RSL3所致生长抑制的敏感性(图2A-C)。此外,在MDA-MB-231细胞中,USP24的敲低增强了其他GPX4抑制剂(包括ML162、ML210和FIN56)的抗肿瘤效果,而对erastin诱导的铁死亡影响甚微(图2D)。为进一步确认USP24在铁死亡中的作用,我们采用PI染色法评估了细胞死亡情况。结果表明,USP24敲低显著增强了RSL3诱导的细胞死亡(图2E)。此外,细胞迁移和集落形成实验显示,USP24敲低增强了RSL3的抗肿瘤效果,降低了三阴性乳腺癌细胞的迁移能力(图2F)和集落形成能力(图2G)。为更贴近肿瘤微环境,我们利用了MDA-MB-231细胞的三维球模型。与二维培养结果一致,USP24敲低同样增强了RSL3在三维球模型中诱导的细胞死亡(图2H, I)。另外,USP24敲低增加了TNBC细胞中由RSL3诱导的脂质过氧化(图2J)。重要的是,使用ferrostatin-1处理,可以逆转USP24敲低细胞中观察到的铁死亡敏感性和脂质过氧化水平的升高,而凋亡抑制剂Z-VAD-FMK则无此效果(图2K, L)。综上所述,这些发现表明,USP24通过调节铁死亡敏感性和脂质过氧化水平,在三阴性乳腺癌细胞中发挥着抗铁死亡蛋白的作用。
3)USP24抑制与铁死亡诱导剂协同增强TNBC细胞的抗肿瘤作用
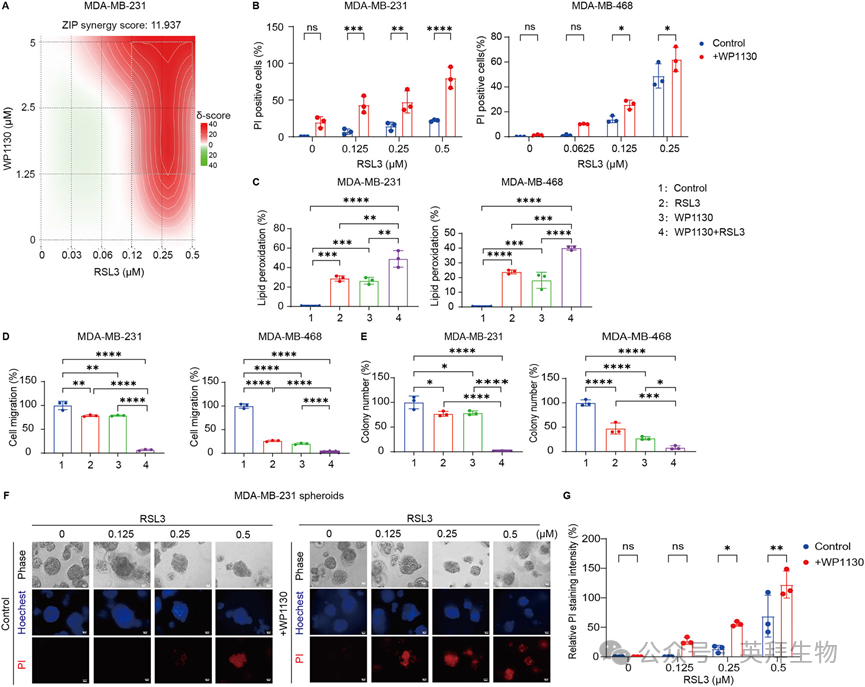
为进一步评估USP24在铁死亡中的作用,我们使用了已知的USP24抑制剂WP1130,以研究其对TNBC细胞铁死亡的影响。实验结果表明,WP1130与铁死亡诱导剂RSL3联合处理表现出显著的协同效应,在MDA-MB-231细胞中,其协同得分高达11.937(图3A)。进一步的PI染色和脂质过氧化检测结果显示,WP1130增强了RSL3在MDA-MB-231细胞中诱导的细胞死亡和脂质过氧化(图3B, C)。此外,细胞迁移和集落形成实验表明,WP1130与RSL3联用能够抑制TNBC细胞的迁移(图3D)并降低其集落形成能力(图3E)。与二维培养的结果一致,WP1130与RSL3联用也显著增强了细胞毒性效应,能明显减小肿瘤球的大小并增加细胞死亡(图3F, G)。这些研究结果证实,通过WP1130抑制USP24能够增强TNBC细胞的铁死亡,从而为靶向USP24以强化铁死亡驱动的抗癌策略提供了有力的证据,并凸显了其巨大的治疗潜力。
4)DHODH是TNBC细胞中USP24的底物
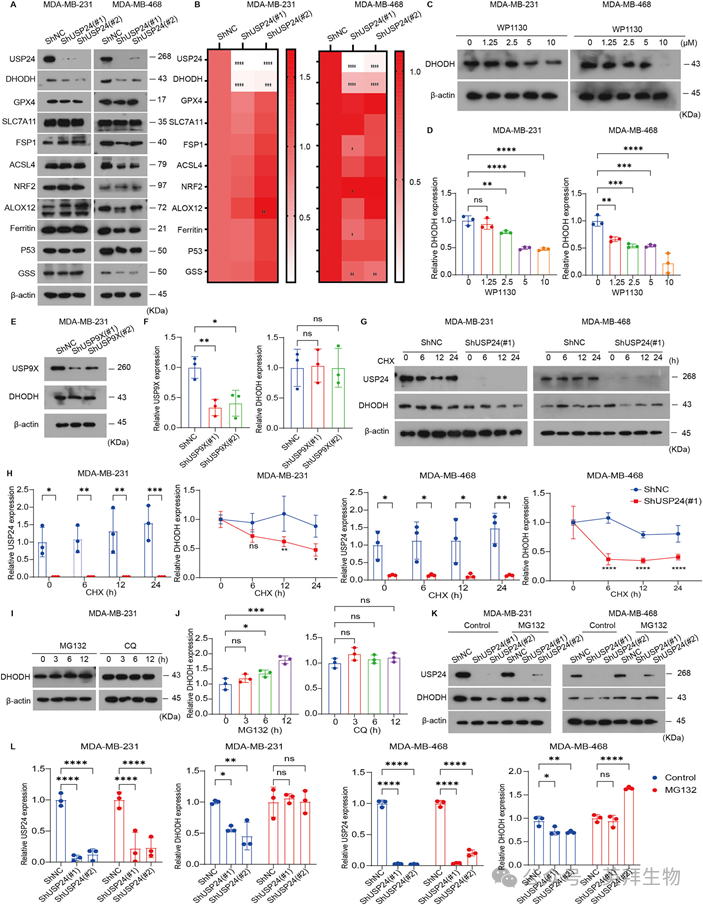
为了阐明USP24抑制铁死亡的具体机制,我们假设USP24可能影响关键铁死亡相关蛋白的稳定性。为了验证这一点,我们检测了USP24基因敲低对几种铁死亡相关蛋白的影响。Western blot检测显示,USP24敲低显著下调MDA-MB-231和MDA-MB-468细胞中的DHODH蛋白水平,而对其他蛋白的影响相对较小,包括GPX4、SLC7A11、FSP1、ACSL4、NRF2、ALOX12、铁蛋白和p53(图4A, B)。USP24的敲低不影响MDA-MB-231细胞中GSS的表达,但会下调MDA-MB-468细胞中GSS的表达,表明GSS的调节是细胞类型依赖性的(图4A, B)。使用USP24抑制剂WP1130处理虽能降低DHODH的蛋白水平,却并不影响其基因表达(图4C, D)。鉴于WP1130也能抑制USP9X,我们进一步探究了USP9X对DHODH蛋白表达的影响。然而,我们的结果显示,敲低USP9X并不影响DHODH的蛋白水平(图4E, F)。这些发现表明,USP24是通过转录后机制来调控DHODH蛋白水平的。为进一步探究USP24是否在翻译后水平影响DHODH,我们使用Cycloheximide来抑制蛋白质的合成。尽管阻断了蛋白质的合成,敲低USP24依然降低了TNBC细胞中DHODH的蛋白水平(图4G, H),这支持了USP24在翻译后水平调控DHODH蛋白稳定性的假说。由于细胞内蛋白质降解主要通过泛素-蛋白酶体系统(UPS)或自噬发生,因此我们试图确定哪种途径参与了DHODH的降解。蛋白酶体抑制剂MG132,而不是自噬抑制剂氯喹(CQ)处理,导致DHODH蛋白显著积累(图4I,J),表明DHODH主要通过UPS降解。此外,MG132在USP24敲低的MDAMB- 231和MDA-MB-468细胞中有效阻断了DHODH的降解(图4K, L),进一步证实了UPS在DHODH稳定性中的作用。
5)USP24通过稳定DHODH蛋白抑制铁死亡
DUB的主要功能是从底物蛋白中去除泛素,从而增强其稳定性。为了验证USP24是否直接与DHODH相互作用,我们进行了免疫共沉淀实验,发现在MDA-MB-231和MDA-MB-468细胞中USP24与DHODH免疫共沉淀(图5A,B)。此外,免疫荧光分析显示,USP24和DHODH主要共定位于MDA-MB-231和MDA-MB-468细胞的细胞质中,支持它们的功能关联(图5C,D)。为了进一步研究功能关系,我们检测了USP24敲低对DHODH泛素化的影响。USP24敲低显著增加了DHODH的总泛素化和K48连接的泛素化,这表明USP24通过催化DHODH的去泛素化来稳定DHODH(图5E,F)。这些发现强调了USP24通过泛素化调控维持DHODH蛋白稳定性的关键作用。接下来,为确定USP24介导的铁死亡抑制是否依赖于DHODH,我们在USP24敲低的细胞中过表达了DHODH。结果显示,过表达DHODH挽救了由RSL3处理和USP24敲低在MDA-MB-231和MDA-MB-468细胞中诱导的细胞死亡(图5G-I)。此外,细胞迁移和集落形成实验表明,过表达DHODH减弱了USP24敲低对细胞迁移和增殖的抑制作用(图5J, K)。一致地,恢复DHODH的表达降低了USP24敲低细胞中升高的脂质过氧化水平(图5L)。从机制上讲,DHODH催化CoQ还原为其活性形式——CoQH₂,这对于减轻脂质过氧化和铁死亡至关重要。为进一步验证该机制,我们向USP24敲低的细胞中补充了线粒体靶向的CoQH₂类似物——mitoQH₂。补充mitoQH₂有效保护了MDA-MB-231和MDA-MB-468细胞免受USP24敲低所触发的铁死亡,从而证实了DHODH活性在抑制铁死亡中的关键作用(图5M)。总之,USP24通过去泛素化作用稳定DHODH的蛋白水平,从而抑制TNBC细胞中的铁死亡。这种稳定作用增强了DHODH的活性,促进了CoQH₂的产生并减轻了脂质过氧化,进而导致TNBC细胞产生铁死亡抗性。
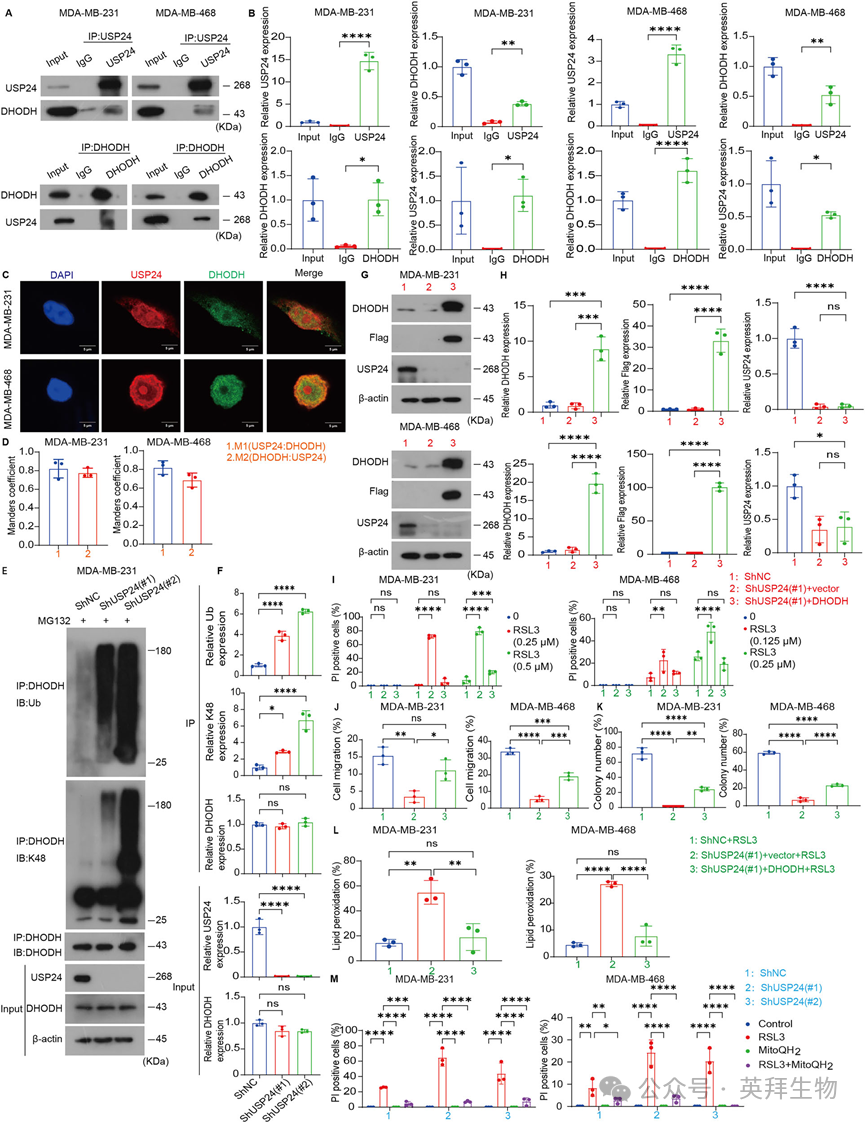
6)USP24在体内抑制RSL3诱导的TNBC细胞的肿瘤抑制
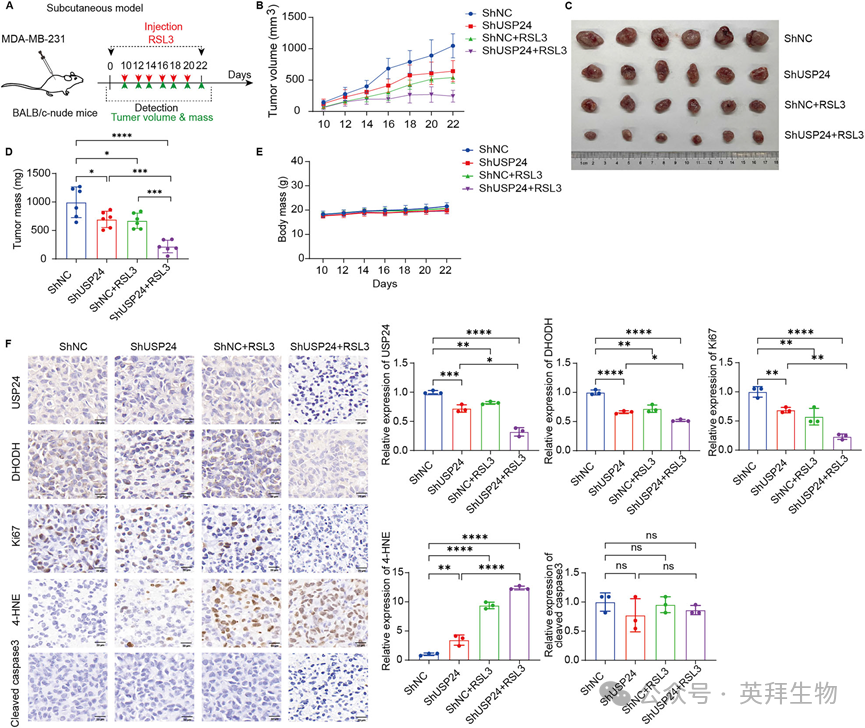
为探究USP24在体内的铁死亡作用,我们通过将USP24敲低及对照的MDA-MB-231细胞注射到BALB/c裸鼠体内,建立了一个皮下异种移植瘤模型(图6A)。待肿瘤形成后,我们用铁死亡诱导剂RSL3对小鼠进行治疗。结果显示,USP24敲低增强了RSL3诱导的肿瘤抑制作用,具体表现为肿瘤体积(图6B)、肿瘤大小(图6C)和肿瘤重量(图6D)的显著降低,而对小鼠的体重没有影响(图6E)。免疫组化分析显示,在USP24敲低的肿瘤中,DHODH和增殖标志物Ki67的水平显著降低,同时4-HNE的水平升高,但cleaved caspase-3的水平未发生改变(图6F)。同样地,使用USP24抑制剂WP1130进行药理学干预,也显著促进了RSL3在TNBC细胞中介导的肿瘤抑制作用和脂质过氧化(图7A-F)。WP1130与RSL3联用显示出更强的抗肿瘤效果,且对小鼠体重没有不良影响。这些研究结果证实,USP24通过稳定DHODH来抑制RSL3诱导的体内肿瘤抑制作用,从而支持TNBC肿瘤的存活。
结论:
我们证实,USP24通过其去泛素化作用稳定DHODH,从而成为三阴性乳腺癌中铁死亡的关键调控因子。我们的研究为泛素化与铁死亡之间的相互作用提供了新的见解,并表明USP24有望成为一个极具前景的治疗靶点。
参考文献:
Yang L, An X, Yang S, Lin X, Chen Z, Xue Q, Chen X, Wang Y, Yan D, Chen S, Fan Y, Tang D, Yu W, Liu J, Chen X. The deubiquitinase USP24 suppresses ferroptosis in triple-negative breast cancer by stabilizing DHODH protein. Cell Death Dis. 2025 Jul 26;16(1):564. doi: 10.1038/s41419-025-07895-4.






