再来一波外泌体高分轰炸
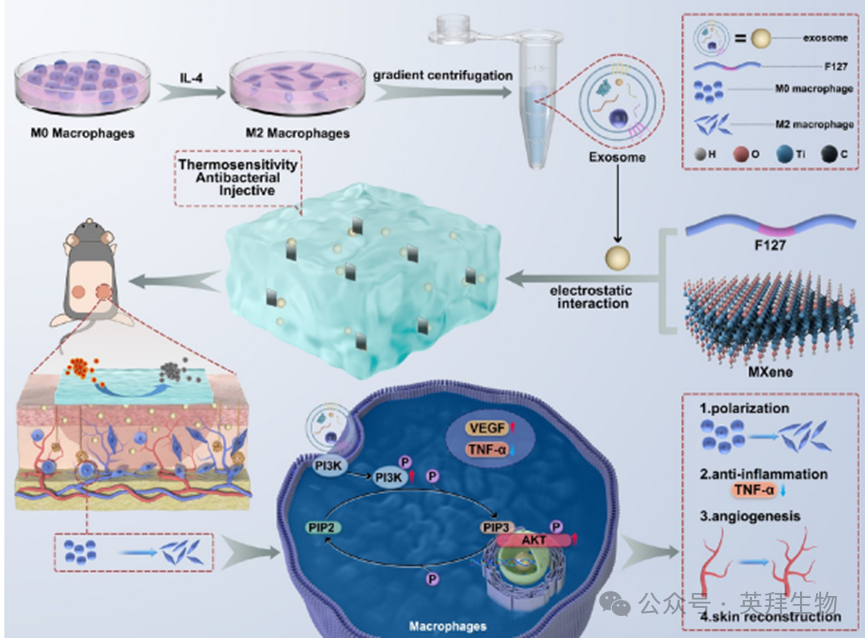
糖尿病创面修复仍具挑战性,主要源于高糖环境引发的免疫抑制效应——这种抑制常导致过度炎症反应、血管生成受损及感染易感性增加。然而,如何利用先进生物材料减轻免疫抑制并调控高糖微环境下巨噬细胞向M2表型转化的策略尚未完全阐明。本研究报道了二维碳化物(MXene)-M2巨噬细胞外泌体(Exo)纳米杂化材料(FM-Exo),通过克服高糖诱导的免疫抑制来促进糖尿病创面修复。FM-Exo可实现M2巨噬细胞外泌体(M2-Exo)长达7天的缓释,并展现广谱抗菌活性。在高糖微环境中,相较于单一外泌体,FM-Exo能通过激活PI3K/Akt信号通路显著优化巨噬细胞M2a/M2c极化比例,促进成纤维细胞增殖迁移,增强内皮细胞血管生成能力。在糖尿病全层皮肤缺损模型中,FM-Exo有效调控巨噬细胞极化状态,促进其向M2表型转化,从而抑制炎症反应、通过VEGF分泌促进血管新生,并改善胶原有序沉积。最终加速愈合进程,实现瘢痕减少的优质修复效果。本研究为应对糖尿病创面提供了新思路,即通过开发生物活性纳米材料来调控高糖环境下的免疫抑制。本文于2024年1月发表在《ACS Nano》IF:15.8 期刊上。
技术路线
主要实验结果:
1、表征F127-MXene水凝胶的物理化学特性
SEM图形显示F127-MXene水凝胶呈现疏松多孔的结构(图1A),孔径大小约为20-90μm。EDS 能谱图(图 1C)显示,钛的特征峰被氧的特征峰所覆盖。由于水凝胶中 MXene 含量低以及 MXene 中氟元素含量低,在图 1C 中未观察到氟的特征峰。此外,对 FM 进行的元素分布图(图 1B)显示,C、O、Ti 元素以及少量的 F 元素在样品中分布均匀,表明 MXene 在 F127 水凝胶中分布均匀。F127 的傅里叶变换红外光谱(图 1D)在 2872.6 cm−1 处显示出 C−H 伸缩振动带,在 1093.8 cm−1 处显示出 C−O−C 伸缩振动,并且FM波谱在掺杂MXene之后没有改变,表明MXene引入F127不会破坏它的结构。图 1E 展示了随着温度升高,G' 和 G" 的变化情况(0 - 40°C)。在温度低于 20.26°C 时,G" 大于 G',这表明 F127-MXene 处于溶胶状态。随着温度继续上升,G' 的增加幅度大于 G'',这表明 FM 水凝胶转变为凝胶状态,并保持了出色的机械性能。不同温度下样品的状态(图 1F)与图 1E 中 G' 和 G" 的变化趋势一致。图 1G 显示了 FM 水凝胶的剪切稀化特性,这是其可注射性的根本原因。随着剪切速率的增加,水凝胶的粘度从 267.42 倍秒迅速下降至 5.30 倍秒。此外,FM 水凝胶能够从注射器中顺利挤出,形成“花朵”形状(图 1H),这直观地表明了其出色的可注射性。当低动态应变(1%)变为高动态应变(1000%)时,FM水凝胶的G′和G″显著降低(图1I)。在第一步应变循环之后,G'显著降低,这是因为第一次压缩过程破坏了水凝胶中不稳定的非共价键,这进而可能导致水凝胶的结构分解或重组,从而影响其稳定性和性能。经过更多的步进拉伸循环后,G' 的变化幅度减小,并显示出结构稳定性,这表明其具有良好的自修复性能。
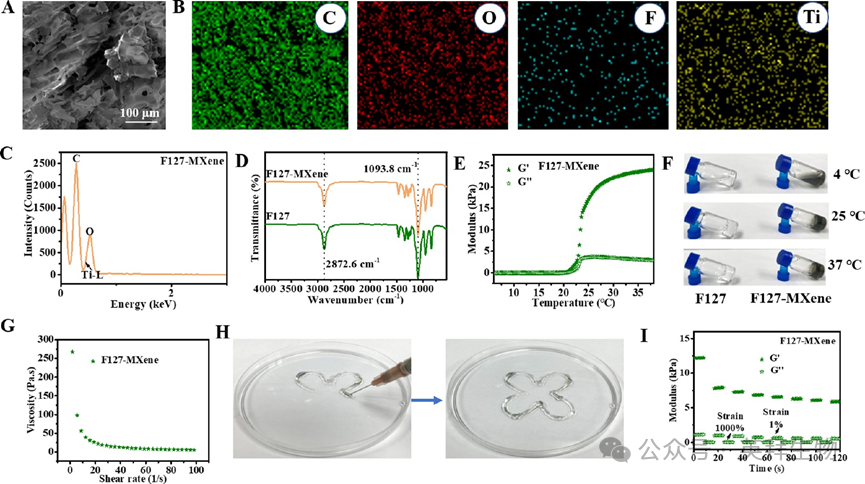
图1 F127-MXene水凝胶的物理化学特性
2、FM-Exo水凝胶刺激RAW264.7巨噬细胞的M2极化
在高糖培养基中共孵育FM-Exo和巨噬细胞,然后检测巨噬细胞的极化表型。结果显示,与对照组比较,FM-Exo组巨噬细胞表型出明显的形态改变(图2A),形态边长,伪足延伸,并且高表达CD206(图2B-C),此外还高表达M2巨噬细胞极化相关标志物ARG1,YM1,IL-10(图2D)。
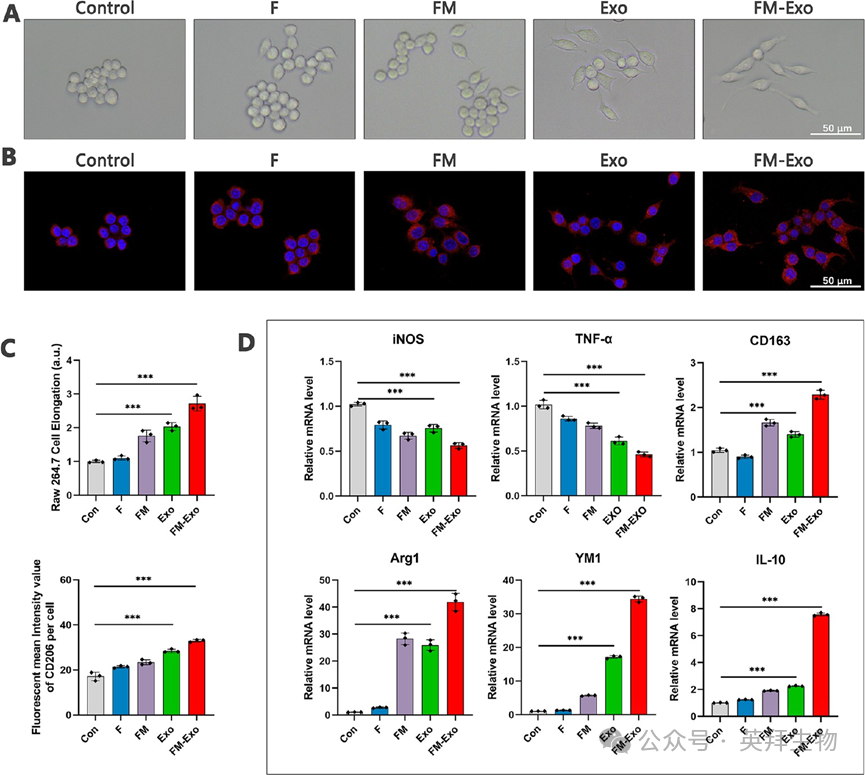
图2 FM-Exo水凝胶刺激RAW264.7巨噬细胞的M2极化
接下来探究FM-Exo水凝胶诱导巨噬细胞M2极化的分子机制,检测了PI3K-AKT通路的激活。结果发现,与对照组比较,FM-Exo组该通路磷酸化表达显著增强,VEGF表达增强,TNF-a表达减弱(图3),表明FM-Exo通过PI3K-AKT通路激活促进M2极化。
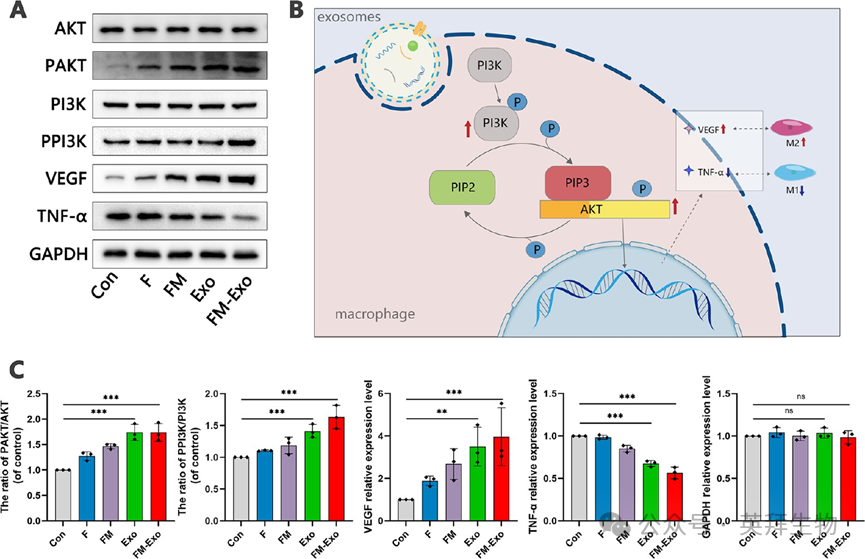
FM-Exo水凝胶增加高唐环境下PI3K/AKT的磷酸化激活
3、FM-Exo促进HUVECs的细胞迁移,管形成和伤口愈合
接下来探究FM-Exo水凝胶的条件培养基(CM)对高糖环境下HUVECs的保护作用。如图4所示,与对照组比较,FM-Exo显著促进高糖环境下HUVECs迁移、管形成、伤口愈合。
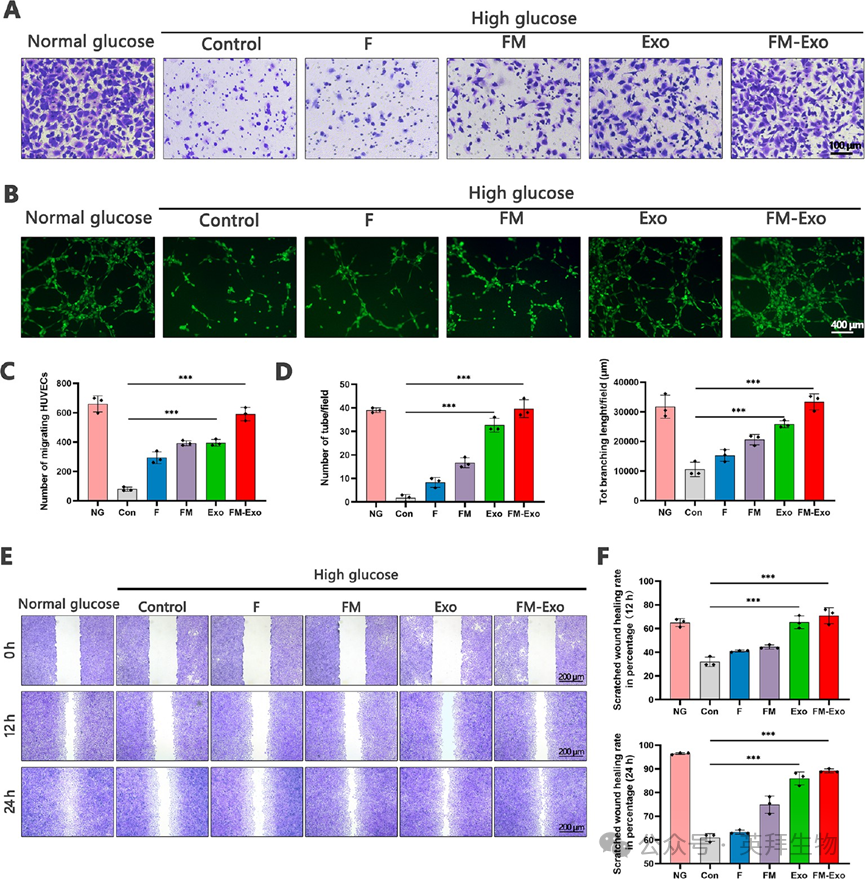
图4 FM-Exo对HUVECs的细胞迁移,管形成和伤口愈合的影响。
4、FM-Exo改善糖尿病伤口的伤口愈合
基于体外实验的结果,接下来在体内探究FM-Exo水凝胶对糖尿病全层创面的影响。如图5A所示,建立全层糖尿病皮肤创面模型,并使用分组处理伤口。如图5和图6所示,与对照组比较,FM-Exo水凝胶处理组的伤口愈合速度最快,在第21天时,几乎已经完全愈合,且显著促进胶原蛋白的沉积和伤口恢复。
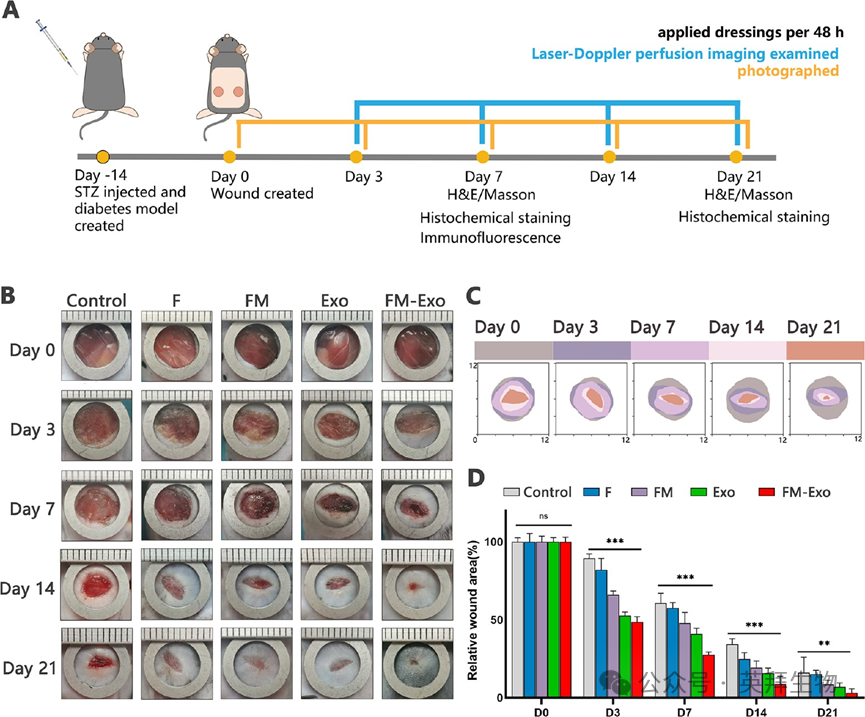
图5 FM-Exo改善糖尿病伤口的伤口愈合
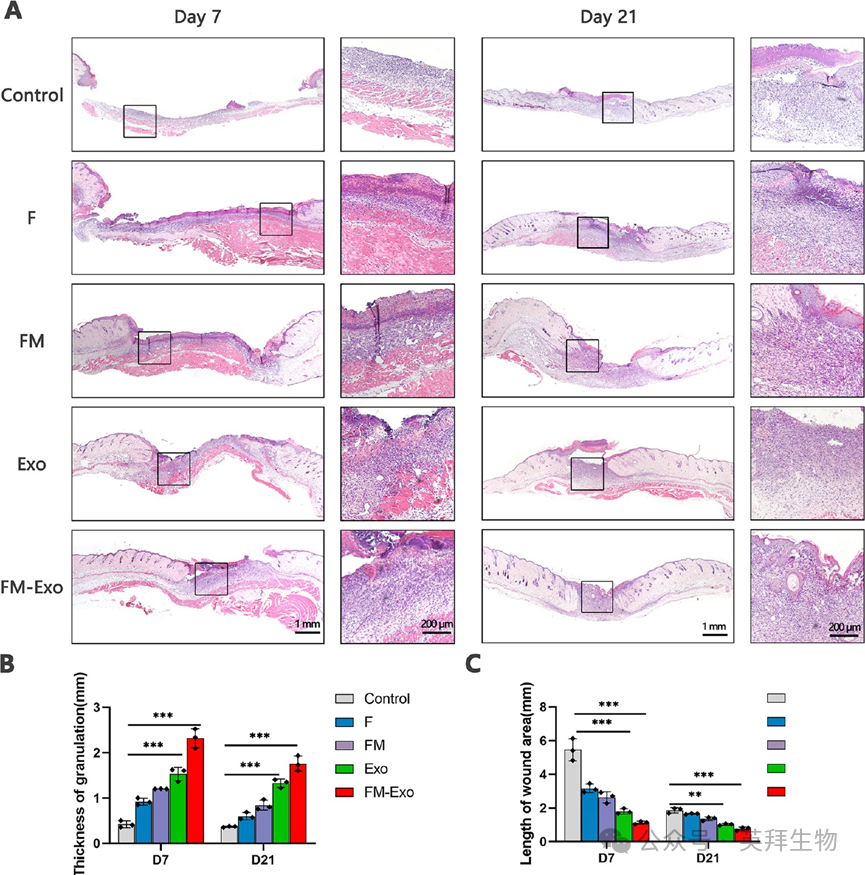
图6 FM-Exo促进伤口愈合和颗粒形成
接下来对伤口组织进行免疫荧光评估巨噬细胞浸润情况,结果显示,与对照组比较,FM-Exo处理组的TNF-a的表达显著下降,F4/80标记的ARG1阳性M2巨噬细胞的比例显著增多,iNOS阳性的M1巨噬细胞则显著减少(图7)。这些结果支持FM-Exo通过诱导巨噬细胞M2极化改善伤口愈合。
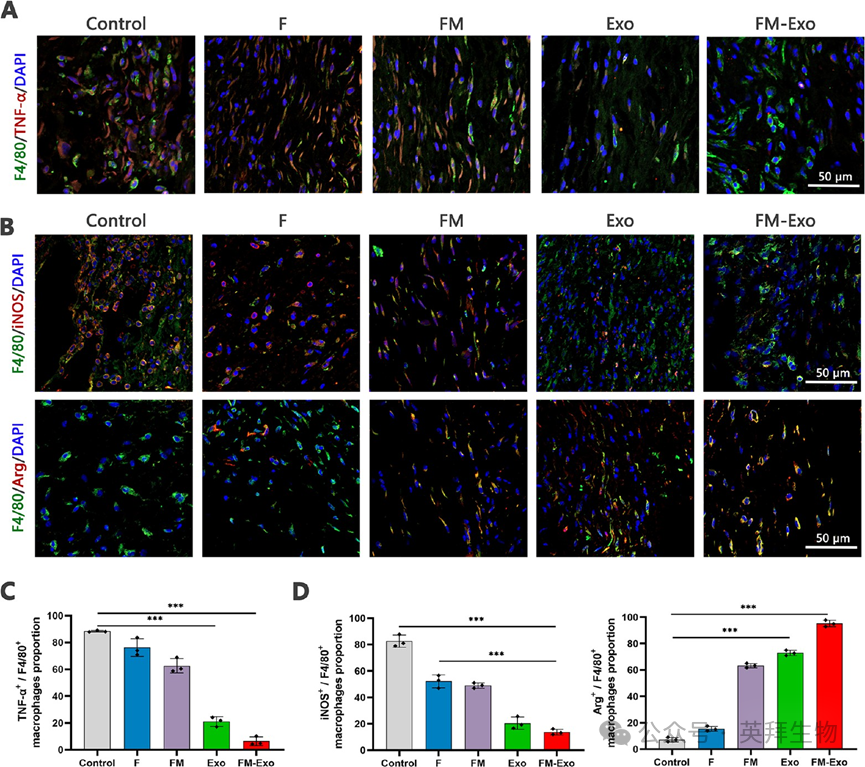
图7 FM-Exo减轻炎症通过诱导M2巨噬细胞形成
接下来评估FM-Exo对背部创伤的血流量和新生血管网络的影响,结果显示,与对照组比较,各时期的FM-Exo组的伤口处血流量和新生血管数量均显著高于对照组(图8A和8C)。随后用α-SMA免疫荧光表征新生血管网络,使用VEGF表征新生血管形成,使用COL蛋白的免疫组化表征胶原蛋白合成。结果显示,相比于对照组,FM-Exo组α-SMA和VEGF的表达均显著增加,胶原蛋白collagen I/III的表达也显著增多(图8和图9)。表明FM-Exo可促进伤口处的新生血管形成和胶原沉积。
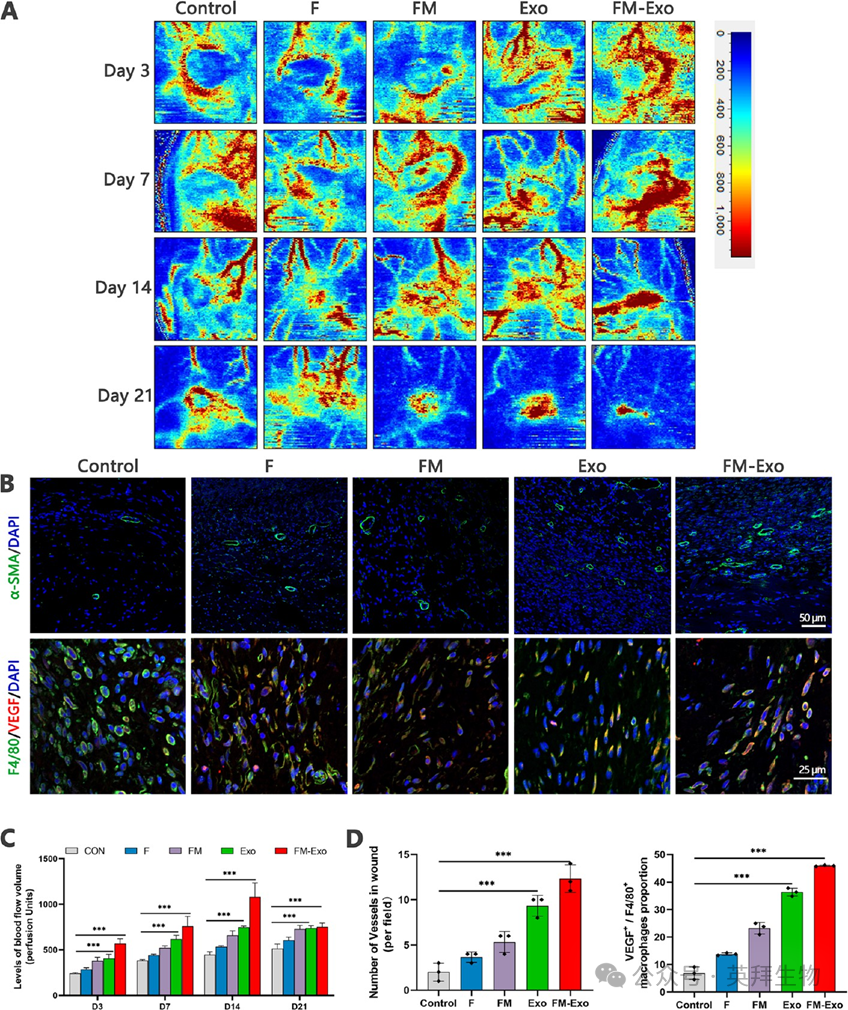
图8 FM-Exo水凝胶促进糖尿病伤口的功能性血管形成
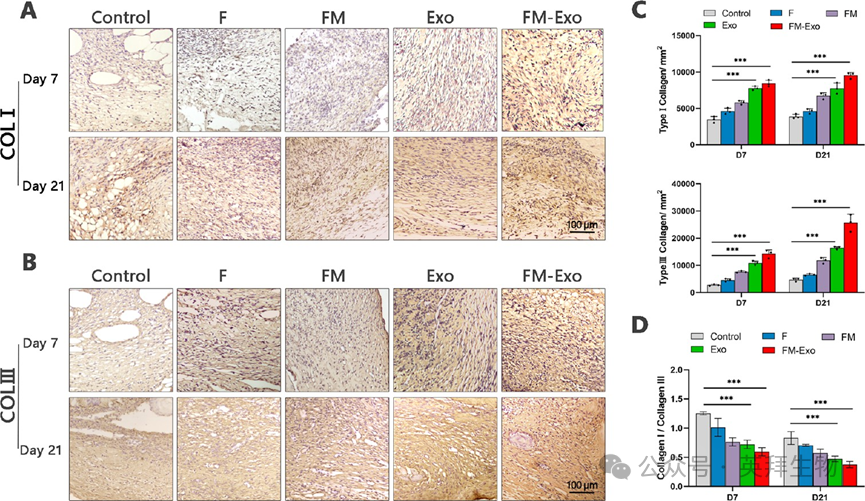
图9 FM-Exo水凝胶促进糖尿病伤口的胶原蛋白沉积
参考文献:
Jiang X, Ma J, Xue K, Chen J, Zhang Y, Zhang G, Wang K, Yao Z, Hu Q, Lin C, Lei B, Mao C. Highly Bioactive MXene-M2-Exosome Nanocomposites Promote Angiogenic Diabetic Wound Repair through Reconstructing High Glucose-Derived Immune Inhibition. ACS Nano. 2024 Feb 6;18(5):4269-4286. doi: 10.1021/acsnano.3c09721. Epub 2024 Jan 25. PMID: 38270104.






