失巢凋亡相关特征的风险模型表明RAC3是肝细胞癌中一种新的肿瘤启动子基因
肝细胞癌(HCC)细胞中的失巢凋亡抵抗可提高存活率和转移率。本研究旨在建立一个基于失巢凋亡相关基因(ARGs)的模型来预测HCC患者的预后,并探讨关键ARGs的临床病理意义和功能。HCC队列的转录表达模式由TCGA、GEO和ICGC汇编而成。进行单变量和LASSO多变量分析以筛查预后ARG。采用功能获得和丧失研究、RNA测序和质谱来阐明ARG在HCC中的潜在机制。我们建立了HCC预后的五基因ARGs风险模型,1年生存期的AUC值为0.812。在这五个基因中,Rac家族小GTP酶3(RAC3)在HCC中相对于邻近的正常组织上调,与HCC患者的总体生存率和无病生存率呈负相关。RAC3在HCC细胞中的沉默导致细胞凋亡增加,细胞增殖和侵袭减少。从机制上讲,我们发现RAC3与SOX6的结合通过NNMT介导的cAMP/MAPK/Rap1信号的刺激促进HCC细胞的进展。特别是,靶向RAC3的小分子抑制剂EHop-016显著抑制HCC的进展。该研究于2025年3月发表在《MedComm》,IF 10.7分。
技术路线:

主要研究结果:
1、具有临床意义的ARGs筛查
研究分析了从TCGA_LIHC数据集中获取的480个抗凋亡相关基因(ARGs)的mRNA表达谱,并在癌症基因数据库(GeneCards)中识别出118个在肝细胞癌(HCC)组织与相邻正常组织之间表达差异显著的基因。其中,113个基因在肿瘤组织中表达上调,5个基因表达下调(图1A),热图显示了代表性差异表达基因(DEGs)(图1B)。通过将HCC数据集GSE14520与118个DEGs进行交集分析,发现105个基因在两个数据集中均有出现(图1C),这些基因被选为构建风险模型的基础。为了探究这105个基因的临床意义,首先,我们将TCGA_LIHC中的370例HCC病例随机分为两组:包含222例的训练队列和包含148例的测试队列,两组的临床特征保持平衡(表S1);随后,我们对训练队列应用单变量Cox回归分析以确定预后ARGs,发现105个ARGs中有58个与总生存(OS)显著相关(图1D)。
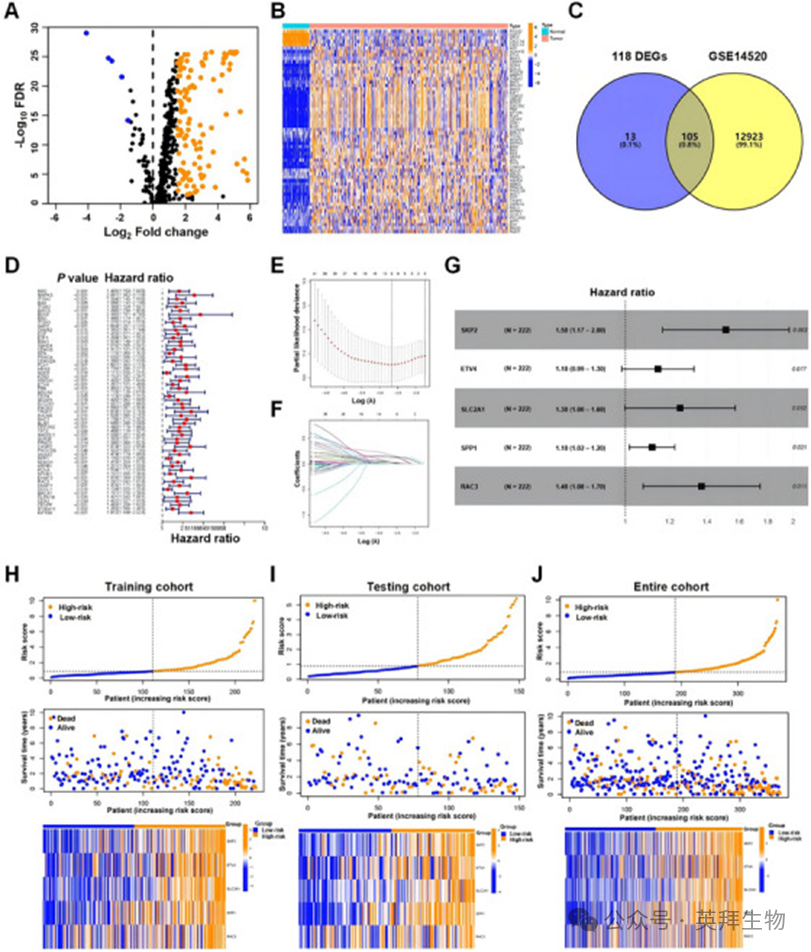
图1:为HCC患者构建ARG特征
2、基于ARGs的HCC患者无监督聚类
我们利用58个ARGs对HCC患者进行亚型分类。通过逐步增加聚类变量(k)的值,从2到9,观察发现当k=2时,组内相似性(组内相关性)最高,组间相似性(组间相关性)最低。这一最佳点表明,基于58个ARGs的表达谱,370例HCC患者可以被有效划分为两个不同的聚类群(C1和C2)(图S1A)。C1聚类群中ARGs表达较低的患者比C2聚类群中ARGs表达较高的患者具有更长的总生存期(OS)(图S1B)(p < 0.001)。热图展示了C1和C2聚类群中58个ARGs的转录表达谱(图S1C)。进一步分析了C1和C2聚类群之间的差异表达基因(DEGs),共鉴定出2430个DEGs(图S1D)。这些DEGs主要涉及细胞因子-细胞因子受体相互作用、细胞周期和细胞外基质-受体相互作用等通路(图S1E)。基因集富集分析(GSEA)显示,细胞因子-细胞因子受体相互作用和细胞外基质受体相互作用等通路在C2聚类群中显著富集,而脂肪酸代谢通路主要富集在C1聚类群中(图S1F)。这些结果表明,基于ARGs的表达,不同亚型组的HCC患者在HCC进展过程中表现出不同的分子模式。
3、基于ARGs的风险模型的建立与验证
为探索HCC的ARGs特征,我们采用逐步方法,将58个ARGs纳入LASSO Cox回归和多变量Cox回归,以建立用于预测HCC患者生存结果的风险模型。通过交叉验证,最终从58个与OS强相关的ARGs中筛选出5个基因(S期激酶相关蛋白2 [SKP2]、ETS变体转录因子4 [ETV4]、溶质载体家族2成员1 [SLC2A1]、分泌型磷酸蛋白1 [SPP1]和RAC3),用于构建风险模型,风险模型的构建方式如下:风险评分 =(0.415×SKP2表达量)+(0.134×ETV4表达量)+(0.226×SLC2A1表达量)+(0.110×SPP1表达量)+(0.314×RAC3表达量)(图1G)。在TCGA_LIHC训练队列中,计算得出的中位风险评分为0.911;评分低于此阈值的患者被划分为低风险组,而评分达到或超过0.911的患者被归为高风险组。高风险队列中这五个ARGs的表达水平更高,且随着风险评分的升高,总生存(OS)呈下降趋势(图1H)。当将该风险模型应用于测试队列和整个队列(TCGA_LIHC 370例)时,结果与训练队列一致,从而验证其可靠性(图1I、J)。
高风险组的个体在所有三个队列中均显示出显著较差的总生存(OS),与低风险组的个体相比(图2A)。在训练队列中进行的接收者操作特征(ROC)分析显示,该风险模型具有强大的预测能力,其曲线下面积(AUC)值分别为0.812、0.733和0.705,用于预测1年、3年和5年的生存率。相应地,在测试队列中,AUC值分别为0.754、0.607和0.602,用于相同的生存期,而在整个队列中,AUC值分别为0.782、0.692和0.671(图2B)。为进一步验证模型的诊断预测准确性,我们使用外部数据集ICGC_LIRI和GSE14520进行额外验证,结果与初始训练队列一致(图2C、D)。
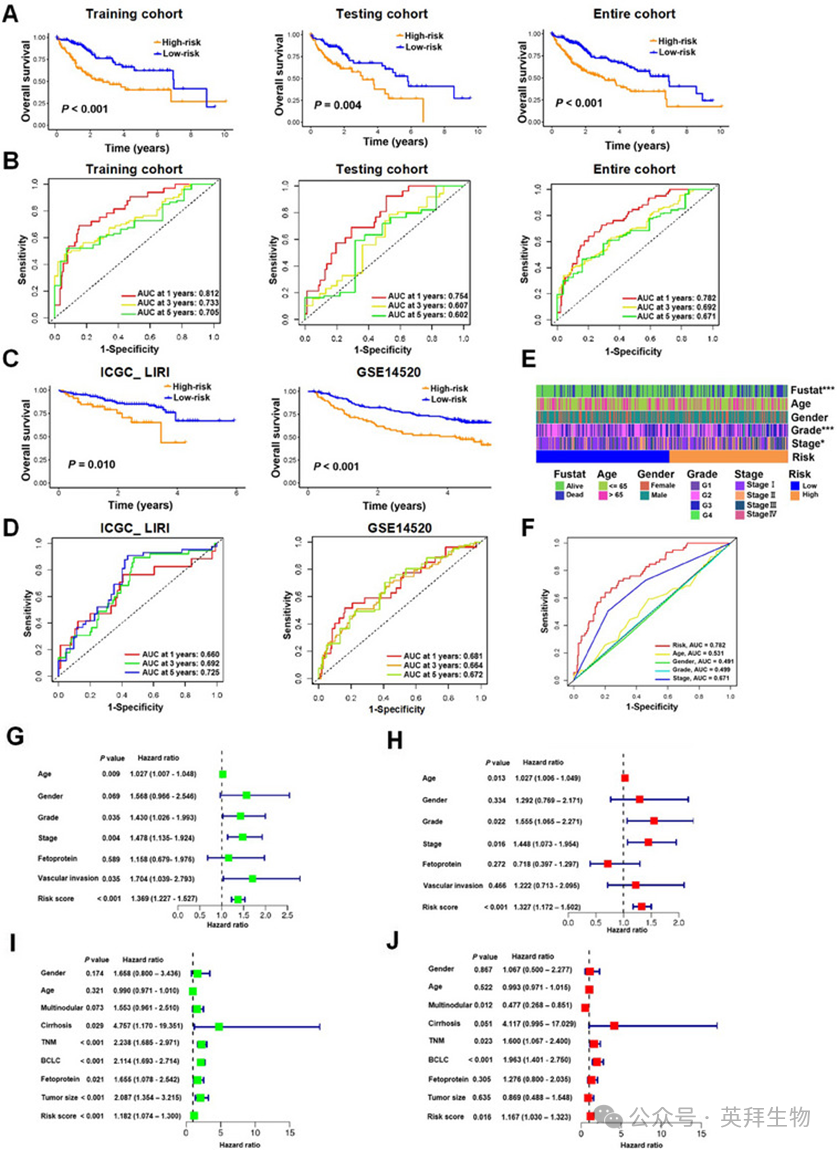
图2:ARG特征预测HCC诊断和预后
4、ARGs信号作为HCC患者预后的独立预测因子
我们接下来研究ARGs特征与HCC患者的临床特征之间的相关性。研究发现,在高风险组和低风险组之间,肿瘤分期、肿瘤分级和生存情况存在显著差异(图2E)。此外,ROC分析证实,风险模型显示出优越的预测能力,其AUC值为0.782,优于其他临床特征,包括年龄、性别、分级和分期,在TCGA_LIHC队列中(图2F)。
为确定ARGs特征的风险评分是否可以作为HCC患者的独立预后生物标志物,我们对HCC队列进行单变量和多变量Cox回归分析,考虑风险评分和其他临床特征等变量。对于TCGA_LIHC队列,单变量分析表明,年龄、肿瘤分级、肿瘤分期、血管侵犯或风险评分与总生存(OS)相关(图2G),而多变量分析证实,年龄、肿瘤分级、肿瘤分期或风险评分可以独立预测HCC患者的预后(图2H)。对于GSE14520队列,单变量和多变量分析均显示TNM分期、巴塞罗那临床肝癌(BCLC)分期或风险评分与OS显著相关(图2I、J)。这些结果共同表明,从ARG特征得出的风险评分有潜力作为HCC患者的独立预后因素。
5、免疫细胞浸润和化疗敏感性列线图构建与评价
为提高风险模型在临床实践中的应用价值,我们在TCGA_LIHC基础上构建一个预测诺莫图,用于估计1年、3年和5年的总生存期,该诺莫图基于临床特征,包括性别、肿瘤分级、年龄、肿瘤分期和ARGs特征的风险评分(图S2A)。ROC分析显示诺莫图具有良好的准确性,AUC值分别为0.752、0.731和0.742(图S2B),校准曲线也证实诺莫图的高准确性(图S2C)。这些结果表明,诺莫图可以应用于辅助临床决策制定,并预测HCC患者的总生存期。
HCC患者生存率的差异可能归因于肿瘤免疫微环境的复杂性。我们分析了高风险组和低风险组之间免疫细胞浸润和免疫相关通路的差异,发现在TCGA_LIHC队列中,特别是被归为高风险的个体中,树突状细胞、巨噬细胞、Th2细胞和调节性T细胞显著增加(p < 0.05)(图S2D),而B细胞、肥大细胞和NK细胞等免疫细胞亚群则显著下调(p < 0.05)(图S2D)。在免疫相关通路方面,高风险组中检查点和主要组织相容性复合体I类分子的表达显著增加(p < 0.05),而I型和II型干扰素反应则显著降低(p < 0.05)(图S2E)。进一步研究高风险组和低风险组之间免疫亚型的差异发现,淋巴细胞耗竭样本的分布在两组之间相对平衡。然而,低风险组中炎症样本的频率更高,与之相比,高风险组中以愈合伤口和干扰素-γ主导的样本更为常见(图S2F)。
此外,在两组之间对化疗药物的反应也存在显著差异。高风险组对多西他赛和吉非替尼的IC50值显著更高,表明对这些药物的耐药性更强。相反,高风险组对吉西他滨和伊马替尼的IC50值较低,意味着对这些药物更敏感(图S2G)。总之,从ARGs特征得出的风险评分能够预测HCC患者的生存率以及对化疗药物的反应。
6、RAC3上调与HCC患者的肿瘤进展和预后不良有关
随后,我们发现风险模型中五个ARGs的mRNA和蛋白水平在HCC组织中显著高于相邻正常组织(图S3A、B)。此外,这五个ARGs表达的增加与总生存(OS)的降低显著相关(图S3C)。然而,只有RAC3与无病生存(DFS)的降低在统计学上显著相关(p=0.026)(图S3D)。因此,我们接下来专注于RAC3在HCC发生和发展中的作用及其机制。
RAC家族包括RAC1、RAC2和RAC3,其中RAC3在HCC中与相邻正常组织相比显著上调(p < 0.001,3.3倍)(图S4A)。此外,在TCGA泛癌分析中,如膀胱癌(BLCA)、乳腺癌(BRCA)、宫颈鳞状细胞癌(CESC)、结肠癌(COAD)、食管癌(ESCA)、头颈鳞状细胞癌(HNSC)、肝细胞癌(LIHC)、肺腺癌(LUAD)、肺鳞癌(LUSC)、肾上腺皮质癌(PCPG)、前列腺癌(PRAD)、胃癌(STAD)和子宫内膜癌(UCEC)等肿瘤组织中也观察到RAC3的显著上调(图S4B)。相比之下,RAC3在肾透明细胞癌(KICH)、肾癌(KIRC)、肾乳头状细胞癌(KIRP)和甲状腺癌(THCA)的肿瘤组织中表达显著降低(图S4B)。此外,与低RAC3表达相比,高RAC3表达与膀胱癌、KIRC、肉瘤和甲状腺癌患者的预后不良相关,但在乳腺癌和胰腺导管腺癌(PDAC)患者中则与更长的生存期相关(图S4C)。
我们基于GSE14520、GSE22058和ICGC_LIRI数据集对RAC3表达进行分析,结果证实RAC3 mRNA在HCC组织中显著高于相邻正常组织(图3A)。此外,通过UALCAN对CPTAC数据库的分析显示,与相邻正常组织相比,HCC组织中RAC3蛋白显著上调(图3B)。Kaplan–Meier绘图分析显示,RAC3高表达与HCC患者的预后不良相关,尤其是在II期和AJCC_T2期患者中(表S2,图S5)。这些结果强烈表明,RAC3可以作为HCC患者的有希望的预后生物标志物。
随后,我们通过qRT-PCR和西方印迹分析评估五种HCC细胞系中RAC3的表达水平(图3C、D)。研究发现,RAC3在HCCLM3和HLE细胞中表达显著,而在MHCC97H和Huh-7细胞中表达较低。此外,我们还对包含89对HCC肿瘤及其相邻正常组织的HCC组织微阵列进行了免疫组化染色,以检测RAC3的表达。同样,我们观察到RAC3在HCC组织中的表达显著高于匹配的正常组织(图3E、F)。RAC3蛋白表达与临床病理参数之间的相关性分析显示,高RAC3表达与大于3厘米的肿瘤(p=0.049)、肿瘤复发(p=0.034)和总生存期(OS)(p=0.001)之间存在显著关联(表1)。单变量分析进一步表明,肿瘤大小(p=0.016)、肿瘤分级(p=0.027)、肿瘤包膜完整性(p=0.045)、TNM分期(p=0.006)和RAC3表达(p=0.005)与OS显著相关(表S3)。我们进一步进行多变量Cox回归分析,纳入单变量分析中有显著意义的变量,结果证实RAC3蛋白表达是OS的独立预测因子(p=0.044)(表S4)。Kaplan–Meier生存曲线显示,RAC3蛋白表达越高,预后越差(p=0.002)(图3G),累积无复发生存率越高(p=0.044)(图3H)。总之,这些结果表明,RAC3表达的升高在HCC的恶性程度和进展中起着关键作用。
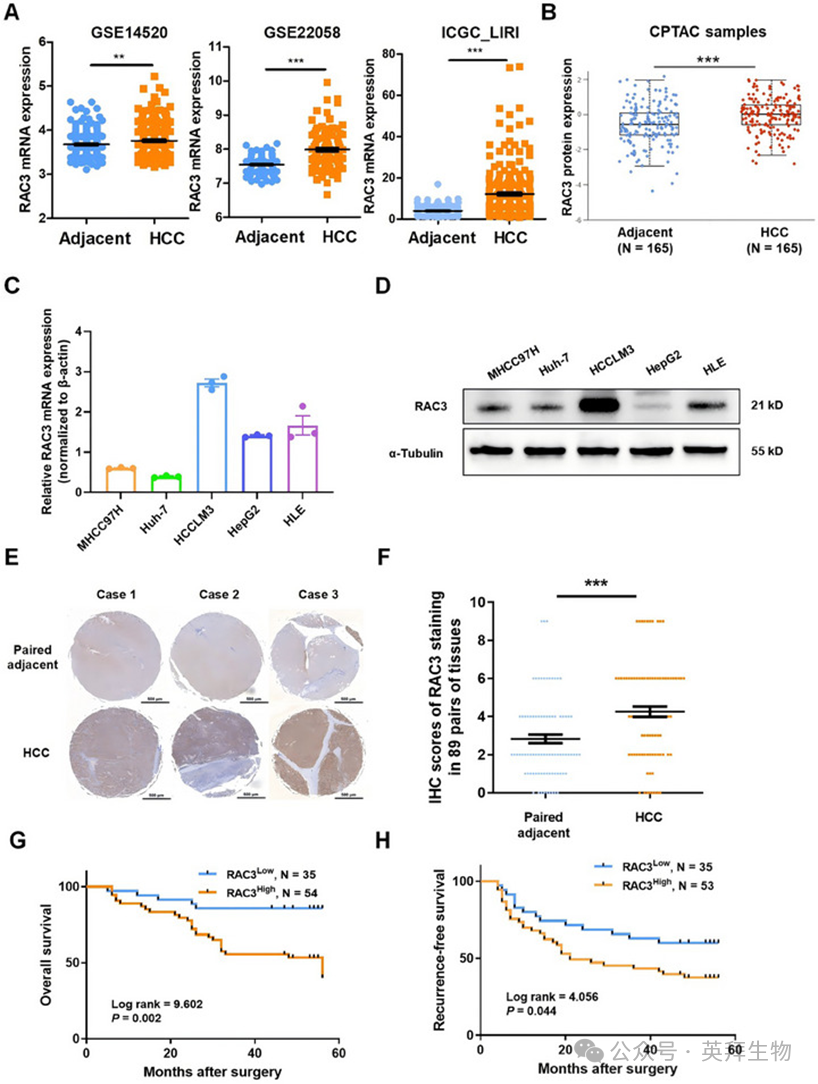
图3:RAC3在HCC组织中的表达和预后意义
7、RAC3促进HCC细胞的恶性表型
基于TCGA_LIHC的GSEA富集分析显示,RAC3表达与凋亡(ES=0.54,p=0.00)、细胞外基质受体相互作用(ES=0.68,p=0.00)和细胞黏附分子CAMs(ES=0.62,p=0.00)呈正相关(图S6A),表明其在抗凋亡抵抗中的潜在功能。此外,为评估RAC3在HCC中的作用,我们在Huh-7细胞系中建立了稳定的RAC3过表达,并在HCCLM3和HLE细胞系中进行RAC3敲低。RAC3的敲低显著抑制体外细胞增殖和侵袭,而RAC3的过表达则促进这些行为(图4A、B)。此外,我们在HCCLM3细胞系中建立稳定的RAC3敲低(图S6B),并发现RAC3的敲低抑制细胞增殖和侵袭(图S6C、D)。凋亡实验显示,RAC3抑制后凋亡率显著增加(图4C)。
然后,我们构建一个肿瘤转移模型,将稳定表达荧光素酶的MHCC97H或HCCLM3细胞(RAC3稳定过表达或沉默)通过尾静脉注射到NCG(NOD/ShiLtJGpt-Prkdcem26Cd52Il2rgem26Cd22/Gpt)小鼠中。我们发现,RAC3过表达使肺部的荧光素酶强度显著增加,而RAC3敲低则使其降低(图4D)。裸鼠皮下接种稳定过表达RAC3的Huh-7细胞和稳定敲低RAC3的HCCLM3细胞。如图4E所示,RAC3过表达显著增加第21天的肿瘤质量。相反,RAC3敲低显著降低第14天的皮下肿瘤形成。免疫组化分析证实,在RAC3过表达的肿瘤组织中检测到高表达的Ki-67,而在RAC3敲低组中则相反(图S7A、B)。
此外,qRT-PCR分析显示,RAC3的敲低导致抗凋亡标志物(包括Bcl-2、SNAI1、NFKB1和TWIST1)的表达降低,而在RAC3过表达的Huh-7细胞中则相反(图4F)。最后,西方印迹分析显示,RAC3的敲低导致增殖标志物PCNA、抗凋亡标志物Bcl-2的表达降低,以及caspase介导的凋亡增加,而在RAC3过表达的Huh-7细胞中则相反(图4G)。总之,RAC3在启动和促进HCC中起着关键作用。
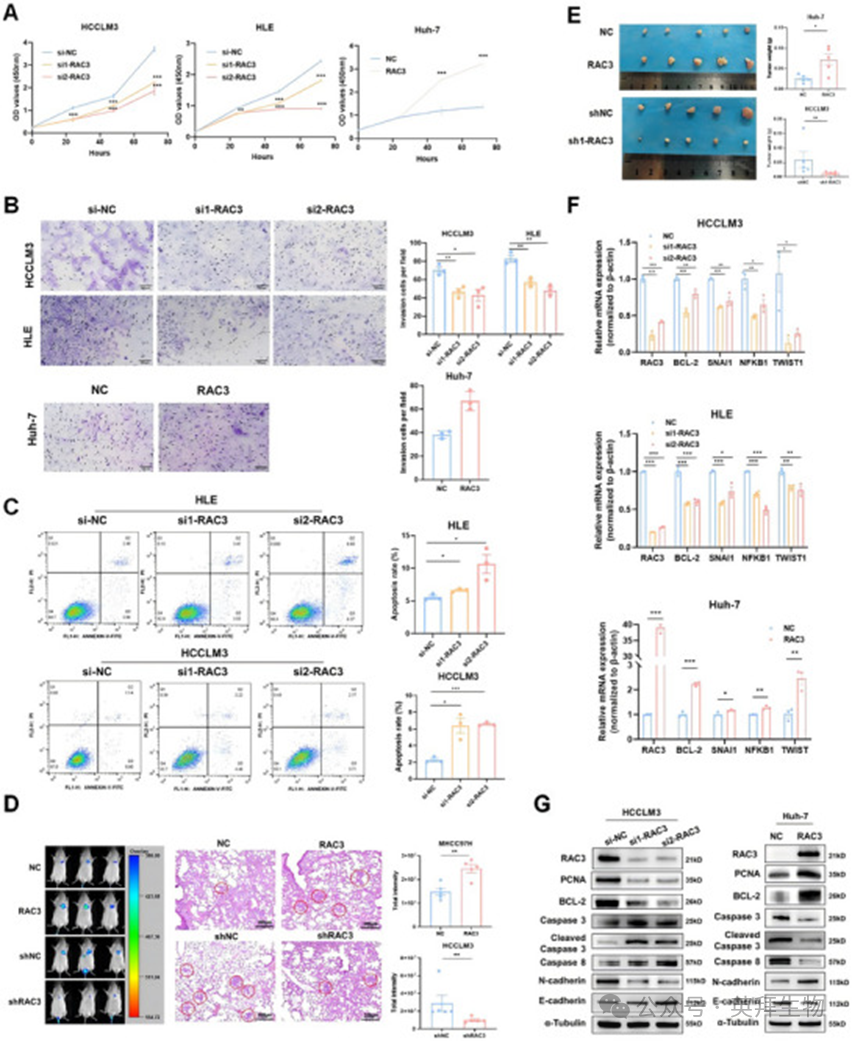
图4:RAC3促进HCC细胞的恶性表型
8、RAC3通过上调NNMT激活cAMP/MAPK/Rap1信号传导
为探索RAC3促进HCC进展的机制,我们进行RNA测序结合蛋白质组学分析,以确定RAC3调控的基因。在RAC3过表达后,有236个基因和27个蛋白质下调,而226个基因和35个蛋白质上调(图5A、B)。代表性DEGs以热图形式展示(图5C、D)。基于RNA-seq数据的KEGG分析显示,Rap1信号通路(p=3.16e-2)、MAPK信号通路(p=3.14e-2)和细胞因子-细胞因子受体相互作用(p=5.71e-3)显著富集(图5E)。基于蛋白质组数据的KEGG分析显示,cAMP信号通路(p=1.70e-2)、趋化因子信号通路(p=3.92e-2)和MAPK信号通路(p=5.02e-2)显著富集(图5F)。此外,我们对RNA-seq数据中的462个DEGs和蛋白质组中的62个DEGs进行交集分析,发现三个基因(GBP1、NAT1和NNMT)共同被RAC3过表达上调(图5G)。随后,我们通过qRT-PCR对这三个基因进行验证。结果表明,NNMT在RAC3过表达下的上调最为显著,考虑到p值和倍数变化(图5H)。先前的研究表明,NNMT在HCC中表达上调,能够增强HCC细胞的侵袭和转移,并与预后不良相关。此外,NNMT还被报道能够增强结直肠癌对ROS诱导凋亡的抵抗。因此,我们假设NNMT可能作为RAC3介导的HCC进展的关键调节因子,通过cAMP/MAPK/Rap1信号通路发挥作用。
为验证这一假设,我们建立一个原位肝HCC模型,通过原位注射稳定过表达荧光素酶和RAC3的MHCC97H细胞,并敲除NNMT。我们发现,NNMT的敲除逆转了RAC3在促进HCC生长中的作用(图5I、J),并抑制RAC3过表达HCC组织中Ki67和Bcl-2的表达(图S8A、B)。此外,我们还进行凋亡实验,验证NNMT敲除在体外增加了RAC3过表达HCC细胞的凋亡(图5K)。此外,我们验证三种NNMT siRNAs的效率,并选择si1-NNMT进行NNMT拯救实验(图S8C)。我们发现,通过RAC3过表达在HCC细胞中上调的PRKACB(cAMP信号的关键分子)、p-ERK/ERK(MAPK信号的关键分子)和Rap1b(Rap1信号的关键分子)可以通过NNMT敲除被抑制(图5L)。此外,西方印迹分析还表明,抗凋亡和EMT标志物被RAC3过表达激活,这一作用可以被NNMT敲除所抵消(图5L)。总之,这些结果表明,RAC3可能作为肿瘤促进因子,通过NNMT激活cAMP/MAPK/Rap1信号通路,从而驱动肝癌的发生和HCC的恶性程度。
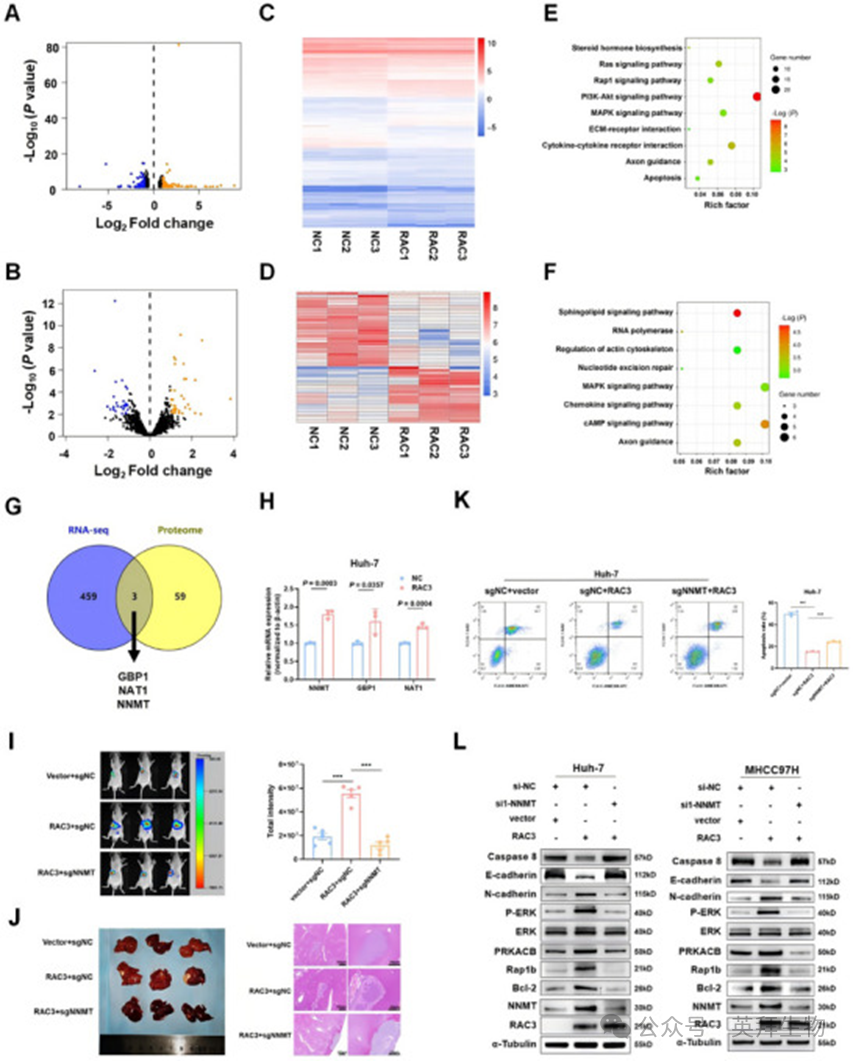
图5:RAC3通过上调NNMT激活cAMP/MAPK/Rap1信号传导
9、RAC3与SOX6转录激活NNMT相互作用
据报道,RAC3通过与转录因子相互作用间接激活靶基因的转录。因此,我们假设RAC3可能作为转录共激活因子,增强NNMT的转录活性,从而促进HCC的进展。因此,我们在过表达RAC3的Huh-7细胞中进行了共免疫沉淀(Co-IP)结合质谱分析,以筛选与RAC3相互作用的转录因子(表S5)。在与RAC3相互作用的蛋白质中,SOX6是仅有的被注释的转录因子,且通过Jaspar数据库进一步预测为NNMT结合的转录因子。然后,我们通过Co-IP在HCC细胞系中验证了RAC3与SOX6之间的相互作用(图6A)。由于Jaspar数据库中没有人SOX6的结合位点,我们预测了可能结合到小鼠NNMT启动子区域的小鼠SOX6的核心结合位点(图6B)。我们发现两个小鼠NNMT启动子的DNA序列与人类同源,可能结合到SOX6(图6C,图S9)。我们突变了这两个序列(命名为mut 1和mut 2),并设计两对引物(target 1和target 2),使用染色质免疫沉淀(ChIP)-qPCR检测这两个序列(图6D)。结果表明,SOX6可以直接结合到NNMT启动子(-345/-338 bp)(图6E)。此外,双荧光素酶报告基因实验表明,RAC3增强SOX6调节的NNMT转录,这一作用可以通过NNMT启动子mut1(-345/-338 bp)显著抑制(图6F)。总之,RAC3作为SOX6的转录共激活因子,促进NNMT转录。
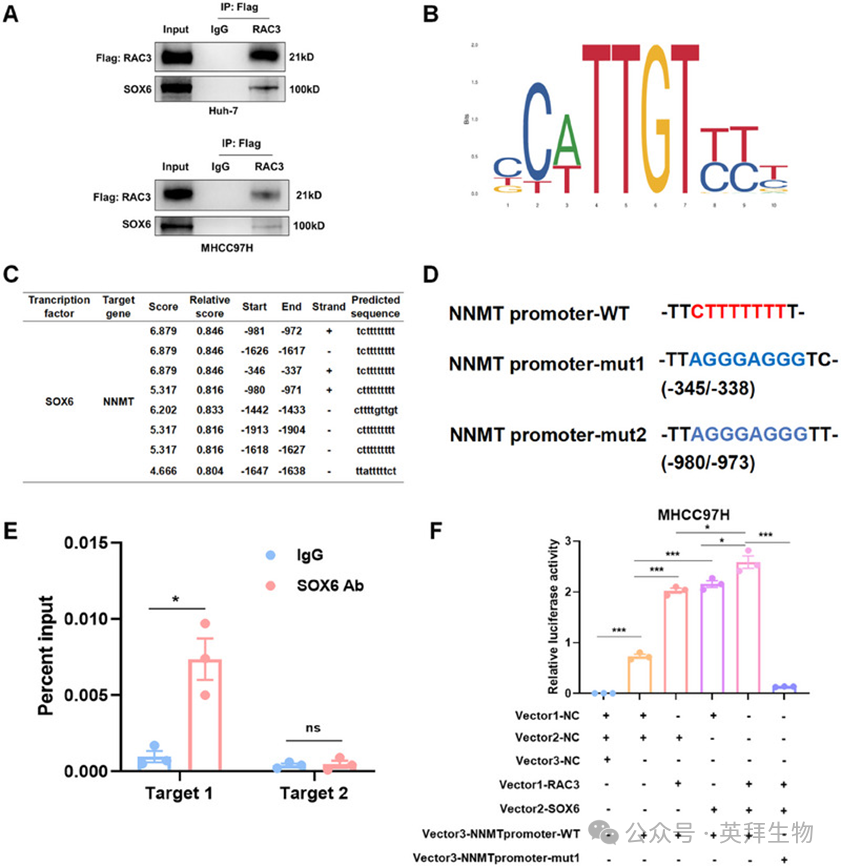
图6:RAC3与SOX6 相互作用以转录激活 NNMT
10、靶向RAC3的特异性抑制剂EHop-016抑制HCC进展
我们随后研究靶向RAC3的干预效果。据报道,小分子抑制剂EHop-016能够特异性靶向RAC3 GTPase。随后,我们用不同浓度的EHop-016处理MHCC97H细胞24小时,发现EHop-016以浓度依赖的方式抑制RAC3的酶活性和NNMT的表达(图7A)。此外,我们基于RAC3、SOX6和EHop-016的三维(3D)结构进行分子对接,并发现RAC3与SOX6之间的氢键力约为3埃,表明它们之间的结合很强(图7B)。此外,EHop-016结合到RAC3和SOX6的相互作用界面上,表明EHop-016可能通过抑制RAC3的活性来破坏它们的相互作用(图7C)。为进一步评估EHop-016在体内的药效学,我们建立一个原位HCC小鼠模型,通过腹腔注射EHop-016和生理盐水(NC)(图7D)。我们发现,经过EHop-016处理后,肝脏中荧光素酶的强度和荧光素酶阳性病变的数量显著减少(图7E-G)。总之,EHop-016被确定为一种有效的化合物,可用于靶向HCC治疗中的RAC3。
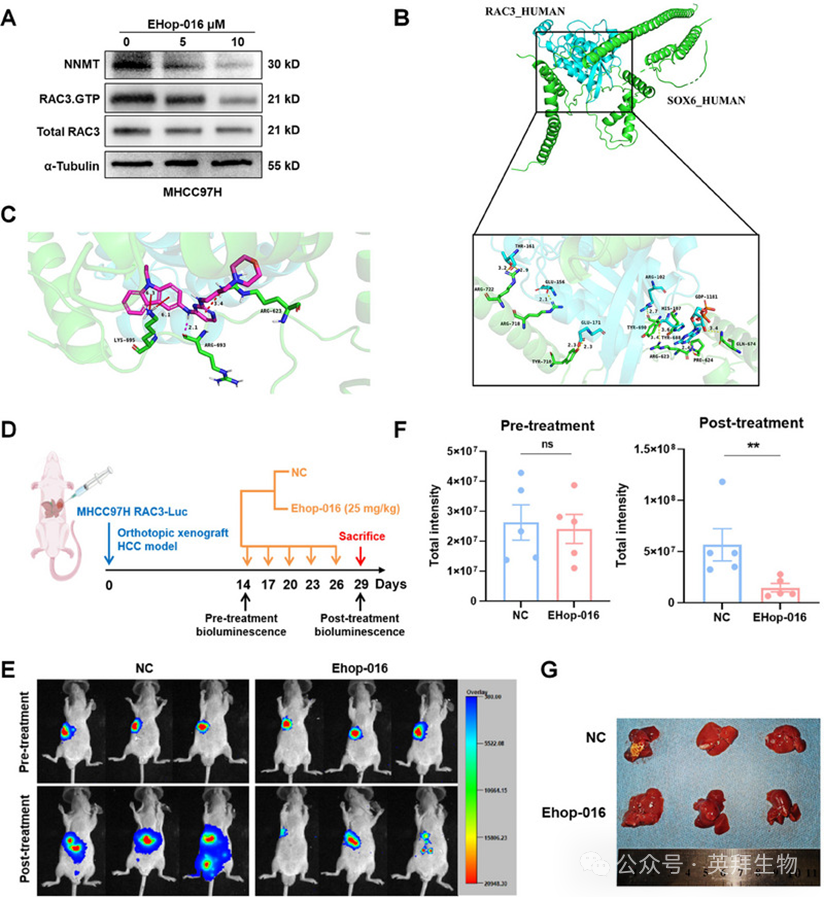
图7:靶向RAC3的EHop-016抑制HCC进展
结论:
总之,我们的研究构建了一个由五个ARGs组成的HCC患者预后风险模型。我们证明该模型具有高灵敏度和高特异性,为HCC患者的预后提供一个强有力的新工具。更重要的是,我们发现RAC3能够抑制凋亡并促进细胞增殖和侵袭,从而推动HCC的进展,这为HCC的分子机制提供新的见解。通过小分子化合物EHop-016靶向RAC3显示出对HCC治疗的潜在效果。然而,我们的研究仍存在一些局限性:首先,我们将进一步收集并扩大HCC患者队列,以验证风险模型的可靠性;其次,NNMT介导的RAC3激活通路的分子机制尚未完全明确。
参考文献:
Wu D, Liu ZK, Sun Y, Gou CH, Shang RZ, Lu M, Zhang RY, Wei HL, Li C, Shi Y, Zhang C, Wang YT, Wei D, Chen ZN, Bian H. Integrated Analysis of the Anoikis-Related Signature Identifies Rac Family Small GTPase 3 as a Novel Tumor-Promoter Gene in Hepatocellular Carcinoma. MedComm (2020). 2025 Mar 22;6(4):e70125. doi: 10.1002/mco2.70125. PMID: 40123831; PMCID: PMC11928873.






