抑制低氧外泌体miR-423-3p通过限制星形胶质细胞的自噬来减少胶质瘤的进展
胶质瘤的肿瘤微环境(TME)包括胶质瘤细胞和周围的细胞,如星形细胞、巨噬细胞、T细胞和神经元。在TME中,胶质瘤细胞可以通过分泌外泌体来激活正常人类星形细胞(NHAs),而星形细胞的激活可以进一步促进胶质瘤的进展,导致患者预后不良。然而,胶质瘤激活NHAs的分子机制在很大程度上仍然未知。在这项研究中,胶质瘤衍生的外泌体(GDEs)在调节自噬和激活NHAs中起着重要作用。与常氧GDEs相比,缺氧胶质瘤衍生的外泌体(H-GDEs)进一步改善了星形细胞的自噬和激活,这极大地促进了胶质瘤细胞的进展。在来自胶质瘤的两种外泌体之间的miRNA阵列中,miR-423-3p在H-GDEs中高表达,并在自噬中发挥了重要作用,导致NHAs的激活。确定了缺氧胶质瘤细胞与NHAs反应以创建免疫抑制微环境的机制,并建立了15d-PGJ2作为抑制miR-423-3p以抑制NHAs激活的有效抑制剂。这些发现为通过靶向自噬和miR-423-3p表达提供了对胶质瘤诊断和治疗的新见解。本文于2025年4月发表于“Cell Death and Disease”(IF=8.1)上。
技术路线: 
结果:
1)H-GDEs诱导体外NHAs细胞自噬
为了研究GDEs对星形细胞功能的影响,从在常氧(N-GDEs)和缺氧(H-GDEs)条件下培养的U251和P3#GBM细胞中提取了GDEs。透射电子显微镜(TEM)显示,从上清液中提取的内容物是直径为30-100 nm的圆形物体(图1A),这表明外泌体的成功提取。此外,Western blotting显示,在提取的囊泡中,外泌体标记物的表达丰富,包括CD9和TSG101,而calnexin未被检测到(图1B)。由于假设缺陷自噬会触发反应性星形细胞,因此研究了GDEs对星形细胞中自噬的影响。使用TEM测量自噬体的形成。与N-GDE处理相比,H-GDE处理后的自噬体体积显著增加(图1C,D)。使用Western blotting检测NHA中与自噬相关的分子LC3B和P62的表达(图1E)。N-GDEs和H-GDEs均增加了NHA中的自噬,其中H-GDEs处理的星形细胞中自噬增加更为显著,这表明GDEs直接影响星形细胞中的自噬。同样,根据免疫荧光染色,星形细胞在暴露于来自U251和P3#GBM(图1F)的H-GDEs后,其内的LC3B增加。使用3-甲基腺嘌呤(3-MA)抑制自噬减弱了H-GDE处理的NHA中LC3B的表达,进一步证实H-GDEs促进星形细胞中的自噬(图1G)。此外,进行了siRNA介导的beclin1敲除,并使用Western blotting验证了这种敲除的有效性作为抑制自噬的替代方法。与3-MA处理一致,beclin1的敲除导致LC3B类似的下调(图1H)。值得注意的是,3-MA和beclin1沉默均有效逆转了H-GDE诱导的自噬体组装(图1I,J)。此外,Western blotting显示,在使用这些抑制剂治疗后,LC3B的表达如预期的那样下调,同时P62的表达上调(图1K)。总的来说,这些发现强调了H-GDEs诱导星形胶质细胞自噬的能力。
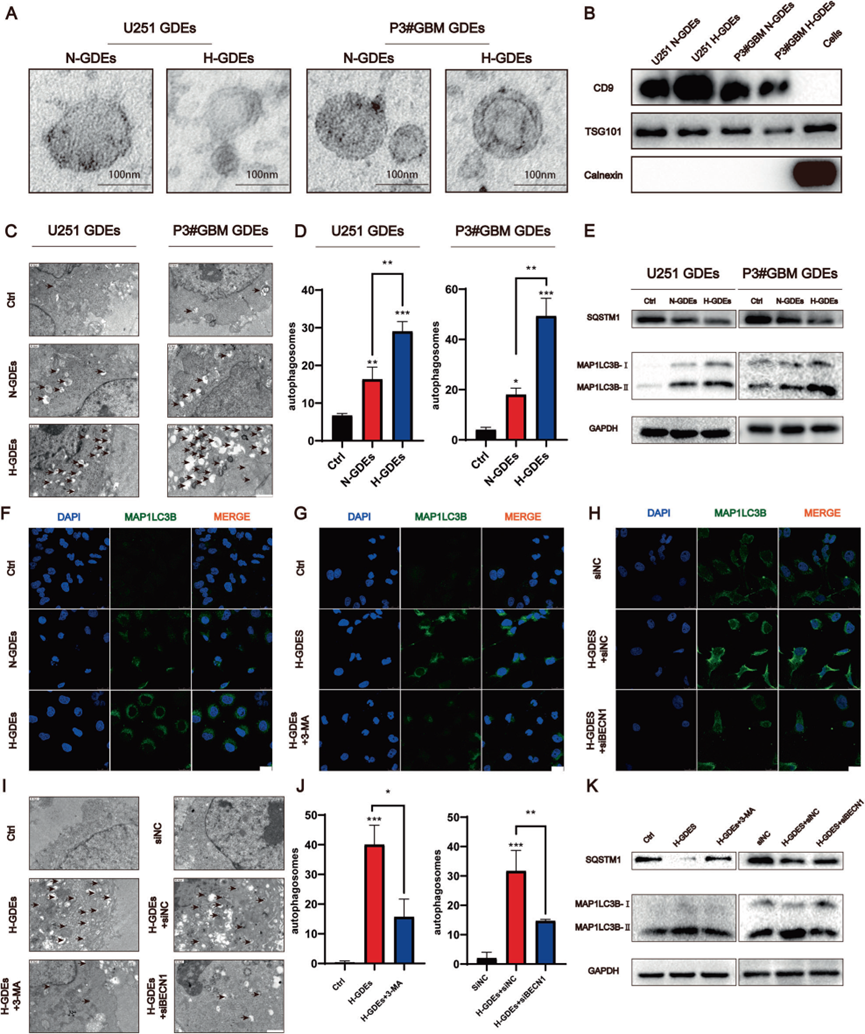
2)H-GDEs比N-GDEs更能诱导NHAs活化
鉴于GDEs可以诱导NHA中的自噬,因此确定了GDEs对星形细胞功能的后续影响。使用EdU和Transwell测定,我们发现N-GDEs和H-GDEs均增强了NHA的增殖和迁移,其中H-GDEs的效果比N-GDEs更强(图2A,C,E)。ELISA显示,NHA增殖和迁移的增加伴随着H-GDE处理的细胞中IL-6和IL-8分泌的显著增加(图2I)。GFAP是反应性星形细胞的经典标记物,因此,在用N-GDEs和H-GDEs处理后评估了GFAP的表达。研究结果显示,NHA在暴露于H-GDEs后,GFAP表达显著上调(图1G),证实了H-GDEs在星形细胞激活中的强效前反应作用。接下来,研究了自噬是否在这一转变中发挥作用。在H-GDE处理的组中,通过3-MA抑制自噬或敲低beclin1减弱了H-GDE诱导的IL-6和IL-8的分泌(图2J)。然后研究了GDEs暴露后NHA中观察到的功能变化是否由自噬介导。EdU和Transwell测定还显示,自噬的下调阻断了H-GDEs对NHA增殖和迁移的影响(图2B,D,F)。此外,Western blotting揭示,通过3-MA或beclin1的基因敲低实现的抑制自噬,导致GFAP表达显著降低(图2G)。总的来说,这些结果强烈表明H-GDEs可以通过调节自噬诱导NHA转变为反应表型。
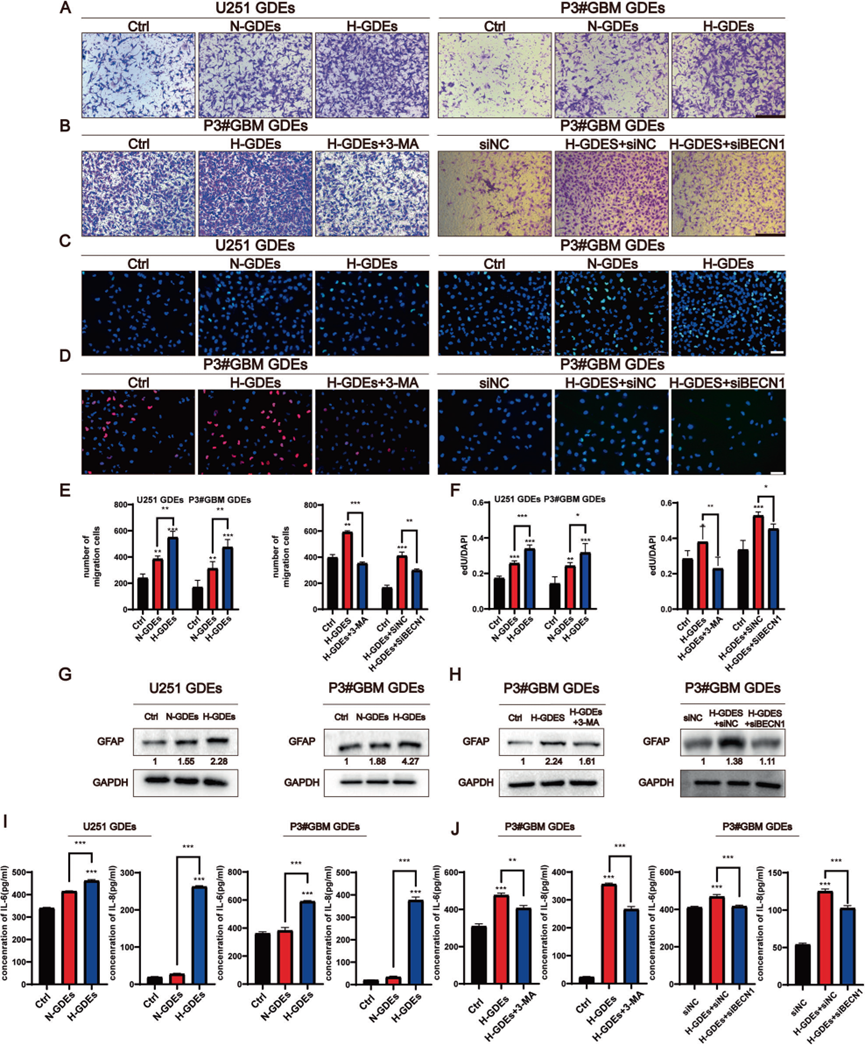
3)H-GDEs通过miR-423-3p诱导NHAs细胞自噬,其作用可被3-MA抑制
外泌体可以在细胞之间运输miRNAs 。为了确定导致NHA转化的GDE相关的miRNA,使用miRNA阵列分析了来自U251和P3#GBM细胞的N-GDEs和H-GDEs中的miRNA含量(图3A)。比较了N-GDEs和H-GDEs中差异表达的miRNA,并鉴定了从两种细胞系中提取的H-GDEs中高表达的top 10 miRNA(图3B)。确定了这10个miRNA对NHA中自噬调节的影响。MiR-423-3p显著提高了NHA中LC3B的表达,通过半定量测量(图3C,D),表明其在调节自噬中的重要作用。对来自P3#GBM细胞(图3E)的N-GDEs和H-GDEs进行了qRT-PCR,证实了miR-423-3p的上调。此外,与来自健康患者的血液中收集的外泌体相比,来自GBM患者的血液中收集的外泌体的表达水平更高(图3F)。Western blotting和免疫荧光图像显示,miR-423-3p增加了NHA中的自噬(图3G,I)。当在miR-423-3p转染的细胞中敲低beclin1时,观察到了相同的趋势(图3H,I),表明了miR-423-3p的自噬诱导效应。鉴于miRNA-423-3p可以诱导自噬,研究了miR-423-3p是否介导GDEs对自噬的影响。与对照相比,提取的GDEs显著上调了NHA中的LC3B(图3J,L),并且使用针对miR-423-3p的抑制RNA消除了NHA中LC3B的上调(图3L)。LC3B的免疫荧光染色显示出了相似的结果(图3K)。在形态上,miR-423-3p诱导了自噬体的形成,这被3-MA、beclin1敲低和miRNA抑制剂所抑制(图3M,N)。总的来说,miR-423-3p在诱导NHA自噬中发挥了重要作用。
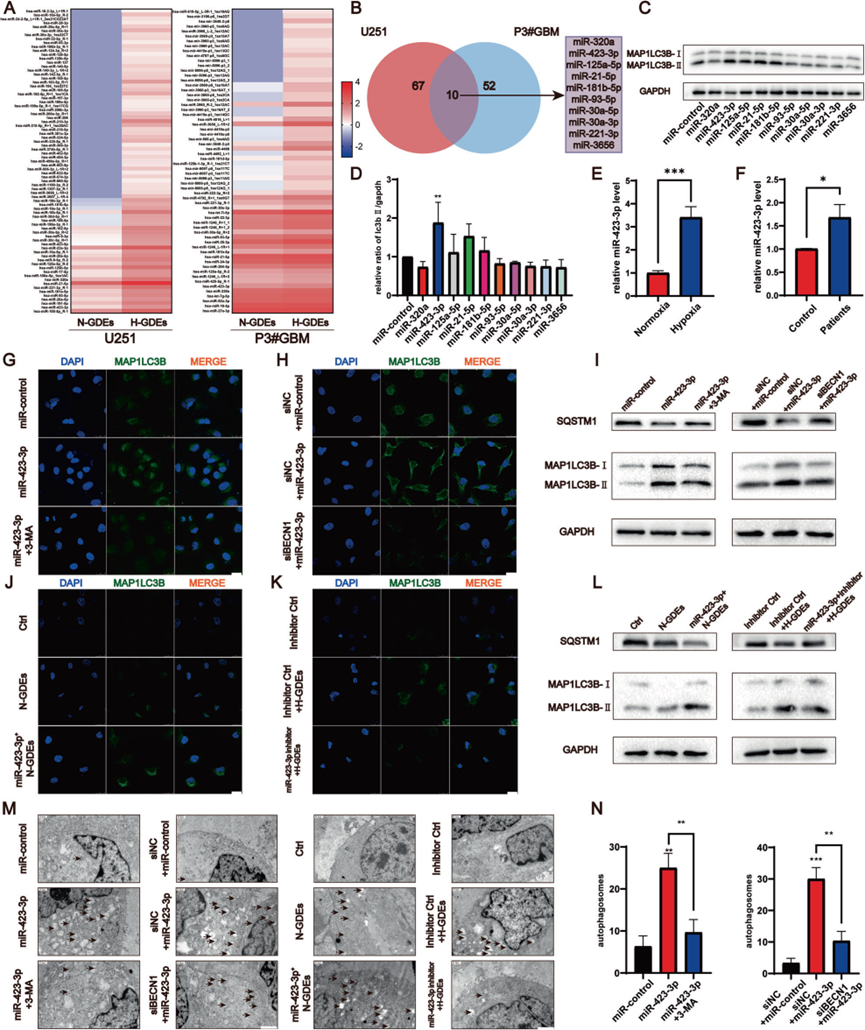
4)miR-423-3p诱导的H-GDEs自噬促进星形胶质细胞的活化
MiR-423-3p诱导NHA中的自噬,因此,研究了miR-423-3p是否促进了星形细胞的转化。使用miR-423-3p模拟物转染NHA,并使用3-MA或beclin1敲低RNA进行自噬抑制处理。Transwell和EdU测定显示,miR-423-3p显著增加了NHA的增殖和迁移,这被自噬抑制所减弱(图4A,C,E,F)。使用ELISA和Western blotting,我们证实miR-423-3p增加了星形细胞中IL-6和IL-8的分泌(图4I),并上调了GFAP的表达(图4G)。这些结果表明miRNA-423-3p促进了NHA向RA的转变。为了进一步验证miR-423-3p是否介导GDEs对NHA转化的影响,从常氧条件下过表达miR-423-3p的P3#GBM细胞中提取GDEs来处理NHA。将含有抑制miR-423-3p的miRNA的H-GDEs添加到另一组中。MiR-423-3p显著增强了转化,而抑制RNA则挽救了H-GDE诱导的NHA转化(图4B,D-F,H,J)。总的来说,这些结果表明H-GDEs中的miR-423-3p通过自噬促进了NHA的肿瘤促进转化。
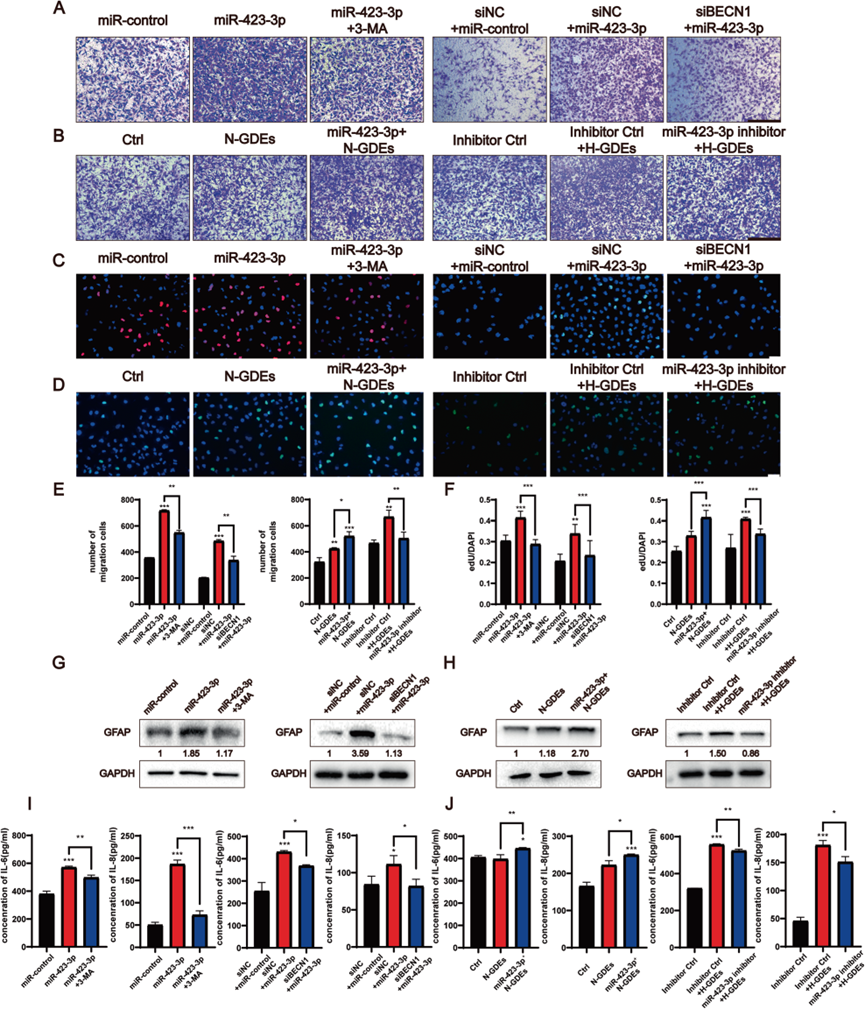
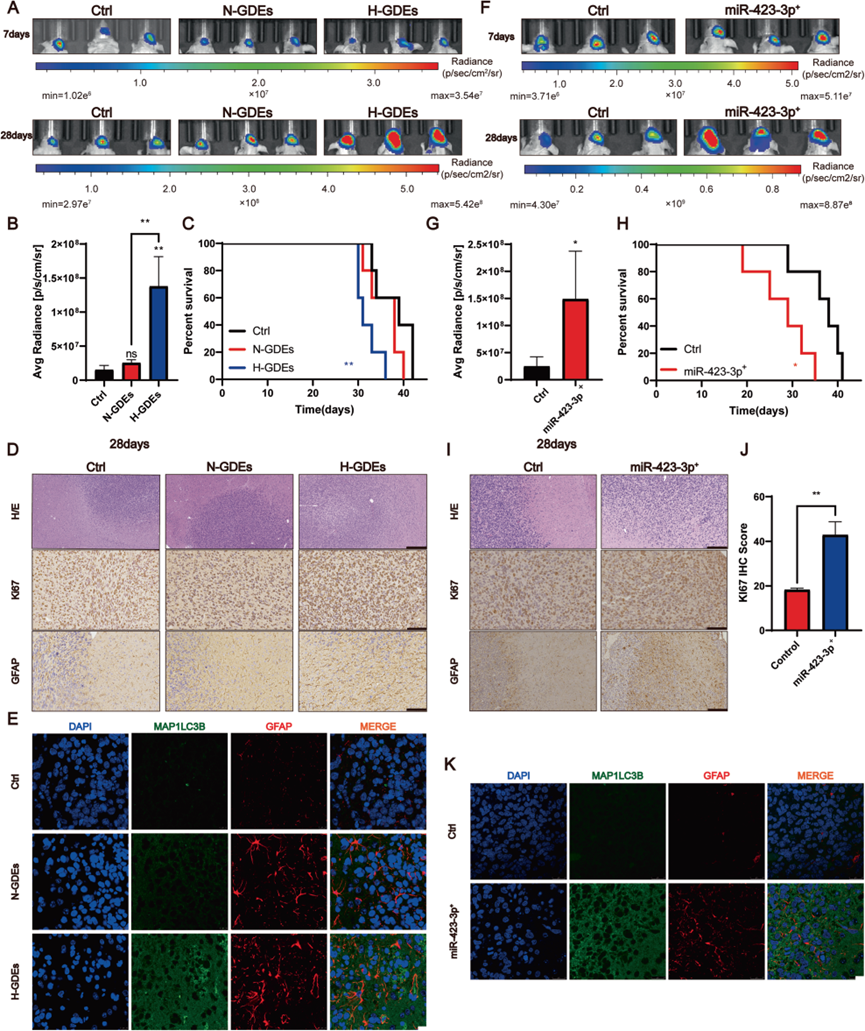
5)H-GDEs中miR-423-3p诱导的RAs在体内促进胶质瘤的进展
鉴于胶质瘤细胞可以通过外泌体机制诱导NHA向RA的转变,研究了GDEs或miR-423-3p诱导的星形细胞转化是否可以促进胶质瘤的进展。将用PBS、N-GDEs和H-GDEs预处理的P3#GBM细胞和星形细胞共植入裸鼠的大脑中,并通过尾静脉每3天给小鼠注射PBS、N-GDEs和H-GDEs。植入后1周和4周通过生物发光成像测量的肿瘤体积显示,与另外两组小鼠相比,用H-GDE处理的小鼠的肿瘤体积显著更大(图5A,B)。随后,用H-GDE处理的小鼠的生存时间比其他组的小鼠短(图5C)。H&E和Ki67的免疫组化染色显示,H-GDE处理组的肿瘤边界不清且Ki67表达高。还对星形细胞标记物GFAP进行了染色;用H-GDE处理的NHA表现出异形GFAP的高表达,分支数量明显增加(图5D)。此外,LC3B和GFAP的共免疫染色显示,H-GDE处理显著增加了NHA中LC3B和异常GFAP的表达(图5E),表明H-GDE可以在体内促进NHA的自噬和转化。在确认了H-GDEs在体内促进胶质瘤进展的作用后,研究了miR-423-3p对肿瘤进展的影响。将NHA用lenti-miR-control或lenti-ov-miR-423-3p病毒转染,并与P3#GBM细胞一起植入裸鼠中以生成原位异种移植。生物发光成像显示,到第4周时,miR-423-3p增加了裸鼠的肿瘤大小(图5F,G)。此外,植入小鼠的存活率低于对照组小鼠(图5H)。一致地,H&E染色显示miR过表达组中有强烈的肿瘤浸润(图5I)。此外,Ki67和GFAP的IHC染色显示,miR-423-3p诱导的NHA激活促进了胶质瘤的增殖率和NHA中异形GFAP的表达(图5I,J)。共免疫染色进一步表明,与对照小鼠相比,lenti-miR-423-3p表达小鼠的LC3B和异形GFAP水平更高(图5K)。总的来说,这些结果表明,来自H-GDEs的miR-423-3p可以促进TME中NHA向RA的转变,并随后在体内促进胶质瘤的进展。
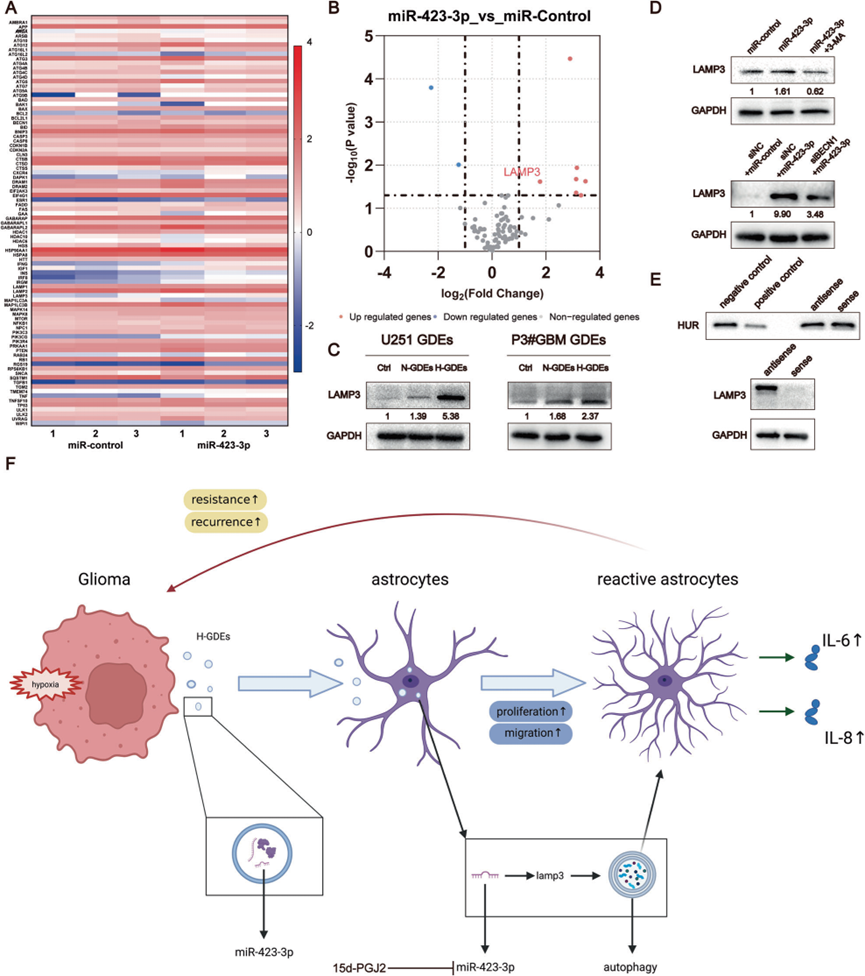
6)LAMP3是miR-423-3p的下游靶基因,在NHAs中参与自噬
为了检测miR-423-3p在调节自噬过程中的下游基因,我们使用了qPCR阵列来探测转染了对照和miR-423-3p模拟物的NHA细胞中与自噬相关的靶基因(图6A,B)。根据之前的研究,LAMP3可能是miR-423-3p的下游靶点,其功能与自噬密切相关。通过Western blotting比较了来自U251和P3#GBM细胞的PBS、N-GDEs和H-GDEs处理的NHA细胞中LAMP3的表达。H-GDEs显著增加了NHA细胞中LAMP3的表达(图6C)。此外,在转染了miR-423-3p的NHA细胞中,LAMP3的表达增加,当自噬被抑制时,这种趋势被逆转(图6D)。这些实验表明LAMP3可能参与了miR-423-3p对自噬诱导的影响。进一步的pull-down实验显示miR-423-3p与LAMP3之间存在直接相互作用,进一步支持了这一推测(图6E)。
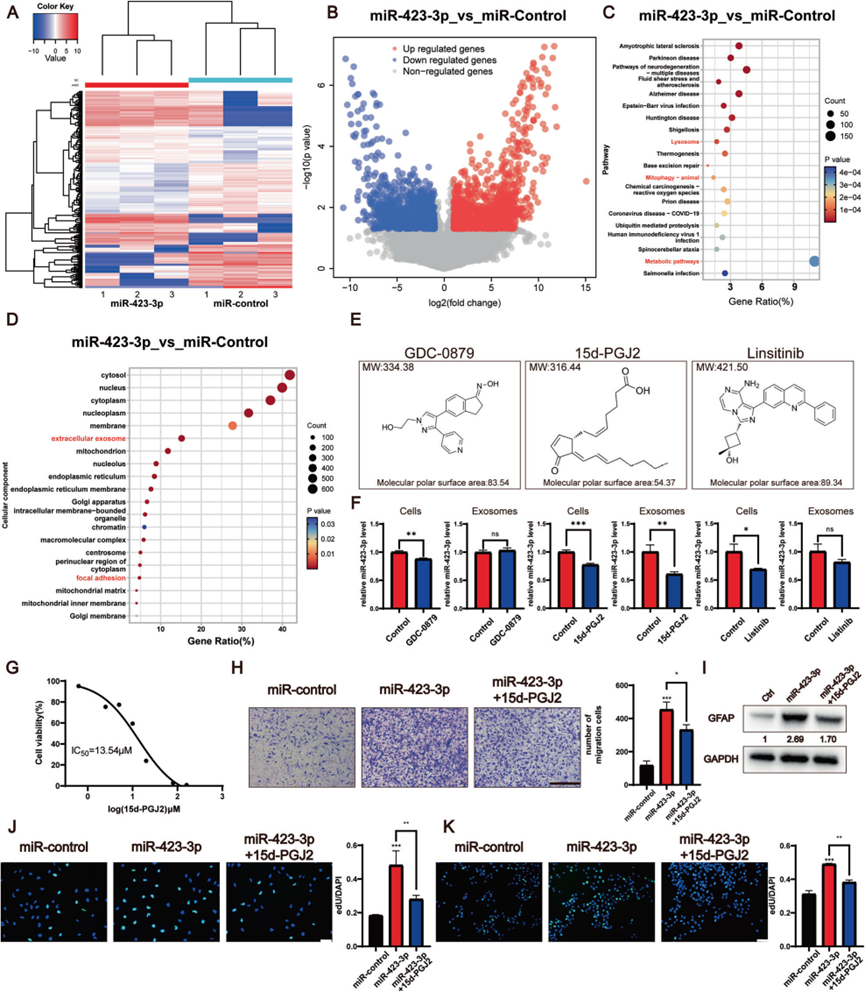
7)15d-PGJ2可以抑制miR-423-3p的活性,抑制NHAs的激活
为了识别可能抑制miR-423-3p活性的药物,我们对用miR-control或miR-423-3p处理的NHA进行了转录组测序,这使我们能够识别差异表达基因(图7A,B)。KEGG富集分析显示,差异表达基因与溶酶体功能、线粒体自噬和代谢途径相关,所有这些都与自噬有关(图7C)。此外,GO富集分析突出了外泌体和焦点黏附,有助于随后形成胶质瘤微环境(图7D)。我们使用CMap数据库基于差异表达基因预测潜在药物。预测能通过血脑屏障(BBB)的前三种药物是GDC-0879、15d-PGJ2和linsitinib(图7E)。在5 μM浓度下,15d-PGJ2对胶质瘤细胞和外泌体均表现出强效抑制作用,这使其效力与GDC-0879和linsitinib区分开来(图7F)。结合使用CCK-8测试的IC50(图7G),这些候选物的分子拓扑极性表面积和分子量,我们选择了15d-PGJ2进行以下实验。在NHA中,15d-PGJ2处理导致miR-423-3p诱导的迁移率(图7H)、GFAP水平(图7I)和增殖率(图7J)降低。随后,观察到当与用15d-PGJ2预处理的NHA共培养时,P3#GBM细胞的增殖率降低(图7K),这突出了这种化合物在复杂细胞微环境中对GBM细胞增长的潜在抗增殖效应。因此,15d-PGJ2被预测为一种有前途的抑制剂,可减少NHA的激活和TME的形成。
结论:
这项研究揭示了一种正反馈机制,通过这种机制,胶质瘤触发星形细胞激活,而星形细胞激活反过来又促进胶质瘤的恶性程度。此外,胶质瘤通过分泌含有miR-423-3p的外泌体,促进了NHA向RA的转变,随后通过自噬诱导星形细胞反应性。
实验方法:
Western blot,Pull down,免疫荧光,ELISA,qRT‒PCR,EdU,Transwell,CCK-8,RNA-seq,免疫组化。
参考文献:
Tang Z, Xue Z, Liu X, Zhang Y, Zhao J, Liu J, Zhang L, Guo Q, Feng B, Wang J, Zhang D, Li X. Inhibition of hypoxic exosomal miR-423-3p decreases glioma progression by restricting autophagy in astrocytes. Cell Death Dis. 2025 Apr 8;16(1):265. doi: 10.1038/s41419-025-07576-2.






