FBXO31介导的OGT泛素化维持O-GlcNAcylation稳态以抑制子宫内膜恶性肿瘤
蛋白质O-GlcNAc糖基化是一种与细胞代谢可塑性密切相关的翻译后修饰。在包括子宫内膜癌(EC)在内的多种癌症中均观察到异常的O-GlcNAc糖基化现象。然而,关于EC中O-GlcNAc糖基化稳态失调的临床特征及其分子机制研究仍不完善。本研究通过包含219例肿瘤组织的中国患者队列分析发现,O-GlcNAc糖基化水平与EC组织学分级呈正相关,该结果在癌症基因组图谱(TCGA)数据集中得到验证。在患者来源的子宫内膜上皮类器官中,提高O-GlcNAc糖基化水平可促进增殖和干细胞样特性,而降低O-GlcNAc糖基化则会抑制子宫内膜癌类器官的生长。CRISPR筛选和生化分析表明,肿瘤抑制因子FBXO31通过泛素化修饰O-GlcNAc转移酶OGT来调控EC中的O-GlcNAc糖基化稳态。下调O-GlcNAc糖基化可有效抑制小鼠模型中EC肿瘤的形成。本研究系统论证了O-GlcNAc糖基化可作为晚期低分化EC病例的分层标志物和治疗靶点。该研究于2025年2月发表在《Nature Communications》,IF:14.7。
技术路线:
主要研究结果:
1.子宫内膜癌中O-GlcNAc糖基化水平升高与组织学分级及不良预后呈正相关
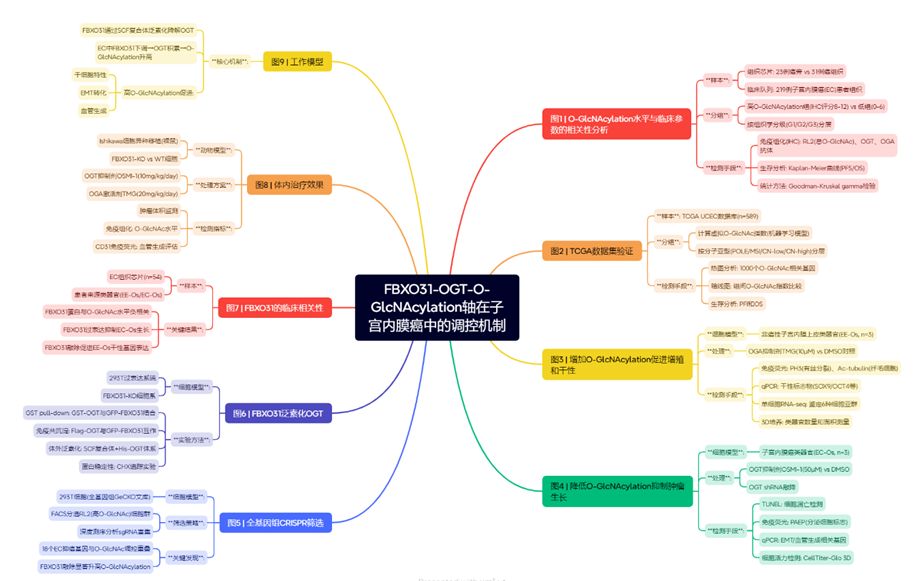
为探究EC组织中O-GlcNAc糖基化的整体水平,我们采用上海芯超生物科技有限公司提供的EC组织芯片(包含23例癌旁和31例癌变子宫内膜标本),使用抗O-GlcNAc单克隆抗体RL2(该抗体以大鼠肝细胞核孔复合体-核纤层组分为免疫原制备,已通过多种应用场景验证其跨物种检测O-GlcNAc糖基化的广泛适用性24,27–34)以及OGT、OGA抗体进行免疫组化分析(图1a)。结果显示,相较于对照组,EC组织上皮细胞中O-GlcNAc糖基化水平和OGT表达量均显著升高(图1b-e),这与既往研究结论一致24。然而,OGA在癌旁与癌变子宫内膜组织中的表达未见显著差异。
为深入探究O-GlcNAc糖基化水平与子宫内膜癌临床特征的关系,我们将研究队列扩展至中南大学湘雅医院妇科接受子宫切除术的219例EC患者(图1a)。对石蜡包埋的EC组织切片进行免疫组化分析,通过RL2抗体染色半定量评估各样本O-GlcNAc糖基化水平并进行患者分组。具体而言,由两名独立评估人员根据阳性染色肿瘤细胞比例(评分0-4分:0=阴性;1=1-25%;2=26-50%;3=51-75%;4=76-100%)和染色强度(评分0-3分:0=阴性;1=弱;2=中等;3=强)进行量化评分,并经病理学家复核确认。最终以比例评分与强度评分的乘积作为各样本的免疫组化总分35-37。根据IHC评分将患者分为高O-GlcNAc糖基化组(High-RL2:8-12分)和低O-GlcNAc糖基化组(Low-RL2:0-6分)。这种高低分组状态与EC组织学分级、FIGO分期及远处转移显著相关(附表1)。值得注意的是,组织学分级更高的EC患者组织中O-GlcNAc糖基化水平显著升高(图1f),且G3级患者中高O-GlcNAc糖基化病例明显富集(图1g)。进一步统计分析显示,O-GlcNAc糖基化水平与肿瘤组织学分级(Goodman-Kruskal gamma统计量p≤0.0001;双侧gamma-knife γ=0.473)及远处转移(Goodman-Kruskal gamma统计量p=0.003;双侧gamma-knife γ=1)均呈正相关。Kaplan-Meier分析表明,高O-GlcNAc糖基化组患者的无进展生存期(PFS)和总生存期(OS)均显著短于低O-GlcNAc糖基化组(图1h,i)。单因素分析显示O-GlcNAc糖基化水平与年龄、FIGO分期、肌层浸润深度均为PFS的显著相关因素。后续对所有显著性变量(p<0.05)进行多因素Cox回归分析,最终确定O-GlcNAc糖基化水平与年龄是EC患者临床结局的独立预测因子(附表2)。
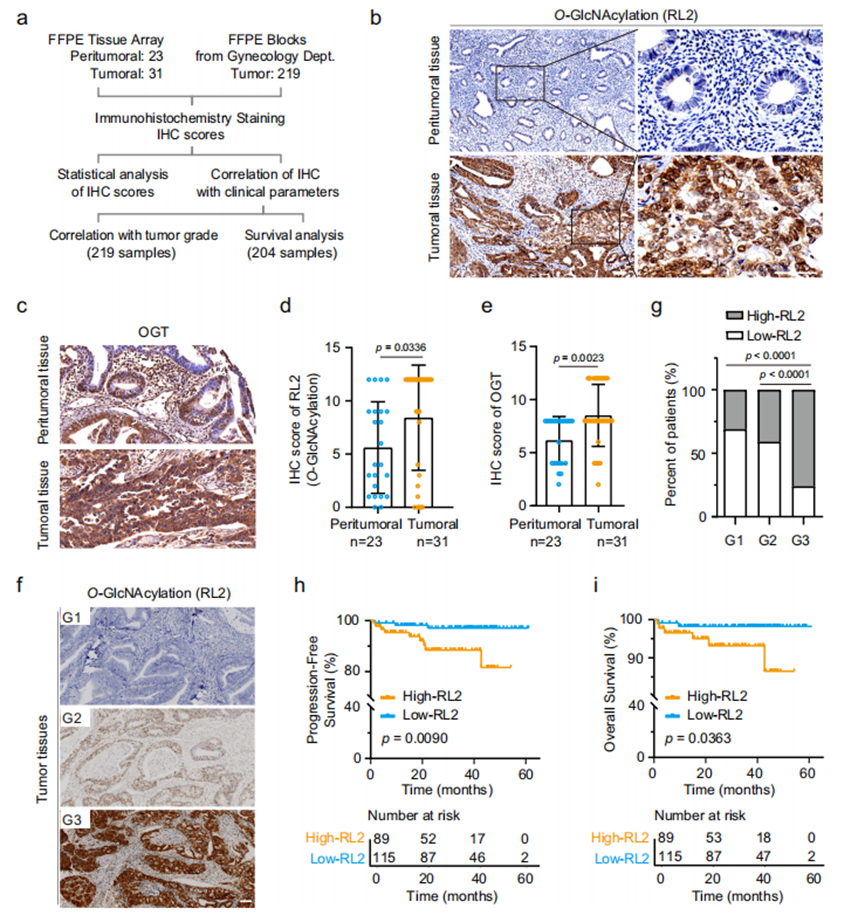
图1.子宫内膜癌中O-GlcNAc糖基化水平升高与组织学分级及不良预后呈正相关
2.基于TCGA子宫内膜癌数据集计算的虚拟O-GlcNAc指数与肿瘤组织学分级及生存期相关
为验证本研究中发现的关联性,我们利用TCGA UCEC数据集进行验证分析。仅基于OGT或OGA表达的总体生存期(OS)Kaplan-Meier分析未显示统计学差异,提示单纯OGT或OGA的mRNA丰度不足以反映O-GlcNAc糖基化水平,EC中OGT蛋白量可能受翻译或翻译后调控。为更准确评估O-GlcNAc糖基化水平,我们根据RL2免疫组化评分选取40例高O-GlcNAc糖基化和15例低O-GlcNAc糖基化冷冻EC样本进行RNA测序。基因集富集分析(GSEA)显示,高O-GlcNAc糖基化组中上皮-间质转化(EMT)和血管生成相关基因显著富集。进一步计算各基因转录水平与O-GlcNAc糖基化免疫组化评分的Pearson相关系数(r),筛选r>0.3的前1000个基因构成O-GlcNAc糖基化相关基因集。基因本体(GO)分析表明这些基因在纤毛相关生物过程中高度富集,该结果与O-GlcNAc糖基化水平与EC组织学分级的关联性一致,因为多纤毛形成是子宫内膜上皮细胞分化的标志。
我们随后基于该基因集表达矩阵,采用R语言机器学习算法构建数学模型,计算TCGA UCEC队列中每个样本的虚拟O-GlcNAc指数。TCGA数据集中计算的O-GlcNAc指数与组织学分级和FIGO分期显著相关(图2a),这巩固了本EC队列的观察结果。晚期G3级患者组的O-GlcNAc指数显著高于G1或G2级组(图2b);同样,FIGO II-IV期患者的指数也较I期患者显著升高(图2c)。值得注意的是,分析O-GlcNAc指数与EC分子分型的关系发现,在所有EC病例中临床预后最差的拷贝数高型患者39,其O-GlcNAc指数显著高于其他分子亚型(图2d)。该指数还随年龄增长而升高,而年龄是EC患者临床结局的独立预测因子(图2e)。我们进一步以O-GlcNAc指数中位值为界,将TCGA队列中的EC患者分为高/低O-GlcNAc糖基化组,高O-GlcNAc糖基化组患者的无进展间期(PFI)和总生存期(OS)均显著缩短(图2f,g)。综上所述,无论是在本研究的EC患者队列还是TCGA UCEC数据集中,子宫内膜癌组织中升高的O-GlcNAc糖基化水平均与更晚期的组织学分级及更差的临床预后显著相关。
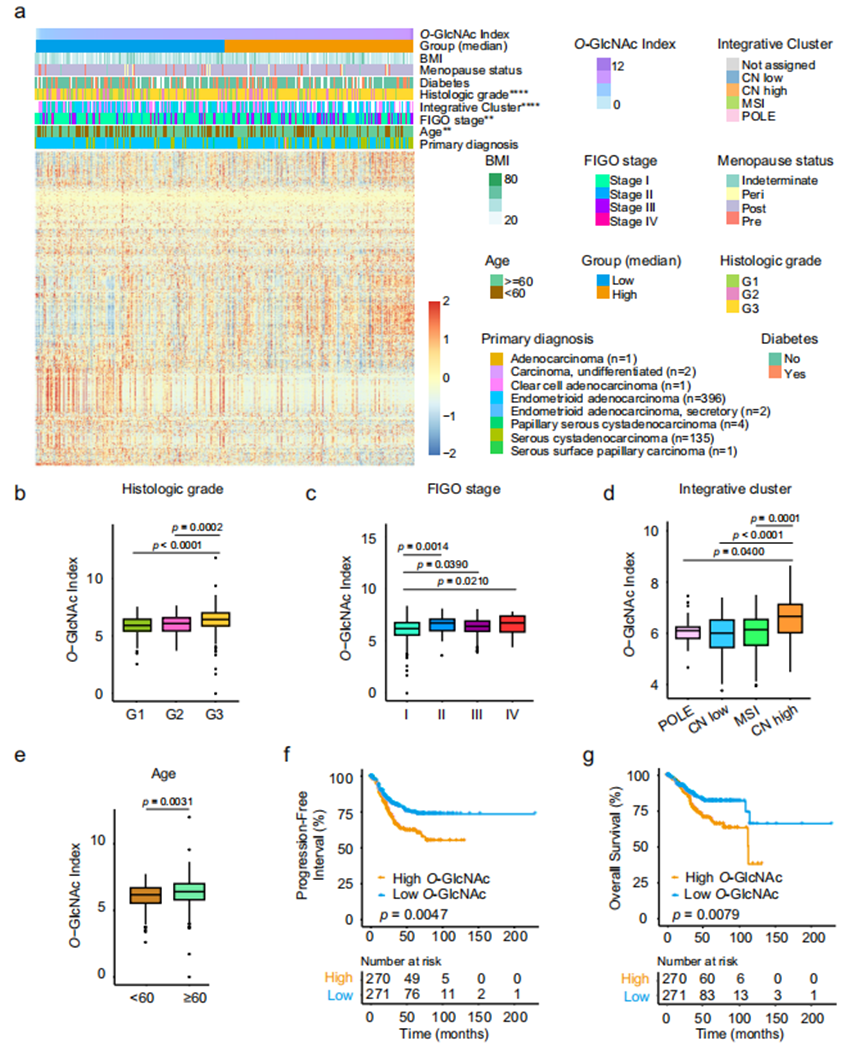
图2.基于TCGA子宫内膜癌数据集计算的虚拟O-GlcNAc指数与肿瘤组织学分级及生存期相关
3.抑制OGA升高O-GlcNAc糖基化促进非癌性子宫内膜上皮类器官增殖与干性
已有小分子抑制剂可调控O-GlcNAc循环酶OGT和OGA活性,被广泛用于体外和体内研究O-GlcNAc糖基化功能42-52。我们使用OGA抑制剂Thiamet-G(TMG)处理EE-Os以提升细胞O-GlcNAc糖基化水平(图3a,b)。TMG处理增强了EE-Os的集落形成能力和类器官生长(图3c,d),并增加每个EE-O中有丝分裂细胞数量(图3e,f)。乙酰化α-微管蛋白(Ac-tubulin)和PAEP分别是子宫内膜多纤毛上皮细胞和分泌细胞的分化标志物41。TMG处理导致PAEP阳性细胞和Ac-tubulin标记的多纤毛细胞数量减少(图3g,h),提示O-GlcNAc糖基化水平升高引起EE-Os中子宫内膜细胞去分化。我们进一步检测了子宫内膜干性标志物(SSEA-1、SOX9、ALDH1、OCT4、CD133和SOX2)表达水平。与PAEP mRNA水平下降相反,所有干性标志物表达均上调(图3i)。鉴于GSEA提示高O-GlcNAc糖基化可能促进EMT和血管生成,我们还检测了TMG处理EE-Os中这两个过程相关基因的表达。上皮标志物E-cadherin和ZO-1表达无变化,但6个间质标志物中的FN-1、Snail1、TWIST2和MMP1表达升高;血管生成相关基因中,PDGFA和VEGFC表达上调,其余基因表达未变或下调。这些发现表明,O-GlcNAc糖基化升高可促进子宫内膜上皮细胞去分化,并不同程度地增强其EMT和血管生成能力。为深入解析TMG处理对EE-Os中不同细胞亚型的影响,我们对对照组和TMG处理的EE-Os进行单细胞RNA测序分析(图3j)。根据已知标志物的特异性表达38,53,细胞被聚类分为六种主要亚型:前纤毛细胞型、纤毛细胞型、干细胞型、增殖型、O-GlcNAc相关干样细胞型和炎症型。值得注意的是,我们发现了一种O-GlcNAc相关干样细胞亚型,该亚型细胞表现出激活的干细胞多能性调控信号通路及O-聚糖生物合成通路。TMG处理导致EE-Os中纤毛和前纤毛细胞亚型比例显著降低,同时增殖型和O-GlcNAc相关干样细胞亚型比例增加(图3k),这一结果证实O-GlcNAc糖基化水平上调可促进子宫内膜上皮细胞的增殖和干性。
作为对比,我们使用OGT抑制剂OSMI-1处理EE-Os,分析降低O-GlcNAc糖基化对非癌性子宫内膜上皮细胞的影响。OSMI-1处理仅轻微影响EE-Os生长,且类器官形成数量无显著变化。TUNEL染色显示OSMI-1处理的EE-Os未出现明显凋亡,多纤毛分化细胞数量保持稳定。对OSMI-1处理的EE-Os中干性、EMT和血管生成标志基因的检测也未发现一致性改变,这些结果表明OGT抑制对EE-Os细胞的影响较为有限。
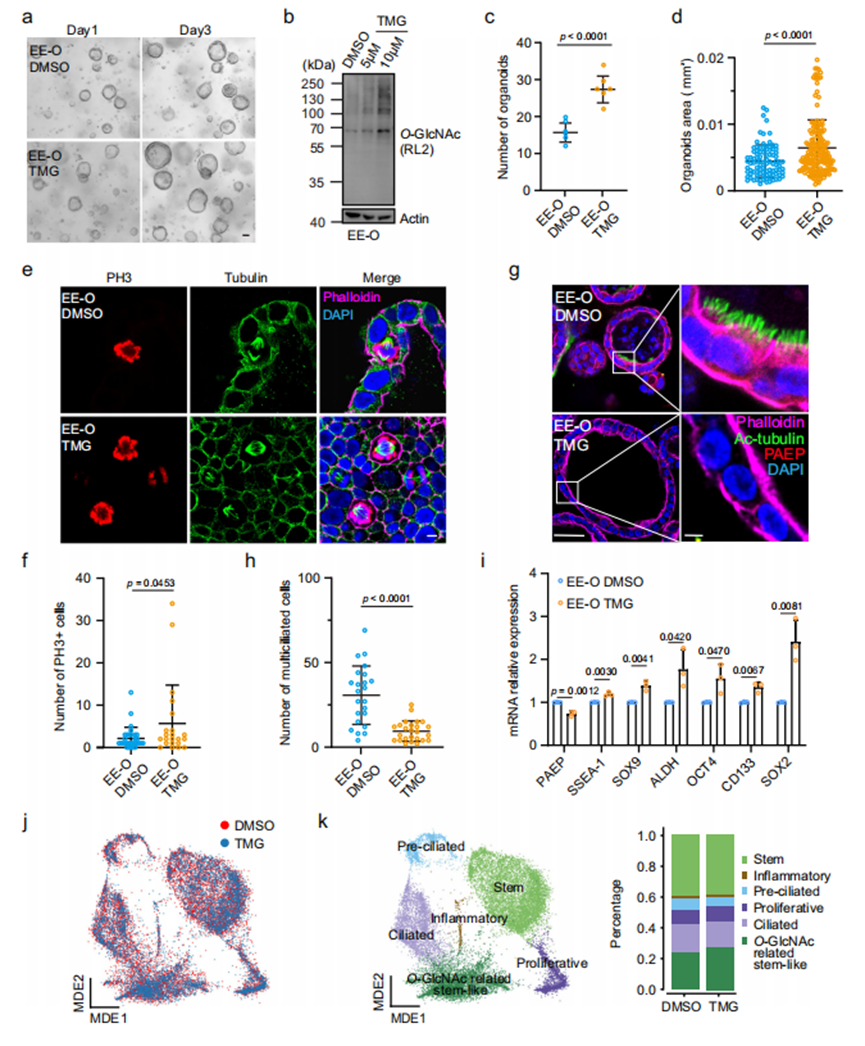
图3.抑制OGA升高O-GlcNAc糖基化促进非癌性子宫内膜上皮类器官增殖与干性
4.抑制OGT降低O-GlcNAc糖基化可阻碍子宫内膜癌类器官增殖并诱导分化与细胞死亡
为探究降低O-GlcNAc糖基化能否抑制EC-Os中肿瘤细胞生长,我们采用OGT化学抑制剂OSMI-1处理EC-Os(图4a,b)。OSMI-1的加入显著阻碍了EC-Os的形成与生长。与同期对照组相比,OSMI-1处理组中大量EC-Os出现细胞暗化裂解现象,导致类器官数量和体积均显著减少(图4a-d)。TUNEL染色显示OSMI-1处理的EC-Os中存在大量凋亡细胞(图4e)。对形态相对正常的残留EC-Os进行免疫荧光分析发现,经OSMI-1处理后,磷酸化组蛋白H3(PH3)标记的有丝分裂细胞几乎不可见(图4f,g)。同时,这些EC-Os中PAEP阳性分泌细胞和Ac-tubulin标记的多纤毛细胞比例均增加(图4h,i),表明OSMI-1处理促进了细胞分化。与此一致,OSMI-1处理的EC-Os中干性标志物(SSEA-1、SOX9、ALDH1、OCT4、CD133和SOX2)表达显著下调,而分化标志物PAEP表达上调(图4j)。所有间质标志物(FN-1、Vimentin、Snail1、TWIST2、TGFB1和MMP1)表达均下降(图4k),多数血管生成标志物在OSMI-1处理的EC-Os中也呈现表达降低(图4l)。
为确认OSMI-1对EC-Os的作用具有靶向特异性,我们通过短发夹RNA(shRNA)直接敲低OGT表达并重复实验。与OSMI-1处理结果一致,shRNA敲低OGT同样能下调O-GlcNAc糖基化水平,并显著抑制EC-Os的形成与生长。OGT敲低后的EC-Os细胞凋亡增加,残留细胞多呈现多纤毛化,且分化标志物PAEP表达上调、干性基因表达下调。这些结果表明,不同方式诱导的O-GlcNAc糖基化水平降低均可导致EC-Os中肿瘤细胞的生长受限、分化增强和凋亡增加。
我们同样采用OGA抑制剂TMG处理EC-Os以验证其促瘤效应。TMG处理显著增加EC-Os的数量和体积,干性基因(如SOX9、ALDH1、CD133和SOX2)表达上调而分化标志物PAEP下调。此外,所有间质标志物及多数血管生成基因在TMG处理的EC-Os中表达均升高,提示OGA抑制可进一步加剧恶性表型。
子宫内膜类器官的OGT/OGA抑制剂实验显示,EE-Os对O-GlcNAc糖基化下调的敏感性低于EC-Os。为验证此现象,我们选取2例O-GlcNAc糖基化水平较高的EC患者来源EC-Os和2例非EC患者EE-Os进行3D细胞活力检测。除OSMI-1外,还加入其衍生物OSMI-454。结果显示,TMG处理促进EE-Os和EC-Os增殖,而OSMI-1或OSMI-4抑制OGT时,EC-Os的活力降低程度显著大于对照EE-Os(图4m)。这些发现表明,OGT抑制剂能有效抑制体外肿瘤类器官的扩增,尤其对固有高O-GlcNAc糖基化水平的肿瘤效果显著。
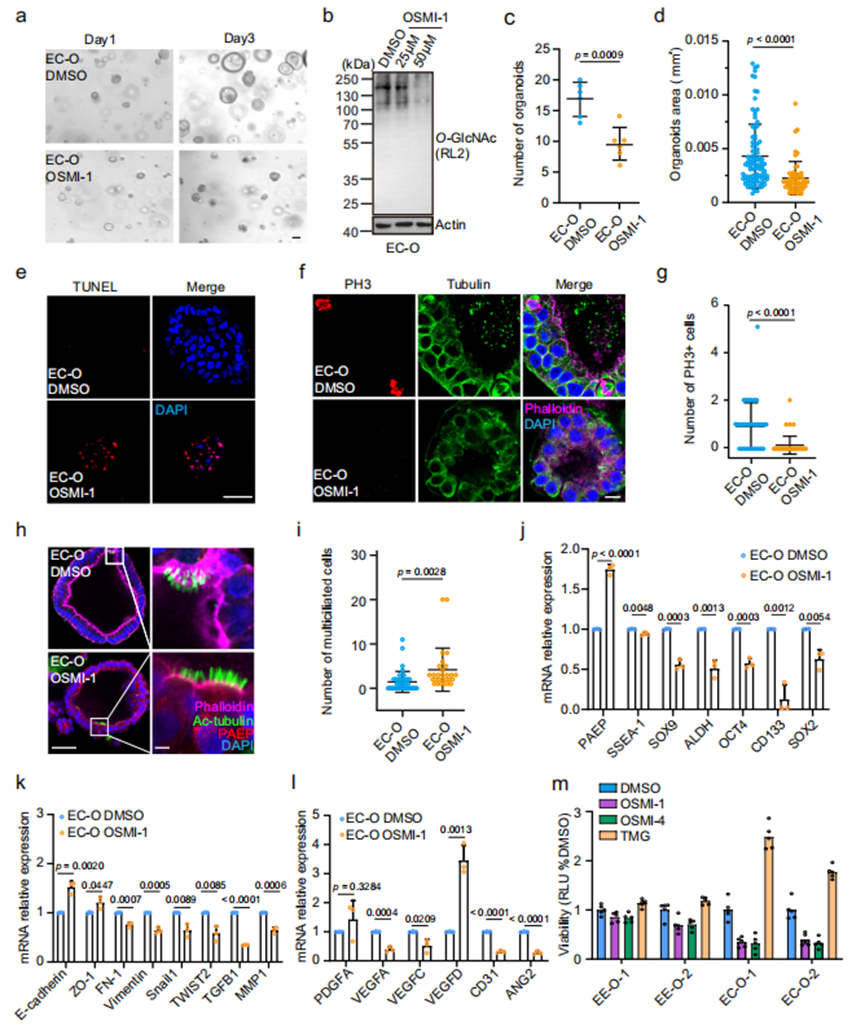
图4.抑制OGT降低O-GlcNAc糖基化可阻碍子宫内膜癌类器官增殖并诱导分化与细胞死亡
5.全基因组筛选维持O-GlcNAc糖基化稳态的肿瘤抑制因子
为鉴定调控内皮细胞O-GlcNAc糖基化稳态的关键因子,我们开展了全基因组CRISPR-Cas9敲除筛选实验。将靶向19,050个基因(每个基因6条sgRNA)的慢病毒单导RNA(sgRNA)文库与1000条非靶向对照sgRNA以0.3的感染复数(MOI)共转染293T细胞,确保每个细胞仅表达单一sgRNA。使用抗O-GlcNAc抗体RL2染色后,通过流式分选(FACS)分离RL2荧光信号最强的5%细胞群,并对该群体中的sgRNA进行深度测序(图5a、b)。基于sgRNA丰度数据,采用MAGeCK55计算各基因的稳健秩和聚合(RRA)评分进行排序,RRA评分越小表明基因重要性越高。通过文献回顾我们收集了已知能影响细胞O-GlcNAc糖基化稳态的调控因子56–71。负向调控O-GlcNAc糖基化的基因(如TSC2、SIRT1和TP53)RRA评分较小,在基因列表中较正向调控因子更集中于前半部分(图5c)。对筛选获得的1038个高置信度基因(p<0.05)进行KEGG通路分析,发现这些基因显著富集于ECM-受体相互作用、产热作用、组氨酸代谢、癌症中的蛋白聚糖以及青少年发病的成人型糖尿病等通路(图5d)。
为进一步明确影响内皮细胞(EC)组织中O-GlcNAc糖基化水平的关键调控因子,我们将全基因组筛选获得的1038个阳性候选基因与526个EC潜在抑癌基因72,73进行交叉比对,最终鉴定出18个重叠基因(图5e),包括ACVR1C、AGTR1、CADM2、PRKAA1、CDKN1C、CMTM3、DIRAS3、SIK1、EPHB4、GATA5、ITGAV、KLF10、MAP3K8、PLA2G2A、PTPN11、RNASEL、SPARCL1及FBXO31。基于TCGA UCEC数据集对上述基因进行Kaplan-Meier生存分析,发现仅FBXO31在EC组织中表达下调且与患者不良预后显著相关。为此,我们通过CRISPR技术构建了FBXO31敲除(FBXO31-KO)的293T细胞系。RL2抗体免疫荧光染色证实,FBXO31-KO细胞中O-GlcNAc糖基化水平显著升高(图5f)。
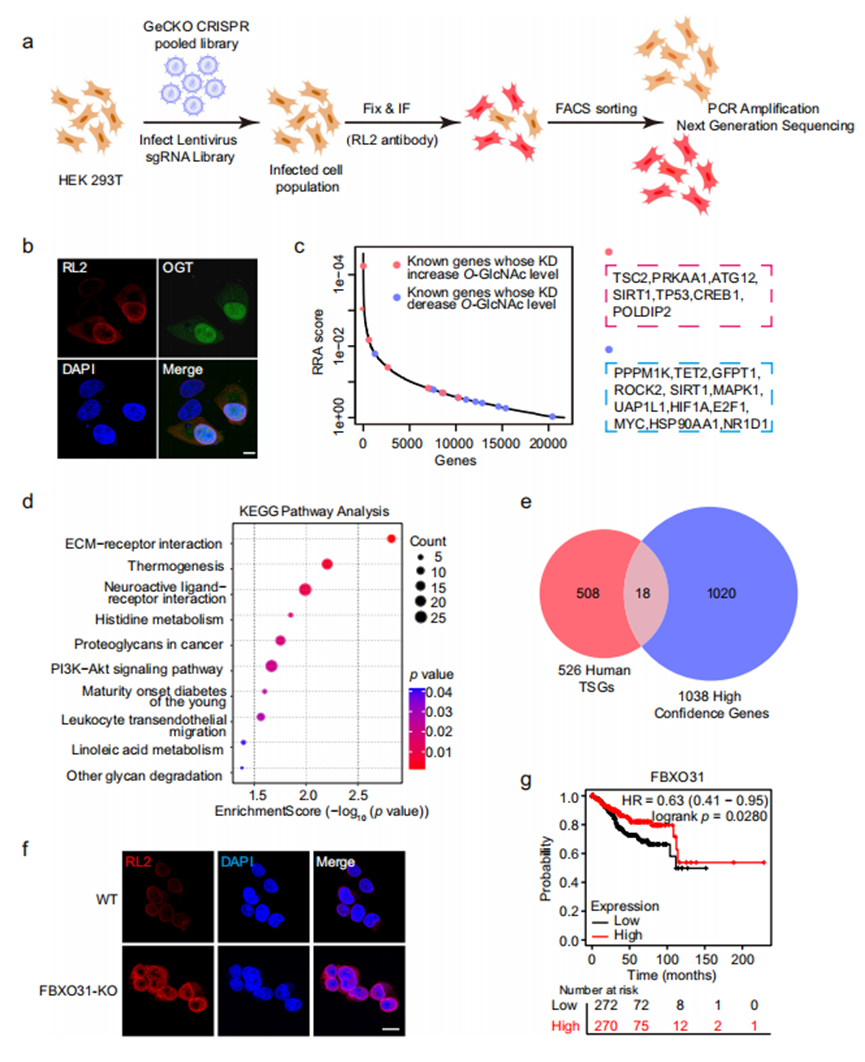
图5.全基因组筛选维持O-GlcNAc糖基化稳态的肿瘤抑制因子
6.FBXO31通过结合并泛素化OGT限制O-GlcNAc糖基化水平
FBXO31作为SCF泛素E3连接酶复合物的底物识别组分,可调控多种蛋白的降解(参考文献74-79)。据此我们推测,FBXO31可能通过直接结合并泛素化O-GlcNAc转移酶OGT来调控O-GlcNAc糖基化水平。为验证FBXO31与OGT的相互作用,我们首先采用细菌纯化的GST-OGT蛋白与表达GFP-FBXO31的293T细胞裂解液进行pull-down实验。Western blot结果显示,相较于GST对照,GST-OGT能显著下拉GFP-FBXO31(图6a)。进一步在过表达Flag-OGT和GFP-FBXO31的293T细胞中进行免疫共沉淀实验,发现GFP-FBXO31可与Flag-OGT共沉淀,且当加入蛋白酶体抑制剂MG132后,免疫沉淀物中Flag-OGT和GFP-FBXO31的含量均显著增加(图6b)。
为评估FBXO31与OGT的相互作用是否调控OGT蛋白稳态,我们在293T细胞中转染梯度浓度的GFP-FBXO31质粒,通过Western blot检测OGT及O-GlcNAc糖基化水平。结果显示,OGT蛋白量与细胞O-GlcNAc糖基化水平均与GFP-FBXO31表达量呈负相关(图6c)。值得注意的是,蛋白酶体抑制剂MG132可显著逆转GFP-FBXO31过表达导致的OGT下调,表明FBXO31通过泛素-蛋白酶体降解途径调控OGT水平(图6d)。
为证实FBXO31能否诱导OGT泛素化,我们在过表达GFP-FBXO31和HA-泛素的293T细胞裂解液中免疫沉淀OGT,Western blot检测到GFP-FBXO31存在时OGT呈现强烈多聚泛素化信号(图6e)。进一步通过体外实验验证:从表达HA标记的Skp1、Cul1和Roc1(含或不含FBXO31)的293T细胞中,用HA磁珠亲和纯化SCF复合物,与细菌纯化的E1、E2、泛素及His-OGT共孵育。结果显示含FBXO31的SCF复合物可直接催化His-OGT发生多聚泛素化(图6f)。鉴于SCF复合物中Skp1通过F-box结构域招募F-box蛋白,我们构建了FBXO31的F-box缺失突变体(FBXO31ΔF)。在293T细胞中,GFP-FBXO31与HA-泛素共表达可诱导免疫沉淀的Flag-OGT发生显著多聚泛素化,而GFP-FBXO31ΔF突变体则显著削弱该效应(图6g),证实FBXO31需依赖完整SCF复合物发挥E3泛素连接酶活性。
在FBXO31-KO的293T细胞中,OGT蛋白及O-GlcNAc糖基化水平均显著升高(图6h)。蛋白质合成抑制剂CHX处理实验显示,FBXO31缺失使OGT半衰期明显延长(图6i),表明FBXO31通过调控OGT降解维持其细胞内稳态。
为验证该调控机制在子宫内膜癌细胞中的普适性,我们在Ishikawa细胞中过表达GFP-FBXO31。免疫荧光显示GFP-FBXO31阳性细胞中OGT及RL2检测的O-GlcNAc信号均显著降低。CRISPR构建的FBXO31-KO Ishikawa细胞中,OGT与O-GlcNAc水平明显上调。虽然内源性FBXO31与OGT相互作用较弱,但外源过表达的GFP-FBXO31与Flag-OGT在Ishikawa细胞中可明确共沉淀。在过表达GFP-FBXO31和HA-泛素的Ishikawa细胞中,免疫沉淀OGT检测到显著的多聚泛素化信号,证实FBXO31在子宫内膜癌细胞中同样通过泛素-蛋白酶体途径调控OGT。
已知O-GlcNAc糖基化可通过稳定YAP、β-catenin和c-Myc等蛋白促进肿瘤进展。在野生型与FBXO31-KO Ishikawa细胞中,虽然YAP和β-catenin变化不明显,但c-Myc水平显著升高且该效应依赖OGT——敲低OGT可使c-Myc恢复至野生型水平。免疫沉淀实验证实c-Myc在子宫内膜癌细胞中存在O-GlcNAc修饰,且FBXO31缺失细胞中O-GlcNAc修饰的c-Myc显著增加。这些结果揭示c-Myc是FBXO31-OGT调控轴下游的关键效应分子,其O-GlcNAc修饰促进子宫内膜癌进展。
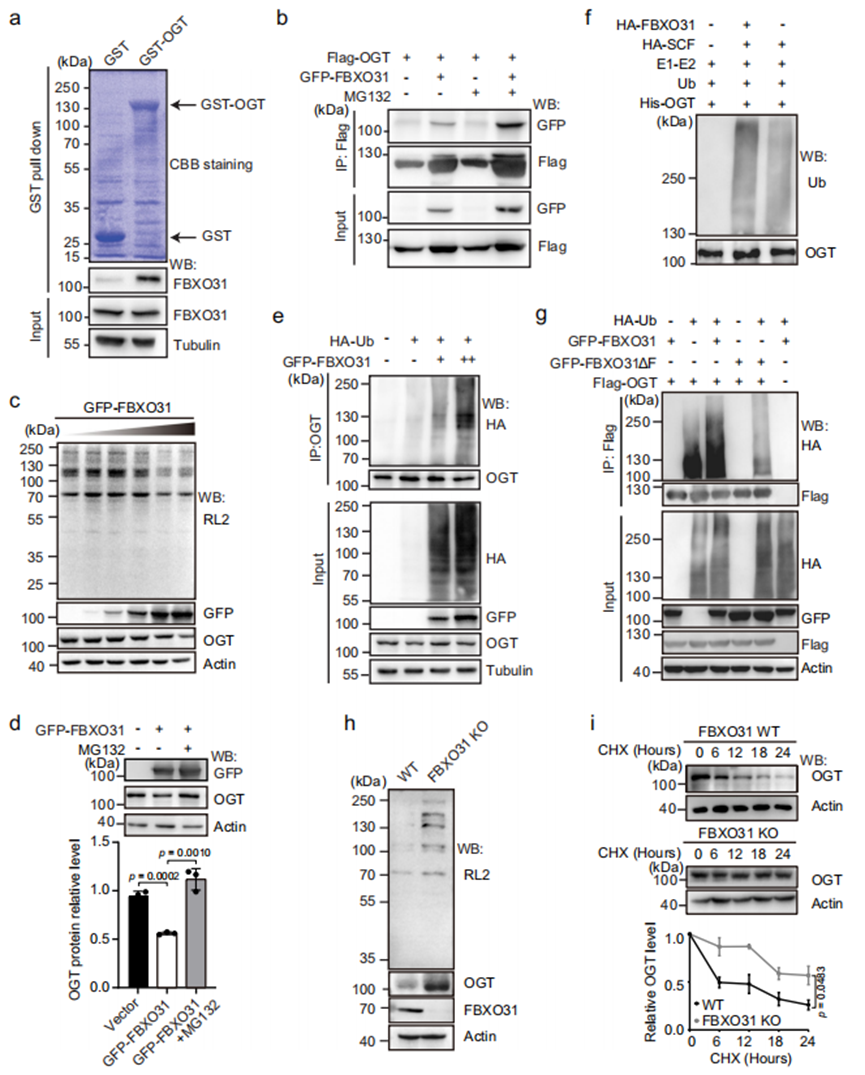
图6 FBXO31通过结合并泛素化OGT限制O-GlcNAc糖基化水平
7.FBXO31缺失通过增加O-GlcNAc糖基化促进子宫内膜类器官生长
为探究FBXO31调控O-GlcNAc糖基化稳态的临床意义,我们利用子宫内膜癌队列组织标本进行分析。免疫组化(IHC)显示,相较于正常子宫内膜组织,EC组织中FBXO31蛋白水平显著下调,且常与O-GlcNAc糖基化水平呈负相关模式(图7a, b)。基于IHC信号半定量分析发现,低O-GlcNAc糖基化EC组的FBXO31蛋白水平明显高于高O-GlcNAc糖基化组(图7c)。进一步分析TCGA UCEC队列中虚拟O-GlcNAc指数与FBXO31表达水平的关系,观察到显著负相关性(图7d)。Western blot结果显示,与正常子宫内膜类器官(EE-Os)相比,EC类器官(EC-Os)中FBXO31蛋白水平降低伴随OGT水平升高(图7e),提示EC组织中O-GlcNAc糖基化升高源于OGT上调。将EC队列病例分为FBXO31低表达组与高表达组,发现FBXO31表达与O-GlcNAc糖基化状态及组织学分级显著相关(附表3)。
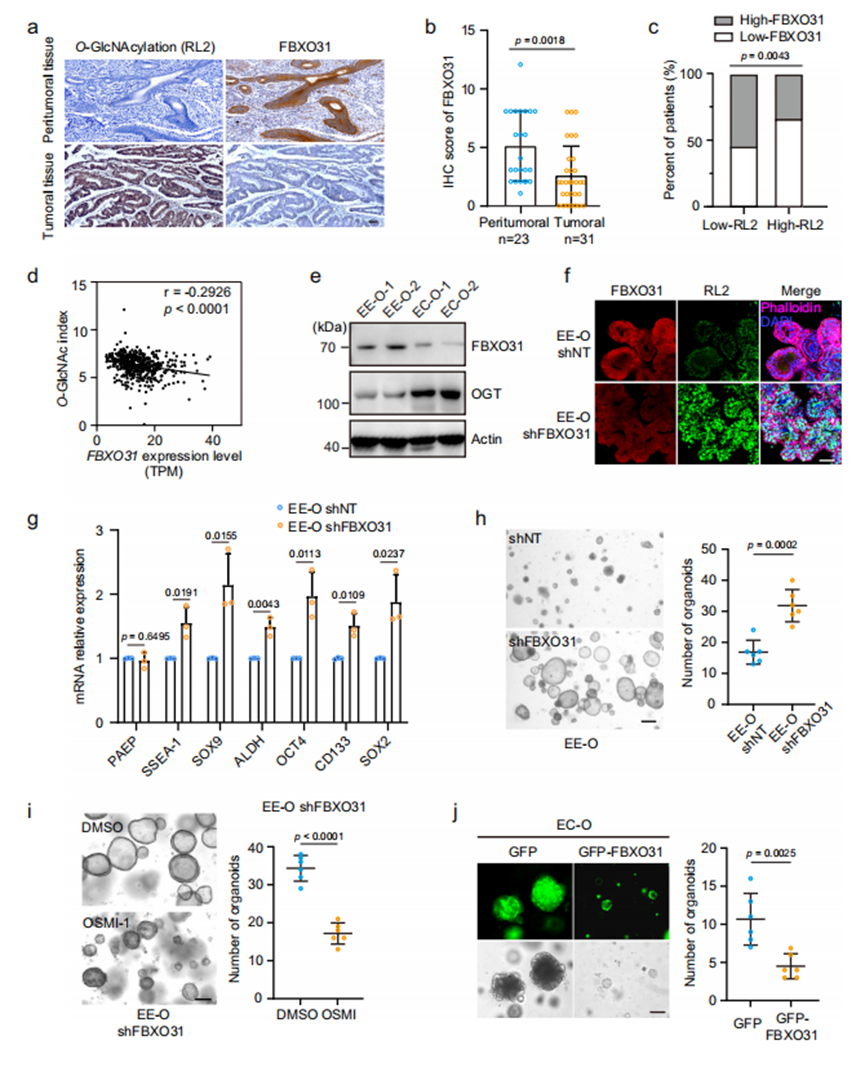
图7 FBXO31缺失通过增加O-GlcNAc糖基化促进子宫内膜类器官生长
8.OGT化学抑制抑制小鼠模型子宫内膜肿瘤生长
体外实验证实O-GlcNAc糖基化对子宫内膜癌细胞的影响后,我们推测靶向OGT降低O-GlcNAc水平可能成为潜在治疗策略。为此,我们在Ishikawa细胞异种移植小鼠模型中评估了OGT抑制剂OSMI-1的抗肿瘤效果。皮下移植Ishikawa细胞10天后,将荷瘤小鼠随机分为三组,分别通过腹腔注射给予DMSO(溶剂对照)、TMG(20 mg/kg/天)或OSMI-1(10 mg/kg/天)(图8a)。与对照组相比,TMG处理促进肿瘤生长并缩短生存期,而OSMI-1处理显著减小肿瘤体积并延长生存时间(图8b, c)。对切除肿瘤组织的免疫组化分析显示,OSMI-1组O-GlcNAc糖基化水平较TMG组或DMSO对照组明显降低(图8d)。一致性分析表明,OSMI-1处理后肿瘤组织中分化标志物PAEP表达升高,同时多种干性基因表达轻度下调;而TMG处理则导致PAEP表达下降与干性标志物上调。
为探究FBXO31缺失是否促进子宫内膜癌(EC)小鼠模型中的肿瘤形成并增强对OSMI-1治疗的敏感性,我们将野生型(WT)与FBXO31敲除(FBXO31-KO)的Ishikawa细胞皮下接种于裸鼠。移植10天后,将荷瘤小鼠随机分组,通过腹腔注射给予DMSO(溶剂对照)或OSMI-1(10 mg/kg/天)(图8e)。FBXO31-KO细胞形成的肿瘤生长速度显著快于WT组(图8f),且干性基因(SOX9、ALDH、OCT4、CD133和SOX2)表达上调。OSMI-1处理可降低两组肿瘤组织的O-GlcNAc糖基化水平,抑制干性基因表达,并显著延缓WT与FBXO31-KO组的肿瘤生长(图8f)。值得注意的是,FBXO31-KO肿瘤对OSMI-1治疗的敏感性较WT组更高(图8f, g)。此外,CD31免疫荧光染色显示FBXO31-KO肿瘤具有更丰富的血管网络(图8h),而OSMI-1处理能显著抑制其血管生成(图8i)。
综上,本研究证实FBXO31缺失通过增强肿瘤干性和血管生成促进EC体内成瘤,而抑制OGT降低O-GlcNAc糖基化可有效抑制此类肿瘤。这些发现表明,靶向EC中失调的O-GlcNAc糖基化稳态是一种具有临床转化潜力的治疗策略。
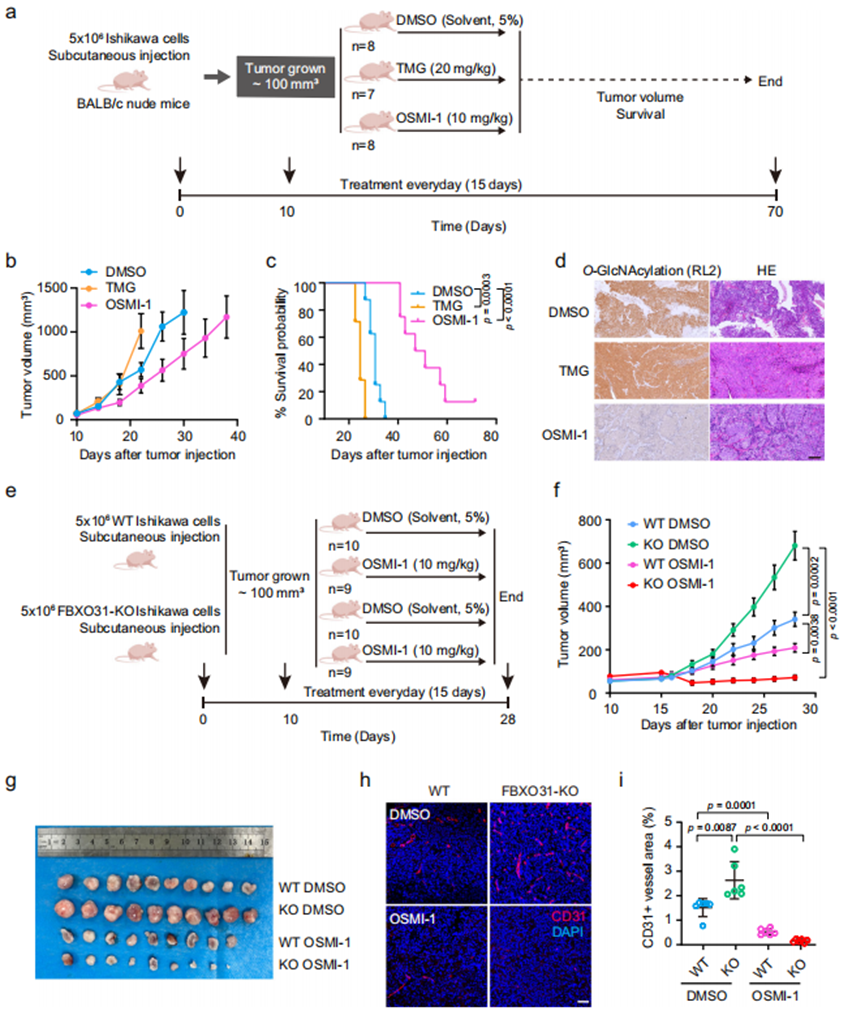
图8 OGT化学抑制抑制小鼠模型子宫内膜肿瘤生长
5.相关机制
本研究深入揭示了O-GlcNAc糖基化稳态与子宫内膜癌(EC)进展的分子关联,阐明了异常O-GlcNAc糖基化水平的临床意义,并首次在子宫内膜组织中鉴定出一个调控O-GlcNAc稳态的关键分子模块(图9)。
结论:
该研究揭示了FBXO31通过泛素化修饰O-GlcNAc转移酶OGT来调控O-GlcNAcylation稳态,并抑制子宫内膜恶性肿瘤的进展。研究发现,子宫内膜癌(EC)中O-GlcNAcylation水平与组织学分级呈正相关,且与不良预后相关。FBXO31的缺失会导致O-GlcNAcylation水平升高,促进肿瘤细胞增殖和干性特征。通过小鼠模型实验,研究还证实了靶向OGT的小分子抑制剂能够限制EC肿瘤的形成,表明靶向O-GlcNAcylation稳态是一种有潜力的治疗策略。
数据处理和分析、 虚拟O-GlcNAc指数计算、GSEA、RNA测序、基因表达谱分析、免疫组化、 免疫荧光分析、 Western blot、 免疫共沉淀、 体外泛素化实验、 CRISPR-Cas9基因编辑、 小分子抑制剂处理、单细胞RNA测序、细胞培养、 细胞增殖和活力检测、 细胞凋亡检测、 细胞分化检测、小鼠异种移植模型、 肿瘤生长和生存期观察、 肿瘤组织分析、组织芯片制作、 H&E染色、 TUNEL测定
参考文献:
Zhang N, Meng Y, Mao S, Ni H, Huang C, Shen L, Fu K, Lv L, Yu C, Meekrathok P, Kuang C, Chen F, Zhang Y, Yuan K. FBXO31-mediated ubiquitination of OGT maintains O-GlcNAcylation homeostasis to restrain endometrial malignancy. Nat Commun. 2025 Feb 2;16(1):1274.






