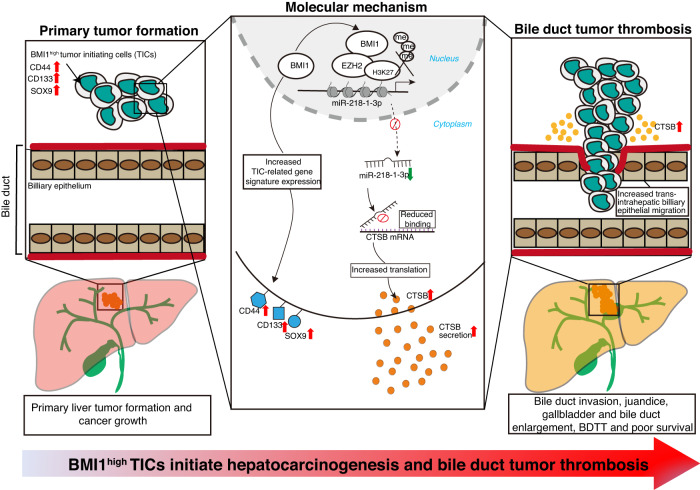
组织蛋白酶促进BMI1高表达肝癌细胞的侵袭驱动胆管癌血栓形成
胆管癌栓(BDTT)是一种可能发生于晚期肝细胞癌(HCC)患者的严重并发症,可导致生活质量迅速下降,并与较差的临床结局相关。然而,由于其细胞起源和发病机制不明,合并BDTT的HCC患者常被误诊误治。因此,开发一种有效的肝癌合并胆管癌栓的诊断和治疗方法是临床上的迫切要求。既往研究主要集中在探索BDTT的HCC患者的临床病理或治疗措施,而对BDTT的发展过程知之甚少。根据初步的临床研究,有研究推测高度侵袭性的肿瘤细胞可能通过邻近胆管壁的上皮下侵袭,导致癌栓的形成。此外,他们注意到BMI1在有BDTT12的HCC患者中表达上调。BMI1在一系列细胞过程中发挥关键作用,包括干细胞自我更新、增殖和保存基因组稳定性。此外,它涉及多种癌症,包括血液系统恶性肿瘤和实体瘤,其过表达常与侵袭性肿瘤行为、肿瘤起始细胞(TICs)的存在和不良预后相关。miRNA是已知的小非编码分子,参与调节基因表达,其异常表达与TICs特征相关。然而,由于缺乏专门设计的BDTT动物模型,BMI1及其下游效应miRNA在BDTT中的潜在作用仍未被探索。溶酶体组织蛋白酶B(CTSB)是溶酶体半胱氨酸蛋白酶家族的一种成员,积极调节细胞外基质成分的蛋白水解、破坏细胞内通讯、降解基底膜和改变细胞-细胞之间的相互作用,因此在癌症进展中具有多重潜在作用。然而,BMI1是否通过表观遗传调控CTSB在TICs中的分泌从而通过miRNA调控BDTT的发育仍不清楚。该研究发表在《Nature Communications》,IF: 16.6。
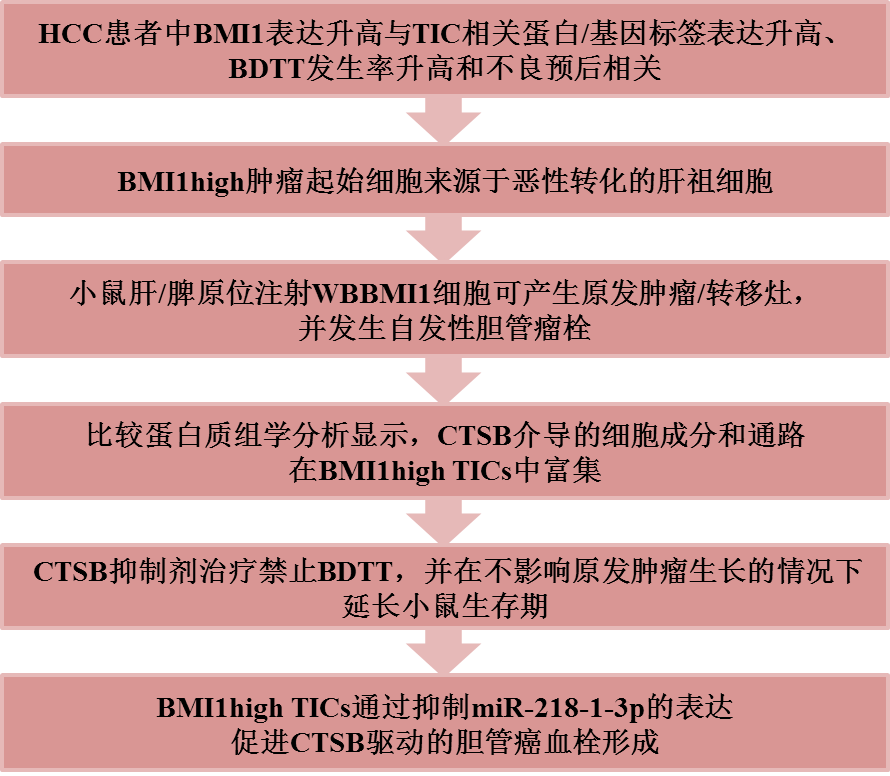
技术路线
主要研究结果
1. 在HCC患者中,BMI1表达升高与TIC相关蛋白/基因标签表达升高、BDTT发生率升高和不良预后相关
由于BMI1表达与HCC患者预后之间的关系尚未得到充分探索,因此研究者对来自癌症基因组图谱(TCGA)数据库的临床和RNA测序数据进行了生物信息学分析。此外,对收集的HCC患者队列进行了IHC检查,发现在HCC患者中,BMI1的高表达水平与较差的总生存期、增加的肿瘤大小和升高的癌症进展相关(图1a-c)。与之前的研究相比,研究者还收集了一个相对较大的有或无BDTT的HCC患者的样本队列,并使用他们对BMI1表达进行了IHC分析,结果表明有BDTT的患者与较差的总生存率相关(图1d),而BDTT和BMI1高表达的患者与较低的总生存率相关(图1e)。此外,研究者发现BMI1表达的升高区分了那些BDTT发生率增加的HCC患者(图1f)。
鉴于BMI1表达在控制TIC自我更新中的作用,进一步研究了HCC患者中TIC相关标签与BMI1蛋白和mRNA表达之间的关系。在肿瘤区域中,TIC相关蛋白标签和BMI1的表达呈正相关(图1g,h)。进一步的临床研究表明,在HCC患者中,TIC相关蛋白/基因标签的高表达与BDTT发病率的增加、较差的总生存率相关(图1i-k)。最后,研究者发现与低表达TIC相关蛋白/基因标签和BMI1的HCC患者相比,高表达TIC相关蛋白/基因标签和BMI1的HCC患者的总生存率较差(图1l,m)。综上所述,该研究揭示了BMI1与TIC相关标志物的表达之间的潜在关联,提示BMI1在BDTT的发生和HCC的癌症进展中发挥作用。这一发现促使研究者深入研究其在调节癌细胞特性中的功能。
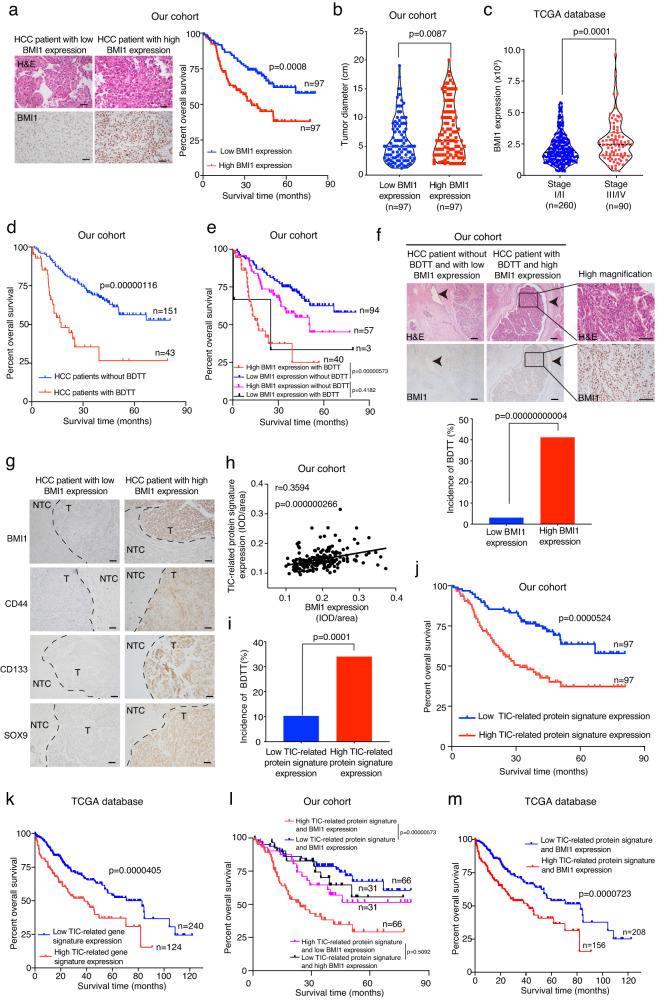
图1 在HCC中,BMI1高表达与TIC相关基因标签表达增强、BDTT发生率增加和总体生存率降低相关
2. BMI1high肿瘤起始细胞来源于恶性转化的肝祖细胞
为了检测BMI1在HCC发生中的细胞功能,研究者在大鼠LPC细胞系WBF344和人HCC细胞系中对BMI1的表达进行了遗传修饰(图2a,b)。研究者的结果表明,与对照细胞相比,BMI1过表达增加了WBBMI1和PLCBMI1细胞的细胞生长(图2c,d)、集落形成(图2e,f)、细胞迁移(图2g,h)和细胞侵袭(图2i,j)以及肿瘤球形成(图2k,l)。
为了确定稳定表达BMI1的细胞是否可以通过旁分泌效应调节其侵袭能力,研究者在transwell matrigel侵袭系统中,将WBCtrl或PLCCtrl细胞暴露于来自WBBMI1/WBCtrl细胞或PLCBMI1/PLCCtrl细胞的条件培养基(CM),表明与分别暴露于来自WBCtrl和PLCCtrl细胞的CM的细胞相比,暴露于来自WBBMI1/PLCBMI1细胞的CM增加了WBCtrl和PLCCtrl细胞的侵袭(图2m-o)。接下来,研究者通过向裸鼠皮下注射少量WBBMI1或WBCtrl细胞来检测它们在体内的成瘤性,表明注射5000个WBBMI1细胞足以在裸鼠体内形成皮下肿瘤,并且100%有效。相反,WBCtrl细胞未能产生任何可触及的肿瘤(图2p,q)。总体而言,这些发现表明,BMI1的过表达可诱导LPC恶性转化为BMI1high TICs,称为WBBMI1。
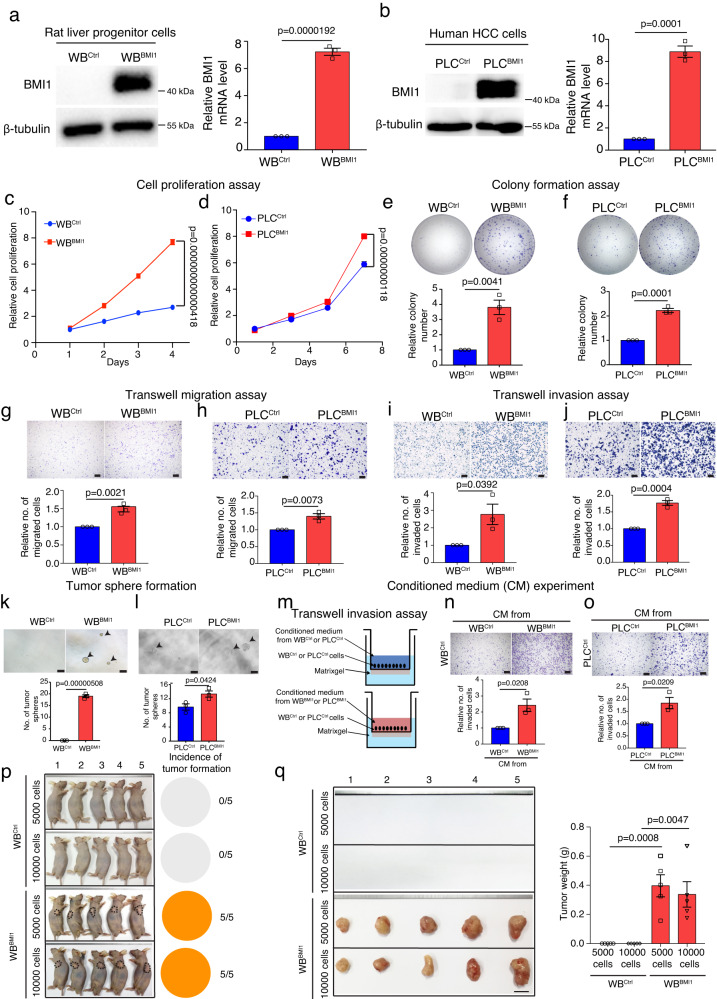
图2 过表达BMI1可自发地将肝祖细胞转化为肿瘤起始细胞
3. 小鼠肝/脾原位注射WBBMI1细胞可产生原发肿瘤/转移灶,并发生自发性胆管瘤栓
为了检查BMI1high TICs是否可以启动原位肿瘤形成和BDTT,研究者在裸鼠中将WBBMI1细胞原位植入肝脏的Glisson包膜(图3a),表明40%植入WBBMI1细胞的小鼠在注射后4周出现黄疸(图3b)。黄疸的出现是合并BDTT2的HCC患者的临床表现之一。磁共振成像显示,将WBBMI1细胞原位植入裸鼠肝脏Glisson包膜后4周内产生了肝脏肿瘤。而WBCtrl移植细胞未能形成任何肿瘤(图3c)。研究者还表明,WBBMI1植入细胞以100%的发生率产生了原发性肝脏肿瘤,而40%的WBBMI1荷瘤小鼠出现了胆囊和胆管增大(图3d)。相比之下,WBCtrl植入小鼠均未显示任何这些表型(图3c,d)。对肿瘤连续切片的进一步组织病理学研究表明,在黄疸的WBBMI1原位肿瘤荷瘤小鼠中存在胆管癌栓,但在植入WBCtrl细胞的小鼠中未见胆管癌栓(图3e)。重要的是,研究者证明了瘤栓是由原发肿瘤部位的WBBMI1细胞侵袭胆管腔引起的(图3e)。由于细胞角蛋白7(CK7)和细胞角蛋白19(CK19)一般表达于胆管上皮,因此研究者在WBCtrl或WBBMI1细胞移植的小鼠的肝组织/肿瘤切片中进行了CK7和CK9的IHC染色,表明在WBBMI1移植的黄疸小鼠的癌栓表面存在CK7和CK19阳性的胆管上皮碎片(图3e)。
为了进一步证实研究者的观察结果,研究者在裸鼠中进行了脾内注射WBCtrl/WBBMI1细胞(图3f),表明注射WBBMI1细胞的小鼠中约有17%在注射后4周出现黄疸,并且血清胆红素水平升高(图3g)。研究者的数据显示,WBBMI1细胞脾内种植形成原发性脾肿瘤的发生率为100%(图3h),而67%的小鼠形成肝转移,约17%的WBBMI1种植小鼠出现胆囊和胆管增大(图3h)。再次,肿瘤连续切片的组织病理学研究显示,在仅黄疸的WBBMI1移植小鼠中存在BDTT,同时还表明,癌栓源于肝转移灶WBBMI1细胞侵袭胆管腔(图3i)。随后对这些组织切片中CK7和CK19表达的IHC分析支持了这一观察结果(图3i)。相比之下,WBCtrl移植小鼠没有发生原发性脾肿瘤和肝转移以及BDTT(图3h,i)。总体而言,研究者的数据表明,原位肝/脾移植BMI1high TICs可以产生原发性肿瘤/肝转移,并诱导自发性BDTT。更重要的是,本研究建立了肝细胞癌胆管癌栓的临床前动物模型,为探索胆管癌栓的分子机制提供了机会。
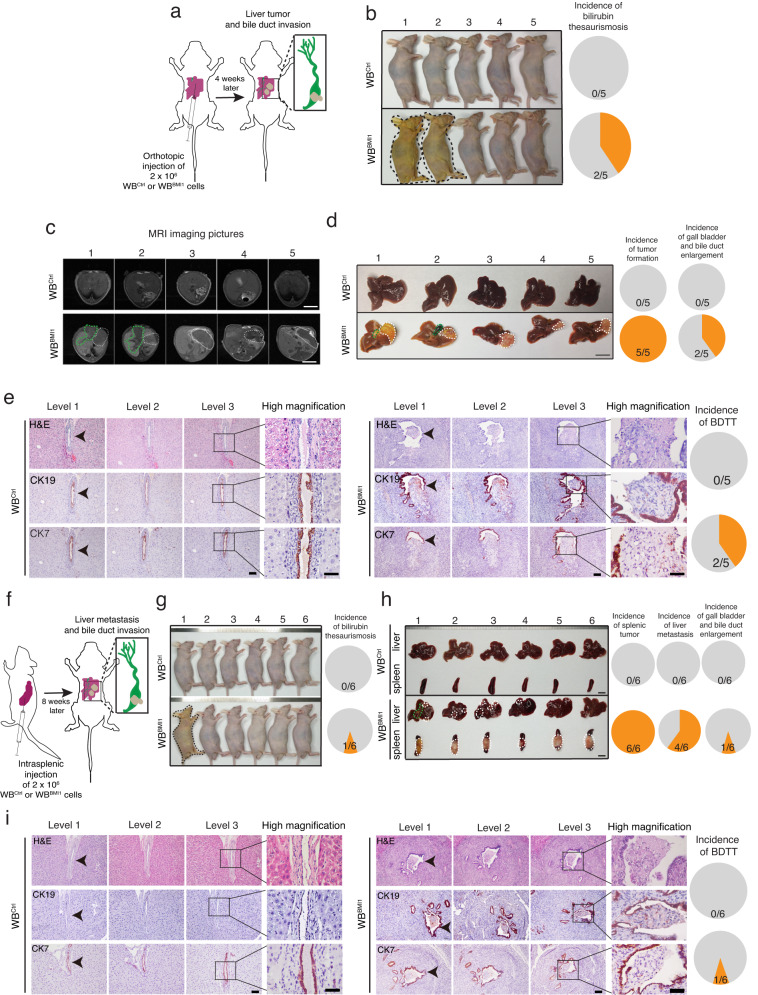
图3 WBBMI1细胞原位移植入小鼠肝脏/脾脏可形成原发性肝脏肿瘤/转移灶,并诱导自发性胆管瘤栓形成。
4. 比较蛋白质组学分析显示,CTSB介导的细胞成分和通路在BMI1high TICs中富集
接下来,研究者试图研究BMI1high TIC介导BDTT的分子机制。通过与WBCtrl和WBBMI1细胞进行比较蛋白质组学分析,与WBCtrl细胞相比,分泌因子CTSB在WBBMI1细胞中表达上调,而进一步的GO富集分析表明,在WBBMI1细胞中,CTSB相关的细胞成分和通路富集(图4a,b)。能够降解细胞外基质,并破坏细胞黏附和连接,从而刺激癌细胞侵袭。蛋白质印迹分析表明,与对照细胞相比,WBBMI1/PLCBMI1细胞中CTSB的表达在翻译水平上调,但在mRNA水平没有上调(图4c,d)。此外,ELISA和CTSB活性测定实验均表明,与来自WBCtrl或PLCCtrl细胞的CM相比,来自WBBMI1或PLCBMI1细胞的CM中CTSB的表达水平和酶活性显著增强(图4e-h)。在临床上,研究者的数据表明,在HCC患者中,CTSB表达升高与较差的总生存期和癌症进展增加相关(图4i,k),但其表达与肿瘤大小无关(图4l)。有趣的是,研究者还发现在HCC中,CTSB的高表达水平与BDTT的发生率增加相关(图4m,n)。重要的是,患BDTT的HCC患者血清CTSB水平上调(图4o)。此外,研究者发现在HCC患者中,BMI1和CTSB的高表达与较差的总生存期强相关(图4p),而它们的表达也呈正相关(图4q)。最后,研究者的数据显示,在HCC患者中,TIC相关蛋白标签和CTSB的高表达与较差的总生存期强相关(图4r),同时它们的表达呈正相关(图4s)。综上所述,该研究表明,CTSB可能作为BMI1介导的HCC进展的下游效应分子,为HCC合并BDTT患者提供了一个有价值的血清标志物的前景。
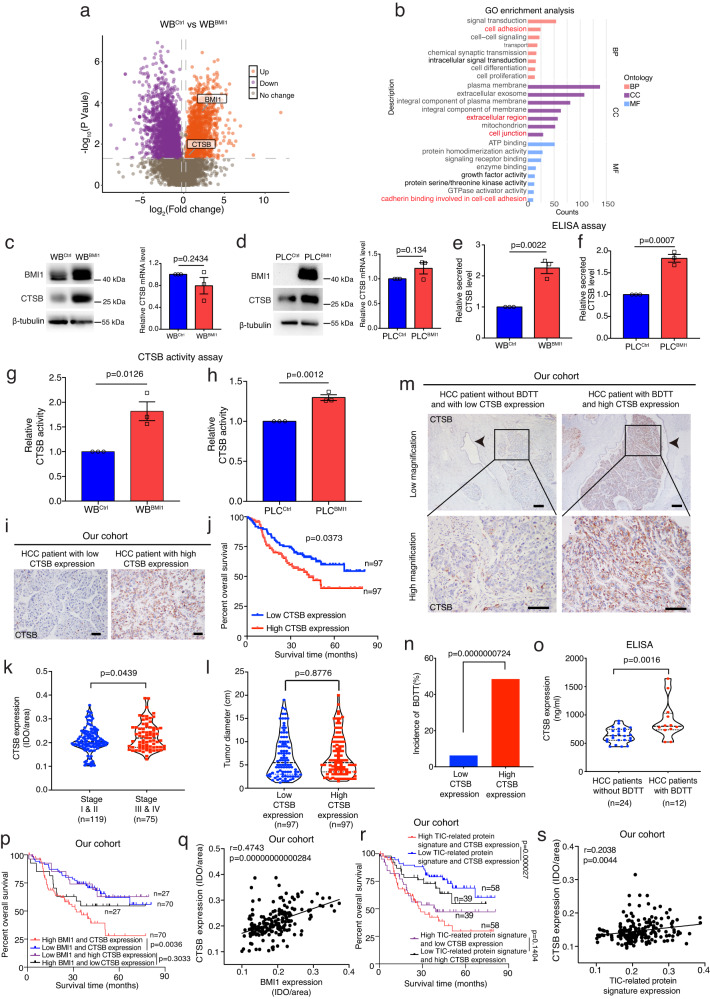
图4 比较蛋白质组学分析揭示了BMI1high TICs中CTSB依赖的细胞成分和通路的富集
5. CTSB抑制剂治疗禁止BDTT,并在不影响原发肿瘤生长的情况下延长小鼠生存期
为了确定CTSB在BMI1介导的癌细胞特性中的作用,研究者对WBBMI1/PLCBMI和BMI1敲除的MHCC97H细胞中的CTSB表达进行了遗传修饰。与非沉默对照siRNA(siNSC)转染/安慰剂处理的细胞相比,通过siRNA或CTSB抑制剂CA-074敲除CTSB降低了WBBMI1和PLCBMI1细胞的侵袭能力(图5a-d)。此外,与使用siNSC转染的WBBMI1/PLCBMI1细胞的CM处理的细胞相比,使用来自CTSB敲除的WBBMI1/PLCBMI1细胞的CM处理的细胞相比,使用来自CTSB敲除的WBBMI1/PLCBMI1细胞的CM处理的细胞降低了其侵袭性(图5e,f)。接下来,研究者创建了体外跨肝内胆管上皮迁移模型,将HCC细胞置于单层的人肝内胆管上皮细胞上,在transwell小室的上室中,transwell小室涂有Matrigel基质,下室装载DMEM + 20%胎牛血清(图5g)。值得注意的是,研究者的数据表明,BMI1过表达增强了人PLC细胞的跨肝内胆管上皮迁移,而通过siRNA或抑制剂去除CTSB降低了PLCBMI1细胞中观察到的增强的跨肝内胆管上皮迁移能力(图5h,i)。此外,与scramble转染细胞相比,在MHCC97H细胞中去除BMI1降低了其跨肝内胆管上皮迁移能力(图5j)。
为了进一步验证体内观察结果,研究者将WBBMI1细胞注射到裸鼠皮下,然后用安慰剂或CTSB抑制剂CA-074处理裸鼠。正如预期,CA-074治疗对WBBMI1皮下肿瘤的生长没有影响(图5k,1)。相反,与安慰剂治疗的小鼠相比,在WBBMI1原位荷瘤小鼠中,CA-074降低了黄疸、胆红素水平升高、胆囊和胆管增大或BDTT的发生率(图5m-o),而在这些小鼠中,它不影响肿瘤的形成和原发肿瘤的生长(图5n-p)。最后,与安慰剂治疗组相比,CTSB抑制剂治疗延长了WBBMI1原位荷瘤小鼠的生存期(图5q)。综上所述,这些发现表明CTSB在BMI1依赖的胆管癌栓中发挥重要作用,并确定了肝癌合并胆管癌栓患者的潜在治疗靶点。
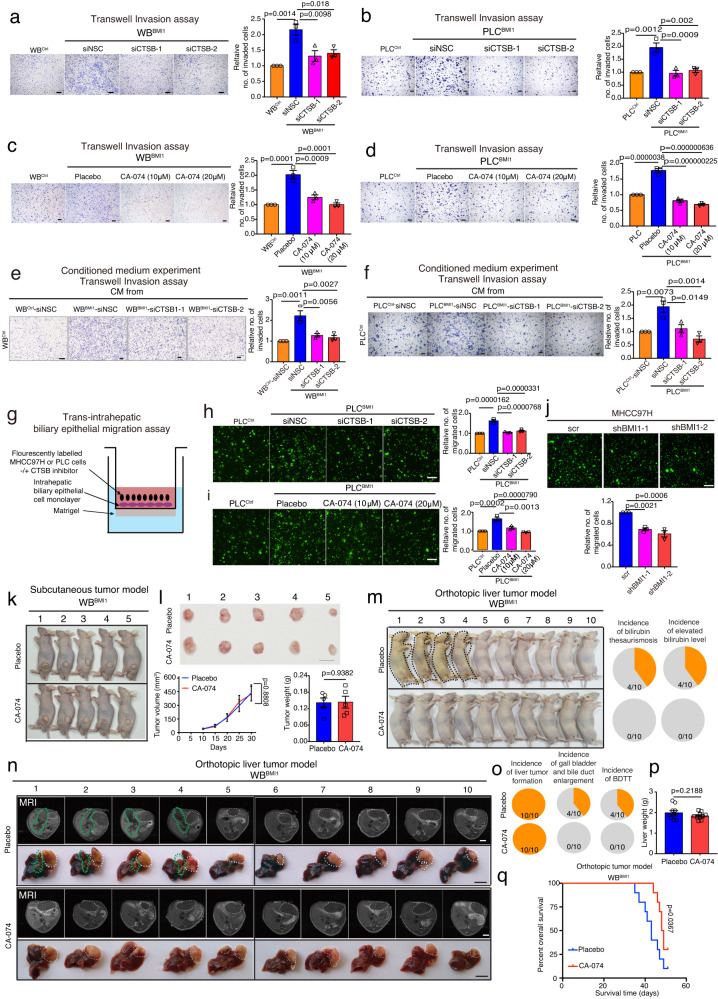
图5 CTSB抑制剂治疗可抑制WBBMI1荷瘤小鼠的胆管肿瘤血栓形成,与原发肿瘤生长无关
6. BMI1high TICs通过抑制miR-218-1-3p的表达促进CTSB驱动的胆管癌血栓形成
目前的研究数据表明BMI1在蛋白水平上调节CTSB的表达。研究者使用三种不同的在线搜索工具,使用CTSB mRNA序列预测其调控miRNA,而维恩图分析表明,这些预测的miRNA中有41个被所有这些工具共同识别(图6a)。接下来,研究者在BMI1基因修饰的肝癌细胞中对这些miRNA进行了RT-PCR定量。特别是,与对照细胞相比,miR-218-1-3p在BMI1稳定表达的PLC细胞中表达下调,而在BMI1敲除的MHCC97H细胞中表达显著增加(图6b)。维恩图分析表明,miR-218-1-3p是only与BMI1表达相关的miRNA(图6c)。接下来,研究者使用之前发表的PRE序列分析了miR-218-1-3p的启动子,表明其启动子包含2个假定的PRE位点(图6d),而染色质免疫沉淀分析表明,与PLCCtrl细胞相比,PLCBMI1细胞中BMI1和三甲基化H3K27在这两个PRE位点上的结合增加(图6e)。BMI1可能与组蛋白甲基转移酶EZH2协同作用,通过重塑染色质结构抑制miR-213-1-3p的表达。为了研究miR-218-1-3p对CTSB表达的调控作用,分别在WBBMI1, MHCC97H和PLCBMI1细胞中过表达miR-218-1-3p,结果显示与阴性对照模拟物转染细胞相比,在表达miR-218-1-3p的WBBMI1/MHCC97H细胞/PLCBMI1细胞中CTSB的表达降低(图6f,g)。这表明溶酶体CTSB是潜在的靶点之一,因为其CTSB的3'UTR区域携带保守的miR-218-1-3p种子匹配序列(图6h)。为了确定miR-218-1-3p是否与CTSB的3'UTR结合位点结合,将含有野生型或突变型CTSB 3'UTR结合位点的荧光素酶报告载体与miR-218-1-3p模拟物或NC模拟物共转染MHCC97H和PLCBMI1细胞。值得注意的是,在转染了携带WT-CTSB 3'UTR结合位点序列的报告载体的MHCC97H和PLCBMI1细胞中,miR-218-1-3p过表达抑制了荧光素酶活性,而在转染了含有突变的CTSB 3'UTR结合位点序列的报告载体构建的细胞中,miR-218-1-3p不影响荧光素酶活性(图6i)。这些结果表明,BMI1和EZH2通过miR-218-1-3p协同调控CTSB的表达。
通过对HCC肿瘤切片进行miR-218-1-3p的荧光原位杂交实验,研究者发现在HCC肿瘤中,miR-218-1-3p的表达水平分别与BMI1/CTSB的表达呈负相关(图6j)。为了检测体内miR-218-1-3p表达在BDTT中的重要性,将miR-218-1-3p或NC模拟物稳定转染WBBMI1细胞的裸鼠肝脏原位注射到裸鼠肝脏中,表明与NC模拟物转染组相比,miR-219-1-3p过表达降低了WBBMI1种植小鼠的黄疸、胆红素升高、胆囊和胆管增大或BDTT的发生率,而不影响原发性肝脏肿瘤的生长(图6k-n)。
总之,该研究揭示了BMI1过表达将LPCs恶性转化为BMI1high TICs,而在小鼠原位肝移植中,这些细胞可以产生原发肿瘤和自发性BDTT。在机制上,BMI1通过PRC依赖的机制沉默miR-218-1-3p的表达,然后表观遗传上调BMI1high TICs中的CTSB分泌,从而促进其侵袭胆管形成BDTT。
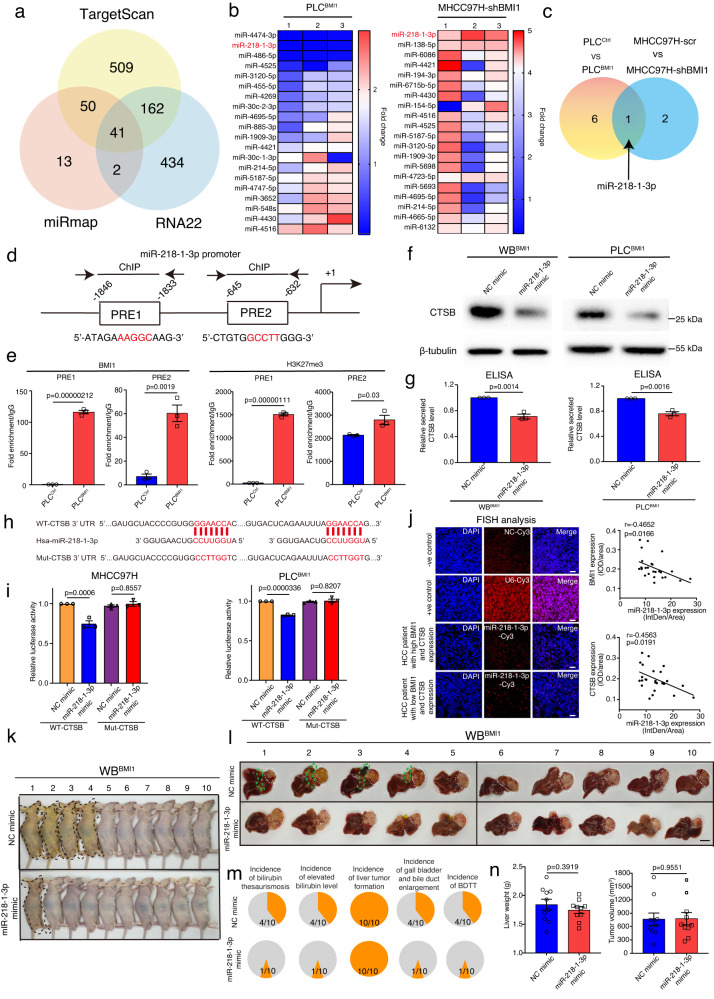
图6 BMI1通过抑制miR-218-1-3p的表达表观遗传上调CTSB的表达
结论
该研究结果解决了肝癌生物学领域中关于BDTT细胞起源和发病机制的谜题,表明BMI1high TICs诱导肝癌发生并经历CTSB驱动的胆管侵犯形成癌栓。更重要的是,该研究为HCC合并BDTT患者提供了潜在的诊断标志物和治疗途径,为未来的临床应用打开了大门。
机制图
实验方法
细胞培养和转染,体外肿瘤发生试验,蛋白质印迹,RT-PCR,免疫组化,免疫染色实验,荧光素酶报告基因检测,体内致瘤性测定,外科原位肝/脾癌模型,蛋白质组学分析,经肝内胆道上皮迁移试验,ELISA检测,CTSB活性测定法,染色质免疫沉淀实验,荧光原位杂交(FISH)实验
参考文献
Xu LB, Qin YF, Su L, Huang C, Xu Q, Zhang R, et al. Cathepsin-facilitated invasion of BMI1-high hepatocellular carcinoma cells drives bile duct tumor thrombi formation. Nat Commun. 2023 Nov 3;14(1):7033. doi: 10.1038/s41467-023-42930-y.






