NAT10/ac4C/FOXP1通过重编程宫颈癌的糖酵解代谢促进恶性进展并促进免疫抑制
在免疫检查点抑制剂(ICIs)(如抗-PD-1/PD-L1抗体)取得的突破性临床成果的推动下,免疫疗法近来已成为宫颈癌(CCa)的主要治疗方法。由NAT10催化的 N4-乙酰胞苷(ac4C)修饰是癌症中mRNA的一种重要转录后修饰。然而,它对CCa中免疫失调和肿瘤免疫疗法反应的影响仍然是个谜。在本研究中,初步观察到NAT10在CCa组织中的表达明显增加,这在临床上与不良预后有关。随后研究发现,HOXC8 通过与其启动子结合激活了NAT10,从而刺激FOXP1 mRNA的ac4C 修饰并提高其翻译效率,最终导致诱导GLUT4和KHK的表达。此外,NAT10/ac4C/FOXP1轴活性导致糖酵解增加,CCa 细胞的乳酸分泌持续增加。富含乳酸的肿瘤微环境(TME)进一步增强了肿瘤浸润调节性T细胞(Tregs)的免疫抑制特性。令人印象深刻的是,NAT10敲除增强了PD-L1阻断剂介导的体内肿瘤消退效果。综上所述,研究结果揭示了NAT10在启动癌细胞糖酵解和免疫抑制之间的串联过程中的致癌作用,它可以成为CCa中PD-1/PD-L1阻断协同免疫疗法的靶点。本文于2023年10月发表于《Advanced Science》,IF=15.1。
技术路线

实验结果
1. NAT10在CCa中发挥潜在的致癌作用
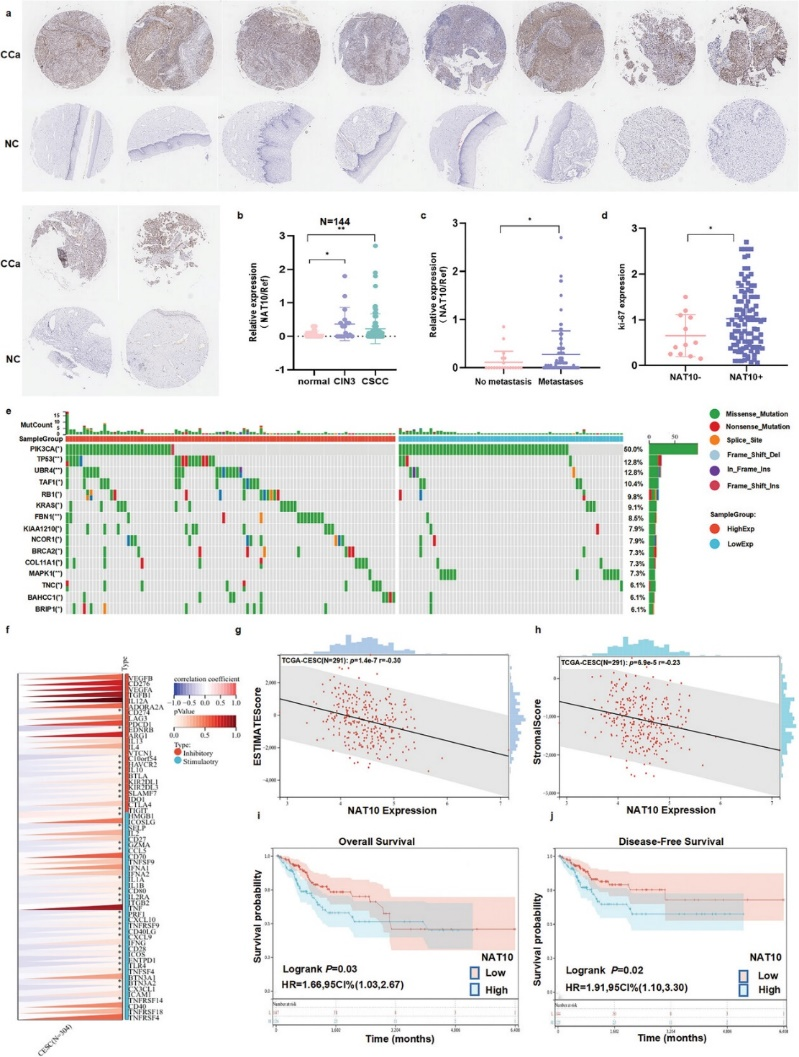
首先,作者根据病理诊断结果,分析了由17例宫颈上皮内瘤变患者样本、95例CCa患者样本和32例对照组样本组成的TMA,从而验证了计算机结果。重要的是,作者的研究结果证实了NAT10蛋白在CCa标本中的表达上调(图1a),而且这种异常上调与CCa患者较差的临床病理特征有关,如肿瘤分期高(P<0.05)(图1b)和淋巴结转移(P<0.05)(图1c)。此外,NAT10表达的增加与Ki-67表达的增加呈正相关(P<0.05)(图1d),Ki-67是癌细胞增殖和预后不良的标志物。
为了描述NAT10高表达的CCa患者的突变情况,根据NAT10表达的中位水平分层比较了NAT10高表达组和NAT10低表达组的突变情况(插入/缺失/单核苷酸变异)。为了进行这项分析,研究人员使用卡方检验分析了通过SangerBox从TCGA数据库下载的CCa患者数据。结果显示,在NAT10表达上调的CCa组织中,TP53、UBR4、KRAS和FBN1等关键基因的突变率明显高于NAT10低表达的CCa组织(图1e)。显然,NAT10在CCa中的表达与关键的免疫检查点通路密切相关。ESTIMATE分析进一步表明,NAT10上调与CCa较低的ESTIMATE评分和基质评分相关,这表明NAT10在调节CCa肿瘤免疫中起着关键作用(图1f-h)。为了研究NAT10对无病生存期(DFS)和总生存期(OS)的影响,作者从TCGA数据库中检索了CCa患者的生存数据。Kaplan-Meier生存分析显示,NAT10的高表达与CCa患者的OS呈弱相关(P = 0.03),并与DFS缩短有关(P = 0.02)(图1i,j)。
2. 转录因子(TF)HOXC8激活CCa中NAT10的转录
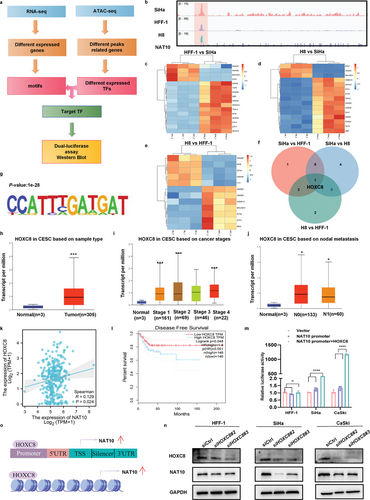
为阐明CCa中NAT10上调的机制,作者通过整合ATAC-seq和RNA-seq数据确定了相关的TF(图2a)。由于90%以上的CCa病例都是由于感染了高危HPV类型所致,作者利用集成基因组学浏览器(IGV)识别了NAT10转录起始位点(TSS)周围可访问染色质的信号,并旨在确定HFF-1(非癌对照)、H8(感染HPV16 E6和E7的非癌细胞)和SiHa(感染HPV16 E6和E7的CCa细胞)细胞中可访问染色质区域的候选TF(图2b)。通过利用HOMER算法从头发现基团,作者确定了32个 TF基团,并将重点缩小到SiHa细胞中富集的基团。从三个不同组中生成的RNA-seq 热图显示了几个可能调控NAT10表达的潜在TF(图2c-e)。通过重叠四个对比组中差异表达的TFs,HOXC8成为SiHa细胞中仅有的高表达TFs(图 2f,g)。此外,TCGA分析表明,HOXC8 mRNA在CCa中表达明显上调(P<0.05)(图2h),这与癌症分期和淋巴结转移呈正相关(P<0.05)(图2i,j)。值得注意的是,基因表达谱交互分析(GEPIA)显示,HOXC8 mRNA水平与CCa中NAT10的表达水平呈正相关(P<0.05)(图2k),而高水平的HOXC8 mRNA表达也与较短的DFS时间显著相关(P<0.05)(图2l)。
为了澄清这一关键TF对NAT10转录的影响,进行了双荧光素酶试验。共转染 HOXC8和NAT10启动子质粒可显著提高荧光素酶活性,萤火虫荧光素酶/肾荧光素酶比率证明了这一点,而在转染载体对照质粒或单独转染NAT10启动子质粒后,两种CCa细胞系的荧光素酶活性都有所下降(图2m)。与这些发现一致的是,Western 印迹结果表明,引入靶向HOXC8的特异性siRNA后,NAT10在CCa细胞中的表达明显受到抑制(图2n)。总之,这些数据有力地表明,HOXC8可通过与NAT10 启动子区域结合并促进其转录,从而增加NAT10在CCa细胞中的表达(图2o)。
3. NAT10基因敲除抑制体外和体内CCa细胞增殖、侵袭和转移
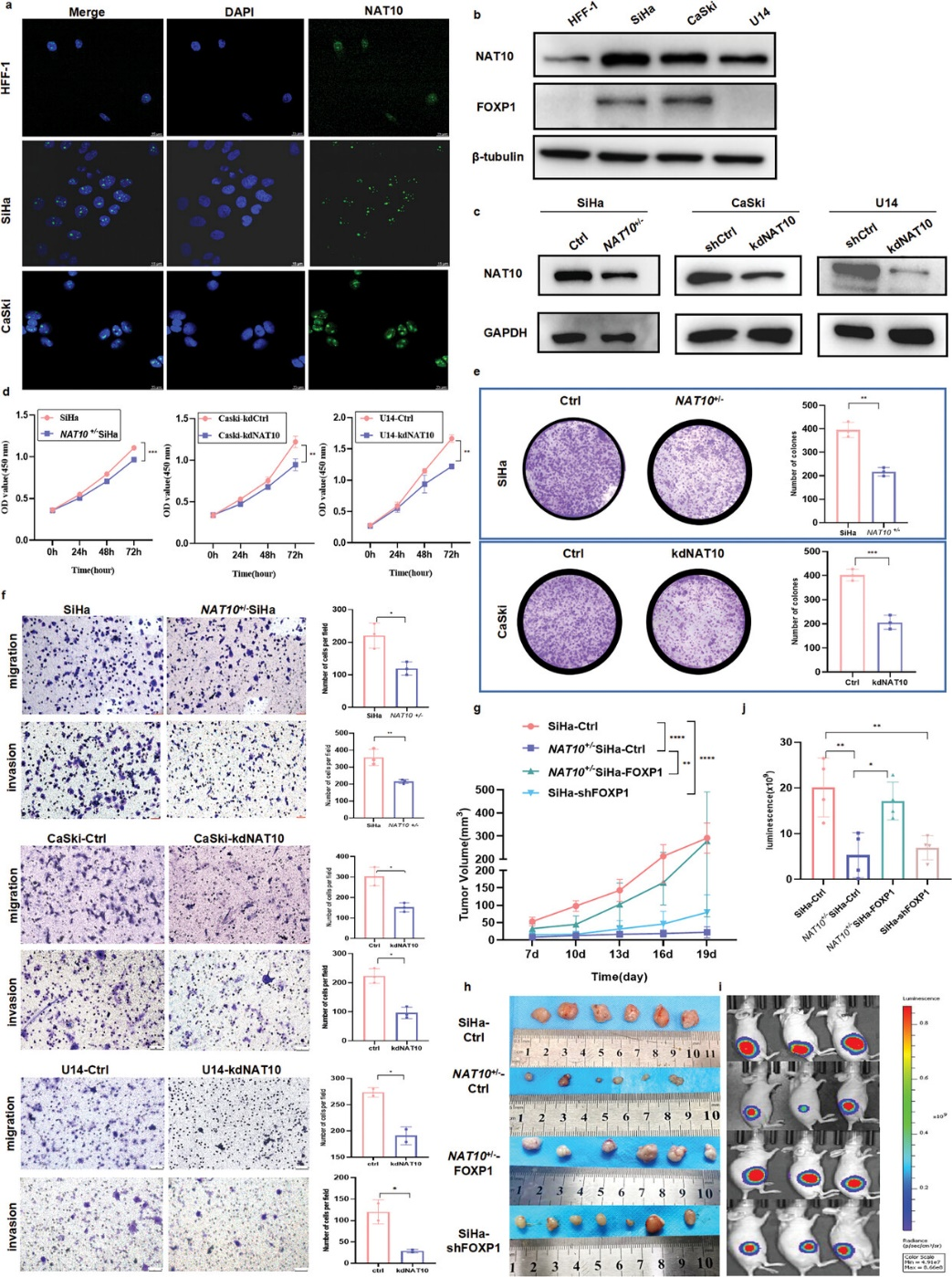
如图3a,b所示,CCa细胞中的NAT10水平明显高于HFF-1细胞。免疫荧光检测进一步表明,NAT10主要定位于细胞核内,没有核输出。为了阐明NAT10在CCa中的功能作用,作者利用CRISPR/Cas9基因编辑系统成功建立了稳定的NAT10杂合敲除细胞系(NAT10+/- SiHa),并采用sgRNA敲除了NAT10在CaSki和U14 CCa细胞中的表达(图3c)。如CCK-8试验所示,NAT10的耗竭或抑制会显著抑制细胞增殖(图3d),而集落形成试验则表明,体外敲除NAT10会大大削弱集落形成能力(图 3e)。此外,Transwell试验表明,抑制或敲除NAT10能有效抑制CCa细胞的迁移和侵袭(图3f)。
为了进一步确定体外NAT10诱导的CCa细胞增殖是否赋予了体内肿瘤生长能力,作者使用标记有萤火虫荧光素酶(-luc)的稳定沉默NAT10的SiHa细胞(NAT10+/- SiHa)建立了裸鼠皮下异种移植模型。在皮下注射SiHa或NAT10+/- SiHa细胞的小鼠中,下调NAT10能明显抑制肿瘤生长(图3g)。体内研究结束后,切除肿瘤,观察到NAT10基因敲除CCa肿瘤的生长率下降(图3h)。此外,通过活体动物成像检测到的荧光素酶信号强度每周显著增加也证明了肿瘤的持续生长(图3i,j)。这些观察结果证实,NAT10具有致癌作用,可促进CCa细胞增殖、侵袭和转移。
4. FOXP1是NAT10修饰ac4C的靶点,NAT10以ac4C依赖的方式增强其翻译效率
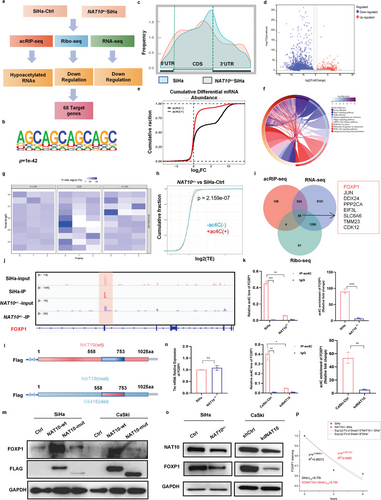
作者对野生型和NAT10+/- SiHa细胞进行了acRIP-seq、RNA-seq和Ribo-seq分析,以鉴定CCa细胞中ac4C修饰的转录本,并揭示ac4C修饰促进CCa进展的分子机制(图4a)。通过acRIP-seq分析,作者确定了808个ac4C峰,并利用MEME算法发现CXXCXXCXX主题在SiHa细胞中高度富集(图4b)。此外,与SiHa细胞相比,在NAT10低表达的细胞中,ac4C在编码区的分布从34.9%降至31.9%,在3′UTR 的分布从37.4% 增至45.5%(图4c)。此外,对因NAT10基因敲除而显著改变的 ac4C峰的注释和分析表明,在NAT10基因沉默的SiHa细胞中,mRNA的总体ac4C 水平显著下降(图4d,e)。此外,通过京都基因和基因组百科全书(KEGG)富集分析来分析差异表达基因(DEGs),结果显示差异表达基因在以下通路中显著富集:细胞粘附通路、癌症通路、PI3K-Akt 信号通路、mRNA 监控通路和HPV感染通路(图 4f)。这一发现表明,RNA的ac4C修饰可能参与了CCa发育的调控。
此外,作者使用Ribo-seq评估了核糖体保护读数所代表的每种mRNA的核糖体负载量(图4g)。Ribo-seq分析结果表明,由于翻译效率降低,ac4C 修饰水平降低导致转录下调(图4h)。耐人寻味的是,在68个mRNA中,FOXP1 mRNA在NAT10 下调后表现出最明显的变化,通过acRIP-seq、Ribo-seq和RNA-seq测定的转录本丰度分别降低了6.39倍、5.12倍和2.78倍(图4i)。因此,考虑到ac4C修饰在CCa中的作用,以及通过IGV软件可视化识别RNA上的ac4C修饰峰(图4j),作者推测FOXP1可能是NAT10在CCa细胞中的一个关键靶标。
为了验证FOXP1 mRNA是否是CCa细胞中ac4C修饰的直接靶标,进行了acRIP-qPCR试验。与对照细胞相比,去除了NAT10的CCa细胞中FOXP1 mRNA上的ac4C 水平显著降低(约10倍)(图4k)。此外,作者构建了含有野生型FLAG标记的NAT10(NAT10-wt)或N-乙酰转移酶修饰位点(del 558-753aa)突变的NAT10(NAT10-mut)序列的质粒(图4l)。引入NAT10-wt而非NAT10-mut会增加FOXP1的表达(图4m)。因此,这些结果共同表明,NAT10介导的ac4C修饰在CCa细胞中FOXP1 的上调过程中起着至关重要的作用。
然而,NAT10沉默导致CCa细胞中FOXP1蛋白水平显著下降,而不影响其mRNA水平(图4n,o)。因此,作者评估了CCa细胞中单个mRNA的稳定性,发现NAT10 基因敲除并没有显著影响FOXP1转录本的稳定性(图4p)。考虑到Ribo-seq的结果,这些数据共同表明,NAT10介导的ac4C修饰可能会调节FOXP1的翻译效率,而不是其mRNA的稳定性。
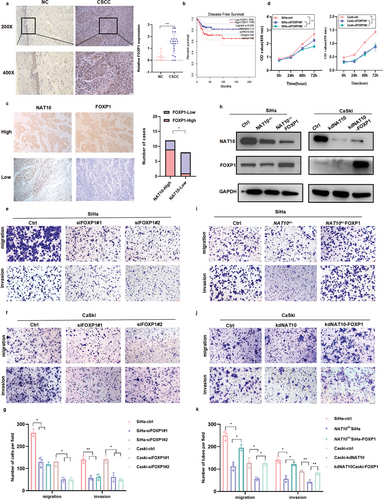
5. 过表达FOXP1可逆转NAT10缺乏对CCa细胞恶性表型的影响
由于FOXP1在CCa中的功能尚不明确,作者初步比较了20个CCa组织和20个正常宫颈上皮组织中的FOXP1蛋白水平,发现与正常组织相比,CCa组织中的FOXP1蛋白水平显著升高(P<0.01)(图5a)。通过GEPIA进行的Kaplan-Meier分析显示,FOXP1 mRNA表达增加的CCa患者的DFS预后较差(P = 0.039)(图5b)。最重要的是,FOXP1 的表达水平与CCa组织中NAT10的水平呈正相关(图5c)。此外,与HFF-1细胞相比,FOXP1在SiHa和CaSki细胞中表达过高,而在U14细胞中FOXP1表达较低(图3b)。敲除FOXP1显著抑制了CCa细胞的增殖(图5d)、迁移和侵袭(图5e-g)。
为了进一步验证FOXP1在NAT10介导的促进CCa进展中的作用,作者在敲除NAT10的SiHa和CaSki细胞上进行了过表达实验(图5h)。重要的是,迁移和侵袭实验结果表明,过表达FOXP1能有效恢复NAT10敲除的CCa细胞的迁移和侵袭能力(图5i-k)。此外,利用shFOXP1和NAT10+/- FOXP1 SiHa细胞建立了皮下肿瘤发生模型。与体内结果一致,该模型的结果证实,过表达FOXP1能减弱NAT10敲除对体内肿瘤生长的抑制作用(图3g-j),进一步强调了NAT10催化的ac4C修饰在 CCa肿瘤发生中的关键作用。总之,这些数据强调了FOXP1上调在CCa恶性进展中的致癌功能;因此,FOXP1上调可改善NAT10敲除在CCa细胞中的抑瘤效应。
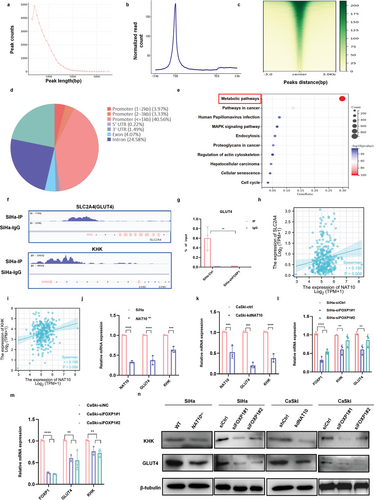
6. NAT10/ac4C/FOXP1轴通过靶向GLUT4和KHK促进糖酵解
CUT&Tag可生成高效的高分辨率测序文库,用于分析各种染色质成分,作者利用CUT&Tag确定了在SiHa细胞中观察到的几乎所有峰的覆盖范围都小于1000bp(图 6a),并且在整组位点,尤其是在TSS处显示出中等强度的信号(图6b)。此外,对所有峰的信号值进行了细致的计算,并生成了热图,表明信号强烈集中在富集位点附近(图6c),其中基因启动子区域(启动子≤1000 bp)的富集程度最高(图6d)。通过GO和KEGG分析鉴定FOXP1结合基因的细胞代谢过程(图6e),作者推测 FOXP1可能在葡萄糖代谢中起着关键的调控作用,这促使作者研究参与糖酵解代谢的关键酶。
有趣的是,CUT&Tag测序数据表明,FOXP1在参与糖酵解的GLUT4和KHK启动子中具有强大的富集作用(图6f),这在许多文献中都有广泛记载。此外,根据 GEPIA对TCGA数据集的分析,CCa中GLUT4的表达与FOXP1和NAT10的表达呈正相关,而KHK的表达与NAT10的表达呈正相关(图 6h,i)。此外,经qRT-PCR(图6j-m)和Western印迹(图6n)证实,删除NAT10或FOXP1会导致GLUT4和KHK在转录和翻译水平上的表达受抑制,这表明FOXP1会调节GLUT4和KHK的表达。
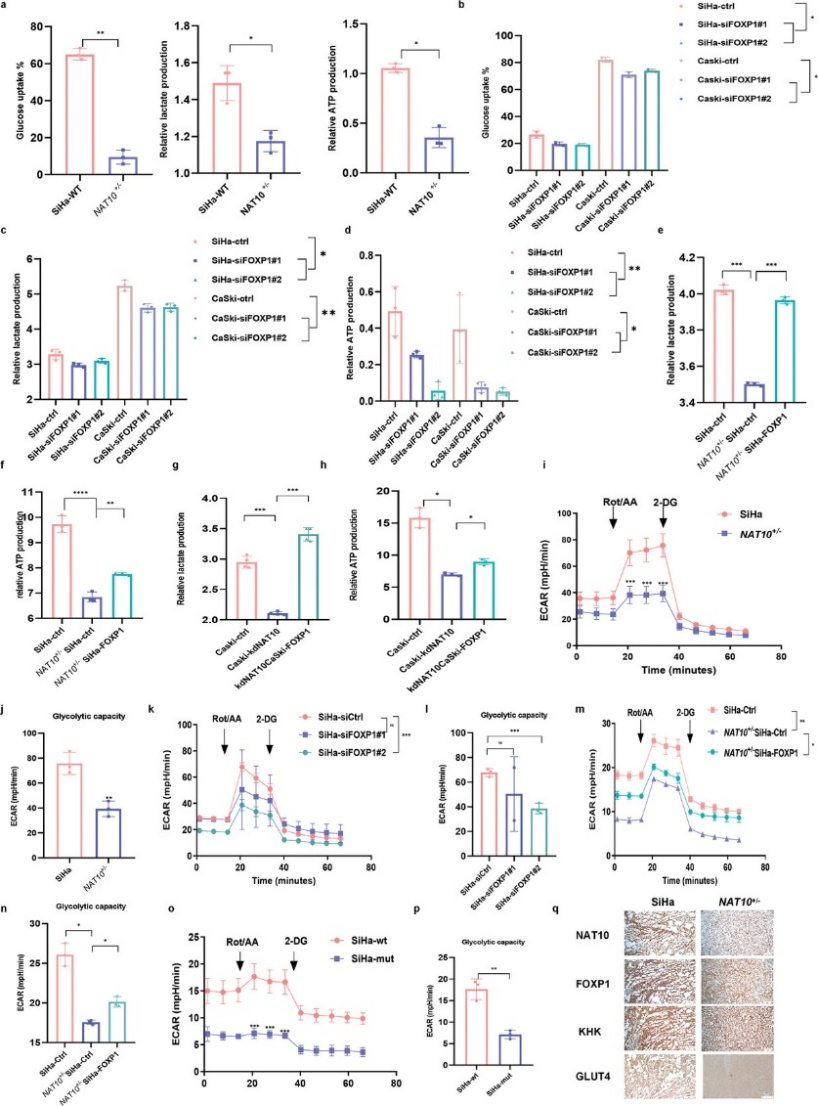
为了研究NAT10在调节糖酵解以促进CCa细胞恶性行为中的作用,作者通过测量细胞外酸化率(ECAR)、葡萄糖消耗、乳酸盐产生和ATP水平来评估糖酵解通量。如图7a所示,NAT10 缺失的CCa细胞表现出明显的葡萄糖消耗减少以及乳酸盐和 ATP 生成减少。与这些发现一致的是,沉默FOXP1也导致葡萄糖消耗、乳酸盐和ATP 生成减少(图7b-d),而在NAT10敲除背景下过表达FOXP1时,糖酵解能力得到恢复(图7e-h)。此外,ECAR 测量结果不仅验证了NAT10或FOXP1基因敲除后CCa 细胞中糖酵解能力的下降(图 7i-l),而且还表明过表达FOXP1可逆转这种效应(图 7m,n)然而,在转染NAT10突变体的CCa细胞中观察到的糖酵解代谢水平一直较低(图7o,p),这表明NAT10催化的ac4C修饰对促进CCa中的糖酵解有重要作用。此外,由缺乏NAT10的细胞建立的SiHa肿瘤异种移植显示NAT10、FOXP1、GLUT4 和KHK的染色显著降低(图7q)。总之,作者的研究结果表明,ac4C修饰诱导的FOXP1上调可激活CCa细胞中GLUT4和KHK的转录,从而增强糖酵解活性。
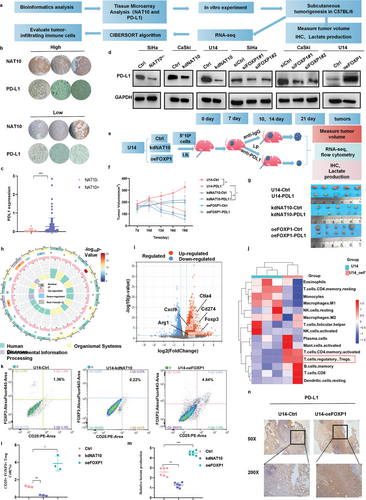
7. NAT10/ac4C/FOXP1轴活性增加高度糖酵解肿瘤中的Treg浸润
如上所述,作者的研究发现,NAT10和FOXP1的上调促进了CCa细胞的增殖、侵袭、迁移和糖酵解能力,这表明NAT10介导的FOXP1乙酰化可能是免疫逃避的关键(图8a),生物信息学分析也表明了这一点(图1g,h)。为了明确NAT10/ac4C/FOXP1轴与CCa中免疫抑制之间的关系(图8a),对TMA核进行了PD-L1免疫组化染色和统计分析,结果显示CCa患者中NAT10和PD-L1的表达呈正相关(图8b,c)。此外,作者还通过 Western 印迹进一步验证了CCa细胞中NAT10、FOXP1和PD-L1 之间的正相关性(图8d)。为了评估靶向 NAT10/ac4C/FOXP1 轴对体内肿瘤进展的影响,作者用U14-kdNAT10和U14-oeFOXP1细胞在C57BL/6小鼠体内建立了皮下肿瘤模型,然后在植入后第10天和第13天用抗PD-L1抗体(每天2.5 mg kg-1)治疗这些小鼠。有趣的是,在用IgG作为对照的小鼠中,NAT10的下调大大抑制了CCa的进展,而对照组和U14-oeFOXP1组之间的肿瘤生长没有明显差异(图8e,f)。此外,为了研究与 NAT10 基因敲除联合治疗对抗 PD-L1 疗效的潜在协同增效作用,作者还监测了模型中不同组别抗PD-L1抗体治疗后的肿瘤生长情况。值得注意的是,U14-kdNAT10组的肿瘤生长速度明显慢于单药治疗组(图8f,g)。因此,与NAT10/ac4C/FOXP1轴在促进免疫检查点基因上调和随后的免疫逃避中的作用一致,抑制该轴可导致PD-L1阻断诱导的肿瘤消退,从而相应地抑制CCa的进展。联合疗法的疗效远远优于单一疗法。
为了评估NAT10/ac4C/FOXP1轴在CCa的TME中诱导的免疫浸润,作者通过对U14-Ctrl和U14-oeFOXP1模型样本的RNA-seq分析,分析了免疫功能正常条件下NAT10诱导的FOXP1过表达的综合分子谱。根据RNA-seq分析结果,作者对与TME相关的DEGs进行了GO富集分析,旨在评估TME的变化。如图8h所示,DEGs主要富集在代谢过程、生物调控和免疫相关的GO项中,这与本研究之前的结果一致。此外,与对照组相比,U14-oeFOXP1组小鼠的组织中观察到PD-L1上调,如火山图所示(图8i);此外,包括 CTLA4、CXCL9、ARG1和FOXP3在内的几个关键基因在U14-oeFOXP1 组小鼠的组织中上调,表明FOXP1的过度表达可能在检查点基因表达中发挥了重要作用。
此外,作者还利用CIBERSORT算法对22种肿瘤浸润免疫细胞(TIICs)进行了相关分析,发现CCa具有独特的免疫表型特征。FOXP1和TIICs的差异表达和相关性分析结果表明,FOXP1过表达与Tregs和活化CD4+ T细胞的浸润呈正相关,但与M1巨噬细胞、静息NK细胞和静息CD4+记忆T细胞的浸润呈负相关(图8j)。随后,作者进行了流式细胞分析,发现FOXP1的上调能有效促进Treg在TME内的浸润,而NAT10的敲除则显示出相反的趋势(图8k,l)。综合来看,差异表达和相关性分析进一步证实了FOXP1和NAT10与CCa组织中免疫抑制性TME密切相关的假设。随后,在肿瘤切除一个月后,测量了TME内的乳酸水平,发现U14-oeFOXP1组明显高于U14-Ctrl组,而U14-kdNAT10组则较低(图8m)。考虑到代谢失调与免疫细胞浸润之间的相互影响,作者通过免疫组化方法检测并验证了不同组中PD-L1的表达,结果显示U14-oeFOXP1组TME中PD-L1的表达呈上升趋势(图8n)。综上所述,作者的研究结果表明了CCa中癌症代谢与免疫反应之间的相互影响。具体来说,在CCa肿瘤中靶向NAT10-FOXP1轴不仅能阻碍肿瘤细胞的糖酵解,还能减少Treg群体向TME的浸润,从而协同增强PD-L1阻断剂的疗效,最终阻止肿瘤进展。综上所述,作者的研究结果表明了CCa中癌症代谢与免疫反应之间的相互影响。具体来说,在CCa肿瘤中靶向NAT10-FOXP1轴不仅能阻碍肿瘤细胞的糖酵解,还能减少Treg群体向TME的浸润,从而协同增强PD-L1阻断剂的疗效,最终阻止肿瘤进展。
结论
总之,作者提供了令人信服的体外和体内证据,揭示了NAT10在CCa进展过程中的致癌作用,并确定了作为一种重要的表观转录调节因子,NAT10介导的肿瘤细胞ac4C修饰可上调TF FOXP1,从而增加Treg浸润,并通过重编程糖酵解代谢促进CCa免疫抑制。此外,NAT10 基因敲除可通过损害肿瘤细胞糖酵解、减少乳酸生成和增强肿瘤组织间质内的免疫监视来显著提高PD-L1阻断疗法的疗效,最终导致肿瘤消退。对NAT10介导的ac4C修饰的阐明有望极大地促进对CCa的进一步研究,并有助于开发前景广阔的治疗策略。
生信实验
组织微阵列(TMA)构建、免疫细胞谱分析、
常规分子实验
免疫组化和肝性染色、双荧光素酶报告基因检测、免疫荧光检测、糖酵解测定、ac4C乙酰化RNA免疫沉淀、acRIP-qPCR、蛋白质印迹分析、定量逆转录PCR、mRNA稳定性检测、CHIP-qPCR
组学实验
acRIP-seq、Ribo-seq、ATAC-seq 、CUT&Tag
细胞实验
细胞培养、质粒构建、慢病毒生产和细胞转导、细胞增殖检测、transwell检测、流式细胞术
动物模型及病理实验
动物研究
参考文献
Chen, X., Hao, Y., Liu, Y., Zhong, S., You, Y., Ao, K., Chong, T., Luo, X., Yin, M., Ye, M., He, H., Lu, A., Chen, J., Li, X., Zhang, J., Guo, X., NAT10/ac4C/FOXP1 Promotes Malignant Progression and Facilitates Immunosuppression by Reprogramming Glycolytic Metabolism in Cervical Cancer. Adv. Sci. 2023, 2302705.






