Lin28b/Wnt5a轴通过癌相关成纤维细胞和肿瘤上皮细胞之间的串扰驱动胰腺癌
肿瘤上皮细胞与肿瘤微环境(TME)之间的双向信号转导对肿瘤的发生发展具有重要意义。本研究表明,Lin28b/let-7通路是调节肿瘤上皮中Wnt5a表达不可或缺的途径,Wnt5a可以在癌相关成纤维细胞(CAFs)中分泌并上调Lin28b。此外,作者证明CAFs中的Lin28b通过诱导细胞因子PCSK9的产生来促进PDAC的生长。使用PDAC原位小鼠模型,作者发现CAFs中Lin28b的缺失降低了肿瘤重量,突出Lin28b在PDAC基质中的重要性。因此,作者研究表明,Lin28b-Wnt5a轴在胰腺肿瘤上皮细胞和TME之间的双向串扰中起关键作用,并导致促肿瘤发生的环境。本文于2023年10月发表于《Nature Communication》,IF:16.6,Q1。
技术路线
主要实验结果
1、Lin28b可在PDAC的CAFs中高表达
既往研究表明,LIN28B可促进PDAC细胞的生长,且LIN28B水平升高与PDAC患者预后不良相关。为进一步探讨LIN28B在PDAC中的功能,作者对人PDAC组织微阵列(TMAs)进行免疫组化染色。作者发现80个PDAC样本中有23个(28.75%)在肿瘤上皮细胞中表达高水平的LIN28B。值得注意的是,LIN28B的表达与晚期肿瘤分级和不良预后相关(图1a-c)。同时,作者观察到一个有趣的现象,即大多数LIN28Bhigh样本(23个样本中的22个)在基质中也表现出了LIN28B的高表达(图1d),这促使作者进一步探索LIN28B在PDAC基质中的表达谱。以α-SMA表达为特征的癌相关成纤维细胞(CAFs)被认为是PDAC的主要基质成分。因此,作者在TMAs上对α-SMA进行免疫荧光染色,观察到LIN28B和α-SMA在LIN28Bhigh样品中的共定位(图1e),表明LIN28B在CAFs中的表达与其在肿瘤中的表达状态高度相关。接下来,作者试图在PDAC小鼠模型中验证作者的发现。原代小鼠PDAC系14837T、14838T和15376T分别从基因工程C57BL/6小鼠(p48-Cre;tetO_LSL KrasG12D;ROSA_rtTA;p53L/+)中分离得到。作者发现Lin28b在15376T中高表达,而在14837T和14838T中不表达(图1f, g)。接下来,作者将14837T、14838T和15376T植入小鼠胰腺,发现15376T的原位模型在肿瘤和间质中都表达了高水平的Lin28b,而14837T和14838T肿瘤仅显示背景水平的Lin28b染色(图1h, j)。这些结果表明,Lin28b可以在CAFs中表达,尽管Lin28b通常被认为在胚胎组织或癌症组织中高度表达。
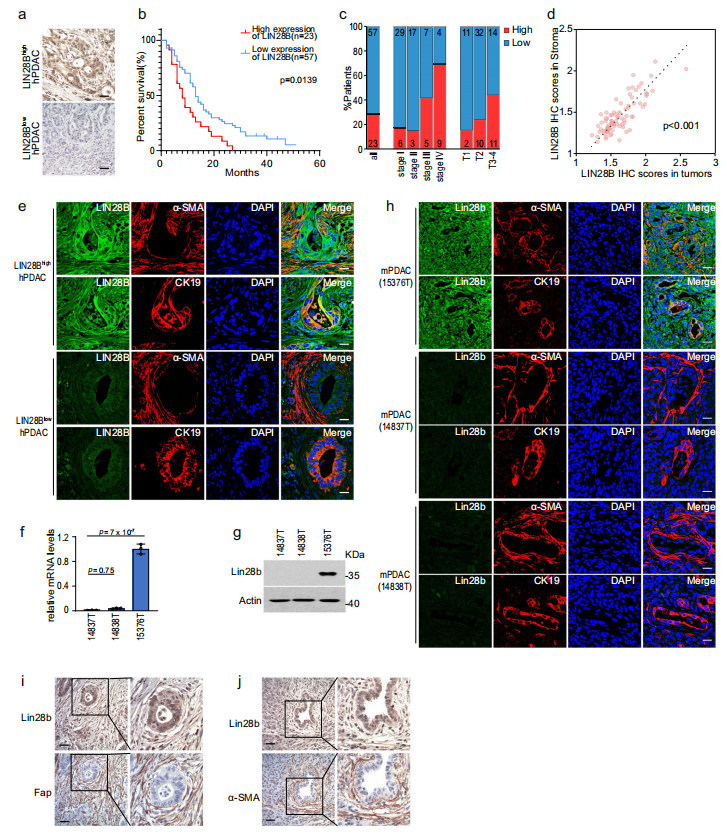
图1 Lin28b可在PDAC的CAFs中高表达
2、在条件培养基中诱导Lin28b在肿瘤细胞中的表达
接下来,作者从原位肿瘤中分离出小鼠CAF细胞系(mCAFs,分别命名为14837CAFs、14838CAFs和15376CAFs)。然而,作者发现在这些体外培养的细胞系中几乎检测不到Lin28b,这与免疫荧光数据不一致(图2a,b)。作者怀疑PDAC细胞可能在维持基质Lin28b表达方面发挥作用。因此,mCAFs与小鼠PDAC系共培养以模拟体内环境。有趣的是,Lin28b可以在与15376T共培养的CAFs中被诱导,而非与14837T或14838T,这表明Lin28b在CAFs中的表达与其在肿瘤中的表达状态有关(图2a, b)。为了进一步证实作者的假设,作者将14837CAFs直接与15376T或14837T共培养6天,然后通过流式细胞术(FACS)进行分类(图2c)。作者发现,当14837CAFs与15376T共培养时,Lin28b的表达增加,而与14837T共培养时,Lin28b的表达没有增加(图2d)。此外,作者从15376T开始用条件培养基(CM)处理CAFs 6天,也发现15376T-CM逐渐上调了Lin28b的表达(图2e-j)。此外,15376T-CM在15376T中去除Lin28b后,其增加CAFs中Lin28b表达的能力被取消(图2k, l)。接下来,作者试图在人类PDAC中验证作者的发现。作者测量了LIN28B在人PDAC细胞系中的表达,发现LIN28B在PANC-1和PANC03.27中高表达,而在ASPC-1、Mia Paca-2、PaTu8988T和PaTu8988S中不表达(图2m, n)。此外,作者从2例患者中分离出人PDAC细胞系,发现LIN28B在hPDAC1#中高表达,而在hPDAC2#中不表达(图2m, n)。在人PDAC中也发现了类似的数据,如PANC-1,PANC03.27和hPDAC1#中的CM以LIN28B依赖的方式诱导人CAFs (hCAFs)中LIN28B的表达(图2p - r),证实肿瘤上皮中LIN28B的缺失导致人和小鼠PDAC中CAFs中LIN28B的失活。为了在体内验证这一现象,作者将15376T或Lin28b-KO 15376T注射到小鼠胰腺中。免疫荧光染色显示,在原位模型中,在肿瘤中沉默Lin28b可降低间质Lin28b的表达(图2s)。综上所述,这些数据表明具有高水平Lin28b (Lin28bhigh)的肿瘤细胞可以上调间质Lin28b的表达。
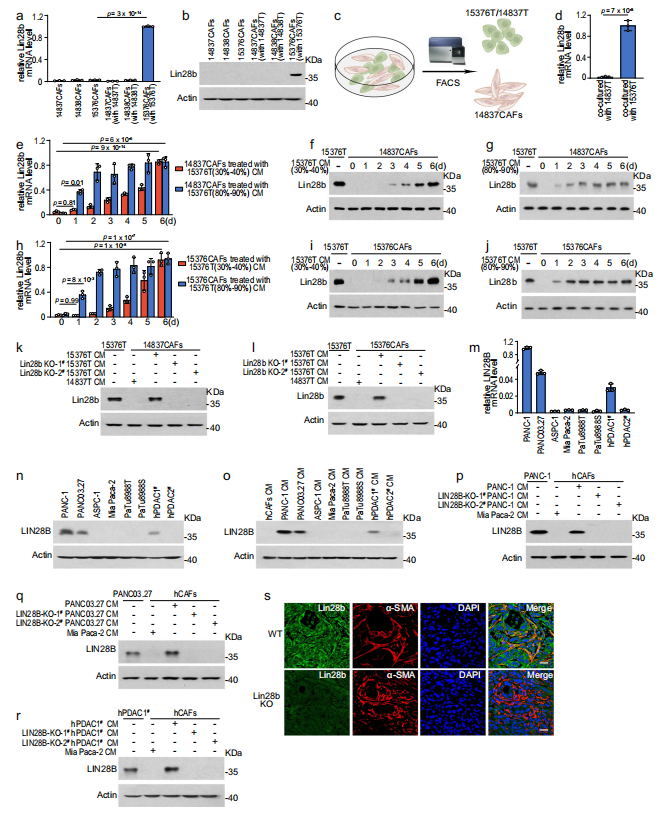
图2 在条件培养基中诱导Lin28b在肿瘤细胞中的表达
3、Lin28bhigh的PDAC细胞分泌Wnt5a诱导CAFs中Lin28b的表达
然后,作者利用15376T、Lin28b- KO、15376T和14837T的RNA测序(RNA-seq)进一步了解肿瘤细胞上调基质Lin28b表达的机制。与Lin28b-KO 15376T和14837T相比,15376T中发现了66个上调基因(图3a)。在这些基因中,作者注意到两个可溶性Wnts (Wnt配体),包括Wnt5a和Wnt10a,在15376T(图3 b, c)和PANC-1(图3 d, e)中上调。此外,Wnt5a和Wnt10a被酶联免疫吸附试验(ELISA)在Lin28bhigh肿瘤但不是Lin28blow肿瘤的CM检测到(图3 f, g)。然后,作者试图确认Wnt5a或Wnt10a在驱动CAFs中Lin28b表达中的作用。如图3h - 1所示,在肿瘤中敲除Wnt5a而不敲除Wnt10a可抑制肿瘤细胞诱导CAFs中Lin28b表达的能力,突出了Wnt5a在诱导Lin28b中的作用。此外,作者发现重组-Wnt5a上调了CAFs中Lin28b的表达(图3m-q),而用中和抗体阻断Wnt5a信号通路会减弱15376T- CM上调CAFs中Lin28b表达的能力(图3r, s)。接下来,作者通过将15376T和Wnt5a- KO 15376T注射到小鼠胰腺来检测Wnt5a在体内的作用。免疫荧光染色显示,在原位模型中,敲除肿瘤中的Wnt5a可降低间质Lin28b的表达(图3t)。
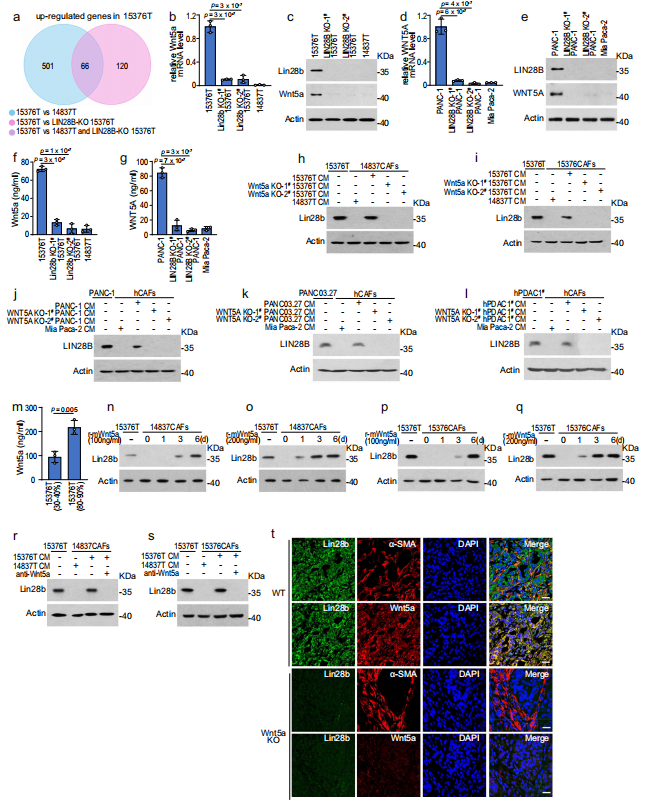
图3 Lin28bhigh的PDAC细胞分泌Wnt5a诱导CAFs中Lin28b的表达
4、Wnt5a-Fzd4-β-catenin通路在Lin28b诱导中起关键作用
由于作者提供Wnt5a导致PDAC基质中Lin28b活化的证据,作者接下来研究Wnt5a诱导Lin28b表达的机制。众所周知,Wnt信号通路通常分为两大类,β-catenin依赖的典型通路和β-catenin独立的非典型通路。Wnt5a传统上被认为是非标准WNT。然而,除了激活非典型信号通路外,据报道Wnt5a在Fzd4受体的存在下也能激活典型信号通路。因此,作者检测了Fzd4的水平,发现Lin28b只能在Wnt5a和Fzd4高表达的肿瘤细胞系中检测到(图4a, b),这表明完整的Wnt5a-Fzd4通路是激活PDAC中Lin28b的必要条件。接下来,作者在CAFs中敲除Fzd4,发现15376T-CM和recombin- wnt5a都不能诱导Fzd4- KO CAFs中Lin28b的表达(图4c, d)。为了进一步证实Fzd4的重要性,并考虑到CAF的异质性,作者使用FACS从KPC (KrasLSL-G12D+;Trp53R172H/+;Pdx1-Cre)小鼠中分离出CAFs,然后使用Fzd4抗体将CAFs分离为Fzd4阳性和Fzd4阴性群体(图4e)。同样,Lin28b也只能在fzd4阳性的CAFs中被诱导表达(图4f)。作者还发现,当诱导Lin28b表达时,β-catenin (Wnt通路中的细胞内信号换能器)的水平在CAFs中上调(图4g - i)。此外,Lin28bhigh肿瘤CM和r-Wnt5a均可诱导CAFs中Lin28b启动子中β-catenin的富集(图j - l)。为了进一步检测Wnt/β-catenin信号通路的激活情况,作者将T细胞因子/淋巴细胞增强因子结合因子(TCF/LEF)荧光素酶报告因子转染到CAFs中,发现Lin28bhigh肿瘤- CM和r-Wnt5a均能促进荧光素酶活性(图4m),提示Wnt/β-catenin信号通路被激活。此外,在CAFs中抑制β-catenin可减弱来自Lin28bhigh肿瘤的CM诱导的Lin28b的表达(图4n-s)。这些数据提示Wnt5a-Fzd4-β-catenin通路在CAFs中刺激Lin28b表达起关键作用。
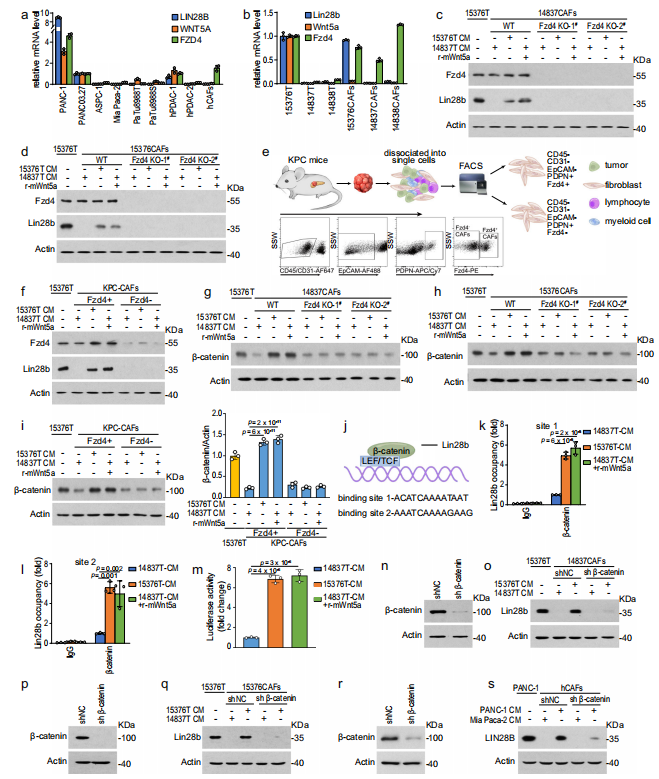
图4 Wnt5a-Fzd4-β-catenin通路在Lin28b诱导中起关键作用
5、Lin28b阳性的CAFs促进胰腺癌的生长
接下来,作者试图探索Lin28b在CAFs中的作用。众所周知,肿瘤对葡萄糖的快速消耗会导致葡萄糖缺乏的微环境。同时,在营养不良的TME中,CAFs可以分泌各种生长因子和代谢物,维持癌细胞的增殖。毫不奇怪,作者发现在葡萄糖限制条件下(2 mM葡萄糖),CAFs对PDAC增殖有积极作用,这再现了体内严峻的肿瘤微环境(图5a)。相比之下,在低糖处理下,Lin28b-KO CAFs不能挽救PDAC的增殖(图5b)。然后,作者发现表达Lin28b的CAFs的CM能够在葡萄糖限制条件下挽救肿瘤生长(图5c, d)。接下来,将肿瘤细胞与不同类型的CAFs共同注射到小鼠胰腺中。15376T与Lin28b-KO 15376CAFs共注射,而不是与WT 15376CAFs共注射,可以减缓肿瘤在体内的生长(图5e-g)。此外,当与表达WT -Lin28b的CAFs共注射时,肿瘤(14837T)的生长显著增加,而当PDAC细胞与14837CAFs或15376CAFs共注射时,肿瘤(14837T)的生长明显减弱(图5h, i)。这些发现表明,间质Lin28b表达可能在PDAC生长中起关键作用。此外,由于作者的数据表明Wnt5a-Fzd4通路对于Lin28b的激活至关重要(图4c, d, f),作者也测试了Fzd4在肿瘤生长中的作用。如图5j-n所示,fzd4阳性的CAFs在体外和体内均能挽救肿瘤的生长,说明fzd4介导的CAFs中Lin28b的表达促进了PDAC的生长。
为了进一步证实Lin28b在CAFs中的作用,作者通过将Lin28bfl/fl小鼠与FSP1-Cre小鼠杂交,建立了成纤维细胞特异性条件Lin28b敲除模型。然后将15376T植入野生型(WT)小鼠和FSP-Cre;Lin28bfl/fl小鼠胰腺,对原位肿瘤进行免疫荧光染色。如图5o所示,与WT小鼠相比,FSP-Cre;Lin28bfl/fl小鼠中基质Lin28b显著下调。在PDAC原位模型中,与WT小鼠相比,FSP-Cre;Lin28bfl/fl小鼠中生长的肿瘤明显更小(图5p)。此外,在FSP-Cre;Lin28bfl/fl小鼠中,Ki67-阳性细胞群显著减少(图5q, r),表明lin28b阳性CAFs促进了体内PDAC的生长。
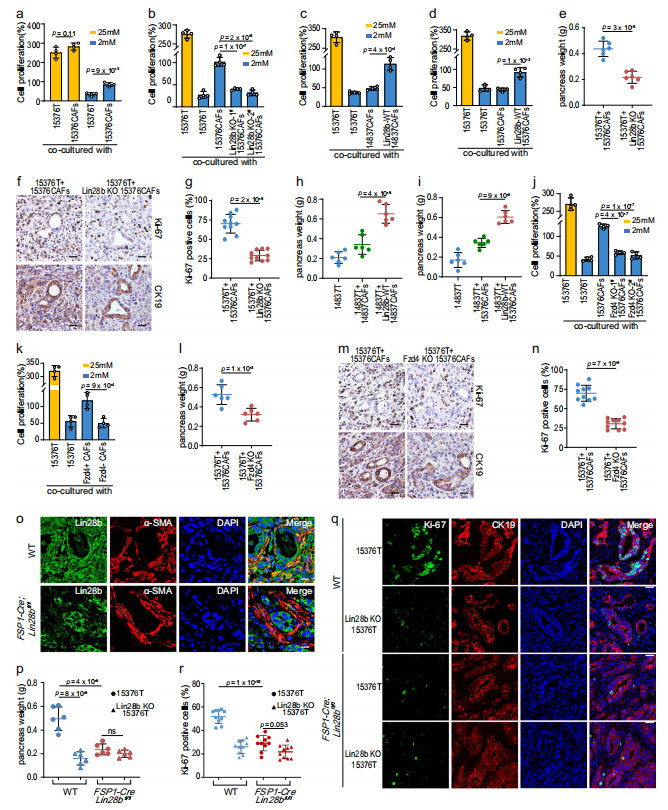
图5 Lin28b阳性的CAFs促进胰腺癌的生长
6、CAFs分泌Pcsk9促进PDAC生长
为了进一步研究Lin28b阳性CAFs促进PDAC生长的机制,作者将CAFs- CM进行了三次冻解冻循环(- 80°C, 60°C)或加热(100°C, 15分钟),发现增加PDAC增殖的能力被取消(图6a)。此外,通过3-kDa切断柱过滤CAFs-CM,在CAFs-CM的>3-kDa部分保留促瘤活性(图6b)。因此,作者认为由CAFs分泌的细胞因子,而不是代谢物,在肿瘤生长中起作用。接下来,作者使用来自15376CAFs或Lin28b- KO 15376CAFs的CM进行了定量分泌组学分析,以鉴定Lin28b阳性CAFs分泌的细胞因子(图6c)。在Lin28b- KO 15376CAFs中下调的分泌蛋白中,TargetScan (https://www.targetscan.org)预测了五个基因(Clu, Cxcl5, FN, PGRN和Pcsk9)作为Lin28b/let-7的直接靶点(图6c)。为了进一步验证这些基因是否受到Lin28b/let-7通路的调控,作者构建了一个不能抑制let-7的小鼠Lin28b突变质粒(图6d、e)。突变体Lin28b包含5个突变(W34A、F43A、F61A、H159A和H181A),分布在冷休克结构域(CSD)和CysCysHisCys (CCHC)锌指RNA结合基元(人W36、F45、F63、H137和H159)。接下来,CRISPR/ Cas9抗性野生型Lin28b (flag-Lin28b- WT (r))和突变型Lin28b (flag-Lin28b- MU (r))在Lin28b缺失的细胞中过表达,作者发现flag-Lin28b- WT(r),而不是flag-Lin28b- MU(r),增加了Clu、Cxcl5、PGRN和Pcsk9的水平(图6f-j)。此外,CAFs- CM中的PGRN和Pcsk9水平远高于肿瘤- CM,因此作者重点研究了PGRN和Pcsk9在CAFs中的功能(图6i, j)。用重组蛋白或中和抗体处理PDAC细胞发现,在限糖条件下,Pcsk9而不是PGRN增加了PDAC的增殖,这表明Pcsk9在调节肿瘤生长方面的作用(图6k, l)。为了进一步验证Pcsk9的功能,作者敲除了CAFs中的Pcsk9(图6m)。值得注意的是,Pcsk9-KO CAFs不能在葡萄糖限制的培养基中挽救肿瘤生长(图6n)。与体外实验数据一致,PDAC细胞与Pcsk9-KO CAFs共注射时,原位肿瘤明显小于野生型CAFs(图6o - s)。作者还检测了Pcsk9抑制剂alirocumab在原位模型中的疗效,发现alirocumab可显著抑制肿瘤生长(图6t)。总之,这些数据表明lin28b阳性CAFs分泌的Pcsk9促进PDAC的生长。
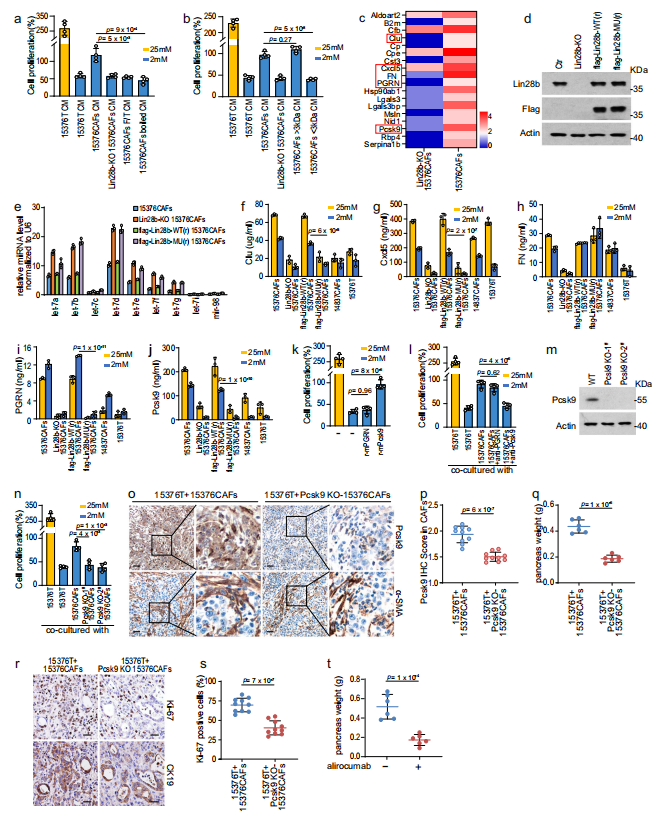
图6 CAFs分泌Pcsk9促进PDAC生长
7、Pcsk9是Lin28b/let-7的直接靶点
接下来,作者试图确定Pcsk9是否是Lin28b/let-7的直接靶点。表达Lin28b的CAFs-CM或Fzd4阳性的CAFs-CM中的Pcsk9水平远高于不表达Lin28b或Fzd4阴性的CAFs的CM(图7a-h)。作者发现flag-Lin28b-WT(r),而不是flag-Lin28b-MU(r),增加了被Lin28b敲除抑制的Pcsk9蛋白水平(图7i)。此外,let-7a agomir降低Pcsk9, let-7 sponge增加Pcsk9,表明Pcsk9能够受到Lin28b/let-7通路的调控(图7j)。然后,双荧光素酶报告基因实验显示,let-7a agomir抑制了Pcsk9 mRNA野生型3’-UTR驱动的荧光素酶,但不影响突变型3’-UTR驱动的荧光素酶(图7k, 1),表明Pcsk9是let-7a miRNAs的直接靶点。miRNAs主要通过促进mRNA降解或抑制蛋白质翻译来调节基因表达。为了进一步探讨Lin28b/let-7是否影响Pcsk9 mRNA的稳定性,作者使用Actinomycin D阻断转录,然后检测mRNA水平。Lin28b敲除不影响Pcsk9 mRNA的降解,这表明Lin28b/let-7不调节Pcsk9 mRNA的降解(图7m, n)。因此,作者研究Lin28b/let-7是否通过调节翻译影响Pcsk9 蛋白水平。值得注意的是,Lin28b缺失减少了Pcsk9 mRNA在多体部分的存在,但在非翻译核糖体部分增加了Pcsk9 mRNA的存在(图7o)。此外,flag-Lin28b-WT(r)而不是flag-Lin28b-MU(r)诱导Pcsk9 mRNA向更重的多聚体部分转移(图7p)。这些结果表明,Lin28b/let-7调控的是Pcsk9的翻译,而不是mRNA的稳定性。此外,IHC染色显示,与野生型小鼠相比,FSP-Cre;Lin28bfl/fl小鼠的Pcsk9表达显著降低,表明体内Lin28b调节了CAFs中Pcsk9的表达(图7q, r)。综上所述,作者研究结果证实Pcsk9是CAFs中Lin28b/let-7的直接靶点。
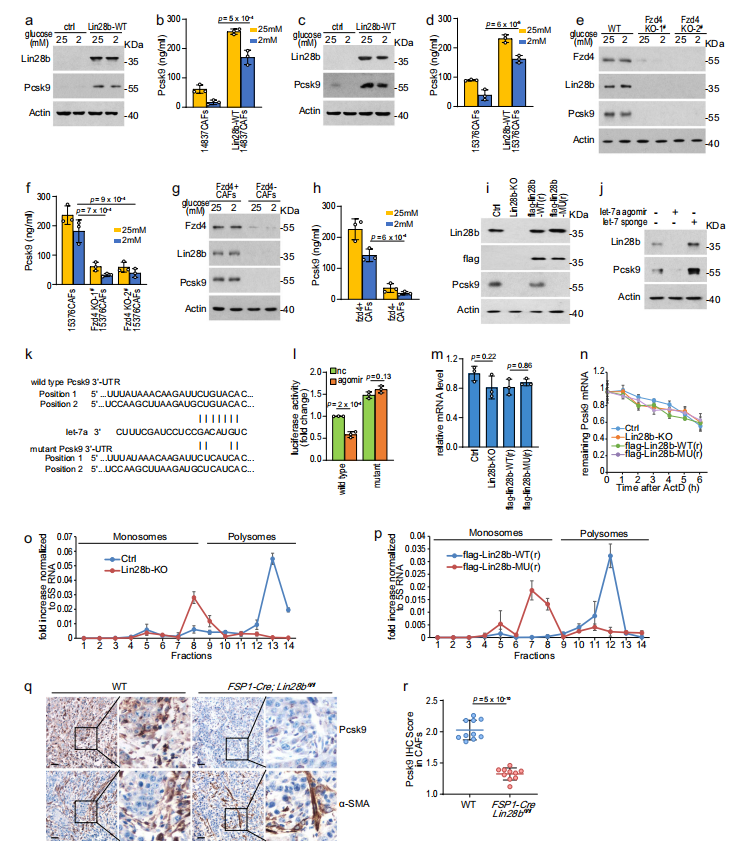
图7 Pcsk9是Lin28b/let-7的直接靶点
结论
在这项研究中,作者发现胰腺癌细胞中Wnt5a和Lin28b之间存在正反馈回路(图8)。研究表明Wnt5a可以作为肿瘤上皮细胞和CAFs之间的信号转换器,Lin28b-Wnt5a轴在胰腺肿瘤上皮细胞和TME之间的双向串扰中起关键作用,并导致促肿瘤发生的环境。
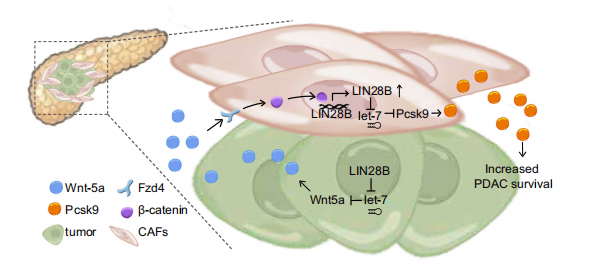
图8 PDAC中Wnt5a和Lin28b之间的正反馈回路
实验方法
转基因小鼠细胞系;小鼠模型;细胞培养;直接接触共培养和FACS;KPC CAFs 的流式细胞术及分选;间接共培养实验(Transwell);条件培养基(CM);异种移植;抗体和试剂;实时荧光定量PCR(qPCR)基因表达分析;基因组DNA分离及基因型鉴定;Western Blotting;ELISA;CRISPR/Cas9 KO细胞系的生成;lentiviral-shRNA干扰;超表达质粒;定量分泌组样品制备及LC-MS/MS分析;分泌数据分析;RNA-seq分析;全外显子组测序(WES)分析;miRNA靶基因的预测;染色质免疫共沉淀(CHIP);质粒构建及荧光素酶测定;mRNA稳定性分析;核糖体的蔗糖梯度分析;免疫组化染色;免疫荧光分析;马森三色染色法。
参考文献:
Shu Z, Fan M, Tu B, Tang Z, Wang H, Li H, Li H, Yuan M, Bai J, Huo S, Wang L, Zhu WG, Wang W, Liu X, Shu S, Zhao Y. The Lin28b/Wnt5a axis drives pancreas cancer through crosstalk between cancer associated fibroblasts and tumor epithelium. Nat Commun. 2023 Oct 28;14(1):6885. doi: 10.1038/s41467-023-42508-8. PMID: 37898598; PMCID: PMC10613206.






